Синтез и исследование композитных материалов на основе яблочного пектина и катионов меди
Автор: Мамедов Э.И., Кольцов В.А., Калмыкова Е.Н.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 2 (96) т.85, 2023 года.
Бесплатный доступ
В работе представлены результаты синтеза металлокомпозитных материалов на основе яблочного пектина и катионов двухвалентного металла - Cu2+; определения степени этерификации и содержания свободных карбоксильных групп исходного пектина методом кислотно-основного титрования, определения степени включения указанного катиона в полисахаридную макромолекулу методом ИК-спектроскопии, а также фунгицидной активности исходного пектина и медных комплексов в отношении Penicillum sp. По результатам титрования установлено, что яблочный пектин обладает высокой степенью этерификации (СЭ = 50,7 %) и низким содержанием карбоксильных групп (Кс = 2,79 %), что предполагает его низкую желирующую активность. Установлено, что увеличение концентрации соли выше 0,005 г-экв/л. приводит к снижению доли получающегося водорастворимого комплекса. Оптимальное значение концентрации CuSO4·5H2O, при которой образуется наибольшая масса водорастворимого комплекса, составляет 0,005 г-экв/л. По данным ИК-спектроскопии произведен расчет степени замещения катионов натрия на катионы меди, которая составила 18 %. Показано, что исходный яблочный пектин не обладает фунгицидной активностью, в то время как медный комплекс на его основе способен подавлять рост культуры уже при действии 10 мкл вещества, а при увеличении объема до 50 мкл проявляется еще более активная фунгицидная активность медного комплекса.
Пектин, металлокомплекс, степень замещения, ик-спектроскопия, кислотно-основное титрование, противогрибковая активность
Короткий адрес: https://sciup.org/140303214
IDR: 140303214 | УДК: 547.458.88 | DOI: 10.20914/2310-1202-2023-3-247-255
Текст научной статьи Синтез и исследование композитных материалов на основе яблочного пектина и катионов меди
В настоящее время разработка композитных материалов на основе полисахаридов с различными органическими и неорганическими наполнителями привлекает активное внимание исследователей различных областей естествознания. Химическая модификация этих природных биополимеров позволяет получить производные с новыми физикохимическими и биологическими свойствами, что значительно расширяет рамки их практического применения в пищевой и фармацевтической промышленности, косметологии и медицине [1, 2].
Известно, что пектины являются эффективными биосорбентами, способными очищать организм от радионуклидов, метаболитов (глюкозы, холестерина), токсикантов и прочих низкомолекулярных биологически активных веществ.
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Наряду с указанными свойствами этому классу биополимеров свойственно проявление противоязвенной, ранозаживляющей, иммуномодулирующей, антиоксидантной и противо-микробной активности [3].
Другим активно развивающимся в последнее время направлением является использование этого класса биополимеров в качестве средства адресной доставки лекарственных препаратов с пролонгированным действием, а также матрикса для создания композитных материалов с заданными свойствами. Одним из направлений модификации является получение металло-комплексов на основе пектинов, выделенных из различных природных источников, с включением различных катионов (Ag+, Ni2+, Со2+, Сu2+, Fе2+, Мg2+, Zn2+).
За последние 20 лет получение металло-комплексов на основе пектинов привлекает внимание российских и зарубежных ученых. Основные области исследований направлены на поиск новых путей синтеза; изучение физикохимических и биологических свойств.
К настоящему времени установлено, что комплексообразование повышает терапевтическую активность лигандов, снижает их токсичность. Кроме того, авторы отмечают, что терапевтический эффект комплексов (например, иммунологическая активность, детоксицирующее и радиозащит-ное действие) значительно выше по сравнению с исходным пектином. В работах [4, 5] приводятся результаты серии исследований, посвященных изучению комплексообразования пектиновых полисахаридов с макро- и микроэлементами (Fе2+, Со2+, Сu2+, Са2+, Zn2+ и Мn2+) с целью получения новых водорастворимых форм, обладающих различными физиологическими свойствами.
Так, выраженными противоанемическими свойствами характеризуются пектаты железа, повышающие уровень гемоглобина и количество эритроцитов в крови, а также способствующие интенсивному восстановлению гематологических показателей после кровопотери [5]. Среди полученных авторами соединений обнаружено, что некоторые пектиновые комплексы, содержащие ионы кобальта и никеля, проявляют антимикробную активность [6].
В работе [7] авторы сообщают о результатах синтеза комплексов на основе яблочного пектина различной степени этерификации с катионами меди. С помощью метода спектрофотометрии показано, что пектин образует с катионами меди комплексы состава 2:1. Методом ИК-спектроскопии установлено, что координационное взаимодействие пектинов с катионами Сu2+ происходит не только за счет карбоксильных групп, но и гидроксильных групп пектиновой матрицы. Методом совмещенного термического анализа (термогравиметрия – дифференциальная сканирующая калориметрия) показана более высокая термическая стабильность пектиновых металлокомплексов по сравнению с исходным пектином.
В работе [8] представлены результаты синтеза комплексов на основе яблочного пектина и ионов серебра. При сопоставлении данных ИК-спектроскопии исходного и модифицированного пектина авторы отмечают незначительные различия между ними. Авторами указано, что полученные комплексы могут быть рекомендованы в качестве бактерицидного средства при лечении инфекционных заболеваний слизистых оболочек (носа, зева).
Среди других композитных материалов на основе пектинов в последние годы внимание исследователей привлекает катион Мg2+ [9]. Создание фармацевтических препаратов на основе полисахаридных комплексов магния расширяет перспективу их более широкого практического применения не только в качестве средств антистрессового действия, но и для лечения кардиологических заболеваний, а также регуляции метаболических процессов и активации ферментативных реакций. Общей особенностью этих препаратов является отсутствие побочных эффектов при приеме. В статье также предложен двустадийный способ получения металлоком-плексов, обеспечивающих максимальный выход; дана оценка физико-химических свойств и иммуномодулирующей активности пектата магния. В статье также отмечается, что комплексы на основе пектата и пектината натрия являются источниками незаменимых макроминералов (магния и натрия) в биодоступной (водорастворимой) форме, которые оказывают стимулирующее воздействие на иммунную систему. Преимуществами этих соединений авторы указывают отсутствие ульцерогенного (раздражающего) воздействия на желудочно-кишечный тракт и хорошую растворимость в воде, что повышает активность их метаболизма.
В зарубежной литературе также имеются сведения о пектиновых металлокомплексах. Например, в статье [10] авторы сообщают о результатах синтеза комплексов на основе яблочного пектина и ионов железа (III), изучении физико-химических свойств и биологической активности. В работах [11–16] авторами приведены сведения о получении композитных материалов на основе пектинов с катионами серебра, меди, платины, палладия, селена и цинка и указана информация об их противовоспалительных, антиоксидантных и антимикробных свойствах.
Цель работы – получение водорастворимых комплексов с катионами меди на основе яблочного пектина, определение степени этерификации и содержания свободных карбоксильных групп исходного пектина методом кислотноосновного титрования, определение степени включения катионов меди в полисахаридную макромолекулу методом ИК-спектроскопии и исследование противогрибковой активности полученных комплексов.
Материалы и методы
В качестве объекта исследования был выбран полисахарид растительного происхождения – яблочный пектин торговой марки «С. Пудовъ», Россия.
Основные реактивы, используемые в работе: гидроксид натрия NаОН 0,1 н.; медь сернокислая 5-водная (СuSО 4 5Н 2 O), ч.; концентрированная соляная кислота (НСl), x.ч; бромтимоловый синий (С 27 Н 28 Вr 2 О 5 S), 0,4%, ч.д.а; красный крезол (С 21 Н 18 О 5 S) 0,4%, ч.д.а; красного фенол (С 19 Н 14 О 5 S 1 ), 0,4%, ч.д.а; этанол (С 2 Н 5 OH), 96%, x.ч.; глюкоза (С 6 Н 12 О 6 ), ч.; натрий азотнокислый (NаNО 3 ), ч.; калий фосфорнокислый однозамещенный (КН 2 РО 4 ), ч.; магний сернокислый 7-водный (МgSО 4 ·7Н 2 O), ч.; калий хлористый (КСl), ч.; вода дистиллированная; агар-агар.
Приборы и оборудование: аналитические весы Госметр ВЛ-210, магнитная мешалка с подогревом ММ-5, настольная центрифуга ЦЛН-2, ИК-Фурье спектрометр IRАffinitу-1, термостат UT-4612.
Степень этерификации и содержание свободных карбоксильных групп исходного пектина определяли в соответствии с методикой в работе [17]. Метод основан на титриметрическом определении свободных и, после омыления, этерифицированных карбоксильных групп полигалактуроновой кислоты в выделенном пектине. Исходный пектин растворяли в дистиллированной воде. Для лучшего растворения пектин можно смочить этиловым спиртом. Отбирали часть от общего объёма и нагревали до 40 °С. Колбу плотно закрывали и взбалтывали до полного растворения пектина. Пробу титровали раствором NаОН (0,1 H) в присутствии смешанного индикатора Хинтона. В раствор добавляли 6 капель индикатора и титровали до тех пор, пока, не появилось тёмно-розовое окрашивание, которое не исчезало в течение 1 минуты. Учитывали объём израсходованного раствора NаОН, приливали 50 мл того же раствора NаОН, закрывали колбу и оставляли на 3 ч для омыления этерифицированных карбоксильных групп. После в раствор добавляли
50 мл раствора соляной кислоты НСl и вновь оттитровывали раствором NаОН.
Степень этерификации СЭ,%, пектина вычисляли по формуле (1):
V
СЭ =-- 2— • 100%
V + V 2
где V 1 – объём раствора гидроксида натрия 0,1 Н, используемого на первое титрование, мл; V 2 – объём раствора гидроксида натрия 0,1 Н, используемого на второе титрование, мл.
Содержание свободных карбоксильных групп К с ,%, определяли по формуле (2):
к V • 0,45
K =----- c
p
где V 1 – объём 0,1 Н раствора гидроксида натрия, используемого на первое титрование, мл; p – навеска пектина, г.
Синтез пектиновых металлокомплексов осуществляли по методике, предложенной авторами в работе [18]. Навеску пектина (0,6 г) растворяли в 30 мл воды для получения 2%-ного раствора и перемешивали в течение 2-x часов на магнитной мешалке при температуре 55–60 °C. Далее в перемешиваемую суспензию добавляли 0,1 н. раствор NаОН до рН = 9 и перемешивали 2 часа для получения пектата натрия. Затем добавляли водный раствор соли двухвалентного металла (СuSО 4 ·5Н 2 O) и оставляли перемешивать 30 минут. Далее целевой продукт осаждали двукратным объемом этанола, центрифугировали и сушили.
ИК-спектры полученных комплексов регистрировали с помощью ИК-Фурье спектрометра IRАffinitу-1 в диапазоне длин волн 4000–400 см-1. Для снятия ИК-спектров в виде тонких пленок пробы высушивали непосредственно на монокристалле кремния в сушильном шкафу при 50 °C. Затем пластинку кремния с нанесенным образцом помещали в прибор и регистрировали полученный спектр.
Расчет степени замещения катионов натрия на катионы меди в медных комплексах осуществлялся по ИК-спектрам пектата натрия и целевых комплексов по отношению интенсивностей полос пропускания карбоксианиона (COO-) в спектре пектата натрия в области 1604 см-1, и в спектре медного комплекса в области 1603 см-1 по формуле (3):
СЗ = 1 1 - - | • 100% (3)
I A )
где B – интенсивность полосы пропускания карбоксианиона в металлокомплексе; A – интенсивность полосы пропускания карбоксианиона в пектате натрия.
Противогрибковый эффект исходного пектина и пектиновых комплексов с катионами меди определяли с использованием грибковой культуры Penicillum sp ., полученной в биологической лаборатории отдела токсикологии и микологии ОГБУ «Липецкая областная ветеринарная лаборатория», г. Липецк.
Для приготовления питательной среды брали 20–30 г. сухого порошка агара Чапека, заливали его 1000 мл водопроводной воды и вымачивали 2 ч при комнатной температуре. Воду сливали и измеряют ее объем для определения количества воды, впитавшейся агаром. Затем агар промывают 2–3 раза дистиллированной водой. Взвешивают остальные компоненты среды и растворяют их в таком объеме дистиллированной воды, который составляла слитая при вымачивании агара. К полученному раствору добавляют отмытый агар-агар, после чего варят среду в автоклаве текучим паром в течение 1 ч. Полученную среду фильтровали, разливали по колбам и стерилизовали в автоклаве при a-D-GalpA-(l -* 2)-a-L-Rhap-(l -> 4)-a-D-GalpA-(l
давлении 0,05 МПа в течение 20 мин; рН питательной среды составлял в пределах 6,0–6,8.
Выращивание микроорганизмов осуществляли путем помещения в центр чашки Петри с агаровым гелем образец тонкого среза предварительно выращенной грибковой культуры размером 2 x 2 мм и выдерживали в термостате при 37 °С в течение 3÷4 суток.
В качестве фунгицидных препаратов использовали исходный и модифицированный полисахарид. Растворы ингибиторов готовили по вышеописанной методике, но с использованием 5% концентрации пектина. Объем пробы раствора ингибитора варьировали в диапазоне 10÷50 мкл. Ингибирующий эффект регистрировали через 3÷7 дней.
Результаты и обсуждение
Из литературных данных известно, что структура повторяющегося звена яблочного пектина представляет собой рамногалактуронан с чередующимися 1,2 и 1,4 связями, рисунок 1 [19].
—> 2)-a-L-Rhap-(l —» 4)-a or -D-GalpA
Рисунок 1. Химическая структура яблочного пектина Figure 1. Chemical structure of apple pectin
Информация о наличии эфирных групп в яблочном пектине носит разноречивый характер в литературных источниках указываются значения 10, 34 и 66% [7], поэтому нами было проведено титриметрическое определение свободных карбоксильных и ОМе-групп. Процесс титрования включает использование титранта NаОН и смешанного индикатора Хинтона, который меняет свой цвет на тёмно-розовый вблизи точки эквивалентности. Для исследования брали растворы полисахаридов одинаковой концентрации. На первом этапе титрования раствором NаОН определяется количество свободных карбоксильных групп. На втором этапе обработкой избытком той же щелочи осуществляется снятие эфирных групп и увеличение количества карбоксильных групп. Далее добавляли соляную кислоту с целью нейтрализации щелочи, вызывающей омыление эфирных групп. Для проведения расчетов брали среднее значение объема раствора щелочи – NаОН, который пошел на каждый этап титрования. По формуле (1) рассчитана степень этерификации пектиновых веществ, которая составила 50,7% (V 1 = 6,2 мл, V 2 = 6,4 мл). Полученные на первой стадии титрования (значение объема титранта V 1 ), используют для расчета определения содержания карбо-ксиль-ных групп в соответствии с формулой (2), которое составило 2,79% (V 1 = 6,2 мл, p = 1 г).
По результатам титрования установлено, что яблочный пектин обладает высокой степенью этерификации (СЭ = 50,7%) и низким содержанием карбоксильных групп (К с = 2,79%), что предполагает его низкую желирующую активность.
Существует разные способы получения пектиновых металлокомплексов [4–7]. Ранее было показано [20], что при низкой степени этерификации свободные COOH-группы конформационно сближаются, что приводит к повышению линейной плотности заряда макромолекулы и, следовательно, к возрастанию силы взаимодействия с катионами металлов. Наличие эфирных групп препятствует такому сближению, поэтому уменьшает степень включения катионов в пектиновый комплекс. В этой связи авторами был предложен двухстадийный способ получения металлокомплексов, который включал стадию щелочного гидролиза полисахарида для удаления ОМе-групп галактуроновых звеньев с последующим образованием пектата натрия.
Важным фактором, который учитывался при синтезе пектиновых металлокомплексов, является температура [18]. Нами было также исследовано влияние температуры в диапазоне 25 ÷ 60 °С на эффективность деэтерификации яблочного пектина. Методом кислотно-основного титрования подтверждено отсутствие ОМе-групп после обработки щелочью при 60 °С.
Действие щелочи при комнатной температуре обеспечивает лишь частичную деэтерификацию пектиновой макромолекулы, не превышающую 30%, что, соответственно, приводит к снижению степени включения катионов двухвалентных металлов в полисахаридную цепь, рисунок 2.
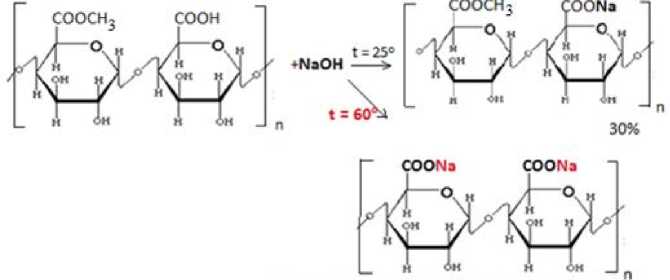
Пектат натрия, степень солеобразования 100 %
Sodium pectate, degree of salt formation, 100%
Рисунок 2. Образование частично или полностью деэтерифицированного пектата натрия
Figure 2. Formation of partially or fully de-esterified sodium pectate
В литературных источниках содержатся сведения о значительно более высокой степени усвояемости биогенных элементов (например, цинка [21, 22]) в организме в виде хелатных комплексов на основе белков по сравнению с раствором неорганической соли при той же концентрации катиона металла.
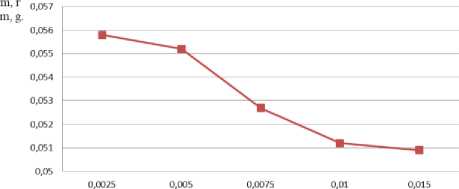
Полисахариды, имеющие большое число полярных гидроксильных, карбоксильных и на получение биоусвояемых комплексов. Каждый образец, представляющего собой смесь различных по растворимости комплексов, осаждали концентрированным этанолом, гелевую фракцию удаляли центрифугированием и определяли массу растворимого продукта после гравиметрическим методом. График зависимости выхода водорастворимого комплекса от концентрации представлен на рисунке 4.
метоксильных групп, характеризуются достаточно сложной системой водородных связей, поэтому они также могут использоваться в качестве матрицы для образования хелатных комплексов, рисунок 3.
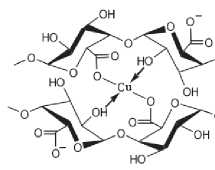
Рисунок 3. Схема металлокомплекса
Figure 3. Scheme of the metal complex
С, г-экв/л.
C, g-eqv/1.
Рисунок 4. Зависимость выхода водорастворимых пектиновых металлокомплексов от концентрации сульфата меди
Figure 4. Dependence of the yield of water-soluble pectin metal complexes on the concentration of copper sulfate
Следующим этапом получения биокомплексов меди была обработка полигалактуроната натрия водным раствором сульфата меди. При этом могут образовываться как водорастворимые комплексы, так и нерастворимые (гели). Необходимость получения водорастворимых комплексов обусловлена их более высокой биологической активностью в метаболических реакциях, поэтому исследовано влияние концентрация соли (в диапазоне 0,0025 ÷ 0,015 г.-экв/л)
Установлено, что увеличение концентрации соли выше 0,005 г.-экв/л. приводит к снижению доли получающегося водорастворимого комплекса. Оптимальное значение концентрации СuSО 4 ·5Н 2 O, при которой образуется наибольшая масса водорастворимого комплекса, составляет 0,005 г.-экв/л (выход металлокомплекса = 87%).
В таблице 1 представлены основные характеристические частоты сигналов ИК-спектров яблочного пектина, пектата натрия и пектинового комплекса с катионами Сu2+.
Таблица 1.
Основные характеристические частоты ИК спектров (в см-1) яблочного пектина, пектата натрия и пектинового комплекса с катионами Сu2+
Table 1.
Main characteristic frequencies of IR spectra (cm-1) of apple pectin, sodium pectate and pectin complex with Сu2+ cations
|
Типы колебаний | Type of vibrations |
Яблочный пектин | Apple pectin |
Пектат натрия | Sodium pectate |
ПГNаСu | РGNаСu |
|
ν (OH) С , ν (Н 2 O) |
3385 |
3372 |
3370 |
|
ν (CH) Е , ν (CH) К |
2932 |
2928 |
2928 |
|
ν (C = O) Е , ν (C = O) А |
1744 |
– |
– |
|
ν (COO-) |
– |
1604 |
1603 |
|
δ (Н 2 O) |
1627 |
– |
– |
|
ν , δ (C-OH) А |
– |
1412 |
1414 |
|
δ s (СН 3 ) Е |
1424 |
– |
– |
|
δ (СН 3 ) К |
1317 |
1323 |
1325 |
|
ν (C-O-C) |
– |
– |
1136 |
|
ν (С-С) (С-О) К |
1099, 1010 |
1117, 1005 |
1001 |
|
Пульсационные колебания пиранозных колец Pulsating vibrations of pyranose rings |
836, 729, 624, 572, 522 |
820, 754, 633, 525 |
820, 756,633, 527 |
Во всех спектрах обнаружены сигналы функциональных групп ν (OH) С (3385 см-1), ν (CH) Е и ν (CH) К (2932 см-1), ν (C = O) Е и ν (C = O) А (1744 см-1), пиранозный цикл (836, 729, 624, 572, 522 см-1), характерные для пектина.
Контроль за эффективностью включения катионов Сu2+ проводили также методом ИК- спектроскопии, (рисунок 5). В ИК спектре пектата натрия исчезновение сигнала при 1744 см-1
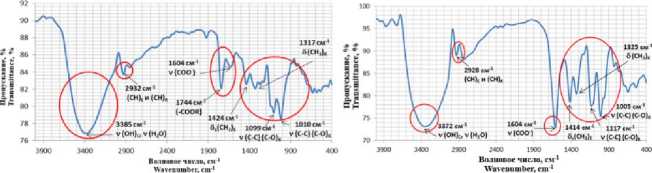
b)
Рисунок 5. ИК-спектры: а) исходный пектин, b) пектат натрия, c) пектат-медный комплекс
Figure 5. IR spectra: a) native pectin, b) sodium pectate, c) pectate-copper complex
На рисунке 5 (c) представлен ИК-спектр комплекса ПГNаСu, который отличается не только от исходного пектина, но и от пектата натрия.
Смещение валентных колебаний гидроксильных групп пектина (3600–3200 см-1) в низкочастотную область на 12–15 см-1 указывает на разрыв или ослабление водородных связей в результате образования координационных связей катионов металла с гидроксильными группами моносахаридов, рисунок 3. В области 1119–1136 см-1 наблюдается смещение полосы пропускания валентных колебаний пиранозного цикла (С–О) на 1–17 см-1, что обусловлено связыванием ионов металлов с кислородным атомом гидроксилов, что коррелирует с ранее опубликованными данными [7, 9]. Снижение интенсивности полосы пропускания при 1603 см-1 (сигнал карбоксильных групп) свидетельствует о замещении
(валентные колебания карбонилов карбоксильных и сложноэфирных групп) свидетельствует о замещении протонов H+ и сложноэфирных групп на ионы Na+. Усиление интенсивности полосы пропускания карбоксианиона в области 1604 см-1 свидетельствует об образовании солевой формы пектина. Следовательно, в результате синтеза получается комплекс состава: пектат-натрий-медь (ПГNаСu).
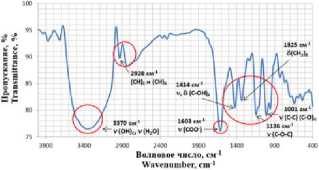
ионов натрия катионами меди. Расчет степени замещения (СЗ) осуществлялся по формуле (3) и составил 18%.
Противогрибковую активность исследовали с использованием аэробной грибковой культуры рода Penicillum , вызывающей поражение кожи и пазух носа. Характеристику противогрибкового действия полисахаридных препаратов осуществляли по регистрации ингибирования роста грибковых культур при действии на них водных растворов исходного пектина и медного комплекса. Для ингибирования использовали водные 3% растворы различных объемов (10 и 50 мкл), которые наносили в чашку Петри на поверхность свежевыросших колоний грибковой культуры. При этом установлено, что добавление 50 мкл раствора комплекса оказывает более выраженный ингибирующий эффект, рисунок 6.

Рисунок 6. Ингибирование исходным пектином и пектиновым комплексом роста грибковой культуры Penicillum sp : а) исходный пектин, b) медный комплекс 10 мкл., c) медный комплекс 50 мкл
Figure 6. Inhibition of growth of fungal culture Penicillium sp . by the native pectin and the pectin complex: a) native pectin, b) pectate-copper complex 10 µl, c) pectate-copper complex 50 µl
С каждым образцом эксперимент проводили в 3-x повторах. Посевы выдерживали от 3 до 7 суток при температуре 25 °С. За положительный противогрибковый результат принималась концентрация препарата в среде, при которой отсутствовал видимый рост культуры.
Исходный яблочный пектин не показал противогрибковой активности (рисунок 6а), о чем свидетельствует отсутствие ореола распространения капли нанесенного раствора на поверхность грибковой культуры.
Медный комплекс продемонстрировал подавление роста грибов уже при нанесении 10 мкл препарата, что подтверждается образованием четкого ореола по границе диффузии раствора медного комплекса (рисунок 6b). Увеличение объема ингибитора (две точки по 50 мкл, рисунок 6с) демонстрирует более активное угнетение роста Penicillum sp ., на что указывает не только присутствие ореола нанесенной капли, но и изменение цвета внутри зоны задержки роста, а также увеличение диаметра зоны в 1,5–2 раза.
Заключение
В ходе выполненной работы получены металлокомплексы на основе яблочного пектина и катионов меди с выходом 87%.
Методом кислотно-основного титрования определена степень этерификации (СЭ = 65,5%) и содержание свободных карбоксильных групп яблочного пектина К с = 2,61%.
Установлено, что оптимальная концентрация сульфата меди для получения водорастворимых комплексов составляет С н = 0,005 г.-экв/л.
Метод ИК-спектроскопии позволил подтвердить включение катионов натрия по смещению и изменению интенсивности сигналов исходного пектина. Методом ИК-спектроскопии определена степень замещения катионов натрия на катионы меди (СЗ = 18%).
При исследовании противогрибковой активности определен оптимальный объем раствора металлокомплекса (50 мкл), необходимый для регистрации ингибирующей активности грибковой культуры Penicillum sp . Показано, что исходный яблочный пектин не обладает фунгицидной активностью, в то время как медный комплекс на его основе способен подавлять рост культуры уже при действии 10 мкл, а при увеличении его объема до 50 мкл происходит не только расширение зоны воздействия ингибитора в 1,5–2 раза, но и изменение цвета внутри диска задержки роста, что может указывать на гибель грибковых гифов.
Полученные результаты открывают перспективу практического применения пектиновых комплексов с ионами меди для создания противогрибковых мазей, гелей, пластырей с пролонгированным антимикробным действием.
Список литературы Синтез и исследование композитных материалов на основе яблочного пектина и катионов меди
- Bush P.L. Pectin: Chemical Properties, Uses and Health Benefits. New York: Nova Science Publishers, 2014. 268 р.
- Kuzmann E., Garg V., Oliveira A., Klencsár Z. et al. Mössbauer study of the effect of pH on Fe valence in iron-polygalacturonate as a medicine for human anaemia // Radiation Physics and Chemistry. 2015. V. 107. P. 195-198.
- Lara-Espinoza C., Carvajal-Millán E., Balandrán-Quintana R., López-Franco Y. et al. Pectin and Pectin-Based Composite Materials: Beyond Food Texture // Molecules. 2018. V. 23. P. 942.
- Minzanova S.T., Mironov V.F., Vyshtakalyuk A.B., Tsepaeva O.V. et al. Complexation of pectin with macro - and microelements. Antianemic activity of Na, Fe and Na, Ca, Fe complexes // Carbohydrate Polymers. 2015. V. 134. P. 524-533.
- Minzanova S.T., Mironov V.F., Mironova L.G., Nemtarev A.V. et al. Synthesis, properties, and antianemic activity of new metal complexes of sodium pectinate with iron and calcium // Russian Chemical Bulletin. 2019. V. 68. № 1. P. 48-54.
- Minzanova S.T., Mironov V.F., Mironova L.G., Nizameev I.R. et al. Synthesis, properties, and antimicrobial activity of pectin complexes with cobalt and nickel // Chemistry of Natural Compounds. 2016. V. 52. P. 26-31.
- Мударисова Р.Х., Куковинец О.С., Колесов С.В., Глазырин А.Б. Металлокомплексы низкометоксилированных пектинов с ионами меди(II) // Вестник Башкирского университета. 2021. Т. 26. № 1. C. 40-46.
- Михеева Л.А., Тры А.В. Выделение пектина из растительного сырья и изучение его некоторых химических свойств // Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. 2013. № 2. С. 53-56.
- Minzanova S.T., Mironov V.F., Khabibullina A.V., Arkhipova D.M. et al. New metal complexes of citrus pectin with magnesium ions: synthesis, properties, and immunomodulatory activity // Russian Chemical Bulletin, International Edition. 2021. V. 70. № 3. P. 433-443.
- Xuemei M., Jing J., Yu J., Wang J. et al. Synthesis and Characterization of a Novel Apple Pectin-Fe(III) Complex // ACS Omega. 2021. V. 1. № 2. P. 1391-1399.
- Nemiwal M., Zhang T., Kumar D. Pectin modified metal nanoparticles and their application in property modification of biosensors // Carbohydrate Polymer Technologies and Applications. 2021. V. 2. P. 100164.
- Al-Muhanna M.K.A., Hileuskaya K.S, Kulikouskaya V.I., Kraskouski A.N. et al. Preparation of stable sols of silver nanoparticles in aqueous pectin solutions and properties of the sols // Colloid Journal. 2015. V. 77. №. 6. P. 683-690.
- Venkatakrishnan S., Veerappan G., Elamparuthi E., Veerappan A. Aerobic synthesis of biocompatible copper nanoparticles: promising antibacterial agent and catalyst for nitroaromatic reduction and C-N cross coupling reaction // RSC Advances. 2014. V. 4. № 29. P. 15003-15006.
- Baran T. Pd(0) nanocatalyst stabilized on a novel agar/pectin composite and its catalytic activity in the synthesis of biphenyl compounds by Suzuki-Miyaura cross coupling reaction and reduction of o-nitroaniline // Carbohydrate Polymers. 2018. V. 195. P. 45-52.
- Qiu W.Y., Wang Y.Y., Wang M., Yan, J.K. Construction, stability, and enhanced antioxidant activity of pectin-decorated selenium nanoparticles // Colloids and Surfaces B: Biointerfaces. 2018. V. 170. P. 692-700.
- Pornwilard M-M., Somchue W., Shiowatana J., Siripinyanond A. Flow field-flow fractionation for particle size characterization of selenium nanoparticles incubated in gastrointestinal conditions // Food Research International. 2014. V. 57. P. 203-209.
- Клебанова Н.А., Тарасова А.В., Седакова В.А., Клебанов А.В. Титриметрическое определение карбоксильных групп продуктов ферментации высоко- и низкоэтерифицированных пектинов // Проблемы устойчивого развития регионов Республики Беларусь и сопредельных стран: сборник научных статей XI Международной научно-практической интернет-конференции. Могилев, 2022. С. 5-8.
- Минзанова С.Т., Архипова Д.М., Хабибуллина А.В., Миронова Л.Г. и др. Получение новых металлокомплексов пектината натрия с ионами кобальта и никеля и их антимикробная активность // Доклады академии наук. 2019. Т. 487. № 5. С. 511-514.
- Wu X., Mort A. Structure of a Rhamnogalacturonan Fragment from Apple Pectin: Implications for Pectin Architecture // International Journal of Carbohydrate Chemistry. 2014. P. 1-6.
- Миронов В.Ф., Карасева А.Н., Цепаева О.В., Выштакалюк А.Б. и др. Некоторые новые аспекты комплексообразования пектиновых полисахаридов с катионами dметаллов // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. № 3. C.45-50.
- Gupta M., Mahajan V., Mehta K., Chauhan P. Zinc Therapy in Dermatology: A Review // Dermatology Research and Practice. 2014. P. 1-12.
- Миронов В.Ф., Карасева А.Н., Выштакалюк А.Б., Минзанова С.Т. и др. Водорастворимые цинк- и никельсодержащие металлокомплексы пектиновых полисахаридов. Биологическая активность цинковых металлокомплексов // Химия и компьютерное моделирование. Бутлеровские сообщения. 2004. Т. 5. № 3. С. 36-38.


