Синтез и исследование структуры g-замещенного дибензоилметаната дифторида бора
Автор: Свистунова Ирина Валентиновна, Заводянский Матвей Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 2 т.15, 2023 года.
Бесплатный доступ
Получен дикетонатный комплекс дифторида бора, в котором у β-углеродных атомов находятся фенильные группы, а у центрального атома углерода (g) - 2-бромтиоэтильная группа. Комплекс был охарактеризован результатами элементного анализа, методами ИК, ЯМР 1Н спектроскопии, а также рентгеноструктурного анализа (РСА). По данным РСА, появление заместителя у g-углеродного атома приводит к развороту фенильных групп, обусловленому необходимостью компенсировать отталкивание между ними и атомом серы гамма-заместителя. Результатом подобного разворота является нарушение сопряжения между электронными системами хелатного цикла и β-заместителей, которое делает невозможным сопряжение β-фенильных групп с π-электронной системой хелатного цикла. В результате g-замещенный дибензоилметанат дифторида бора не проявляет люминесцентных свойств, характерных для незамещённого комплекса. Борнохелатные циклы располагаются в кристалле, образуя линейные цепи: циклы одной цепи компланарны друг другу и одинаково ориентированы в пространстве: связи C-O молекул, образующих цепь, параллельны линии цепи и направлены в одну сторону. При этом экваториально расположенные атомы фтора (F(2)) координируются к атомам серы соседней молекулы. Все атомы фрагмента B-F(2)…S-C(2) лежат в одной плоскости. Образование подобных структур обусловлено координацией отрицательно заряженного атома фтора к связанному с g-углеродом атому заместителя, который несёт небольшой положительный заряд. Сведения о структуре полученного комплекса (таблицы координат атомов, длин связей и валентных углов) депонированы в Кембриджском банке структурных данных № 2174579, deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Дибензоилметанат дифторида бора, комплексы бора, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147240931
IDR: 147240931 | УДК: 546.27+546.22+548.1+542.913 | DOI: 10.14529/chem230206
Текст научной статьи Синтез и исследование структуры g-замещенного дибензоилметаната дифторида бора
Получен дикетонатный комплекс дифторида бора, в котором у β-углеродных атомов находятся фенильные группы, а у центрального атома углерода (γ) – 2-бромтиоэтильная группа. Комплекс был охарактеризован результатами элементного анализа, методами ИК, ЯМР 1Н спектроскопии, а также рентгеноструктурного анализа (РСА). По данным РСА, появление заместителя у γ-углеродного атома приводит к развороту фенильных групп, обусловленому необходимостью компенсировать отталкивание между ними и атомом серы гамма-заместителя. Результатом подобного разворота является нарушение сопряжения между электронными системами хелатного цикла и β-заместителей, которое делает невозможным сопряжение β-фенильных групп с π-электронной системой хелатного цикла. В результате γ-замещенный дибензоилметанат дифторида бора не проявляет люминесцентных свойств, характерных для незамещённого комплекса. Борнохелатные циклы располагаются в кристалле, образуя линейные цепи: циклы одной цепи компланарны друг другу и одинаково ориентированы в пространстве: связи C-O молекул, образующих цепь, параллельны линии цепи и направлены в одну сторону. При этом экваториально расположенные атомы фтора (F(2)) координируются к атомам серы соседней молекулы. Все атомы фрагмента B-F(2)…S-C(2) лежат в одной плоскости. Образование подобных структур обусловлено координацией отрицательно заряженного атома фтора к связанному с γ-углеродом атому заместителя, который несёт небольшой положительный заряд. Сведения о структуре полученного комплекса (таблицы координат атомов, длин связей и валентных углов) депонированы в Кембриджском банке структурных данных № 2174579, ; .
В настоящее время во многих лабораториях проводятся исследования оптических свойств комплексов дифторида бора с β-дикетонами [1, 2]. Некоторые из этих комплексов проявляют агрегационно-индуцированную люминесценцию [3], фосфоресценцию при комнатной температуре [4], сольватохромизм [5], термохромизм [6, 7], механохромизм [8], что делает подобные соединения перспективными для использования в качестве оптических сенсоров [9], компонентов органических светодиодов, электролюминесцентных и полимерных флуоресцентных материалов [10]. Отдельные представители этих комплексов использованы для флуоресцентной биовизуализации [11].
Известно, что появление люминесцентных свойств происходит при расширении π-электронной системы хелатного цикла за счёт сопряжения с ароматическими заместителями, находящимися у β-углеродных атомов хелатного цикла. Типичным представителем подобных люминофоров является дибензоилметанат дифторида бора – F2B(dbmH), в котором у β-углеродных атомов находятся фенильные группы. Нас интересовало, как повлияет на оптические свойства этого комплекса введение к центральному атому углерода хелатного цикла заместителя, обладающего p-электронами и способного взаимодействовать с π-электронной системой хелатного цикла. В настоящее время единственным описанным в литературе примером γ-замещённого ди-бензоилметаната дифторида бора является димерный комплекс, в котором дибензоилметанатный и ацетилацетонатные фрагменты соединены через атом серы [12]. Однако соседство двух борно- хелатных фрагментов, каждый из которых обладает собственными β-заместителями, приводит к значительному стерическому отталкиванию между ними и не позволяет однозначно оценить результат воздействия введённого /-заместителя. Нам требовался дибензоилметанатный комплекс, содержащий более компактный заместитель. Для получения подобного комплекса мы использовали подход, ранее отработанный на примере ацетилацетонатных комплексов: обработка сульфенилхлоридных (бромидных) производных комплексов бора непредельными соединениями, кетонами, другими реагентами позволяет получить широкий круг тиозамещенных хелатов бора [13]. Таким образом нами был получен дибензоилметанат дифторида бора, содержащий в качестве заместителя у /-углеродного атома тиоэтилбромидную группу - F2B(dbmSC2H4Br).
Экспериментальная часть
Синтез F 2 B( dbm SC 2 H 4 Br) (1) . В раствор 0,253 г (0,66 ммоль) F 2 B( dbm SBr) в 10 мл сухого хлороформа в течении 0,5 часа пропускали этилен. При этом реакционная смесь поменяла цвет с красного на жёлто-оранжевый. После удаления растворителя в вакууме остаток перекристаллизовывали из смеси хлороформ-гексан. Было получено 162 мг кристаллов жёлтого цвета. Выход 72 %. Образец для рентгеновского исследования был получен после дополнительной перекристаллизации из смеси бензол-гексан: т. пл. 154-157 ° С, вычислено для C17H14BBrF2O2S, %: C 49,67; S 7,80; Br 19,44. Найдено, %: C 49,38; S 7,69; Br 19,30. ИК, v , см-1: 1599, 1582 (Ph); 1503, 1495 (C=O); 1452; 1431 (C=C); 1340; 1173; 1145; 1084; 1050. ЯМР 1 Н, 5 , м.д.: 2,53 (2H, t, J = 7,75 Гц, SCH 2 ); 3,02 (2H, t, J = 7,75 Гц, CH 2 Br); 7,56; 7,69; 8,10 (10H, t, t, d, 2 C 6 H 5 ).
.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры
|
Параметр |
Значение |
|
Формула |
C 17 H 14 BBrF 2 O 2 S |
|
М |
411,06 |
|
Температура, К |
293,15 |
|
Сингония |
моноклинная |
|
Пр. группа |
P 2 1 /c |
|
a , Å |
10,105(12) |
|
b , Å |
8,962(7) |
|
c , Å |
20,185(15) |
|
а , град. |
90,00 |
|
β, град. |
99,31(4) |
|
Y , град. |
90,00 |
|
V , Å3 |
1804(3) |
|
Z |
4 |
|
р (выч,), г/см3 |
1,514 |
|
- 1 ц , мм |
2,419 |
|
F (000) |
824,0 |
|
Размер кристалла, мм |
0,28 × 0,13 × 0,06 |
|
Область сбора данных по 9 , град. |
6,12 - 56,68 |
Окончание табл. 1
|
Параметр |
Значение |
|
Интервалы индексов отражений |
-13 < h < 13, -11 < k < 11, -26 < l < 26 |
|
Измерено отражений |
41239 |
|
Независимых отражений |
4451 [ R int = 0,0546, R siama = 0,0254] |
|
Переменных уточнения |
246 |
|
GOOF |
1,010 |
|
R -факторы по F 2> 2 о ( F 2) |
R 1 = 0,0395, w R 2 = 0,0862 |
|
R -факторы по всем отражениям |
R 1 = 0,0685, w R 2 = 0,0974 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,33/-0,30 |
Таблица 2
|
Связь, d, A |
Угол, го , град |
||
|
Br(1A)-C(5A) |
2,014(8) |
C(2)S(1)C(4) |
99,35(15) |
|
S(1)-C(2) |
1,779(2) |
C(2)S(1)C(4A) |
100,01(18) |
|
S(1)-C(4) |
1,832(6) |
C(4A)S(1)C(4) |
30,9(2) |
|
S(1)-C(4A) |
1,830(6) |
C(1)O(1)B(1) |
122,63(17) |
|
O(1)-C(1) |
1,301(3) |
C(3)O(2)B(1) |
122,95(18) |
|
O(1)-B(1) |
1,489(3) |
C(25)C(24)C(23) |
120,2(3) |
|
F(2)-B(1) |
1,359(3) |
C(24)C(23)C(22) |
120,2(3) |
|
O(2)-C(3) |
1,302(3) |
C(23)C(22)C(21) |
120,0(3) |
|
O(2)-B(1) |
1,482(3) |
C(22)C(21)C(3) |
117,4(2) |
|
F(1)-B(1) |
1,347(3) |
C(26)C(21)C(22) |
119,6(2) |
|
C(24)-C(23) |
1,373(5) |
C(26)C(21)C(3) |
123,0(2) |
|
C(24)-C(25) |
1,370(5) |
O(2)C(3)C(21) |
113,10(18) |
|
C(23)-C(22) |
1,379(4) |
O(2)C(3)C(2) |
120,82(19) |
|
C(22)-C(21) |
1,390(3) |
C(2)C(3)C(21) |
126,06(19) |
|
C(21)-C(3) |
1,478(3) |
C(3)C(2)S(1) |
121,21(16) |
|
C(21)-C(26) |
1,382(3) |
C(1)C(2)S(1) |
120,59(16) |
|
C(3)-C(2) |
1,407(3) |
C(1)C(2)C(3) |
118,10(19) |
|
C(2)-C(1) |
1,403(3) |
O(1)C(1)C(2) |
121,28(19) |
|
C(1)-C(11) |
1,481(3) |
O(1)C(1)C(11) |
112,55(18) |
|
C(11)-C(12) |
1,384(3) |
C(2)C(1)C(11) |
126,17(19) |
|
C(11)-C(16) |
1,400(4) |
C(12)C(11)C(1) |
122,0(2) |
|
C(12)-C(13) |
1,382(4) |
C(12)C(11)C(16) |
119,4(2) |
|
C(13)-C(14) |
1,384(4) |
C(16)C(11)C(1) |
118,4(2) |
|
C(14)-C(15) |
1,364(4) |
C(13)C(12)C(11) |
119,9(2) |
|
C(5)-C(4) |
1,498(8) |
C(12)C(13)C(14) |
120,2(3) |
|
C(5)-Br(1) |
2,009(6) |
C(15)C(14)C(13) |
120,4(2) |
|
C(15)-C(16) |
1,388(4) |
C(4)C(5)Br(1) |
103,1(4) |
|
C(26)-C(25) |
1,389(4) |
C(5)C(4)S(1) |
111,8(4) |
|
C(4A)-C(5A) |
1,480(11) |
C(14)C(15)C(16) |
120,1(3) |
|
C(15)C(16)C(11) |
119,9(3) |
||
|
F(2)B(1)O(1) |
107,7(2) |
||
|
F(2)B(1)O(2) |
108,3(2) |
||
|
O(2)B(1)O(1) |
109,35(19) |
||
|
F(1)B(1)O(1) |
108,8(2) |
||
|
F(1)B(1)F(2) |
113,3(2) |
||
|
F(1)B(1)O(2) |
109,4(2) |
||
|
C(21)C(26)C(25) |
119,7(3) |
||
|
C(24)C(25)C(26) |
120,3(3) |
||
|
C(5A)C(4A)S(1) |
110,7(5) |
||
|
C(4A)C(5A)Br(1A) |
107,8(5) |
||
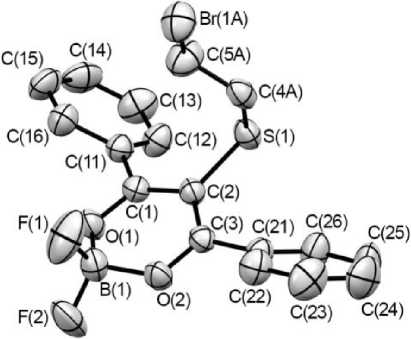
Рис. 1. Структура и нумерация атомов в F 2 B( dbm SCH 2 CH 2 Br)
Обсуждение результатов
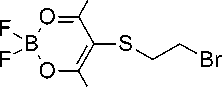
Тиобромэтилсодержащий дибензоилметанатный комплекс был получен с хорошим выходом при обработке соответствующего сульфенилбромида этиленом:
Ph
F
F
sb r + h2C ch2
Ph
Ph
Ph
Соединение 1 является кристаллическим веществом жёлтого цвета, которое совершенно не меняется при длительном хранении. Оно хорошо растворимо в ароматических растворителях, умеренно в хлороформе и крайне слабо в эфире и спирте. В отличие от незамещенного дибензо-илметаната, комплекс 1 не имеет заметной люминесценции.
По содержанию углерода, серы и брома соединение 1 хорошо соответствует расчётным значениям. В ИК спектре комплекса в области 1600-1560 см-1 лежит две полосы средней интенсивности, обусловленные колебаниями р-фенильных колец. В отличии от незамещенного дибензо-илметаната, в спектре комплекса 1 хелатированная группа С=О наблюдается сдвоенной полосой (1452, 1431 см-1), а частота колебаний группы С=С в хелатном цикле понижается до 1431 см-1. Таким образом, для спектров замещённого дибензоилметаната дифторида бора, как и для спектров замещённых ацетилацетонатов дифторида бора, не выполняется «правило Драйдена» [17], в соответствии с которым в ИК спектрах Y -замещённых р-дикетонатов металлов колебания групп С=С и С=О в хелатном цикле наблюдаются одной полосой.
В ЯМР 1 Н спектре присутствует два триплета, обусловленные поглощением протонов двух метиленовых групп во фрагменте SCH2CH2Br, а также три мультиплета в области 7,5-8,1 м. д., обусловленные поглощением десяти протонов двух равноценных в-фенильных групп.
Комплекс 1 имеет пониженную летучесть, поэтому нам не удалось исследовать его методом хромато-масс-спектрометрии и получить для него масс-спектр.
В результате проведённого РСА исследования было установлено, что строение комплекса 1 полностью соответствует предполагаемой структуре - к центральному атому углерода дибензо-илметаната дифторида бора присоединена 1-тио-2-бромэтильная группа.
Хелатный цикл в дибензоилметанатном комплексе повторяет строение цикла в ацетилацето-натном комплексе: группа BF 2 и Y -углеродный атом выходят из плоскости, образуемой атомами О(1)…С β (1)…С β (3)…О(2), придавая хелатному циклу конформацию ванны. Величина излома по линиям О...О и С р ^С р составляет 19,2 и 6,4°. Длины парных связей в цикле выравнены. В незамещённом дибензоилметанате цикл являлся менее изогнутым: величина изломов составляла 16,2 и 3,9° [18]. Введение заместителя не меняет длину связей, в том числе связей C р (1)-C Y и С р (2)-С у . Поэтому нет оснований говорить о том, что отталкивание между у - и р-заместителями увеличивает длину связи C р -C Y и тем самым меняет геометрию цикла.
Y -Заместитель имеет строение обычное для сульфидной группы: атомы C Y -S-C(C2H 4 Br) располагаются под углом 99,4°, а сами атомы находятся в плоскости, повёрнутой относительно плоскости хелатного цикла почти перпендикулярно - на 76,4 ° .
β-Фенильные группы располагаются под углами 41 и 45° к плоскости хелатного цикла. Подобным расположением β-заместителей комплекс 1 существенно отличается от незамещённого дибензоилметаната, в котором β-фенильные группы практически компланарны плоскости хелатного цикла [18]. Очевидно, разворот фенильных групп обусловлен необходимостью компенсировать отталкивание между ними и атомом серы введённого заместителя. Результатом подобного разворота является нарушение сопряжения между электронными системами хелатного цикла и β-заместителей, что приводит к исчезновению люминесценции у комплекса 1 .
Хелатные циклы располагаются в кристалле, образуя линейные цепи: циклы одной цепи компланарны друг другу и одинаково ориентированы в пространстве: связи C-O молекул, образующих цепь, параллельны линии цепи и направлены в одну сторону. При этом экваториально расположенные атомы фтора (F(2)) координируются к атомам серы соседней молекулы. Все атомы фрагмента B-F(2)…S-C(2) лежат в одной плоскости, что обеспечивает линейность упаковки молекул. Ранее аналогичная упаковка была обнаружена у некоторых замещённых ацетилацетона-тов – F 2 B(acacCl), F 2 B(acacBr) [19], F 2 B(acacSCN) [20]. Предполагается, что образование подобных структур обусловлено координацией отрицательно заряженного атома фтора к связанному с Y —углеродом атому заместителя, который несёт небольшой положительный заряд [19].
Кроме того, мы полагаем, что именно это межмолекулярное взаимодействие приводит к выходу борфторидной группы из плоскости хелатного цикла и увеличению его излома.
Выводы
В результате проделанной работы предложен способ получения дибензоилметанатов дифторида бора с серосодержащим заместителем у центрального атома углерода хелатного цикла. Установлено, что появление заместителя у центрального атома углерода препятствует сопряжению электронных системы хелатного цикла и ароматических заместителей, находящихся у β-угле-родных атомов, что приводит к исчезновению люминесцентных свойств борного комплекса.
Выражаем благодарность проф. В.В. Шарутину за проведённые рентгеноструктурные исследования.
Список литературы Синтез и исследование структуры g-замещенного дибензоилметаната дифторида бора
- Aromatic difluoroboron p-diketonate complexes: effects of n-conjugation and media on optical properties / S. Xu, R.E. Evans, L. Tiandong, G. Zhang, J.N. Demas, C.O. Trindle, C.L. Fraser // Inorg. Chem. 2013. Vol. 52. P. 3597-3610. DOI: 10.1021/ic300077g
- Non-conventional low-molecular-weight organogelators with superhydrophobicity based on fluorescent P-diketone-boron difluorides / P. Zhu, X. Yan, Y. Li, H. Lan, S. Xiao // Dyes and Pigments. -2020. Vol. 175. 108176 DOI: 10.1016/j.dyepig.2019.108176
- Effects of alkyl chain length on aggregation-induced emission, self-assembly and mechanofluo-rochromism of tetraphenylethene modified multifunctional P-diketonate boron complexes / H. Gao, D. Xu, Y. Wang, Y. Wang, X. Liu, A. Han, C. Zhang // Dye. Pigment. 2018. Vol. 150. P. 59-66. DOI: 10.1016/j.dyepig.2017.11.018
- Multi-emissive difluoroboron dibenzoylmethane polylactide exhibiting intense fluorescence and oxygen-sensitive room-temperature phosphorescence / G. Zhang, J. Chen, S.J. Payne, S.E. Kooi, J.N. Demas, C.L. Fraser // J. Am. Chem. Soc. 2007. Vol. 129. P. 8942-8943. DOI: 10.1021/ja0720255
- Crystal structures and emission properties of the BF2 Complex 1-phenyl-3-(3,5-dimethoxyphe-nyl)-propane-1,3-dione: multiple chromisms, aggregation- or crystallization-induced emission, and the self-assembly effect / P. Galer, R.C. Korosec, M. Vidmar, B. Sket // J. Am. Chem. Soc. 2014. Vol. 136. P. 7383-7394. DOI: 10.1021/ja501977a
- Luminescence and reversible luminescence thermochromism of bulk and microcrystals of diben-zoylmethanatoboron difluoride / A.G. Mirochnik, E.V. Fedorenko, V.G. Kuryavyi, B.V. Bukvetskii, V.E. Karasev // J. Fluoresc. 2006. Vol. 16, no. 3. P. 279-286. DOI: 10.1007/s10895-005-0039-7
- Мирочник А.Г., Федоренко Е.В. Температурно-зависимая люминесценция дикетонатов дифторида бора. Формирование и диссоциация J-агрегатов // Известия Академии наук. Серия химическая. 2023. Т. 72, № 1. С. 223-232.
- Polymorphism, mechanofluorochromism, and photophysical characterization of a carbonyl substituted difluoroboron-p-diketone derivative / M. Louis, A. Brosseau, R. Guillot, F. Ito, C. Allain, R. Me-tivier // J. Phys. Chem. C. 2017. Vol. 121. P. 15897-15907. DOI: 10.1021/acs.jpcc.7b01901
- Plasmonic fluorescence enhancement of DBMBF2 monomers and DBMBF2-toluene exciplexes using Al-hole arrays / T.M. Schmidt, V.E. Bochenkov, J.D.A. Espinoza, E.C.P. Smits, A.M. Muzafarov, Y.N. Kononevich, D.S. Sutherland // J. Phys. Chem. C. 2014. Vol. 118. P. 2138-2145. DOI: 10.1021/jp4110823
- Color tuning of avobenzone boron difluoride as an emitter to achieve full-color emission / H.W. Mo, Y. Tsuchiya, Y. Geng, T. Sagawa, C. Kikuchi, H. Nakanotani, F. Ito, C. Adachi // Adv. Funct. Mater. 2016. Vol. 26. P. 6703-6710. DOI: 10.1002/adfm.201601257
- Fluorescent boron difluoride curcuminoides as perspective materials for bio-visualization / A.G. Mirochnik, Z.N. Puzyrkov, E.V. Fedorenko, I.V. Svistunova, A.A. Markova, A.V. Shibaeva, I.D. Burtsev, A.A. Kostyukov, A.E. Egorov, V.A. Kuzmin // Spectrochimica Acta Part A. 2023. Vol. 291. P. 122319. D0I:10.1016/j.saa.2023.122319
- Synthesis and structure of boron difluoride binuclear p-diketonates / I.V. Svistunova, V.V. Sha-rutin, G O. Tretyakova, Z.N. Puzyrkov // Inorg. Chim. Acta. 2020. Vol. 501. P. 119230. DOI: 10.1016/j .ica.2019.119230
- Svistunova I.V., Shapkin N.P., Zyazeva Mu.Y. Boron difluoride acetylacetonate sul-fenyl(selenyl) halides // Russian Journal of General Chemistry. 2010. V. 80. № 12. P. 2430-2437. DOI: 10.1134/S1070363210120054
- Bruker. SMART and SAINT-Plus Data Collection and Processing Software for the SMART System Versions 5.0, Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data Versions 5.10, Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V. OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Holtzclaw H.F., Collman J.P. / Infrared Absorption of Metal Chelate Compaunds of 1,3-Diketones // J. Am. Chem. Soc. 1957. Vol. 79, no. 13. P. 3318-3322. DOI: 10.1021/ja01570a006.
- Crystal structure and excimer fluorescence of dibenzoylmethanatoboron difluoride / A.G. Mi-rochnik, B.V. Bukvetsky, E.V. Gukhman, P.A. Zhikhareva, V.E. Karasev // Russian Chemical Bulletin. 2001. Vol. 50, no. 9. P. 1612-1615. DOI: 10.1023/A:1013086518794
- A study of the crystal structure of chloro-and bromo-substituted acetylacetonates of boron dif-luoride / I.V. Svistunova, V.V. Korochentsev, N.P. Shapkin, V.I. Vovna, A.V. Gerasimenko // J. Struct. Chem. 2012. Vol. 53, no. 6. P. 1105-1110. DOI: 10.1134/S0022476612060133
- Structure and vibrational spectra of iodo-, acetoxy- and thiocyanato-substituted acetylacetonates of boron difluoride / L.A. Kuarton, O.B. Ryabchenko, I.V. Svistunova, B.V. Bukvetskii // J J. Mol. Struct. 2019. Vol. 1175. P. 512-523. DOI: 10.1016/j.molstruc.2018.07.100


