Синтез и электрохимические характеристики катодного материала LiNi1/3Mn1/3Co1/3O2
Автор: Нефедова Ксения Валерьевна, Сивцова Ольга Викторовна, Журавлев Виктор Дмитриевич, Бамбуров Виталий Григорьевич, Павленко Елена Анатольевна, Галкина Елена Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Исследованы условия синтеза LiNi1/3Mn1/3Co1/3O2 с двумя видами внутреннего органического топлива: поливинилового спирта и аминоуксусной кислоты (глицина). Рассмотрено влияние природы органического компонента на электрохимические характеристики материала.
Глицин-нитратный синтез, катодный материал
Короткий адрес: https://sciup.org/147160188
IDR: 147160188
Текст научной статьи Синтез и электрохимические характеристики катодного материала LiNi1/3Mn1/3Co1/3O2
Оксид лития никеля марганца кобальта (3:1:1:1:6) представляет собой альтернативу широко известному ЫСоОг [1]. Это более дешевый и менее токсичный материал по сравнению с LiCoO2 и его аналогом LiNiO2 [2]. Впервые он был получен твердофазным способом Ohsuku и Makimura [3]. Новый оксид представляет собой один из твердых растворов ЫЬПохМпоз-хСог^Ог, обладает слоистой ромбоэдрической структурой (а = 2,85730 А, с = 14,2250 А, пр.гр. R-Зт). Известно, что электрохимическая активность и качество материала ЫН1|/зМп|/зСо1/зО2 весьма чувствительны к условиям синтеза [4]. В настоящей работе исследованы условия получения и характеристики Ы№1/зМП1/зСО1/зО2 в реакциях combustion synthesis (CS) [5] с поливиниловым спиртом (ПВС) и аминоуксусной кислотой (глицин). Цель работы - создать основу технологии производства катодного материала в интересах ОАО «Сатурн».
Экспериментальная часть
В качестве исходных реактивов использовали нитраты кобальта, никеля, марганца и лития. Синтез проводили в два этапа: на первом получали смешанный сложный оксид CoMnNiOx, сжигая растворы, содержащие нитраты солей, и в качестве комплексующего агента и топлива - ПВС или глицин. Полученный тонкодисперсный порошок смешанного оксида трех металлов пропитывали раствором лития азотнокислого, сушили и отжигали при 900—1 000 °C с последующим помолом в специальных стержневых мельницах из метакрилата при умеренных скоростях и нагрузке (2-3): 1. После аттестации на монофазность, распределение, морфологию частиц и определения удельной поверхности полученный материал направлялся на электрохимические испытания. Содержание электрохимически активного материала в электродах составляло - 85 мае. %, 10 мае. % - электропроводная добавка, 5 мае. % - поливинилиденфторид. В качестве противо-электрода применён литиевый электрод (металлический литий, армированный отожжённой никелевой сеткой). Электролит: 1 М раствор LiPF6 в смеси этиленкарбоната с диметилкарбонатом (1:1 вес. ч.). В качестве сепаратора использовали материал марки ПОРП-А. Перед сборкой катоды были высушены при 130 °C в течение 16 часов в вакууме. Группы были собраны в атмосфере аргона и герметизированы в трехслойной фольге (ламинированная конструкция) с предварительным вакуумированием и заправкой электролитом. На ресурсные испытания было поставлено по две группы образцов, полученных с двумя видами топлива.
Обсуждение результатов
Теоретически в условиях стехиометрии уравнения
Co(NO3)2 + Ni(NO3)2 + Mn(NO3)2 + 2,5 NH2 - CH2 - COOH ->•
-> CoMnNiO4 5 + 4,25 N2 + 5 СО2 + 6,25 Н2О + 1,125 О2
процесс протекает с полным восстановлением оксидов азота, выделяющихся при разложении нитратов металлов.
Однако ранее было показано [6], что оксиды tZ-металлов обладают каталитическим эффектом и восстановление диоксида азота начинается при меньших относительных концентрациях восстановителя (50-70 % от теоретического), в роли которого выступает как органическое топливо, так и окисляющиеся до более высоких степеней катионы Со2+ и Мп2+. Поэтому содержание восстановителя в обоих случаях не превышало 0,7 от теоретического количества. Установлено, что интенсивность процесса CS исследуемого материала определяет наличие в исходном растворе кобальта азотнокислого. Процессы с ПВС протекают более спокойно, чем с глицином. Однако технологическим недостатком этого варианта синтеза является неконтролируемое увеличение объема реакционной массы при нагревании. По этой причине синтез с глицином в режиме объемного горения (ф = 0,8—1,0) приводит к потерям продукта и более технологичными оказались режимы с ф < 0,8.
Готовые порошки представляют овальные нано- и субмикронные частицы, собранные в агрегаты (рис. 1), с пиком распределения на 2-4 мкм (рис. 2) и удельной поверхностью 0,21-1,78 м2/г.
I
5kV ХЮ,000 1pm 1649 09 30 SEI 10kV Х5,000 5pm 1658 14 30 SEI
а) б)
Рис. 1. Микрофотографии образцов к1М11/зМп1/зС01/з02,, полученных с ПВС (а), с глицином (6)
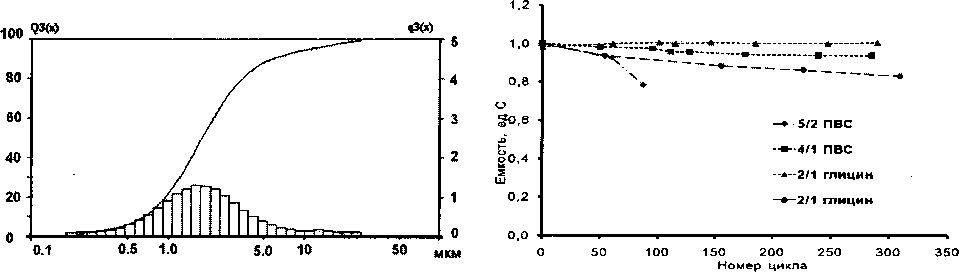
Рис. 2. Кривая распределения частиц по размеру Рис. 3. Изменение емкости на контрольных циклах в процессе циклирования
Несмотря на близость характеристик оксида, полученного с ПВС и глицином, оценка начальной удельной емкости синтезированного катодного материала показала (рис. 3), что после 300 циклов деградация отсутствует лишь у образца, полученного с глицином. В табл. 1 представлены данные по измерению сопротивления материалов, полученных с ПВС и с глицином.
Там же для сравнения приведены характеристики образца кобальтата лития производства фирмы «Umicore» (LCO). Из представленных данных видно, что сопротивления синтезированных образцов примерно одинаковы. В то же время при использовании кобальтата лития аналогичные сопротивления меньше в 2-3 раза. Вероятно, истинное сопротивление синтезированного материала выше, чем у кобальтата лития вследствие влияния различной дисперсности образцов.
Нефедова К.В., Сивцова О.В., Журавлев В.Д., Синтез и электрохимические характеристики Бамбуров В.Г., Павленко Е.А., Галкина Е.В.катодного материала ЦНи/зМпмСомОг
Начальную удельную емкость определяли в режиме: заряд током 5 мА до 4,2 В и разряд током 5 мА до 3,0 В. Было проведено три цикла (рис. 4). Как видно из полученных данных, удельная емкость образцов не имеет существенных отличий и находится в диапазоне 139-148 мА ч/г.
Таблица 1
Измерение сопротивления материалов
|
№ образца |
D50, мкм |
Удельная поверхность (ВЕТ), м2/г |
К(1-П), Омсм при давлении прессования т/см2 |
Rh(l-n), Ом см проката |
||
|
0,9 |
2,0 |
2,8 |
||||
|
ПВС 1/12 |
1,4 |
0,82 |
3,2 |
1,8 |
1,6 |
20,6 |
|
ПВС 2/12 |
1,8 |
1,78 |
3,5 |
2,0 |
1,7 |
23,7 |
|
Глицин 4/12 |
3,4 |
0,21 |
з,з |
1,9 |
1,6 |
18,6 |
|
LCO |
11,0 |
0,22 |
0,9 |
0,8 |
0,6 |
5,2 |
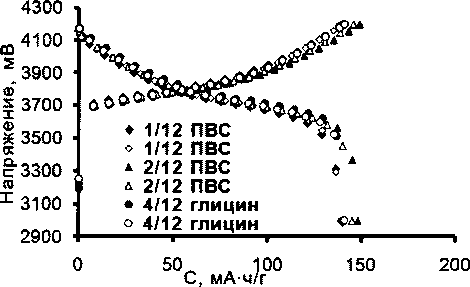
Рис. 4. Заряд-разряд на цикле тренировки /з = /р = 0,1 С; Us = 4,2 В; Up = 3 В
Поляризационные характеристики оценивали при заряде до напряжения 4,2 В и разряде до 3,0 В одинаковыми токами заряда и разряда. Испытания проводили при трех значениях тока -0,1С, 0,2С и 0,5С. Полученные результаты представлены в табл. 2. Видно, что средние разрядные напряжения образцов практически одинаковы и не зависят от вида горючего. Относительная разрядная емкость с ростом тока разряда повышается в ряду образцов от ПВС к глицину.
Таблица 2
Относительная разрядная емкость для различных токов
|
Ток |
Номер электрохимической группы |
|||||
|
ПВС 1 |
ПВС 1 |
ПВС 2 |
ПВС 2 |
Глицин |
Глицин |
|
|
0,1С |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
|
0,2С |
0,91 |
0,90 |
0,935 |
0,94 |
0,97 |
0,95 |
|
0,5С |
0,69 |
0,78 |
0,78 |
0,81 |
— |
— |
Были выполнены исследования начального циклирования токами 0,2 и 0,5С (рис. 5). На рис. 6 представлены результаты контрольных циклов перед началом циклирования током 0,5С и после 50 циклов. Как видно из представленных данных, деградация образцов, при токе циклирования 0,2С, возрастает в ряду глицин - ПВС. Хотя все образцы имели одинаковую предысторию, для токового режима 0,5С соотношение по стабильности образцов не так очевидно. Но просматривается некоторая начальная деградация на проведенных циклах. Возможно, она связана с большим суммарным количеством циклов в различных режимах.
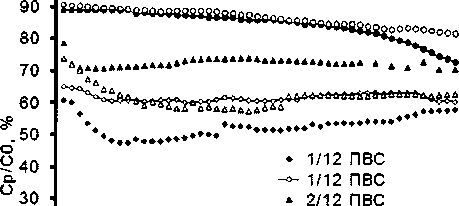
20 •
10 ■
* 2/12 ПВС
-*- 4/12 глицин
° 4/12 глицин
* 90
О 88
§ 86
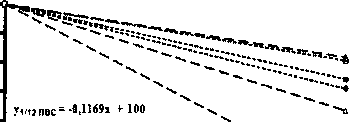
У$.:12ПЮ~"0Д^35х + 100
У2Ч2 пвс = -0,0739т + 100 у*д* пвс = 0.1467, +100
У4/11 глеем ='0Д039, + 100
У4л$г™= -0,0784, + 100
♦ 1/12 ПВС
♦ 1/12 ПВС
* 2/12 ПВС
* 2/12 ПВС
■ 4/12 глицин о 4/12 глицин
О 10 20 30
Номер цикла
40 50
0 10 20 30 40 50 60
Номер цикла
Рис. 5. Циклирование током /з = /р = 0,5С в интервале напряжений 4,2-2,7 В; t = 22-24 °C
Рис. 6. Изменение емкости на контрольных циклах /з = /р = 0,1С
Заключение
Результаты проведенных испытаний показывают, что характеристики материала не уступают известным импортным образцам.
Работа выполнена в рамках проекта ОХНМ № 09-Т-3-10.
Список литературы Синтез и электрохимические характеристики катодного материала LiNi1/3Mn1/3Co1/3O2
- Rossen, Е. Structure and electrochemistry of LixMnyNi1-yO2/E. Rossen, C.D.W. Jones, J.R. Dahn//Solid State Ionics. -1992. -Vol. 57, № 3-4. -P. 311-318.
- Ohzuku, T. Layered lithium insertion material of LiNi1/2Mn1/3Co1/2O2: A possible alternative to LiCo02 for advanced lithium-ion batteries/T. Ohzuku, Y. Makimura//Chemistry Letters. -2001. -Vol. 8. -P. 744-745.
- Ohzuku, T. Layered lithium insertion material of LiCo1/3Ni1/3Mn1/3O2 for lithium-ion batteries/T. Ohzuku, Y. Makimura//Chemistry Letters. -2001. -Vol. 7. -P. 642-643.
- Effect of synthesis method on the electrochemical performance of LiNi1/3Mn1/3Co1/3O2/D. Li, T. Muta, L. Zhang et al.//Journal of Power Sources. -2004. -Vol. 132. -P. 150-155.
- Mukasyan, A.S. Solution combustion synthesis of nanomaterials/A.S. Mukasyan, P. Epstein, P. Dinka//Proceedings of the combustion institute. -2007. -Vol. 31. -P. 1789-1795.
- Журавлев, В.Д. Получение нанооксидов меди и никеля/В.Д. Журавлев, К.В. Нефедова, О.Г. Резницких//Альтернативная энергетика и экология. -2007. -№ 8. -С. 20-24.


