Синтез и оптические свойства наночастиц оксида железа для фотодинамической терапии
Автор: Куликова Мария Владимировна, Кочубей Вячеслав Иванович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-1 т.14, 2012 года.
Бесплатный доступ
Разработана методика синтеза наночастиц оксида железа (III). Определены размеры, степень агрегации и оптические свойства полученных наночастиц. Проведено фотодинамическое воздействие на патогенную микрофлору.
Синтез наночастиц, оксид железа, подавление роста микрофлоры
Короткий адрес: https://sciup.org/148201165
IDR: 148201165 | УДК: 533.9.082.5
Текст научной статьи Синтез и оптические свойства наночастиц оксида железа для фотодинамической терапии
Увеличение доли поверхностных атомов наночастиц с уменьшением размера кардинально меняет физические и химические свойства наночастиц, что делает их значительно отличающимися от компактных материалов. Уникальные свойства наночастиц ведут к тому, что многие отрасли наук занимаются внедрением нанотехнологий и изучением свойств наночастиц [1, 2].
Магнитные наночастицы представляют особый интерес для исследований и имеют большой потенциал в применении их в биологии и медицине. Токсичность оксидных наночастиц невысока по сравнению с металлическими наночастицами, поэтому они используются для реализации уникальных методов, таких как целевая доставка [3], термическая терапия, например, при нагреве лазерным или СВЧ излучением до температур разрушения расположенной вокруг патологической ткани, и т.д. [4].
В то же время развитая поверхность наночастиц приводит к ее повышенной химической активности, что даёт возможность применения оксидных наночастиц для подавления роста патогенных бактерий, в том числе, устойчивых к антибиотикам [5, 6]. Облучение наночастиц сравнительно маломощным излучением может приводить к фотостимулированным реакциям на поверхности наночастиц. Такие реакции – в частности, генерацию синглетного кислорода – используют при фотодинамической терапии, в частности, также возможно применение для подавления роста патогенной микрофлоры.
стиц в биологии и медицине и применение полученных наночастиц для подавления роста патогенной микрофлоры.
-
2. ПОЛУЧЕНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА (III)
-
2.1. Синтез наночастиц оксида железа (III)
-
-
2.2. Исследование свойств полученных наночастиц
Одной из задач работы являлся выбор метода синтеза магнитных наночастиц с малым разбросом по размеру и форме. Применение наночастиц в биомедицинских целях требовало выбрать способ получения непокрытых наночастиц, так как использование поверхностно-активных веществ привело бы к увеличению токсичности наночастиц. В то же время, отсутствие стабилизирующего покрытия должно приводить к агрегации наночастиц [2].
Синтез проводился следующим образом: 0,5 г хлорида железа (III) (FeCl3) и 20 мл дистиллированной воды постепенно смешивали с 6 мл водного 40% раствора аммиака. Смешивание проводилось в течение 10 минут. При этом увеличивалось рассеяние света образующимися наночастицами, и раствор и приобретал характерный коричневый цвет. Таким образом, был получен гидроксид железа (III).
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
Полученный гидроксид железа (III) отделялся от воды центрифугированием и сушился в течение суток. Затем гидроксид железа (III) разлагался на оксид железа (III) обжигом при 450°С
2Fe(OH)3 = Fe2O3 + 3H2O.
На рис. 1 представлено изображение наночастиц, полученное на атомно-силовом микроскопе SOLVER-P47 в контактном режиме. Видно, что наночастицы имеют размер от 5 нм до 20

Рис. 1. АСМ-изображение наночастиц Fe2O3 нм, при этом они образуют кластеры размером примерно 250 нм. Слипание наночастиц происходит на этапе отжига при 450°С и разложения гидроксида железа (III). Наночастицы имеют практически сферическую форму. В полуконтак-тном режиме в магнитной моде было получено изображение магнитных свойств частиц. На рис. 2 представлено изображение пространственного распределения магнитных сил по поверхности образца.
Видно, что кластеры частиц размером примерно 250 нм обладают магнитными свойствами. Форма поверхности на изображении фазы совпадает с формой самих частиц, то есть частицы имеют однородное строение и обладают магнитными свойствами.
На спектрофотометре Lambda 950 в интервале длин волн от 350 до 800 нм были получены спектры поглощения взвеси наночастиц в воде. На рис. 3 представлен спектр поглощения. На рисунке виден край поглощения, соответствующий приблизительно 400 нм. Данный спектр соответствует наноразмерному оксиду железа (III), отличающемуся от массивного образца. [7] Таким образом можно утверждать, что в результате синтеза получены наночастицы оксида железа (III), обладающие магнитными свойствами.
-
3. ВОЗДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ЖЕЛЕЗА (III) НА РОСТ ПАТОГЕННОЙ МИКРОФЛОРЫ
На базе Биологического Факультета СГУ было проверено воздействие полученных наночастиц на рост патогенной микрофлоры.
Частицы, растворённые в воде в концентрации 0.005 вес %, вводили в микрофлору и облу-

а)
Рис. 2. АСМ-изображение наночастиц Fe2O3 а) рельеф, б) фаза

б)

0,02
300 400 500 600 700 800
к, nm
Рис. 3. Спектр поглощения наночастиц Fe2O3
чали светодиодом с плотностью мощности 31,5 мВт/см2 в течение 5, 10,15 и 30 минут в диапазоне длин волн от 385 до 425 нм, что соответствует максимуму поглощения наночастиц в видимой области. На рис. 4 - 6 представлена зависимость изменения концентрации патогенной микрофлоры от времени облучения. Для вида S.aureus заметен спад численности микрофлоры в обоих случаях, однако в присутствии наночастиц концентрация убывает заметно быстрее
При облучении образца S.Simulans менее 10 минут также заметен спад. Однако при дальнейшем облучении наблюдается рост численности микрофлоры, причём более заметный в присутствии наночастиц.
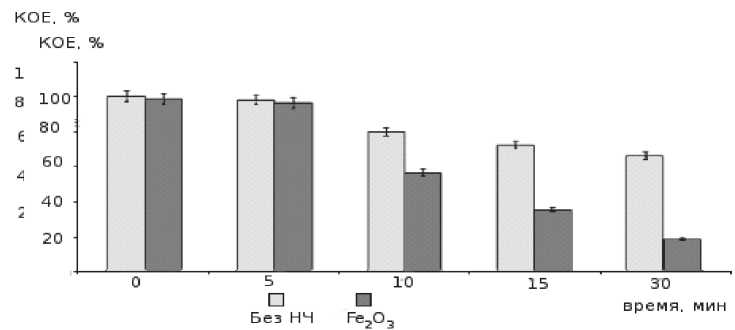
Рис. 4. Концентрация S.aureus в зависимости от времени облучения в присутствии наночастиц и без них
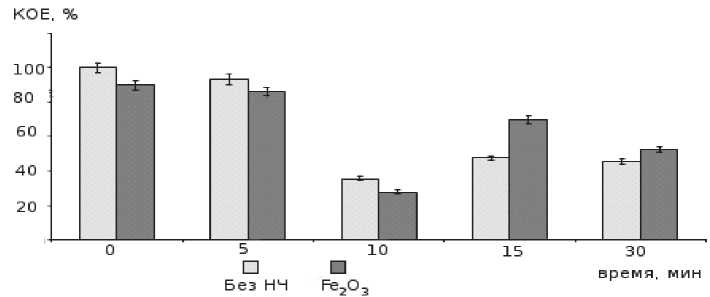
Рис. 5. Концентрация S.simulans в зависимости от времени облучения в присутствии наночастиц и без них
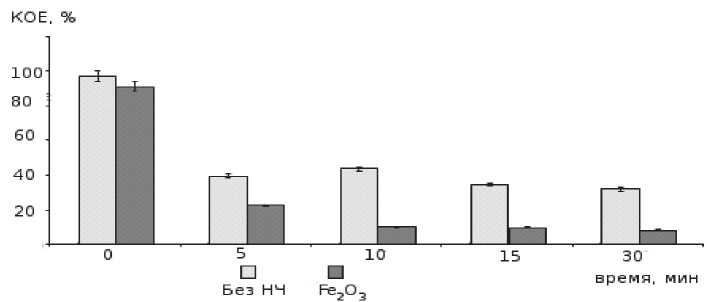
Рис. 6. Концентрация Dermabacter hominis в зависимости от времени облучения в присутствии наночастиц и без них
Облучение образца Dermabacter hominis показало ещё большее воздействие наночастиц оксида железа (III) на подавление роста микрофлоры: численность бактерий значительно снизилась по сравнению с облучением без присутствия наночастиц.
При облучении наночастиц оксида железа (III) на длине волны, соответствующей максимуму поглощения, оказывается также тепловое воздействие на раствор. На табл. 1 представлены температуры облучаемых растворов в зависимости от времени облучения. Растворы, в которых при облучении присутствовали наночастицы оксида железа (III), нагревались более чем на 10 °С по сравнению с образцами без наночастиц. Однако такое повышение температуры не является смертельным для данных образцов микрофлоры. Более того, возможно, что именно повышение температуры провоцирует увеличение концентрации микрофлоры.
Из табл. 1 видно, что температура раствора значительно возрастает при наличии наночастиц, хотя и не достигает значений, критического для патогенной микрофлоры.
При облучении наночастиц на длине волны, соответствующей максимальному поглощению, на поверхности наночастиц возможна фотохимическая реакция, ведущая к образованию син-
Таблица 1. Изменение температуры растворов при облучении
ЗАКЛЮЧЕНИЕ
По разработанной методике синтеза получены наночастицы; Fe2O3, продемонстрировано, что данный метод позволяет получать наночастицы в массовом производстве. Определены свойства, размеры, степень агрегации и оптические свойства полученных наночастиц. Полученные наночастицы использованы в экспериментах, проведенных на биологическом факультете СГУ по фотодинамическому воздействию на патогенную микрофлору. Определены характерные времена облучения лазерным светом, за которые происходит подваление роста микрофлоры.
Список литературы Синтез и оптические свойства наночастиц оксида железа для фотодинамической терапии
- Магнитные наночастицы: методы получения, строение и свойства/С.П. Губин, Ю.А.Кокшаров, Г.Б. Хомутов, Г.Ю. Юрков//Успехи химии. 2005. Т.74. №6.C.539-574.
- Першина А.Г., Сазонов А.Э., Мильто И.В. Использование магнитных наночастиц в медицине//Бюллетень сибирской медицины. 2008. № 2. С. 70-78.
- Peng X H., Qian X., Mao H. Targeted magnetic iron oxide nanoparticles for tumor imaging and therapy//International Journal of Nanomedicine. 2008. 3(3). 311-321.
- Hergt, S. Dutz, R. Müller, M. Zeisberger Magnetic particle hyperthermia: nanoparticle magnetism and materials development for cancer therapy//Journal of Physics: Condensed Matter, 2006, 18 (38), S2919 34.
- Photoactive Hybrid Nanomaterial for Targeting, Labeling, and Killing Antibiotic Resistant Bacteria/C. A. Strassert, M. Otter, R.Q. Albuquerque, A. Hцne, Y. Vida, B Maier L. De Cola//Angew. Chem. Int. Ed.. 2009. Vol 48. 42. 7928-7931.
- Saptarshi Chatterjee, Arghya Bandyopadhyay, Keka Sarkar Effect of iron oxide and gold nanoparticles on bacterial growth leading towards biological//Journal of Nanobiotechnology 2011. URL http://www.jnanobiotechnology.com/content/9/1/34 (дата обращения 20.03.2012).
- Lladi Merhari Hybrid nanocomposites for nanotechnology: electronic, optical, magnetic and biomedical applications//Springer Science+Buisness Media LCC (2009). 488-492.


