Синтез и предварительные in vivo исследования радиофармпрепаратов на основе металлокомплексов радионуклида технеция-99m с аналогами соматостатина
Автор: Тищенко В.К., Федорова А.В., Рыжикова Т.П., Чибисова О.Ф., Степченкова Е.Д., Белкина С.В., Цишнатти Н.А., Щербакова А.Н., Власова О.П., Минаева Н.Г., Морозова Н.Б., Иванов С.А.
Рубрика: Научные статьи
Статья в выпуске: 3 т.34, 2025 года.
Бесплатный доступ
Нейроэндокринные опухоли представляют собой гетерогенную группу злокачественных новообразований, происходящих из нейроэндокринных клеток. Их ключевой особенностью является сверхэкспрессия рецепторов соматостатина – молекулярной мишени, обеспечивающей возможность таргетного нацеливания радионуклида в составе радиофармацевтических лекарственных препаратов (РФЛП). Применение РФЛП на основе синтетических аналогов соматостатина пептидной природы, меченных технецием99m (99mТс), позволяет не только определять локализацию первичного опухолевого очага и очагов метастазирования, но и позволяет проводить мониторинг ответа на лечение с последующим наблюдением за рецидивом заболевания. Цель данного исследования – синтез металлокомплексов 99mTcHYNICTOC и 99mTcHYNICTATE и проведение оценки биораспределения полученных соединений in vivo. Металлокомплексы 99mTcHYNICTOC и 99mTcHYNICTATE были синтезированы с использованием ЭДДА и трицина в качестве солигандов при нагревании до 95 С в присутствии хлорида олова SnCl2·2H2O. Радиохимическая чистота 99mTcHYNICTOC и 99mTcHYNICTATE превышала 90%. При однократном внутривенном введении полученных металлокомплексов лабораторным мышам с ксенотрансплантатом SKMel28 было продемонстрировано повышенное накопление исследуемых РФЛП в опухоли по сравнению с большинством внутренних органов и тканей, за исключением почек. Содержание 99mTcHYNICTOC и 99mTcHYNICTATE в почках составило 1,36649,637 %/г и 4,79746,661 %/г соответственно. При этом статистически значимых различий в уровнях накопления 99mTcHYNICTOC и 99mTcHYNICTATE во внутренних органах и тканях отмечено не было. Полученные результаты демонстрируют возможность дальнейшего применения разработанных РФЛП для визуализации нейроэндокринных опухолей.
Аналоги соматостатина, технеций-99m, нейроэндокринные опухоли, соматостатиновые рецепторы, HYNIC-TOC, HYNIC-TATE, радиофармпрепарат, сцинтиграфия рецепторов соматостатина, лабораторные мыши, радиобиология, ядерная медицина
Короткий адрес: https://sciup.org/170210834
IDR: 170210834 | УДК: 616-006.04:577.112.6:546.718.02.99:599.323.4 | DOI: 10.21870/0131-3878-2025-34-3-18-29
Текст научной статьи Синтез и предварительные in vivo исследования радиофармпрепаратов на основе металлокомплексов радионуклида технеция-99m с аналогами соматостатина
Молекулярной основой таргетной радионуклидной диагностики и терапии нейроэндокринных опухолей (НЭО) является повышенная экспрессия соматостатиновых рецепторов (ССТр) клетками опухоли по сравнению с окружающими здоровыми тканями. Именно эта особенность делает возможным адресную доставку радионуклида непосредственно к опухоли с минимальным воздействием на нетаргетные (неопухолевые) клетки.
Своевременная диагностика онкологического заболевания во многом определяет дальнейшую тактику и исход лечения. На сегодняшний день функциональная визуализация НЭО с
Тищенко В.К.* – зав. лаб., д.б.н.; Федорова А.В. – ст. науч. сотр., к.б.н.; Рыжикова Т.П. – вед. инженер; Чибисова О.Ф. – науч. сотр.; Степченкова Е.Д. – мл. науч. сотр.; Белкина С.В. – вед. науч. сотр., к.б.н.; Цишнатти Н.А. – лаборант; Щербакова А.Н. – инженер; Власова О.П. – вед. науч. сотр., к.б.н.; Минаева Н.Г. – вед. науч. сотр., к.б.н.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Морозова Н.Б. – ст. науч. сотр., к.б.н. МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
применением радиофармацевтических лекарственных препаратов (РФЛП) на основе пептидов, синтетических аналогов соматостатина, является важным исследованием, позволяющим оценить экспрессию и функциональную активность молекулярной мишени (ССТр), а также принять решение о целесообразности дальнейшей биотерапии аналогами соматостатина или таргетной радионуклидной терапии.
Первым препаратом, предложенным для функциональной визуализации ССТр, стал 123I-Tyr3-октреотид, не получивший широкого распространения в практической медицине из-за низкой доступности 123I и сложности радиохимического синтеза самого препарата.
С 1993 г. для диагностики и стадирования НЭО проводится сцинтиграфия рецепторов соматостатина (СРС) с 111In-DTPA-октреотидом (пентетреотидом) [1]. В России для этих целей был разработан и зарегистрирован отечественный РФЛП «Октреотид, 111In», аналог зарубежного РФЛП «Oктреоскан», предназначенный для первичной предоперационной диагностики НЭО, вторичной диагностики НЭО и контроля их гормонального и химиотерапевтического лечения [2]. Однако с недавнего времени производство лиофилизата октреотида для приготовления РФЛП в России прекращено [1].
На сегодняшний день основным методом диагностики НЭО является позитронно-эмиссионная томография (ПЭТ), часто в сочетании с КТ или МРТ, с использованием РФЛП на основе аналогов соматостатина DOTA-TOC или DOTA-TATE (реже DOTA-NOC) и радионуклида 68Ga. Однако невысокая доступность ПЭТ-сканеров и значительная стоимость проводимых исследований диктуют необходимость поиска более доступных и дешевых методов диагностики НЭО. Так, технеций-99m (99mTc) до сих пор является наиболее используемым радионуклидом в диагностической ядерной медицине, что обусловлено оптимальными характеристиками его ядер-ного распада (Т 1/2 =6,01 ч, Е γ =140,5 кэВ, 98,6%) и удобством получения с помощью коммерчески доступных генераторов 99W/99mTc [3, 4]. Кроме того, значительные усовершенствования гамма-камер за счёт оснащения твердотельными кристаллами, состоящими из сплава теллуридов кадмия и цинка, и инновационными конструкциями коллиматоров привели к тому, что пространственное разрешение однофотонной эмиссионной компьютерной томографии (ОФЭКТ) приближается к разрешению ПЭТ без сопутствующего снижения чувствительности [3]. В России на сегодняшний день имеется зарегистрированный набор реагентов Тектротид (Tektrotyd®, Polatom, Польша) для приготовления РФЛП 99mTc-EDDA/HYNIC-TOC. Полученный раствор 99mTc-Тектротид предназначен для использования у взрослых в качестве вспомогательного средства при диагностике и лечении НЭО с вовлечением ССТр, помогая выявлению их локализации. В состав набора входят два флакона, каждый из которых содержит лиофилизат для приготовления раствора для инъекций. Однако стоимость такого исследования в диагностических центрах России составляет 65-75 тыс. рублей. Предполагается, что появление отечественного РФЛП с 99mTc, нацеленного на ССТр, позволит увеличить доступность диагностики НЭО для онкологических пациентов в Российской Федерации.
Таким образом, цель данного исследования – синтез РФЛП на основе металлокомплексов радионуклида 99mTc с аналогами соматостатина и проведение оценки биораспределения полученных соединений in vivo .
Материалы и методы
Химическая часть
-
99mT в виде пертехнетата натрия Na99mTcO 4 получали из генератора 99Mo/99mTc ГТ-4К (АО «НИФХИ им. Л.Я. Карпова», Россия).
В работе использовали химические предшественники HYNIC-TOC и HYNIC-TATE (мол. массы 1169,5 и 1183,4 соответственно) в форме лиофилизата с чистотой не менее 96% производства АО «Фарм-Синтез» (Россия). Использовали вспомогательные компоненты и реактивы: трицин (Merck, Германия), этилендиаммония диацетат (ЭДДА, Merck, Германия), глюконат натрия (Sigma Aldrich, США), олово (II) хлорид 2-водное (Merck, Германия), соляная кислота концентрированная 36% хч (ООО «ХИМПРОМ-М», Россия), ацетон осч (АО «ЭКОС-1», Россия), ацетонитрил осч для ВЭЖХ сорт 0 (Криохим, Россия), пластины для тонкослойной хроматографии ТСХ Sorbfil силикагель СТХ-1А на алюминиевой подложке (Imid Ltd., Россия).
Синтез металлокомплексов 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE осуществляли следующим образом. Во флаконы, содержащие 50 мкг HYNIC-TOC и HYNIC-TATE в лиофильной форме, добавляли 0,5 мл воды, перемешивали до полного растворения и переносили растворы во флаконы объёмом 10 мл. Затем к растворенному пептиду добавляли 15-20 мг трицина, растворенного в 0,5 мл воды для инъекций, 5-10 мг ЭДДА, растворенного в 1,5 мл воды для инъекций, а также 20 мг глюконата натрия в 0,4 мл воды для инъекций (50 мг/мл). Полученную смесь тщательно перемешивали, добавляли 15 мкг хлорида олова SnCl 2 ·2H 2 O, предварительно растворенного в 0,1 мл 0,1 М соляной кислоты, и элюат 99mTc. Каждый реакционный флакон укупоривали резиновой пробкой и завальцовывали алюминиевым колпачком. Флаконы с полученными реакционными смесями помещали в нагревательный блок нагревательной системы для приготовления радиофармпрепаратов НФ-10А (ООО «НТЦ Амплитуда») и выдерживали при температуре 95 ° С в течение 30 мин, после чего охлаждали при комнатной температуре и фильтровали через фильтрующую насадку с размером пор 0,22 мкм (Acrodisc®, Pall Corporation, США).
Качество полученных РФЛП оценивали по следующим параметрам: внешний вид, наличие механических примесей, рН растворов и радиохимические примеси (РХП). Определение внешнего вида и наличия механических примесей в растворах РФЛП осуществляли визуальным методом через защитное стекло с эквивалентом свинца 25-30 мм. Измерение рН проводили с использованием индикаторной бумаги с узкой шкалой рН (Johnson, Великобритания). Определение РХП осуществляли методом быстрой тонкослойной хроматографии на полосках Sorbfil с силикагелем СТХ-1А на алюминиевой подложке с тремя различными подвижными фазами в качестве элюентов: ацетон – для определения свободного 99mTcO 4 - (R f 0,9-1,0), 0,9% NaCl – для определения комплексов 99mTc-ЭДДА/99mTc-трицин (R f 0,9-1,0) и ацетонитрил-вода в соотношении 1:1 – для определения коллоидного TcO 2 (R f 0,0-0,1). Для этого стерильным шприцем отбирали по 50 мкл препаратов в пластиковую пробирку типа эппендорф. Затем микродозатором 5 мкл препарата наносили на хроматографические полоски длиной 110 мм и шириной 10 мм. Полоски помещали в хроматографические камеры. После поднятия элюента на высоту 100 мм, полоски извлекали из хроматографической камеры, высушивали при комнатной температуре и проводили радиометрию разрезанной на фрагменты полоски с помощью автоматического гамма-счётчика «2480 Wizard» (Perkin Elmer/Wallac, Финляндия). Сумма РХП не должна превышать 10%.
Биологическая часть
В качестве тест-систем использовали лабораторных мышей линии NU/J – самки с перевитой подкожно меланомой SK-Mel-28 (масса: 17-23 г; возраст: 7-8 недель; количество: 31 особь). Животные были получены из ЦКП «Центр генетических ресурсов лабораторных животных («SPF-виварий») ИЦиГ СО РАН» (г. Новосибирск). Все животные поступили с ветеринарным паспортом и сертификатом качества.
Прибывшие животные до начала исследования были помещены в отдельные комнаты на период адаптации/карантина (14 сут). Во время этого периода у животных контролировали проявление отклонений в состоянии здоровья.
Животные содержались по 3-4 особи в пластиковых клетках ИВК GM500 Sealsafe PLUS (Tecniplast, Италия) в контролируемых условиях окружающей среды (температура 24-28 °C и относительная влажность 30-57%). В комнатах содержания животных поддерживался 12-часовой цикл освещения и, по крайней мере, 10-кратная смена объёма воздуха комнаты в час.
Клеточная линия меланомы человека SK-Mel-28 получена из коллекции ECACC (European Collection of Authenticated Cell Cultures). Для получения подкожных ксенографтов меланомы человека SK-Mel-28 каждому животному вводили по 100 мкл клеточной суспензии (5 x 10 6 клеток) подкожно в область расположения правой молочной железы грудной клетки.
Введение металлокомплексов 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE осуществлялось через 14 сут после перевивки опухоли. Для этого каждому животному линии NU/J вводили внутривенно (в хвостовую вену) однократно РФЛП 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE в объёме 0,1 мл с активностью 0,39 МБк/мышь и 0,52 МБк/мышь соответственно. После введения радиоактивных веществ животные содержались в изолированном помещении, специально предназначенном для работы с РФЛП.
Биораспределение РФЛП в организме животных оценивали ex vivo по общей и удельной интенсивности ионизирующего излучения в образцах внутренних органов и тканей, измеренного радиометрическим методом на автоматическом гамма-счётчике «2480 Wizard» (Perkin Elmer/Wallac, Финляндия).
В различные сроки после внутривенного введения РФЛП (через 5 мин, 1, 3 и 24 ч) по 3-4 животных на каждый срок подвергали эвтаназии путём цервикальной дислокации, выделяли образцы органов и тканей, помещали их в предварительно взвешенные пластиковые пробирки, взвешивали на лабораторных электронных весах («Sartorius», Германия) и проводили радиометрию. На момент введения в отдельную пробирку отбирали пробу РФЛП в объёме 0,1 мл для использования в качестве стандарта введённой дозы.
По данным радиометрии на каждый срок наблюдения рассчитывали концентрацию РФЛП на 1 г органа или ткани (%/г), а также общее содержание препаратов в органе или ткани (%/орган) с использованием непосредственно полученных результатов взвешивания органов или таблиц среднего веса соответствующих органов или тканей мышей [5].
Также были рассчитаны коэффициенты дифференциального накопления (КДН) как частное от деления величин концентраций РФЛП в опухоли к концентрации в других органах и тканях мышей.
Статистический анализ данных выполняли с использованием программы Origin 2019b с вычислением средних арифметических значений (M) и стандартных ошибок среднего (SEM). Значимость межгрупповых различий оценивали с использованием U-критерия Манна-Уитни. Различия считали достоверными при p<0,05.
Результаты и их обсуждение
В результате анализа литературных данных было установлено, что HYNIC (6-гидразинонико-тиновая кислота) – один из наиболее популярных бифункциональных хелаторов для 99mTc [6-10]. Поскольку HYNIC может координироваться с металлом не более чем через 2 донорные группы (пиридильный азот и гидразиновый азот), он не может занять всю координационную сферу 99mTc, поэтому координационная сфера должна быть заполнена с помощью дополнительных солигандов. В качестве солигандов чаще всего используются этилендиамин диацетат (ЭДДА) и трицин [11, 12]. Основываясь на этих данных, а также на результатах собственного опыта по разработке технологии синтеза РФЛП с 99mTc, в качестве солигандов были выбраны ЭДДА и трицин.
-
99mTc элюируется из генератора в виде водного раствора пертехнетата натрия Na99mTcO 4 , который не вступает в реакцию комплексообразования, из-за чего его нужно восстанавливать до более низкой степени окисления для лёгкого взаимодействия с хелатообразующими реагентами. Чаще всего для этих целей используется хлорид олова SnCl 2 ·2H 2 O.
Анализ литературных источников также продемонстрировал, что для связывания 99mTc с лигандами HYNIC-TOC и HYNIC-TATE требуется нагревание реакционной смеси до 100 ° С в течение 10-60 мин [6-10]. Поэтому в данной работе введение радиоактивной метки также осуществлялось при нагревании до 95 ° С в течение 30 мин.
Полученные РФЛП 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE представляют собой растворы для внутривенного введения. Описать их можно как прозрачные бесцветные растворы, свободные от посторонних включений. рН растворов 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE составили 5,2 и 5,0 соответственно. Радиохимическая чистота 99mTc-HYNIC-TOC составила 94,2%, 99mTc-HYNIC-TATE – 95,1%.
В целом РФЛП 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE характеризовались сходным профилем биораспределения in vivo (рис. 1). В опухоли максимальное накопление РФЛП 99mTc-HYNIC-TOC составило 7,764 ± 1,371 %/г в срок 5 мин, после чего наблюдалось снижение концентрации препарата до 2,177 ± 0,223 %/г, 1,804 ± 0,093 %/г и 0,255 ± 0,024 %/г в сроки 1, 3 и 24 ч соответственно. Начальное содержание 99mTc-HYNIC-TATE в опухоли было выше по сравнению с 99mTc-HYNic—TOC и достигало 16,517 ± 0,827 %/г (p>0,05). Однако уже через 1 ч концентрация 99mTc-HYNIC-TATE снизилась до значений, сопоставимых с таковыми для 99mTc-HYNIC-TOC.
Следует отметить, что оба РФЛП быстро выводятся из крови. Так, через 1 ч после введения содержание 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE в крови снизилось почти в 6 раз по сравнению с первоначальным значением. В последующие сроки концентрация обоих препаратов продолжала снижаться, и через 24 ч в крови оставалось не более 0,2%/г 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE (рис. 1).
Особый интерес представляет изменение концентрации РФЛП 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE в почках, являющихся критическим органом при введении радиоконъюгатов – производных аналогов соматостатина, вследствие выведения РФЛП преимущественно через мочевыделительную систему. Из-за относительно небольшого размера пептидов, по сравнению с другими биомолекулами, такими как белки и антитела, пептиды часто демонстрируют улучшенную фармакокинетику за счёт способности эффективно проникать в опухоли, быстрого выведения из кровотока и неопухолевых тканей, а также отсутствия иммуногенности [13]. С другой стороны, пептидные молекулы малых размеров выводятся из организма путём клубочковой фильтрации с последующей реабсорбцией в проксимальных канальцах, что может приводить к лучевому повреждению почек и развитию нефротоксичности. Кроме того, в норме почки экспрессируют ССТр, что также может стать причиной увеличенного содержания 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE в этом органе [14]. Поэтому при проведении пептид-рецепторной радионуклидной терапии, где вводимые активности существенно выше диагностических, для обеспечения защиты почек инфузия терапевтического РФЛП осуществляется одновременно с раствором аминокислот (2,5% L-лизина/2,5% L-аргинина в 0,9% растворе хлорида натрия) [15, 16]. На фоне инфузии аминокислот концентрация РФЛП в почках снижается за счёт ингибирования канальцевой реабсорбции [17]. В целом высокое накопление РФЛП в почках не является противопоказанием для проведения радионуклидной диагностики или терапии, но вместе с тем эту особенность следует учитывать при проведении данных процедур, особенно у пациентов с уже имеющимися нарушениями функций почек.
Так, накопление в почках исследуемых РФЛП не имело статистически значимых различий. Начальные концентрации препаратов составили 49,637 ± 2,754 %/г и 46,661 ± 5,182 %/г для 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE соответственно. Далее снижение содержания 99mTc-HYNIC-TOC происходило быстрее, чем 99mTc-HYNIC-TATE (рис. 1). Максимальная величина общего содержания 99mTc-HYNIC-TOC в почках, зарегистрированная через 5 мин после введения, составила 6,394 ± 0,141% от введённой дозы, а 99mTc-HYNIC-TATE – 4,568 ± 0,643% от введённой дозы.
В остальных органах и тканях наблюдалась следующая тенденция: максимальные величины концентраций 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE регистрировались в срок 5 мин после введения препарата, однако уже через 1 ч отмечалось значительное снижение концентрации РФЛП (рис. 1). Обращает на себя внимание быстрое снижение концентрации обоих препаратов в щитовидной железе, что косвенно свидетельствует об их высокой стабильности in vivo .
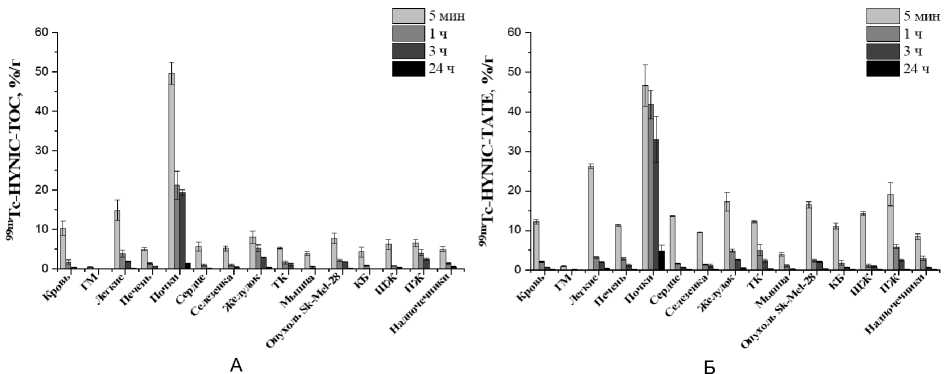
Рис. 1. Динамика изменения концентрации 99mTc-HYNIC-TOC (А) и 99mTc-HYNIC-TATE (Б)
в органах и тканях мышей линии NU/J с перевитой подкожно меланомой SK-Mel-28 после внутривенного введения (в % от введённой дозы на 1 г органа или ткани): ГМ – головной мозг, ТК – тонкая кишка, КБ – кость бедра, ЩЖ – щитовидная железа, ПЖ – поджелудочная железа.
Так, в течение 1 ч после инъекции накопление 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE снижается в 8-13 раз и сохраняется на уровне менее 1 %/г до конца исследования. Известно, что несвязанный 99mTcO 4 - накапливается в щитовидной железе за счёт высокого сродства к Na+/I-симпортеру – трансмембранному белку, отвечающему за поглощение йода клетками щитовидной железы [18]. Ранее было показано, что введение раствора пертехнетата натрия Na99mTcO 4
лабораторным животным приводило к высокому накоплению и длительному удержанию свободного 99mTc в щитовидной железе [19].
При анализе общего содержания 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE во внутренних органах и тканях было установлено, что наибольшее накопление препаратов отмечалось в мышце и коже. Максимальное содержание 99mTc-HYNIC-TOC в мышце и коже достигало 32,007 ± 2,336% и 29,466 ± 10,729% от введённой дозы соответственно, а 99mTc-HYNIC-TATE – 25,326 ± 3,575% и 30,307 ± 1,585% от введённой дозы соответственно. В последующие сроки наблюдалось снижение общего содержания РФЛП в мышечной ткани и коже; такая же тенденция отмечалась и в остальных органах и тканях.
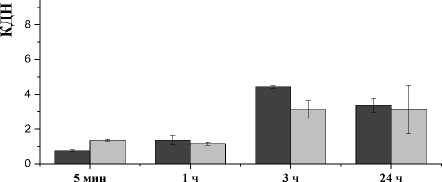
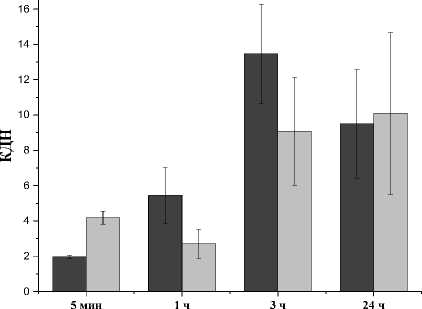
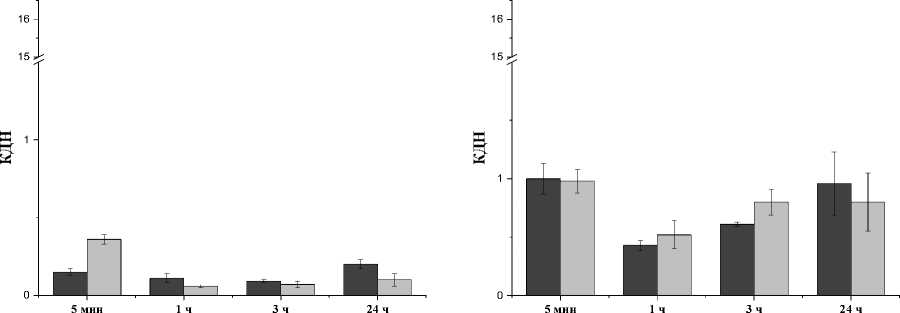
При анализе величин КДН опухоль/внутренние органы было установлено, что для большинства органов и тканей эти значения были выше 1 в течение всего исследования. Так, для 99mTc-HYNIC-TOC величины КДН опухоль/кровь варьируют от 0,76 ± 0,04 в срок 5 мин до 4,42 ± 0,07 в срок 3 ч после введения, а опухоль/мышца – от 1,97 ± 0,10 до 13,46 ± 2,80 (рис. 2). Для 99mTc-HYNIC-TATE КДН опухоль/кровь возрастали с 1,35 ± 0,06 в срок 5 мин до 3,13 ± 1,40 в срок 24 ч. КДН опухоль/мышца увеличивались в течение 24 ч со значений 4,18 ± 0,36 до 10,09 ± 4,57 (рис. 2). При этом обращает на себя внимание, что значения КДН опухоль/почки меньше 1 во все сроки исследования. Кроме того, в некоторые сроки значения КДН были меньше 1 для отношений опу-холь/желудок для обоих препаратов (рис. 2). При этом величины КДН, рассчитанные для 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE, не имеют статистически значимых различий.
■ 99m Tc-HYNIC-TOC
99mTc-HYNIC-TATE
А Б
В Г
Рис. 2. Динамика изменения КДН опухоль/кровь (А), опухоль/мышца (Б), опухоль/почки (В) и опухоль/желудок (Г) мышей линии NU/J с перевитой подкожно меланомой SK-Mel-28 после внутривенного введения 99mTc-HYNIC-TOC и 99mTc-HYNIC-TATE.
Заключение
Исследование выполнено при финансовой поддержке Минздрава России (государственное задание № 124030500022-1).


