Синтез и прогноз противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-D]пиримидин-4(3H)-она
Автор: Чиряпкин Алексей Сергеевич, Кодониди Иван Панайотович, Ивченко Александр Владимирович, Смирнова Людмила Павловна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 12 т.7, 2021 года.
Бесплатный доступ
В статье приводятся модифицированный метод синтеза 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3 H )-она и прогноз их противовоспалительной активности. Предложенная методика получения производных тетрагидротиенопиримидина является препаративно эффективной и простой. Их синтез осуществлялся путем гетероциклизации азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида в среде ледяной уксусной кислоты при каталитическом добавлении диметилсульфоксида. Предварительный прогноз противовоспалительной активности in silico позволили выявить наиболее перспективные соединения. Из них наибольший интерес может представлять структура 4b, содержащая 2-гидроксифенильный фрагмент во втором положении пиримидин-4(3H)-она. Представляется целесообразным дальнейшее исследование спектра биологической активности изучаемых соединений.
In silico, прогноз, молекулярный докинг, цог-2, азометины, тетрагидротиенопиримидины, синтез, противовоспалительная активность
Короткий адрес: https://sciup.org/14122831
IDR: 14122831 | УДК: 547.853.3:519.876.5 | DOI: 10.33619/2414-2948/73/02
Текст научной статьи Синтез и прогноз противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-D]пиримидин-4(3H)-она
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 547.853.3:519.876.5
Поиск новых соединений, обладающих высокой эффективностью и низкой токсичностью, является основополагающим направлением разработки новых лекарственных средств. Перспективным центроидом для дизайна биологически активных соединений является ядро пиримидинона, так этот субструктурный фрагмент входит в различные эндогенные соединения, например, азотистые основания и витамины группы В. Производные пиримидинона используют для лечения инфекционных, онкологических, неврологических заболеваний и многих других патологических процессов [1].
Данные фармакологических исследований свидетельствуют о возможности применения тетрагидротиенопиримидинов для лечения рака предстательной железы [2], толстой кишки человека [3] и молочных желез [4]. Также они могут ингибировать продукцию медиаторов воспаления [5]. Некоторые производные тетрагидробензотиенопиримидина проявляли выраженную антимикробную активность [6].
В современных публикациях приводятся результаты исследований, в которых показано, что ядро тетрагидробензо[4,5]тиено[2,3-d]пиримидина может служить центроидом для разработки противомалярийных средств [7]. Азометиновые производные 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида являются менее изученным классом органических соединений, так как их не выделяют в качестве интермедиатов в процессе синтеза 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она. Они могут ингибировать протеинкиназу G из Mycobacterium tuberculosis [8] и фактор роста фибробластов [9], проявлять антибактериальные свойства [10].
Таким образом поиск биологически активных соединений среди производных тетрагидротиенопиримидинона и их ациклических предшественников является актуальным и целесообразным направлением создания новых эффективных и безопасных нестероидных противовоспалительных средств.
Материалы и методы исследования
В качестве объектов исследования выступают 2-замещенные 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она.
Молекулярный докинг осуществлялся с использованием программы Autodock 4.0 [11]. Молекулярное моделирование проводилось с учетом конформационной подвижности лигандов, торсионные углы которых были установлены в данной программе. Атомные заряды моделируемой системы рассчитаны алгоритмом гастейгера (Gasteiger algorithm) с учетом только полярных атомов водорода. Энергия лиганд-ферментного взаимодействия
cc) ® I
вычислялась ламарковской скоринговой функцией (Lamarckian GA 4.2). Для расчета энергии взаимодействия с ферментом генерировалось 200 энергетически выгодных конформаций исследуемых структур с целью поиска устойчивого молекулярного комплекса с ЦОГ2. Расстояние между точками сетки составляло 0,375 ангстрема. Прогноз противовоспалительной активности проводился с использованием человеческой циклооксогеназа 2-го типа с идентификационным номером 5IKT [12]. В этом комплексе находится ингибитор данного фермента — толфенамовая кислота. Областью вычислительного эксперимента является куб, центр которого находится по следующим координатам: x = 165,42, y = 185,74, z = 192,38. Количество точек в измерениях по осям x, y и z равно 46.
Виртуальные структуры исследуемых соединений были построены в программе HyperChem 8.0.4, а затем геометрически оптимизированы методом молекулярной механики с использованием метода MM+ [13]. Окончательная оптимизация геометрии виртуальных структур была рассчитана в программе ORCA 4.1 с использованием метода теории функционала плотности (UB3LYP) и базового набора 6-311G**. Преобразование формата hin в pdb, необходимое для молекулярного моделирования, было выполнено в программе Open Babel 2.4.1.
1Н ЯМР-спектры регистрировали на приборе Bruker Avance III 400 МГЦ с датчиком CryoProbe Prodigy (Bruker, Германия).
Общая методика синтеза азометиновых производных 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида.
В 30 мл безводного этанола растворяют 0,01 молям (1,96 г) 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и частями добавляют эквимолекулярное количество соответствующего альдегида (2) (в случае соединения 3е 0,012 моля). Далее реакционную смесь кипятили в течение 30–60 минут. Полноту прохождения реакции контролировали ТСХ. После охлаждения реакционной среды образуется осадок, который отфильтровывают и промывают этанолом. В случае 2-[(4-Гидрокси-3-метоксифенил)метиленамино]-4,5,6,7-тетрагидро-бензотиофен-3-карбоксамид полученный продукт дополнительно осаждают водой. Очищают продукты реакции перекристаллизацией из этанола. Характеристики полученных соединений приведены по следующей ссылке [14].
Общая методика синтеза 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она. В 10–30 мл ледяной уксусной кислоты при кипячении растворяют 0,08 моль соответствующего азометинового производного 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида в течение 30–60 минут. Далее прикапывают 1,0–2,0 мл диметилсульфоксида (ДМСО) и продолжают кипятить реакционную смесь еще 60 минут. На следующий день отфильтровывают образовавшийся осадок. Затем оставшийся в фильтрате целевой продукт осаждают раствором хлорида натрия. Осадки объединяли и промывали уксусной кислотой. Перекристаллизацию целевых продуктов проводили из ЛУК.
Результаты и их обсуждение
Из результатов молекулярного докинга следует (таблица 2), что наиболее энергетически устойчивый комплекс образуют соединения 4b, 4f и 4j. Их энергия формирования лиганд-ферментного комплекса превосходит толфенамовую кислоту. Наиболее перспективным соединением среди моделируемых структур является 4b, которое содержит во втором положении конденсированного гетероциклического ядра 2-гидроксифениловый фрагмент. Главным образом, 2-замещенные 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)- она вступают во взаимодействие со следующими остатками активного сайта циклооксигеназы 2-го типа: Val 116, Val 349, Leu 352, Tyr 355, Leu 359, Leu 384, Tyr 385, Trp 387, Met 522, Gly 526, Ala 527, Ser 530 и Leu 531. Межмолекулярную водородную связь образует только соединение 4i, взаимодействуя атомом кислорода карбонильной группы с аминокислотным остатком Ser 530. Результаты молекулярного докинга представлены в Таблице 1.
Таблица 1
МИНИМАЛЬНЫЕ ЭНЕРГИИ ОБРАЗОВАНИЯ
УСТОЙЧИВОГО КОМПЛЕКСА ЛИГАН-ЦОГ-2
|
Соединение |
Энергия докинга (ккал/моль) |
Соединение |
Энергия докинга (ккал/моль) |
|
4a |
-8,70 |
4g |
-8,36 |
|
4b |
-9,61 |
4h |
-8,38 |
|
4c |
-8,07 |
4i |
-8,05 |
|
4d |
-8,01 |
4j |
-9,01 |
|
4e |
-7,94 |
4k |
-8,03 |
|
4f |
-9,22 |
4l |
-8,52 |
|
толфенамовая кислота |
-8,52 |
На Рисунке 1 показано расположение толфенамовой кислоты (A) и соединения 4b (B). Из рисунка следует, что карбоксигруппа лекарственного препарата накладывается на 2-гидроксифенольный заместитель тетрагидротиенопиримидина. При этом атом азота гетероциклической сопряженной пиримидиновой системы практически находится в одной точке в пространстве с атомом азота толфенамовой кислоты. Таки образом, полярные атомы моделируемых соединений занимают схожее расположение в активном сайте фермента, что возможно приводит к близкому электростатическому взаимодействую с активным центром ЦОГ-2. Следовательно, можно предположить соответствие в величине и селективности ингибирующего фермента соединений A и B при взаимодействии с ЦОГ-2.
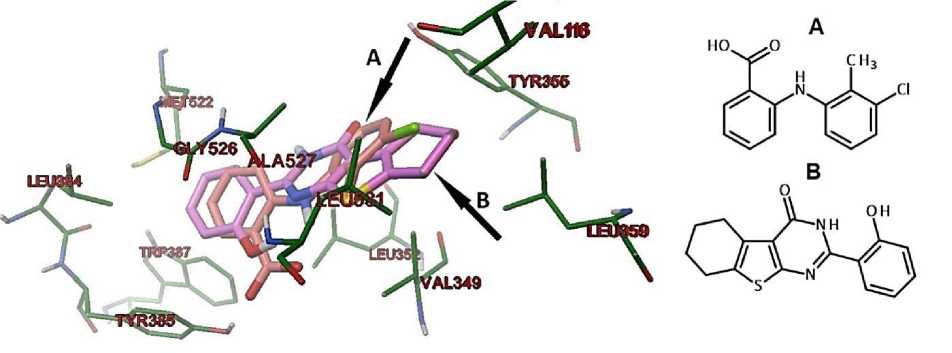
Рисунок 1. Лиганд-рецепторный комплекс с ЦОГ-2. А — Толфенамовая кислота (рентгеноструктурный анализ). В — Расположение соединения 4b (молекулярный докинг)
Достаточно высокую достоверность расчетов методом молекулярного докинга, подтверждает среднее квадратическое отклонение между местоположением толфенамовой кислоты в комплексе 5IKT (рентгеноструктурный анализ) и ее расположение в лиганд-рецепторном комплексе по данным молекулярной стыковки, которое составляет 0,86 ангстрема.
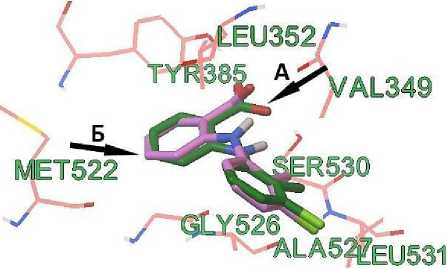
Рисунок 2. Расположение толфенамовой кислоты в активном сайте ЦОГ-2. А — рентгеноструктурный анализ (зеленый цвет), Б — молекулярный докинг (розовый цвет)
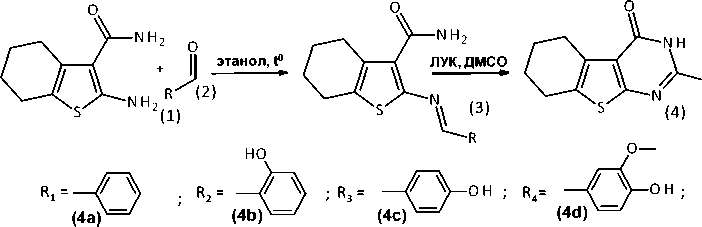
Синтез целевых 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она осуществлялся в два этапа. На первом этапе проходило взаимодействие 2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида с альдегидами, в результате которого получали азометиновые производные, которые в дальнейшем подвергали циклоконденсации с образованием соответствующих 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она. Этот процесс проводился в среде ледяной уксусной кислоты с добавлением полярного апротонного растворителя ДМСО. Схема получения прогнозируемых соединений приведена на Рисунке 3.
он он
■ОН ;
НО о—
Rs =
R5 = —С ')—О ; R6 =
(4e)

;
r 7 = — (4g)
;
R 9 = —
(4i)

•О ; Rio
(4j)
(4f)
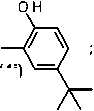
R 11 =
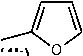
;
(4k)
R 12
(4h)
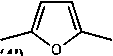
(4l)
Рисунок 3. Схема синтеза целевых соединений
В Таблице 2 приведены выходы целевых тетрагидротиенопиримидин-4(3H)-онов и характеристики протонных сигналов связи NH, наличие которой указывает о формировании конденсированных гетероциклических систем пиримидин-4(3H)-она. В результате модифицированных условий синтеза получаются 2-замещенные 5,6,7,8- тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она с высокими выходами.
Модифицированная методика препаративно проста и эффективна, экономически выгодна и экологически безопасна. Она может с успехом использоваться для синтеза активной фармацевтической субстанции производных тетрагидробензопиримидин-4(3H)-она с целью создания новых высокоэффективных НПВС.
Таблица 2 ВЫХОДЫ 2-ЗАМЕЩЕННЫХ 5,6,7,8-ТЕТРАГИДРОБЕНЗО[4,5]ТИЕНО[2,3-D]ПИРИМИДИН-4(3H)-ОНА И ХАРАКТЕРИСТИКА NH – СВЯЗИ ГЕТЕРОЦИКЛА
ТЕТРАГИДРОБЕНЗТИЕНОПИРИМИДИН-4(3H)-ОНА
|
Соединение |
Выход, % |
NH |
Соединение |
Выход, % |
NH |
|
4a |
96 |
12.53, cинглет |
4g |
88 |
12.39, cинглет |
|
4b |
86 |
12.04, cинглет |
4h |
90 |
12.34, cинглет |
|
4c |
83 |
12.26, cинглет |
4i |
85 |
12.38, cинглет |
|
4d |
72 |
12.30, cинглет |
4j |
89 |
12.38, cинглет |
|
4e |
75 |
12.28, cинглет |
4k |
90 |
12.51, cинглет |
|
4f |
80 |
12.16, cинглет |
4l |
92 |
12.35, cинглет |
Выводы
Согласно результатам молекулярного докинга наиболее активными соединения по противовоспалительной активности являются соединения 4b, 4f и 4j. Из них наиболее персептивным соединением предположительно обладающим ингибированием ЦОГ2 является 4b. В ходе проведенных исследований был предложен модифицированный метод синтеза 2-замещенные 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она, который является препаративно доступным, экономически выгодным и экологически безопасным. Представляется целесообразным дальнейшее изучение противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидин-4(3H)-она с целью подтверждения достоверности результатов молекулярного конструирования.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №20-315-90060.
Список литературы Синтез и прогноз противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-D]пиримидин-4(3H)-она
- Самотруева М. А., Цибизова А. А., Ясенявская А. Л., Озеров А. А., Тюренков И. Н. Фармакологическая активность производных пиримидинов // Астраханский медицинский журнал. 2015. Т. 10. №1. С. 12 29.
- Amawi H., Hussein N., Boddu S. H., Karthikeyan C., Williams F. E., Ashby C. R., Tiwari A. K. Novel thienopyrimidine derivative, RP 010, induces β catenin fragmentation and is efficacious against prostate cancer cells // Cancers. 2019. V. 11. №5. P. 711. https://doi.org/10.3390/cancers11050711
- Wang Y. D., Johnson S., Powell D., McGinnis J. P., Miranda M., Rabindran S. K. Inhibition of tumor cell proliferation by thieno [2, 3 d] pyrimidin 4 ( one based analogs // Bioorganic & medicinal chemistry letters. 2005. V. 15. №16. P. 3763 3766. https://doi.org/10.1016/j.bmcl.2005.05.127
- Ouyang L., Zhang L., Liu J., Fu L., Yao D., Zhao Y., Liu B. Discovery of a small molecule bromodomain containing protein 4 (BRD4) inhibitor that induces AMP activated protein kinase modulated autophagy associated cell death in breast cancer // Journal of medicinal chemistry. 2017. V. 60. №24. P. 9990 10012. https://doi.org/10.1021/acs.jmedchem.7b00275
- Zhang, Y., Luo, L., Han, C., Lv, H., Chen, D., Shen, G., ... & Ye, F. Design, synthesis, and biological activity of tetrahydrobenzo [4, 5] thieno [2, 3 d] pyrimidine derivatives as anti inflammatory agents // Molecules. 2017. V. 22. №11. P. 1960.
- Bhuiyan M. D., Rahman K., Mizanur M., Hossain M. K., Rahim A., Hossain I., Naser M. A. Synthesis and antimicrobial evaluation of some new thienopyrimidine derivatives // Acta pharmaceutica. 2006. V. 56. №4. P. 441 450.
- Pal K., Raza M. K., Legac J., Rahman M. A., Manzoor S., Rosenthal P. J., Hoda N. Design, synthesis, crystal structure and anti plasmodial evaluation of tetrahydrobenzo [4, 5] thieno [2, 3 d] pyrimidine derivatives //RSC Medicinal Chemistry. 2021. https://doi.org/10.1039/D1MD00038A
- Missio A., Bacher G., Koul A., Choidas A., inventors; Axxima Pharmaceuticals AG., assignee. 4,5,6,7 Tretrahydrobenzo[B] thiophene derivatives and methods for medical intervention against mycrobacterial infections. United States patent US 20090018149. 2009 Jan 15.
- Zhu W., Chen H., Wang Y., Wang J., Peng X., Chen X., Liu H. Design, synthesis, and pharmacological evaluation of novel multisubstituted pyridin 3 amine derivatives as multitargeted protein kinase inhibitors for the treatment of non small cell lung cancer // Journal of medicinal chemistry. 2017. V. 60. №14. P. 6018 6035. https://doi.org/10.1021/acs.jmedchem.7b00076
- El Sharief A. S., Micky J. A. A., Shmeiss N. A. M. M., El Gharieb G. Synthesis and reactions of some tetrahydrobenzothieno [2, 3 d] pyrimidine derivatives with biological interest // Phosphorus, Sulfur, and Silicon and the Related Elements. 2003. V. 178. №3. P. 439 451. https://doi.org/10.1080/10426500307912
- Morris G. M., Huey R., Lindstrom W., Sanner M. F., Belew R. K., Goodsell D. S., Olson A. J. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility // Journal of computational chemistry. 2009. V. 30. №16. P. 2785 2791. https://doi.org/10.1002/jcc.21256
- Orlando B. J., Malkowski M. G. Substrate selective inhibition of cyclooxygeanse 2 by fenamic acid derivatives is dependent on peroxide tone // Journal of Biological Chemistry. 2016. V. 291. №29. P. 15069 15081. https://doi.org/10.1074/jbc.M116.725713
- Teppen B. J. HyperChem, release 2: molecular modeling for the personal computer // Journal of chemical information and computer sciences. 1992. V. 32. №6. P. 757 759. https://doi.org/10.1021/ci00010a025
- Чиряпкин А. С., Кодониди И. П., Ларский М. В. Целенаправленный синтез и анализ биологически активных азометиновых производных 2 амино 4, 5, 6, 7 тетрагидро 1 бензотиофен 3 карбоксамида // Разработка и регистрация лекарственных средств. 2021. Т. 10. №2. С. 25 31. https://doi.org/10.33380/2305 2066 2021 10 2 25 31

![Синтез и прогноз противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-D]пиримидин-4(3H)-она Синтез и прогноз противовоспалительной активности 2-замещенных 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-D]пиримидин-4(3H)-она](/file/cover/14122831/sintez-i-prognoz-protivovospalitelnoj-aktivnosti-2-zameshhennyh.png)
