Синтез и психофармакологические свойства новых циклических производных 2-тиоурацила
Автор: Озеров А.А., Новиков М.С., Муриити А.К., Ковалев Д.Г., Дьякова Е.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 2 (18), 2008 года.
Бесплатный доступ
Синтезированы новые циклические производные 2-тиоурацила и исследованы их психофармакологические свойства. Проявили выраженную антидепрессантную активность в опытах на крысах 6-(N-Пиперидино)- и 6-(N-морфолино)-производные 7-метил-2,3-дигидро-5Н-[1,3]тиазоло-[3,2-а]пиримидин-5-она.
Производные 2-тиоурацила, психотропные свойства
Короткий адрес: https://sciup.org/142148716
IDR: 142148716 | УДК: 615.3:547.854.4
Текст научной статьи Синтез и психофармакологические свойства новых циклических производных 2-тиоурацила
Химическая структура 2-тиоурацила представляет собой чрезвычайно интересный объект для дальнейшей направленной модификации, поскольку содержит четыре активных нуклеофильных центра — атомы азота N1 и N3, атом углерода С5 пиримидиновой системы и экзоциклический атом серы, по которым могут легко протекать реакции замещения и циклизации. Ранее нами с целью синтеза новых потенциальных фармакологически активных веществ были разработаны методы получения цик- лических производных 2-тиоурацила — частично гидрированных тиазолопиримидинов, пиримидоти-азинов и пиримидотиазепинов [1]. В дальнейшем было установлено, что бромирование этих циклических производных 2-тиоурацила не затрагивает атом серы и протекает исключительно как замещение при атоме углерода С5 пиримидинового ядра, при этом сам атом брома может быть легко замещен на аминогруппу при взаимодействии с циклическими вторичными аминами [3].
ЦЕЛЬ РАБОТЫ
Для расширения ряда полученных ранее соединений и исследования их психофармакологических свойств осуществить синтез разнообразных циклических производных 2-тиоурацила, отвечающих общим формулам трех типов:
OO
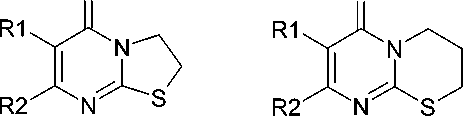
(A) (B)
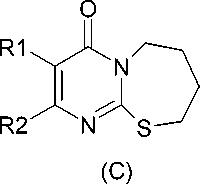
где: R1 = H, Br, N(CH2)4, N(CH2)5, N(CH2CH2)2O, N(CH2CH2)2NH, N(CH2CH2)2NCH3, N(CH2CH2)2NC6H5;
R2 = CH3, NH2, C6H5
МЕТОДИКА ИССЛЕДОВАНИЯ
Исходные 6-замещенные 2-тиоурацилы были получены путем циклизации ацетоуксусного, циануксусного или бензоилуксусного эфира с тиомочевиной в среде кипящего метанола в присутствии метилата натрия [2]. Частично гидрированные ти-азолопиримидины, пиримидотиазины и пиримидо-тиазепины были синтезированы путем алкилирования 6-замещенных 2-тиоурацилов, соответственно, 1,2-дибромэтаном, 1,3-дибромпропаном или 1,4-дибромбутаном при температуре 80—100 оС в среде безводного диметилформамида в присутствии карбоната калия. Бромирование проводили в 50 %-й водной уксусной кислоте при температуре 40—50 оС при использовании эквимолярного количества брома. Финальную стадию аминирования осуществляли путем кипячения полученных бромидов в 5—10-кратном молярном избытке пирролидина, пиперидина или морфолина, а при аминировании пиперазином, N-метилпипера-зином или N-фенилпиперазином для понижения температуры кипения реакционной массы в качестве растворителя использовали 2-этоксиэтанол [1]. Строение полученных соединений доказано методом ПМР-спектроскопии, чистота и индивидуальность подтверждены методом тонкослойной хроматографии. Выход и физико-химические свойства полученных соединений представлены в таблице.
Таблица
Свойства синтезированных соединений
|
Соединение |
R1 |
R2 |
Тип цикла |
Выход, % |
Т. пл., оС |
|
1 |
H |
CH 3 |
А |
82 |
126–129 |
|
2 |
H |
CH 3 |
B |
72 |
122–124 |
|
3 |
H |
CH 3 |
C |
27 |
67–69 |
|
4 |
H |
C 6 H 5 |
A |
79 |
160–164 |
|
5 |
H |
C 6 H 5 |
B |
81 |
174–177 |
|
6 |
H |
NH 2 |
A |
55 |
214–217 |
|
7 |
H |
NH 2 |
B |
69 |
255–257 |
|
8 |
Br |
CH 3 |
A |
83 |
208–211 |
|
9 |
Br |
CH 3 |
B |
74 |
329–330 |
|
10 |
Br |
CH 3 |
C |
68 |
206–207 |
|
11 |
Br |
C 6 H 5 |
A |
81 |
194–195 |
|
12 |
Br |
NH 2 |
A |
72 |
211–213 |
|
13 |
Br |
NH 2 |
B |
91 |
188–190 |
|
14 |
N(CH 2 CH 2 ) 2 |
CH 3 |
A |
83 |
228,5–230 |
|
15 |
N(CH 2 CH 2 ) 2 CH 2 |
CH 3 |
A |
72 |
207–210 |
|
16 |
N(CH 2 CH 2 ) 2 O |
CH 3 |
A |
91 |
207–209 |
|
17 |
N(CH 2 CH 2 ) 2 NH |
CH 3 |
A |
52 |
136–138 |
|
18 |
N(CH 2 CH 2 ) 2 NCH 3 |
CH 3 |
A |
51 |
204–208 |
|
19 |
N(CH 2 CH 2 ) 2 NC 6 H 5 |
CH 3 |
A |
59 |
190–194 |
|
20 |
N(CH 2 CH 2 ) 2 |
CH 3 |
B |
47 |
126–145 |
|
21 |
N(CH 2 CH 2 ) 2 |
CH 3 |
C |
40 |
126–140 |
|
22 |
N(CH 2 CH 2 ) 2 CH 2 |
C 6 H 5 |
A |
59 |
173–175 |
|
23 |
N(CH 2 CH 2 ) 2 O |
C 6 H 5 |
A |
62 |
174–177 |
Исследование психотропных свойств синтезированных соединений осуществлялось с использованием традиционных моделей фармакологического скрининга in vivo — теста «открытое поле» (психостимулирующая активность), приподнятого «плюс»-лабиринта (анксиолитическое действие), теста форсированного плавания (антидепрессан-тные свойства). Опыты были выполнены на белых беспородных крысах обоего пола массой 180— 250 г. Исследуемые вещества в физиологическом растворе (опытным группам) или физиологический раствор (контрольным группам) вводили внутрибрюшинно за 1 ч до начала тестирования в дозах 10 и 50 мг/кг.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
И ИХ ОБСУЖДЕНИЕ
Анализ обнаруженных соотношений «химическая структура — психотропная активность» позволил выявить следующие закономерности.
Среди исходных циклических производных 2-тиоурацила (соединения 1—7) не было обнаружено веществ с психотропными свойствами. Исключение составляет соединение 6 — 7-амино-2,3-ди-гидро-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он, которое и в дозе 10 и в дозе 50 мг/кг проявляет отчетливую (но статистически не значимую) тенденцию к сокращению длительности иммобилизации в тесте Порсольта и достоверно увеличивает количество прыжков. Последующее введение брома в это соединение (12) усиливает его антидепрессантную активность, которая становится достоверной в обеих изученных дозах. Остальные промежуточные бромиды (8—11 и 13) либо вообще не проявили активности в использованных тестах, либо оказывали разнонаправленное и слабо выраженное действие только в одной из использованных доз.
Наиболее выраженные психотропные свойства продемонстрировали аминозамещенные циклических производных 2-тиоурацила (14—23). Обнаружено, что направленность их действия определяется природой аминосодержащего заместителя и размерами серусодержащего цикла, конденсированного с пиримидиновым ядром. Так, наиболее высокую активность продемонстрировали производные тиазолопиримидина (пятичленный серусодержащий цикл), тогда как пирими-дотиазины и пиримидотиазепины (соответственно шести- и семичленные циклы) были малоактивны. Введение любого из использованных пиперазиновых фрагментов в структуру тиазоло-пиримидина (соединения 17—19) приводит к появлению выраженных психоугнетающих свойств, что проявляется в значительном снижении двигательной и ориентировочно-исследовательской активности животных в «открытом поле», уменьшении количества выходов в открытые рукава и увеличении продолжительности пребывания в них в приподнятом «плюс»-лаби-ринте, и в увеличении длительности иммобилизации в плавательном тесте Порсольта. Замена пиперазинового цикла на пиперидиновый (соеди- нение 15) или морфолиновый (соединение 16) в структуре производного тиазолопиримидина придает ему отчетливые антидепрессантные свойства. Указанные соединения в обоих дозах статистически значимо сокращали длительность иммобилизации в тесте Порсольта и при этом не оказывали влияния на поведение животных в «открытом поле», что свидетельствует о наличии у них специфической антидепрессантной, а не общей психостимулирующей активности.
ЗАКЛЮЧЕНИЕ
Таким образом, нами обнаружено, что синтезированные соединения 6-(N-пиперидино)-7-метил-2,3-дигидро-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (15) и 6-(N-морфолино)-7-метил-2,3-дигидро-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (16) обладают выраженной антидепрессантной активностью и представляют интерес для дальнейшего углубленного доклинического исследования.


