Синтез и сорбционные свойства наноразмерного фосфата магния по отношению к ионам меди (II)
Автор: Долганов А.В., Ключагина А.Н., Кяшкин В.М., Нагаева И.Г., Начкина Л.В., Осипов А.К., Чугунов Д.Б.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 19 т.4, 2016 года.
Бесплатный доступ
Синтезирован наноразмерный сорбент на основе фосфата магния. Проведено его исследование рентгенофазовым и ИК-спектроскопическим методами. Определены основные сорбционные характеристики фосфата магния по отношению к ионам меди (II).
Дизайн поверхности сорбента, изотерма сорбции лэнгмюра, кинетика, кислотность раствора, медь (ii), наноразмерный фосфат магния, сорбционная емкость, сорбция
Короткий адрес: https://sciup.org/147249189
IDR: 147249189 | УДК: 66.081.312:546.46:546.185:546.56
Текст научной статьи Синтез и сорбционные свойства наноразмерного фосфата магния по отношению к ионам меди (II)
Глобальное загрязнение природных и производственных вод поллютантами различного происхождения обуславливает актуальность исследований и необходимость создания новых сорбционных материалов, характеризующихся не только высокой эффективностью, но и селективностью действия. Для получения сорбентов с новыми улучшенными свойствами, отвечающими поставленным практическим задачам, проводится направленное химическое и физическое воздействие или дизайн на сорбционный материал, с целью изменения морфологии поверхности, улучшения структурных характеристик и повышения сорбционной активности сорбента по отношению к отдельным ионам.
В качестве сорбционного материала в работе использован наноразмерный кристаллогидрат фосфата магния. Сорбент получен непрерывным методом путем прикапывания 0,75 М раствора хлорида магния к 0,5 М раствора ортофосфата натрия при постоянном перемешивании и комнатной температуре (рН осаждения около 9). После двухчасового созревания в маточном растворе гелеобразный осадок отфильтровывали, промывали дистиллированной водой от хлорид-ионов и ионов натрия на воронке Бюхнера, сушили на воздухе при комнатной температуре, затем ‒ в сушильном шкафу при 80 оС. После высушивания сорбент представлял собой белый аморфный порошок, средний размер частиц которого, исходя из гистограммы распределения (см. рис. 1) составлял 5 – 10 нм. Размеры частиц измерены с помощью анализатора размера частиц Microtrac NANO-flex. Состав наноразмерного сорбента, определенный весовым методом, соответствует формуле Mg3(PO4)2·3H2O. Сорбируемый ион – ион меди (II), содержание которого в исходном растворе составляло 15,7 ммоль/л (1000 мг/л) и определялось фотометрически с диэтилдитиокарбаматом натрия на сканирующем однолучевом спектрофотометре ПЭ – 5300ВИ (длина волны – 430 нм, толщина кюветы – 3 см). Кислотность растворов контролировалась с помощью рН-метра HANNA HI 2211 pH/ORP Meter.
Проведена идентификация состава синтезированного образца рентгенофазовым и ИК-спектроскопическим методами. Регистрация дифрактограмм осуществлялась на дифрактометре EMPYREAN PANalytical в излучении меди (длина волны 1,5418 Å). Для анализа дифрактограмм использовалась база данных PDF-2. ИК-спектры регистрировали на инфракрасном Фурье-спектрометре «ИнфаЛЮМ ФТ-02» в интервале волновых чисел 400 – 4000 см-1 (образцы были спрессованы в таблетки с KBr).
Рис. 1. Гистограмма распределения частиц по размерам для наноразмерного фосфата магния.
На рисунке 2 (кривая 1) изображена дифракционная картина наноразмерного синтезированного фосфата магния, которая показывает отсутствие характеристических пиков кристаллических фаз и свидетельствует об аморфности структуры исходного образца до сорбции и его высокой сорбционной способности. Аморфная структура наноразмерного фосфата магния сохраняется после сорбции (см. рис. 2, кривая 2).
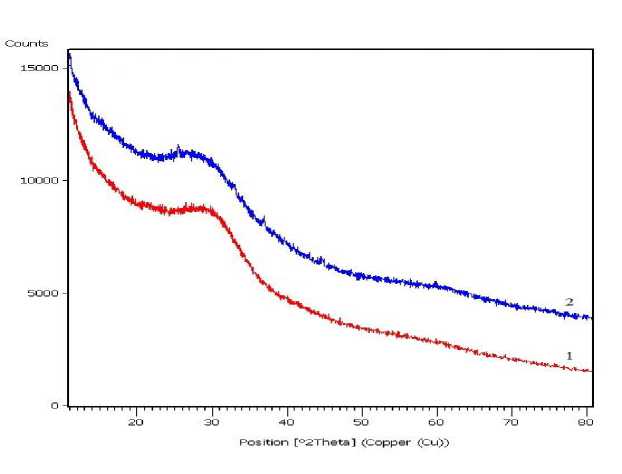
Рис. 2. Дифрактограммы наноразмерного образца фосфата магния:
1 – до сорбции, 2 – после сорбции ионов меди (II).
На рисунке 3 представлен ИК-спектр полученного сорбента, полосы поглощения которого соответствуют фосфату магния: 3449,14 см-1 и 3425,99 см-1 – валентные колебания
ОH- -групп в молекуле воды; 1651,27 см-1 – деформационные колебания молекул воды;
1072,55 см-1 – валентные колебания аниона (РО 4 )3-; 574,86 см-1 – деформационные колебания аниона (РО 4 )3- [1]. Наличие полосы поглощения 2357,30 см-1 также обусловлено валентными колебаниями ОН- – групп в кислом фосфатном анионе (НО–Р), что, по-видимому, можно объяснить частичным образованием кислой соли MgHPO 4 , как указано в работе [2].
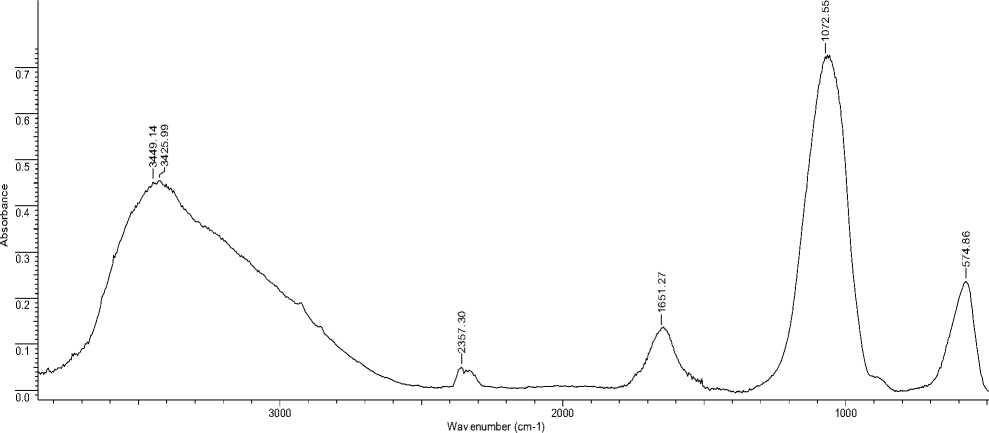
Рис. 3. ИК-спектр наноразмерного фосфата магния до сорбции ионов меди (II).
Для оценки сорбционной способности наноразмерного фосфата магния к ионам меди
(II) определены следующие его характеристики: обменная емкость сорбента, степень извлечения определяемого компонента, скорость ионного обмена, кислотность раствора.
Сорбционная емкость фосфата магния определялась статическим методом и рассчитывалась по разности содержания ионов меди (II) в исходном растворе и в растворе после сорбции по формуле:
СОЕ =
(С о - С р ) • V
m
где СОЕ – статическая обменная емкость, ммоль/г сорбента,
C 0 – исходная концентрация Cu2+ в растворе, ммоль/л,
C p – равновесная концентрация Cu2+ в растворе после сорбции, ммоль/л,
V – объем анализируемого раствора, л, m – навеска сорбента, г.
Степень сорбции (L) ионов Cu2+ рассчитывали по формуле:
(Co — CJ
L = ---% 400%,
C0
где C 0 – исходная концентрация ионов Cu2+ в растворе, ммоль/л,
C p – равновесная концентрация ионов Cu2+ в растворе после сорбции, ммоль/л.
Кинетические свойства фосфата магния изучали путем измерения поглощенного иона сорбентом за различные промежутки времени (до 40 мин) при встряхивании растворов. Кривая сорбции ионов меди (II) наноразмерным фосфатом магния представлена на рисунке 4.
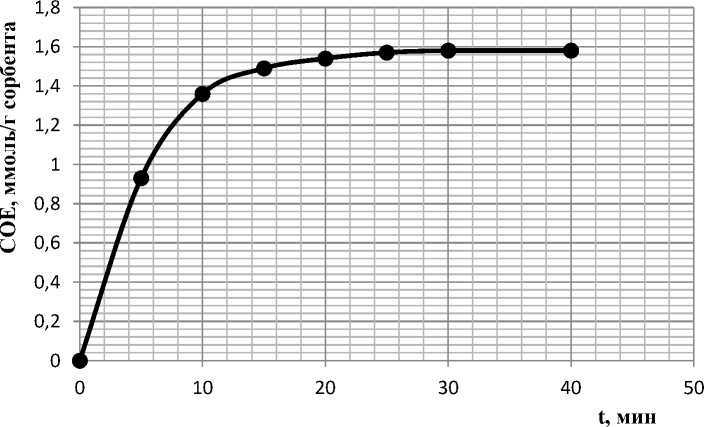
Рис. 4. Кинетическая кривая сорбции меди (II) наноразмерным фосфатом магния.
Из кривой сорбции видно, что сорбционный процесс достигает адсорбционного равновесия после 30 минут контакта твердой и жидкой фаз. Высокая скорость сорбции
(10 мин) на начальном этапе указывает на высокое сродство поверхности к адсорбату. Величина статической обменной емкости наноразмерного фосфата магния составляет 1,57±0,01 ммоль/г сорбента, что соответствует 100±0,1 % степени извлечения меди (II) из раствора.
Исследование влияния кислотности среды на степень сорбции ионов меди (II) наноразмерным фосфатом магния (см. рис. 5) показало, что максимальная степень сорбции наблюдается при рН 5 – 6 и соответствует 100±0,1 % полноте извлечения ионов меди (II) сорбентом из раствора.
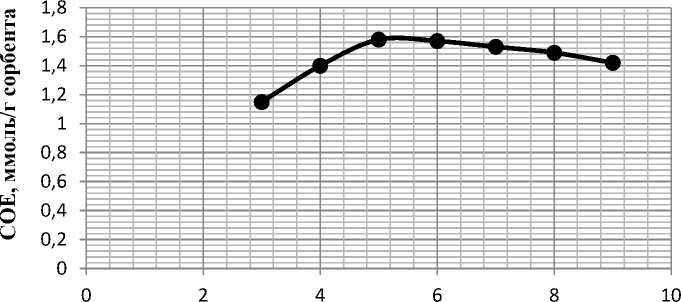
рН
Рис. 5. Влияние рН раствора на сорбцию ионов меди (II) наноразмерным фосфатом магния.
Сорбция ионов меди (II) наноразмерным фосфатом магния сопровождалась подщелачиванием раствора после сорбции, которая обусловлена выделением ионов магния из состава сорбента и хемосорбционным взаимодействием ионов меди (II) с фосфатом магния по уравнению реакции:
Mg 3 (PO 4 ) 2 ·3H 2 O + 3Cu+2 → Cu 3 (PO 4 ) 2 ·3H 2 O + 2Mg+2 [3].
Построена изотерма сорбции ионов меди (II) (см. рис. 6) наноразмерным фосфатом магния, которая отражает функциональную зависимость содержания исследуемого иона в фазе сорбента от равновесной концентрации данного иона в растворе при комнатной температуре. Полученная изотерма сорбции соответствует изотермам сорбции модели Лэнгмюра. Начальный прямолинейный участок кривой показывает, что адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата, образуя мономолекулярный слой.
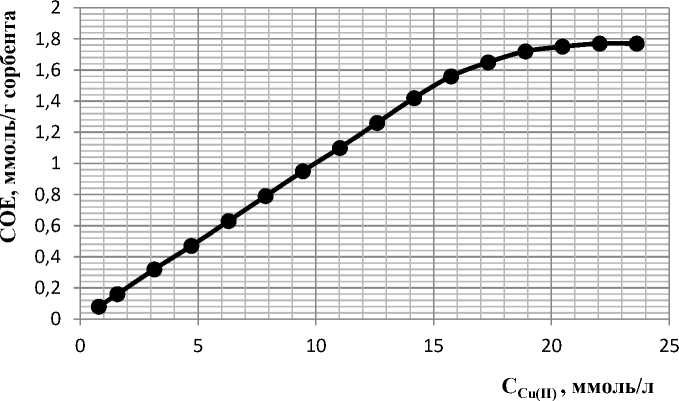
Рис. 6. Изотерма сорбции ионов меди (II) наноразмерным фосфатом магния.
Участки на изотерме с большими концентрациями сорбата отвечают поверхности сорбента полностью насыщенной ионами. Средние участки изотермы сорбции свидетельствуют о промежуточной степени заполнения поверхности сорбента.
Проведенные исследования показали, что направленный дизайн удельной поверхности фосфата магния путем формирования наночастиц позволил улучшить сорбционные свойства материала и определил целесообразность использования наноразмерного фосфата магния в качестве сорбента ионов меди (II) из водных растворов.
Список литературы Синтез и сорбционные свойства наноразмерного фосфата магния по отношению к ионам меди (II)
- Печковский В. В., Мельникова Р. Я., Дзюба Е. Д. и др. Атлас инфракрасных спектров фосфатов. Ортофосфаты. - М.: Наука, 1981. - 248 с.
- Щегров Л. Н. Фосфаты двухвалентных металлов. - Киев: Наукова думка, 1987. - 216 с.
- Шашкова И. Л., Ратько А. И., Дроздова Н. В. Извлечение ионов Cu2, Zn2, Co2 из водных растворов фосфатами кальция и магния // Журн. прикл. химии. - 2012. - Т. 85, № 3. - С. 361-364.


