Синтез и структурные особенности слоистых двойных гидроксидов, интеркалированных тиодиацетат-анионами
Автор: Чернова Екатерина Александровна, Жеребцов Дмитрий Анатольевич, Галимов Дамир Муратович, Бухтояров Олег Иванович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.5, 2013 года.
Бесплатный доступ
В работе исследована возможность интеркаляции тиодиацетат-анионов в структуру магний-алюминиевых слоистых двойных гидроксидов методом соосаждения и методом анионного обмена. Методом рентгенофазового анализа и КР-спектроскопии показано, что тиодиацетат-анионы внедряются в межслоевое пространство СДГ. Полученные материалы представляют интерес как сорбенты для ионов тяжелых металлов.
Слоистые двойные гидроксиды, интеркаляция, тиодиацетат -анионы, рентгенофазовый анализ
Короткий адрес: https://sciup.org/147160256
IDR: 147160256 | УДК: 544.228
Текст научной статьи Синтез и структурные особенности слоистых двойных гидроксидов, интеркалированных тиодиацетат-анионами
Слоистые двойные гидроксиды (СДГ) представляют класс природных и синтетических материалов общей формулы:
[M(II)1–xM(III)x(OH)2](An–)x/n·yH2O, где M(II), M(III) – катионы двух- и трехвалентных металлов, таких как Mg(II), Zn(II), Ni(II), Al(III), Fe(III), Cr(III); An– – межслоевой анион, например, нитрат-, сульфат-, хлорид-анион; x – доля ионов трехвалентного металла в слое СДГ; y – количество молекул воды в межслоевом пространстве соединения [1].
Структура СДГ является производной структуры брусита, Mg(OH) 2 (структурный тип CdI 2 ), в котором катионы металла располагаются в октаэдрическом окружении гидроксильных групп. Октаэдры формируют слои. Частичное изоморфное замещение ионов магния на ионы трехвалентного металла, например алюминия, приводит к возникновению положительного заряда слоев – происходит формирование структуры СДГ. Нейтрализацию заряда осуществляют анионы, локализованные в межслоевом пространстве образца. Кроме анионов между слоями СДГ располагаются молекулы воды. Сеть водородных связей, существующая между гидроксильными группами слоев, анионами и молекулами воды, придает слоистой структуре дополнительную стабильность [2].
Слои СДГ способны различным образом располагаться друг относительно друга. Данное явление приводит к возникновению двух основных политипов: политипа 3R c ромбоэдрической симметрией и политипа 2Н с гексагональной симметрией. Политип 3R характерен для природного минерала гидроталькита, состав которого выражается формулой [Mg 6 Al 2 (OH) 16 ](CO 3 )·4H 2 O. Большинство синтетических СДГ изоструктурны гидроталькиту, поэтому их часто называют «гидроталькитоподобными материалами» [3].
Важным свойством СДГ является их способность к интеркаляции, что позволяет получать материалы с заранее заданными свойствами для конкретных практических целей [1–3]. Интеркаляция может быть осуществлена методом соосаждения и методом анионного обмена. В случае метода соосаждения смешанный раствор солей двух- и трехвалентных металлов добавляют в реактор, содержащий раствор модификатора. При этом внедрение модификатора в межслоевое пространство происходит непосредственно в процессе формирования слоистой структуры образца [4]. Метод анионного обмена позволяет ввести модификатор за счет реакции замещения исходного межслоевого аниона [5]. Данный метод осуществляется в два этапа. На первом этапе синтезируется СДГ-прекурсор, содержащий в межслоевом пространстве нитрат- или карбонат-анион (нитратная или карбонатная форма СДГ, соответственно). Как правило, в качестве исходного межслоевого аниона выбирают нитрат-анион, поскольку он легко вступает в реакцию анионного обмена [3]. На втором этапе осуществляется взаимодействие СДГ-прекурсора с раствором аниона-модификатора. Величина рН раствора модификатора, температура и кристалличность модифицируемого образца оказывают влияние на степень интеркаляции, а также на способ упаковки молекул-модификаторов в межслоевом пространстве СДГ.
Особый интерес представляет изучение особенностей интеркаляции СДГ различными комплексонами, содержащими атомы азота или серы, поскольку в результате можно получать сорбенты ионов тяжелых металлов [6–7].
Цель настоящей работы заключалась в изучении возможности интеркаляции тиодиацетат-анионов в структуру магний-алюминиевых СДГ. Соответственно цели были поставлены следующие задачи: синтезировать магний-алюминиевые СДГ в нитратной форме; провести интеркаляцию образцов методом соосаждения и методом анионного обмена; с помощью метода рентгенофазового анализа и КР-спектроскопии выявить структурные особенности полученных материалов.
Экспериментальная часть
Синтез образцов
В табл. 1 приведены условия синтеза, а также сокращенные обозначения образцов. Нитратная форма магний-алюминиевого СДГ была приготовлена методом соосаждения. Для этого смешанный раствор нитратов магния и алюминия объемом 50 мл с молярным соотношением Mg : Al, равным 2 : 1 (общая концентрация солей 0,75 моль/л), по каплям добавляли к водному раствору нитрата натрия (1,5 моль/л) объемом 100 мл при перемешивании магнитной мешалкой. Синтез вели при постоянном значении рН 10,0±0,05. Постоянство рН поддерживали добавлением в реактор раствора гидроксида натрия (2,0 моль/л). Контроль рН осуществляли с помощью рН-метра «Эксперт-001» с комбинированным стеклянным электродом, предварительно откалиброванным по буферным растворам со значением рН 1,68, 4,01, и 9,18. По окончании осаждения полученную суспензию подвергали термостатированию. Химическая реакция, лежащая в основе процесса, может быть выражена следующим образом:
2Mg2+ + Al3+ + 2OH– + NO 3 – + y H 2 O = [Mg2+ 2 Al3+(OH) 2 ]NO 3 · y H 2 O. (1)
Интеркаляцию тиодиацетат-анионов методом анионного обмена проводили путем взаимодействия навески нитратной формы СДГ с водным раствором тиодиацетата натрия при постоянном перемешивании. Внедрение тиодиацетат-анионов в межслоевое пространство СДГ методом соосаждения осуществляли аналогично получению нитратной формы СДГ, только вместо водного раствора нитрата натрия использовали раствор тиодиацетата натрия. Процессы, протекающие в ходе интеркаляции методом анионного обмена (2) и методом соосаждения (3), можно выразить следующими уравнениями:
[Mg 2 Al(OH) 2 ]NO 3 · y H 2 O + 0,5tda2– = [Mg 2 Al(OH) 2 ](tda) 0,5 · y H 2 O + NO 3 –; (2)
2Mg2+ + Al3+ + 2OH– + 0,5tda2– + y H 2 O = [Mg2+ 2 Al3+(OH) 2 ](tda) 0,5 · y H 2 O, (3)
где tda2– – тиодиацетат-анион.
Таблица 1
Условия синтеза образцов
|
Образец |
Условия синтеза |
|
MgAl-NO 3 |
Соосаждение при рН 10,00. Время термостатирования 28 ч. Температура 90 °С |
|
MgAl-tda-1 |
Соосаждение при рН 10,00. Время термостатирования 28 ч. Температура 90 °С |
|
MgAl-tda-2 |
Соосаждение при рН 10,00. Время термостатирования 5 ч. Температура 90 °С |
|
MgAl-tda-3 |
Анионный обмен при рН 8,00 в течение 50 мин |
|
MgAl-tda-4 |
Анионный обмен при рН 8,00 в течение 1,5 ч |
|
MgAl-tda-5 |
Анионный обмен при рН 8,00 в течение 2 ч |
Методы исследования полученных образцов
Количество ионов магния и алюминия в составе образцов устанавливали методом комплек-сонометрии [8]. Количественное содержание азота и серы определено с помощью автоматического анализатора Perkin Elmer 2400 и барийметрического титрования, соответственно. Количество молекул кристаллизационной воды на одну формульную единицу СДГ оценивали по разности масс образцов, высушенных при температурах 100 и 180 °С [9].
Рентгенофазовый анализ (РФА) проводили на рентгеновском дифрактометре D8 Advance (CuK α -излучение, Ni-фильтр, 40 кВ, 40 мА) в диапазоне углов 2 θ от 5 до 70° с шагом 0,05°. Для характеристики структуры СДГ использовали параметры элементарной ячейки с и а . Параметр с
Физическая химия
зависит от размера межслоевого аниона. Параметр а характеризует расстояние между двумя катионами в слое. Для кристаллов с политипом 3R параметры с и а рассчитываются по следующим формулам:
с = 3 d 003;
а = 2d110, где d003 и d110 – межплоскостные расстояния отражений (003) и (110) на рентгенограмме образца, Å.
Параметры d 003 и d 110 рассчитывали по уравнению Вульфа – Брэгга:
nλ = 2dsinθ, где n – порядок отражения; λ – длина волны, Å; d – величина межплоскостного расстояния, Å; θ – угол отражения. Величину межслоевого пространства (h) СДГ вычисляли по разности между значением межплоскостного расстояния отражения (003) и толщиной слоя СДГ, которая равна 4,80 Å [1].
Спектры комбинационного рассеяния (КР-спектры) были сняты на спектрометре Renishaw InVia Reflex. При этом использовали длину волны возбуждающего излучения 514,0 нм (аргоновый лазер).
Результаты и обсуждение
В табл. 2 приведены формулы синтезированных образцов, выведенные на основании химического анализа. Атомное соотношение катионов магния и алюминия в слоях образцов практически соответствует расчетному значению. Атомное соотношение Al/S для образцов, синтезированных методом соосаждения, стремится к двум, что соответствует практически полной нейтрализации заряда катионов алюминия в слоях с помощью тиодиацетат-анионов. В случае образцов, модифицированных методом анионного обмена, по мере увеличения времени интеркаляции, атомное соотношение Al/S также стремится к двум, что свидетельствует о постепенном замещении нитрат-ионов на тиодиацетат-анионы.
Таблица 2
Химические формулы образцов СДГ
|
№ |
Образец |
Химическая формула |
Атомное отношение |
||
|
Mg/Al |
Al/N |
Al/S |
|||
|
1 |
MgAl-NO 3 |
[Mg 0,69 Al 0,31 (OH) 2 ](NO 3 ) 0,31 ·1,00 H 2 O |
2,20 |
1,00 |
– |
|
2 |
MgAl-tda-1 |
[Mg 0,67 Al 0,33 (OH) 2 ](ТДА) 0,14 (NO 3 ) 0,03 ·0,30 H 2 O |
1,99 |
– |
1,99 |
|
3 |
MgAl-tda-2 |
[Mg 0,65 Al 0,35 (OH) 2 ](ТДА) 0,10 (NO 3 ) 0,08 ·0,39 H 2 O |
1,98 |
– |
2,02 |
|
4 |
MgAl-tda-3 |
[Mg 0,67 Al 0,33 (OH) 2 ](ТДА) 0,11 (NO 3 ) 0,04 ·1,04 H 2 O |
1,99 |
– |
2,72 |
|
5 |
MgAl-tda-4 |
[Mg 0,67 Al 0,32 (OH) 2 ](ТДА) 0,16 ·0,98H 2 O |
1,98 |
– |
2,11 |
|
6 |
MgAl-tda-5 |
[Mg 0,66 Al 0,34 (OH) 2 ](ТДА) 0,17 ·0,95H 2 O |
1,98 |
– |
2,04 |
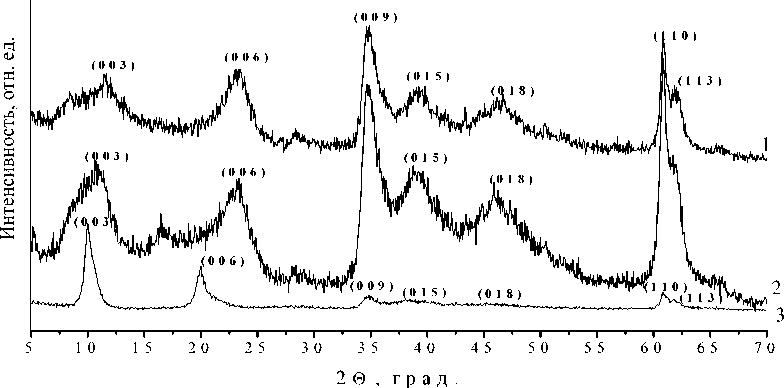
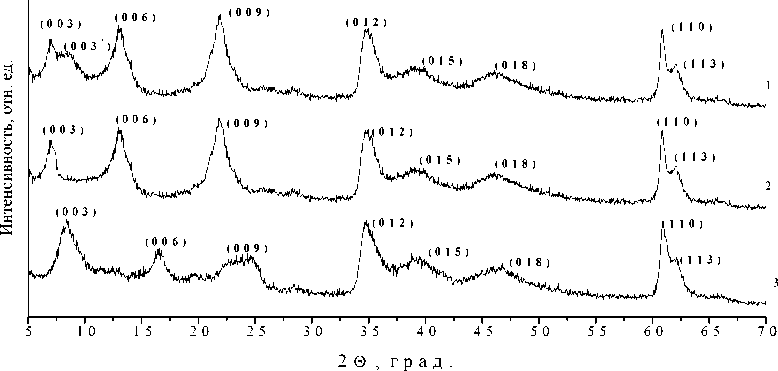
На рентгенограммах всех образцов (рис. 1) присутствует набор рефлексов, характерный для структуры СДГ [2, 3]. Для образца MgAl-NO 3 максимумы рефлексов (003), (006), (009) соответствуют углам 2 θ , равным 10, 20, 35°, соответственно. В случае образцов, интеркалированных методом соосаждения, максимумы данных рефлексов смещаются в область средних углов, что характерно для уменьшения расстояния между слоями СДГ. На рентгенограммах образцов, модифицированных методом анионного обмена, напротив, наблюдается смещение максимумов рефлексов в область малых углов, что связано с увеличением межслоевого пространства СДГ. На рентгенограмме образца MgAl-tda-3 наблюдаются рефлексы (003) и (003)’, которые свидетельствуют о наличии межслоевых областей, в которых тиодиацетат-анионы различным образом ориентированы относительно металлогидроксидных слоев. Данное явление, называемое в иностранной литературе «interstratification», характерно для процесса интеркаляции слоистых материалов [10].
В табл. 3 представлены результаты расчета структурных параметров полученных образцов. Величина межслоевого пространства СДГ меняется в зависимости от способа интеркаляции и количества анионов-модификаторов и молекул воды в нем. Так, для образцов MgAl-tda-1 и MgAl-tda-2 величина h меньше по сравнению с образцом нитратной формы СДГ. Для образцов MgAl-tda-3, MgAl-tda-4, MgAl-tda-5, напротив, наблюдается увеличение межслоевого пространства.
Согласно расчетам в программе Chem3D [11], размер тиодиацетат-аниона составляет 7,55 Å. В геометрическом приближении [12] можно оценить, под каким углом располагается анион-модификатор по отношению к слоям СДГ. По нашим расчетам, в образцах MgAl-tda-1, а также MgAl-tda-2, тиодицетат-анионы располагаются под углами 21 и 25° относительно слоев двойного гидроксида. В образце MgAl-tda-3 присутствуют межслоевые области, в которых тиодиацетат-анионы располагаются под углом 46° (параметр d 003 равен 5,47 Å) и области, в которых их положение практически перпендикулярно по отношению к слоям (в случае, когда параметр d 003 равен 12,62 Å). Анионы ориентируются под углом 50° по отношению к слоям в образце MgAl-tda-5.
a)
б)
Рис. 1. Рентгенограммы образцов: а) 1 – MgAl-tda-1; 2 – MgAl-tda-2; 3 – MgAl-NO 3 ; б) 1 – MgAl-tda-3; 2– MgAl-tda-4; 3 – MgAl-tda-5
Таблица 3
Структурные параметры полученных образцов
|
Образец |
d 003 , Å |
c , Å |
h , Å |
d 110 , Å |
a , Å |
|
MgAl-NO 3 |
8,80 |
26,40 |
4,00 |
1,52 |
3,04 |
|
MgAl-tda-1 |
7,52 |
24,90 |
2,72 |
1,52 |
3,04 |
|
MgAl-tda-2 |
8,03 |
24,09 |
3,23 |
1,52 |
3,04 |
|
MgAl-tda-3 |
12,62 |
37,86 |
7,80 |
1,52 |
3,04 |
|
MgAl-tda-4 |
12,32 |
36,96 |
7,52 |
1,52 |
3,04 |
|
MgAl-tda-5 |
10,54 |
31,64 |
5,75 |
1,52 |
3,04 |
Физическая химия
На расположение тиодиацетат-анионов относительно слоев СДГ оказывает влияние количество молекул кристаллизационной воды в межслоевом пространстве образца: чем больше молекул воды содержит СДГ, тем больше угол, образуемый плоскостью, в которой лежит анион, и плоскостью слоя, и, следовательно, больше межслоевое расстояние. При малом количестве кристаллизационной воды в образце, межслоевые анионы стремятся образовывать водородные связи с гидроксильными группами поверхности слоев, способствуя стабилизации структуры СДГ. При этом плоскость, в которой располагаются анионы, практически горизонтальна плоскости слоев. С увеличением влажности образца анионы формируют максимальное количество водородных связей с молекулами воды, при этом увеличивается угол между плоскостью аниона и плоскостью слоя [13].
Спектры комбинационного рассеяния для образцов MgAl-NO 3 и MgAl-tda-4 приведены на рис. 2. Расшифровка КР-спектров, проведенная с использованием источников [14–16], представлена в табл. 4.
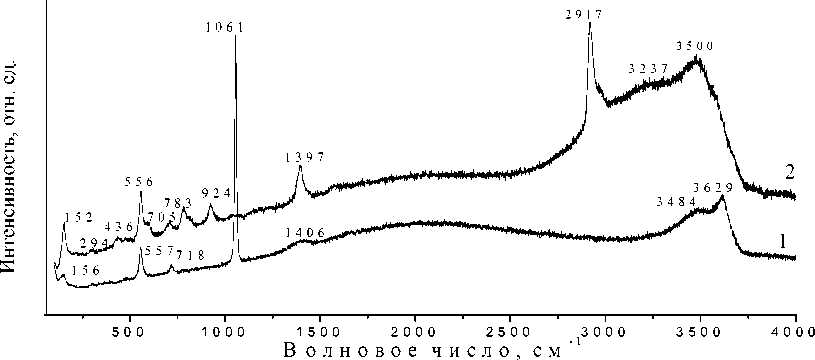
Рис. 2. КР-спектры образцов: 1 – MgAl-NO 3 ; 2 – MgAl-tda-4
Таблица 4
Расшифровка КР-спектров полученных образцов
|
Группа атомов |
Волновое число, см–1 |
|
Валентные колебания Mg/Al–OH |
557 |
|
Валентные колебания межслоевых анионов: NO 3 – |
1061 |
|
Валентные колебания ОН-групп слоев СДГ и молекул воды |
3237, 3500, 3484, 3629 |
|
Валентные колебания связей С–Н СН2-групп тиодиацетат-анионов |
2917 |
|
Валентные колебания связей С–С |
924 |
|
Валентные колебания S–C |
781 |
|
Валентные колебания –СОО–-групп |
1397 |
Общий вид КР-спектра образца MgAl-NO3 согласуется со спектрами нитратной формы магний-алюминиевых СДГ, полученных другими исследователями и содержит моды колебаний всех групп атомов, характерных для СДГ [14]. Интеркаляция образцов тиодиацетат-анионами меняет вид спектра: исчезает мода колебаний нитрат-ионов, появляются полосы поглощения, соответствующие тиодиацетат-анионам. Наличие в КР-спектре мод колебаний аниона-модификатора дополнительно подтверждает интеркаляцию магний-алюминиевых СДГ.
Выводы
Осуществлена интеркаляция тиодиацетат-анионов в межслоевое пространство магнийалюминиевых СДГ методом соосаждения и методом анионного обмена. По данным РФА, в результате интеркаляции получены образцы с различными межслоевыми расстояниями. Установлено, что содержание кристаллизационных молекул воды в образцах оказывает влияние на спо- соб ориентации анионов-модификаторов по отношению к слоям СДГ. Методом КР-спектро-скопии дополнительно доказано внедрение тиодиацетат-анионов в межслоевое пространство образцов. Наличие тиосодержащего комплексона в межслоевом пространстве полученных образцов позволяет рассматривать их в качестве потенциальных сорбентов для катионов переходных металлов.
Список литературы Синтез и структурные особенности слоистых двойных гидроксидов, интеркалированных тиодиацетат-анионами
- Layered double hydroxides: present and future/edit. by V. Rives. -New York: Nova Publishers, 2001. -439 p.
- Химическая модификация слоистых двойных гидроксидов -новый путь к получению функциональных нанокомпозитных материалов/А.В. Лукашин, С.В. Калинин, А.А. Вертегел и др.//ДАН. -1999. -Т. 369, № 6. -С. 781-783.
- Braterman P.S. Layered Double hydroxides (LDH)/S.P. Braterman, Z.P. Xu, F. Yarberry//Handbook of layered materials/Ed. by S.M. Auerbach, K.A. Carrado, P.K. Dutta. -New York: Marcel Deccer, Inc. -2004.
- Crepaldi E.L. Hydróxidos duplos lamelares: sintese, estuctura, propriedades e aplicaçôes/E.L. Crepaldi, J.B. Valim//Quimica Nova. -1998. -Vol. 26. -P. 300-311.
- Исследование анионного обмена в слоистых двойных гидроксидах сиспользованием тритиевой метки/А.В. Лукашин, Е.В. Лукашина, А.А. Елисеев и др.//ДАН. -2004. -Т. 396, № 2. -С. 208-211.
- Pavlovic I. Adsorption of Cu2+, Cd2+ and Pb2+ ions by layered double hydroxides intercalated with the chelating agents diethylenetriaminepentaacetate and meso-2,3-dimercaptosuccinate/I. Pavlovic, MR. Pérez, C. Barriga//Appl. Clay Sci. -2009. -Vol. 43. -P. 125-129.
- Handbook of Clay Science/eds. F. Bergaya, B.K.G. Theng, G. Lagaly. -Amsterdam: Elsevier, 2006. -1224 p.
- Шварценбах Г. Комплексонометрическое титрование/Г. Шварценбах, Г. Флашка. -М.: Химия, 1970. -360 с.
- Бельская О.Б. Исследование процесса формирования платиновых центров на основных носителях типа слоистых двойных гидроксидов. 1. Влияние природы межслоевого аниона на структурные характеристики алюмомагниевого слоистого гидроксида и процесс формирования оксидной фазы/О.Б. Бельская, Н.Н. Леонтьева, Т.И. Гуляева//Кинетика и катализ. -2011. -Т. 52, № 5. -С. 778-786.
- Kaneyoshi M. Exchange of interlayer therephtalate anions from a Mg-Al layered double hydroxide: formation of an intermediate interstratified phases/M. Kaneyoshi, W. Jones//Chem. Phys. Letters. -1998. -Vol. 296. -P. 183-186.
- http://scistore.cambridgesoft.com
- Kameda T. Preparation of organic acid anion-modified magnesium hydroxides by coprecipitation: A novel material for the uptake of heavy metal ions from aqueous solutions/T. Kameda, H. Takeuchi, T. Yoshioka/J. Phys. Chem. Solids. -2009. -Vol. 70. -P. 1104-1108.
- Hansen H. Synthesis and properties of hexacyanoferrate interlayered in hydrotalcite. I. Hexacyanoferrate (II)/H. Hansen, C. Koch//Clays and Clay Miner. -1994. -Vol. 42. -P. 170-179.
- Vibrational modes in layered double hydroxides and their calcined derivatives/W. Kaganya, R. Baddour-Hadjesn, F. Kooli et al.//Chem. Phys. -1998. -Vol. 236. -P. 225-234.
- Tsyganok A.I. Incorporation of transition metals into Mg-Al layered double hydroxides: coprecipitation of cations vs their precomplexation with an anionic chelator/A.I. Tsyganok, A. Sayari//J. Solid State Chem. -2006. -Vol. 179. -P. 1830-1841.
- X-ray structures and farinfrared and Raman-spectra of tetrahedral thiophenolato and seleno-phenolato complexes of zinc (II) and cadmium (II)/N. Ueyama, T. Sugavara, K. Sasaki et al.//Inorg. Chem. -1988. -Vol. 27. -P. 741-747.


