Синтез и свойства 2-(9-антраценил)-4,5-дифенилимидазола
Автор: Танасейчук Борис Сергеевич, Азрапкина Ангелина Ивановна, Маркелова Юлия Анатольевна, Мурюмин Евгений Евгеньевич, Пряничникова Маргарита Константиновна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Химия
Статья в выпуске: 1-2, 2014 года.
Бесплатный доступ
В статье описывается синтез 2-(9-антраценил)-4,5-дифенилимидазола; на основании ИК спектров и квантово-химических расчетов высказывается предположение о возможной структуре димера 2-(9-антраценил)-4,5-дифенилимидазолила.
Имидазол, 2-(9-антраценил)-4, 5-дифенилимидазол, окисление, радикал, димеризация, димер, структура димера
Короткий адрес: https://sciup.org/14720070
IDR: 14720070 | УДК: 547.569.3
Текст научной статьи Синтез и свойства 2-(9-антраценил)-4,5-дифенилимидазола
Серия «Естественные и технические науки»
Радикалы триарилимидазолильного ряда относятся к типу электро-нодифецитных радикалов [5]. Поэтому введение заместителя, обладающего электронодонорным характером, или замена фенильного кольца остатком полицикла должны увеличивать относительную стабильность этих радикалов [4].
В этой связи нам представляется интересной замена фенильного кольца в положении С2 имидазольного кольца на остаток антрацена, поскольку в этом случае возникают два взаимоисключающих фактора, определяющих относительную стабильность радикалов. С одной стороны, остаток антрацена можно рассматривать как электронодонорный заме- ститель, способствующий делокализации электронов по антраценовому кольцу, а с другой, боковые фенильные кольца антрацена могут мешать образованию плоской системы, тем самым дестабилизируя радикал.
Для решения вопроса, что именно является определяющим в стабилизации радикала, – увеличение степени делокализации электрона или стерические факторы, препятствующие этой делокализации, – и был осуществлен синтез 2-(9-антраценил)-4,5-дифенилимида-зола (I).
Имидазол (I) был получен путем конденсации бензила, 9-формилантра-цена (II), ацетата аммония и уксусной кислоты по способу Дэвидсона [8].
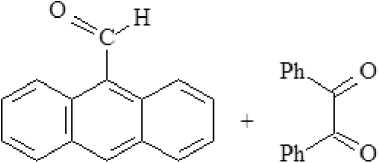
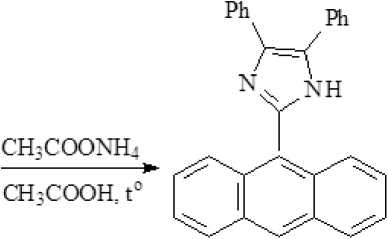
Полученный имидазол (I) представляет собой светло-желтый кристаллический продукт, хорошо растворимый в уксусной кислоте при низких температурах, а в ацетонитриле, спирте, толуоле и ДМСО – при нагревании. Структура имидазола (I) была подтверждена ИК-, ПМР 1Н- и 13С спектрами.
При окислении (I) гексацианоферратом (III) калия в щелочном водно-спир-
ВЕСТНИК Мордовского университета | 2014 | № 1-2
Схема 2
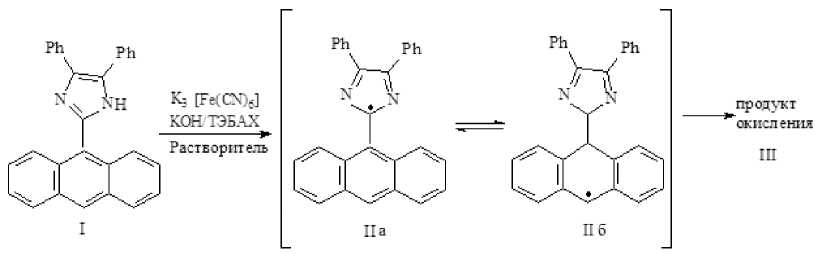
При взаимодействии имидазола (I) с аналогичным окислителем в других растворителях (ацетонитрил, диоксан), где исходный имидазол растворялся лучше, был получен тот же продукт (III), но с гораздо большими выходами, чем при окислении в водно-спиртовом растворе.
В ИК спектре (III) были обнаружены: полоса в области 3 441 см-1, характерная для валентных колебаний NH-
I товом растворе был получен продукт неизвестного строения (III), который по ИК спектру и физическим характеристикам (температура плавления и растворимость в органических растворителях) отличается от имидазола (I). Однако продукт (III) не реагировал с N,N-дифенилпикрилгидразином (ДФПГ∙Н) в отличие от обычных димеров триари-ли мидазолильных радикалов [2].
группы, которая должна отсутствовать в продукте димеризации радикала (II), группа полос в области 1 327–1 265 см-1, характерная для валентных колебаний углеродного скелета, и сильная полоса в области 894 см-1.
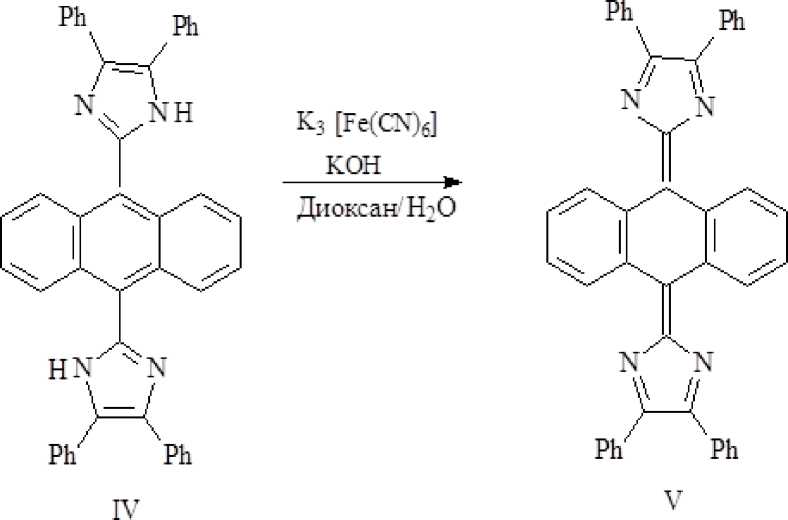
Сравнивая ИК спектры продукта (III) с ИК спектром ранее синтезированного хинона 2,2′-(антрацен-9,10-диилиден) бис(4,5-дифенил-2Н-имидазола) (V) [3], мы обнаружили их большое сходство.
Серия «Естественные и технические науки»
Так, в ИК спектре хинона (V) присутствуют сильные полосы поглощения в области 1 327–1 265 см-1 и очень сильная полоса в области 895 см-1, которые отсутствуют в исходном имидазоле (IV). Аналогичная картина наблюдается и в ИК спектре (III). Интересно, что полосы в области 1 326–1 265 см-1 наблюдались и в случае 2-аминоантра-хинона [1]. Скорее всего, эти полосы принадлежат антрахиноновой структуре.
В масс-спектре продукта (III) присутствует пик с m/z 395, который может быть отнесен только к радикалу (II), образование которого возможно только в том случае, если продукт (III) является димером радикала (II). Отсутствие пика молекулярного иона (III) возможно из-за его низкой устойчивости в условиях съемки масс-спектра. К сожалению, получить ЯМР спектр не представилось возможным из-за очень плохой растворимости (III).
Предлагая на основе данных ИК и масс-спектра возможную структуру димера (III), мы исходили из следующих предпосылок [6; 10].
Классическим вариантом димеризации триарилимидазолилов является образование связи С–N между атомом С2 одного имидазольного цикла с атомом азота другого имидазольного цикла [10], так называемой донорно-акцепторной димеризации, характерной для относительно стабильных радикалов [6] (структура VI a). Для короткоживущих же радикалов характерна димеризация по атомам с наибольшей плотностью неспаренного электрона. В нашем случае из-за стерических препятствий, создаваемых большим объемом антраценового цикла, димеризация радикалов может проходить не обязательно по атомам, несущим наибольшую спиновую плотность, а аналогично димеризации трифенилметильных радикалов.
ВЕСТНИК Мордовского университета | 2014 | № 1-2
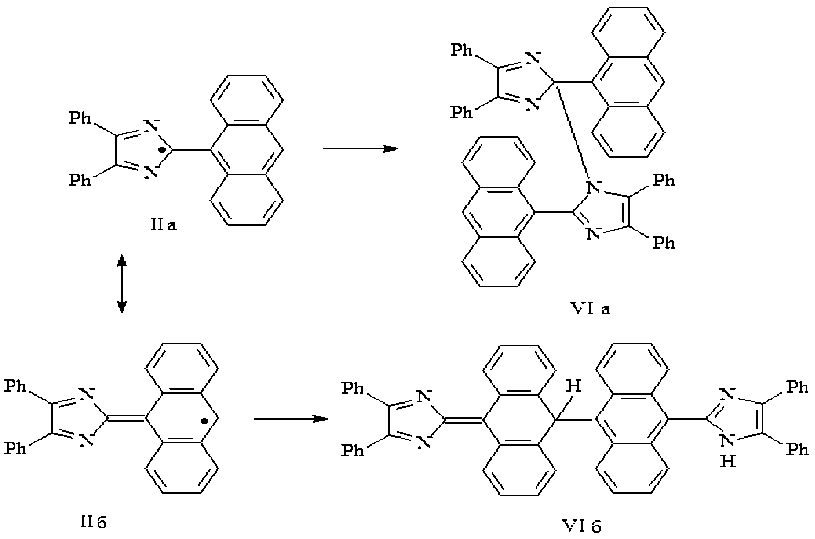
Так как наименее стерически затрудненной оказывается димеризация радикала (II б) по положению С 10 антраценового цикла, то в этом случае в димере (VI б) два антраценовых кольца не мешают друг другу, поскольку являются взаимно ортогональными. При этом половина димера сохраняет ароматичность имидазольного цикла, а вторая, имея хиноидную структуру имидазольного цикла, имеет два бензольных кольца в антраценовом фрагменте.
Предлагаемая нами структура димера (VI б) объясняет наличие в ИК спектре полосы поглощения в области 3 441 см-1, характерной для NH-группы, и полос в области 1 326–1 265 см-1, характерных для антрахинона.
С целью подтверждения возможности образования димера, имеющего структуру (VI б) были выполнены квантово-химические расчеты неэмпирическим методом Хартри-Фока в базисе 6–31 G из пакета прикладных программ [9] для полных энергий структур радикалов (II а–б) и ди- меров (VI а–б). Расчеты показали, что хотя разность в полных энергиях (II а–б) составляет 418,25 ккал/моль, радикал (II а) является более устойчивым, чем радикал (II б), а образование димера (VI б) – более предпочтительным, чем (VI а). Выигрыш в энергии, который представляет собой разность полных энергий продуктов и исходных веществ, т. е. димеров (VI а–б) и радикалов (II а–б) соответственно, в первом случае составляет -763,71 ккал/моль, а во втором – 97,08 ккал/моль. Меньшая стабильность димера (VI а) связана, скорее всего, с возможными стерическими затруднениями, которые могут возникнуть при его образовании.
Таким образом, на основании проведенных исследований констатируем, что в данном случае определяющим фактором дестабилизации радикала являются стерические препятствия, создаваемые взаимным отталкиванием антраценового и имидазольного циклов, и димеризация радикала идет с образованием димера (VI б).
Экспериментальная часть
Качественный анализ синтезированных веществ был проведен методом тонкослойной хроматографии на пластинках Silufol UV-245. ИК спектры веществ регистрировали с помощью Фурье – спектрометра «Инфра-Люм ФТ –02» в таблетках КBr. Электронные спектры видимой области регистрировали на спектрофотометре «СФ-16». ЯМР 13С- и 1Н-спектры были получены на приборе Bruker «АМХ-400» (100 МГц) в растворе ДМСО-d6, масс-спектр – на приборе «KONIK MS Q12» (ионизация электроударом Uиониз. 70 эВ). Квантово-химический расчет выполнен неэмпирическим методом Хартри-Фока в базисе 6–31 G из пакета прикладных программ GAMESS.
9-Формилантрацен был получен методом [7].
2-(9-Антраценил)-4,5-дифенили-мидазол (I). Смесь 1 г (0,0048 моль) 9-формилантрацена, 1.1 г (0,0052 моль) бензила, 5,6 г (0,0728 моль) ацетата аммония и 15 мл ледяной уксусной кислоты кипятили 2,5 ч. Контроль за ходом реакции вели хроматографией на силу-фоле (элюент – метилен хлористый) по исчезновению пятна 9-формилантра-цена (Rf 0,33). По окончании реакции реакционную смесь вылили в ~150 мл воды и добавили ~5 см3 25 % раствора аммиака. Образовавшийся желтый осадок отфильтровали, сушили на воздухе, перекристаллизовывали из толуола. Выход 1,45 г (75,5 %), светло-желтые кристаллы, t пл. 224–225 ºС. Спектр ЯМР 1Н (CD3Cl), δ, м. д.: 7,23 (1H, т. д Ј ~ 14,65 Г3ц), 7,33(3H, т. д Ј ~ 14,65 Гц), 7,41 (2H, т. д Ј ~ 15,11 Гц), 7,55 (6H, т. д Ј ~ 41,22 Гц), 7,68 (2H, т. д Ј ~ 8,24 Гц), 7,94 (2H, т. д Ј ~ 10,07 Гц), 8,16 (2H, т. д Ј ~ 13,28 Гц), 8,75(1H, с). Спектр ЯМР 13С (CD3Cl), δ, м. д.: 126,10, 126,59, 127,12, 127,89, 128,52, 128,80, 129,26, 131,38, 131,48, 136,04, 143,84.
Продукт окисления 2-(9-антраценил)-4,5-дифенилимидазола (III).
-
а) Растворителем является водный спирт. Смесь 0,4 г (0,001 моль)
2-(9-антраценил)-4,5-дифенилимидазола (I), 0,34 г (0,006 моль) гидроксида калия и 70 мл этилового спирта перемешивали до полного растворения всех компонентов. Затем по каплям прибавляли 131,6 мл 1%-ного раствора гексацианоферрата (III) калия. По окончании прибавления окислителя смесь перемешивали при комнатной температуре ~30 мин. Выпавший оранжево-коричневый осадок отфильтровали и промыли на фильтре водой до нейтральной реакции промывных вод и отрицательной реакции на ионы Fe2+ и Fe3+. Сушили на воздухе. Очищали последовательной перекристаллизацией из пиридина и водного диоксана. Выход составил 0,04 г (5,1 %), оранжевые кристаллы.
-
б) Растворитель – диоксан -1,4. К смеси 0,1 г (0,00025 моль) 2-(9-антраценил)-4,5-дифенилимидазола (I), 5 мл диоксана и 4 мл 6%-ного раствора гидроксида калия прибавили охлажденный раствор 0,3 г (0,001 моль) гексацианоферрата (III) калия в 7 мл воды. Раствор изменил окраску с желтой на оранжевую. Реакционную смесь перемешивали ~2 ч при комнатной температуре. Контроль за ходом реакции вели хроматографией на силуфоле (элюент – метилен хлористый:ацетонитрил 1:1) по исчезновению пятна 2-(9-антраценил)-4,5-дифенилимидазола (I) (Rf 0,61). По окончании реакции выпавший осадок отфильтровали, промыли на фильтре водой до нейтральной реакции промывных вод и отрицательной реакции на ионы Fe2+ и Fe3+. Сушили на воздухе. Очищали перекристаллизацией из толуола. Выход 0,088 г (44,5 %), оранжевые кристаллы, t пл. >235–237 ºС.
-
в) Растворитель – ацетонитрил. К смеси 0,1 г (0,00025 моль) 2-(9-антраценил)-4,5-дифенилимидазола (I), 10 мл ацетонитрила и 4 мл 6%-ного раствора гидроксида калия прибавили охлажденный раствор 0,3 г (0,001 моль) гексацианоферрата (III) калия в 7 мл воды. Раствор изменил окраску с желтой на оранжевую. Реакционную смесь перемешивали ~2 ч при охлаждении ледяной водой. Контроль за ходом реакции вели хроматогра-
Серия «Естественные и технические науки»
фией на силуфоле (элюент – метилен хлористый:ацетонитрил 1:1) по исчезновению пятна 2-(9-антраценил)-4,5-дифенилимидазола (I) (Rf 0,61). По окончании реакции выпавший осадок отфильтровали, промыли на фильтре водой до нейтральной реакции промывных вод и отрицательной реакции на ионы Fe2+ и Fe3+. Сушили на воздухе. Очищали перекристаллизацией из толуола. Выход 0,0712 г (36 %), оранжевые кристаллы, t пл. >235–237 ºС.
ВЕСТНИК Мордовского университета | 2014 | № 1-2
Список литературы Синтез и свойства 2-(9-антраценил)-4,5-дифенилимидазола
- Наканиси, К. Инфракрасные спектры и строение органических соединений/К. Наканиси. -Москва: Мир, 1965. -216 с.
- Исследования в области азотсодержащих гетероциклических свободных радикалов : Использование ДФПГ для изучения скорости диссоциации димеров трифенилимидазолильных радикалов // Б. С. Танасейчук [и др.] // Журнал органической химии. - 1969. - Т. 5. - № 11. - С. 2054-2055.
- Редокс-индуцированная обратимая трансформация системы хинон - дианион на основе 2,2'-ан-трацент-9,10-диилиденбис(4,5-дифенил-2Н-имидазола) // Б. С. Танасейчук [и др.] // Журнал органической химии. - 2013. - Т. 4. - № 5. - С. 756-759.
- Танасейчук, Б. С. Исследования в области азотсодержащих гетероциклических свободных радикалов : Синтез и скорость диссоциации бис-а-нафтилдиарилимидазолилов // Б. С. Танасейчук, А. А. Бардина, И. М. Некаева // Химия гетероциклических соединений. - 1972. - № 12. - С. 1688-1689.
- Танасейчук, Б. С. О влиянии заместителей на относительную стабильность свободных радикалов // Б. С. Танасейчук, О. Б. Томилин, К. П. Бутин // Журнал органической химии. - 1982. - Т. 18. - № 2. - С. 241-246.
- Танасейчук, Б. С. К вопросу об общих закономерностях образования димеров свободных радикалов // Б. С. Танасейчук // Журнал органической химии. - 2004 - Т. 40. - № 4. - С. 629-632.
- Campaigne, Е. The use of dimethylformamide as a formylation reagent/E. Campaigne, L. Wesley Archer//Journal American Chemical Society. -1953. -Vol. 75. -№ 4. -P. 991.
- Davidson, D. The action of ammonia on benzyl/D. Davidson, M. Weiss, M. Jelling//Journal of Organic Chemistry. -1937. -Vol. 2. -Р. 319-327.
- General atomic and molecular electronic structure system/M.W. Schmidt [et al.]//J. Comput. Chem. -1993. -Vol. 14. -P. 1347-1363.
- White, D. M. Oxidation of triarylimidazoles. Structures of the photochromic and piezochromic dimers of triarylimidazyl radicals/D. M. White, J. Sonnenberg//Journal American Chemical Society. -1966. -Vol. 88. -№ 16. -P. 3825-3829.


