Синтез и свойства симметричных димочевин на основе производных пропионовой кислоты - потенциальных мультитаргетных ингибиторов sEH и COX-2
Автор: Дьяченко В.С., Гладких Б.П., Бутов Г.М.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 12-3 (87), 2023 года.
Бесплатный доступ
В предыдущей нашей работе мы описали получение изоцианатов с высокими выходами на основе нестероидных противовоспалительных препаратов (НПВП) из группы пропионовой кислоты (напроксен, кетопрофен и флурбипрофен), а также 1,3-дизамещенных мочевин на их основе. В продолжение нашей работы, полученные изоцианаты на основе НПВП были вовлечены в реакцию с гексаметилендиамином (ГМДА), полученна серия симметричных 1,3-дизамещенных димочевин с выходами 56-84%. Полученные симметричные 1,3-дизамещенные димочевины являются потенциальными мультитаргетными ингибиторами растворимой эпоксидгидролазы (sEH) и циклооксигеназы (COX).
Производные пропионовой кислоты, напроксен, кетопрофен, флурбипрофен, димочевина, изоцианаты
Короткий адрес: https://sciup.org/170201569
IDR: 170201569 | DOI: 10.24412/2500-1000-2023-12-3-152-155
Текст научной статьи Синтез и свойства симметричных димочевин на основе производных пропионовой кислоты - потенциальных мультитаргетных ингибиторов sEH и COX-2
Производные пропионовой кислоты из группы нестероидных противовоспалительных препаратов (НПВП) обладают значительным обезболивающим, противовоспалительным и жаропонижающим эффектом за счет подавления продукции простагландинов циклооксигеназы-1 (СОХ-1) [2, 3]. Простагландины, полученные по метаболическому пути циклооксигеназы-2 (COX-2) и эпоксиэйкозатриено-вые кислоты (EET) из пути цитохрома P450/sEH являются важными эйкозаноидами, которые регулируют ангиогенез и онкогенез. Ингибиторы COX-2, блокирующие образование простагландинов, подавляют рост опухоли, в то время как ингибиторы sEH, увеличивают производство эндогенных EETs. EETs оказывают противовоспалительное действие на эндотелий путем ингибирования индуцированного цитокинами транскрипционного фактора NF-kB [4]. Ядерный фактор транскрипции
NF-kB является ключевым компонентом клеточного ответа на повреждение, стресс и воспаление.
Получение нового поколения биодо-ступных мультитаргетных ингибиторов sEH/COX-2 на основе производных пропионовой кислоты (напроксен, кетопрофен и флурбипрофен) при метаболизме которых могут получится соединения с проверенными фармакологическими и токсикологическими свойствами - перспективное направление в медицинской химии.
Обсуждение результатов
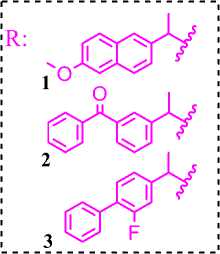
Ранее, мы сообщали о синтезе 2-(1-изоцианатоетил)-6-метоксинафталена, (3 -(1- изоцианатоетил)фенил)(фенил)метанона, 2-фтор-4-(1 -изоцианатометил)-1,1’-бифенила из напроксена, кетопрофена и флурбипрофена и 1,3-дизамещенных мочевин на их основе [1].
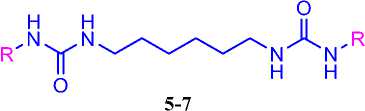
Полученные изоцианаты 1-3 были вовлечены в реакцию c гексаметилендиамином (ГМДА) 4 для получения 1,3-дизамещенных димочевин 5-7 (схема 1). Выбор данного диамина (ГМДА) 4 обусловлен тем, что на его основе были получены 1,3-дизамещенные димочевины с вы- сокой ингибирующую активность в отношение sEH (0.4 nM) [5].
Синтез 1,3-дизамещенных димочевин 57 осуществляли в среде безводного диэтилового эфира в течение 12 ч, при комнатной температуре, в присутствие триэти-ламина.
Схема 1
R — N = C = O
Et2O,Et3N, 25°C, 12h
Выходы полученных мочевин составили от 56% до 84%. Структуру полученных соединений подтверждали методом ЯМР
1H спектроскопии. Свойства синтезированных 1,3-дизамещенных димочевин 5-7 представлены ниже (табл. 1).
Таблица 1. Коэффициенты липофильности, температуры плавления и водораствори-мость 1,3-дизамещенных мочевин 5-7
|
№ |
Структура |
Т пл., °C |
LogP* |
Растворимость, мкМ** |
Выход, % |
|
5 |
I i н н ^</\ANAN/X/X/XxNVN'''^ |
103 |
7.08 |
100 ± 20 |
56 |
|
6 |
H н H I' I / н н | |
96 |
7.51 |
140 ± 20 |
84 |
|
7 |
ЦТ |
171 |
8.35 |
120 ± 20 |
76 |
*Рассчитан с помощью программы Molinspiration © Molinspiration Cheminformatics.
**Водорастворимость соединений была исследована на спектрофотометре «THERMO FISHER SCIENTIFIC Genesys 180» (США) по известной методике.
В спектрах ЯМР 1H соединений 5-7 присутствуют характерные сигналы в области 5.76–5.76 м.д. соответствующие протону NH мочевинной группы связанные между собой спейсером из шести атомов углерода. Сдвиги в области 6.14 м.д. соответствуют протону NH мочевинной группы, связанной с остатками производных пропионовой кислоты (напроксен, кетопрофен, флурбипрофен).
Рассчитанный коэффициент липофильности LogP для синтезированных димочевин 5-7 находится в пределах 7,08-8.35, что несколько превышает допустимые границы по правилу Липински [6].
Таким образом, синтезированы новые мультитаргетные ингибиторы sEH/COX-2, содержащие в своей структуре фрагменты НПВП – производных пропионовой кислоты (напроксен, кетопрофен, флурбипро- фен). Полученные значения водораство-римости (100-140 мкМ) и температур плавления (96-171 °C) сопоставимы или превосходят значения известной 1,3-дизамещенной димочевины испытанного нами ранее в опытах in vivo [5].
Из полученной серии 1,3- дизамещенных димочевин можно выделить соединение «лидер» - 1,1'-(гексан-1,6-диил)бис(3-(1-(3-бензоилфенил)этил) мочевина) 6. В совокупности с высокими выходами (84%), полученное соединение может являться потенциальными высокоактивными мультитаргетными ингибиторами растворимой эпоксидгидролазы (sEH) и циклооксигеназы (COX-2).
Экспериментальная часть
Исходные триэтиламин (BioUltra ≥99.5%, CAS 121-44-8), гексаметилендиамин (99%, CAS 124-09-4) производства фирмы «Sigma-Aldrich».
2-(1-Изоцианатоетил)-6-метоксинафтален, (3-(1- изоцианатоетил)фенил)-(фенил)метанон, 2-фтор-4-(1-изоцианатометил)-1,1’-бифенил на основе производных пропионовой кислоты (напроксен, кетопрофен, флурбипрофен) были получены нами ранее и использовались как смесь энантиомеров S(+) и R(-) [1].
Диэтиловый эфир, этанол очищали общеизвестными методами.
Строение полученных соединений подтверждали с помощью ЯМР 1Н спектроскопии и элементного анализа. ЯМР 1Н выполнен на Bruker Avance 600 (Bruker Corporation, США) в растворителе DMSO-d6; химические сдвиги 1H приведены относительно SiMe4. Элементный анализ выполнен на приборе «Perkin-Elmer Series II 2400» (Perkin-Elmer, США). Температуры плавления определены на приборе OptiMelt MPA100 (Stanford Research Systems, США). Коэффициент липофильности cLogP рассчитывали по программе Molinspiration (.
1,1'-(Гексан-1,6-диил)бис(3-(1-(6-метоксинафтален-2-ил)этил) мочевина) ( 5 ).
К 0,5 г (2,2 ммоль) 2-(1- изоцианатоетил)-6-метоксинафталена 1 в
10 мл диэтилового эфира прибавляли 0,127 г (1,1 ммоль) гексаметилендиамина 4 и 0,4 мл триэтиламина. Реакционную смесь выдерживали при комнатной температуре в течение 12 ч. После добавления 5 мл 1н HCl, смесь перемешивали в течение 1 ч. Выпавший белый осадок отфильтровывали и промывали водой. Продукт очищали перекристаллизацией из этанола. Выход 0,319 г (56%). Т пл. 103 °C. Спектр ЯМР 1Н (DMSO- d 6 ), δ, м.д.: 1.19-1.30 м (8Н, -
(С Н 2 ) 4 -), 1.46 c (6H, -С Н 3 ), 2.88-3.07 м (4Н, -С Н 2 -NH-), 3.83 с (6H, О-С Н 3 ), 4.66-4.80 м (2Н, -С Н -СН 3 ), 5.77 c (2Н, -СН 2 -N H -), 6.14 c (2Н, -N H -СН-), 6.99-7.79 м (12Н, С Н аром ). Найдено,%: С 71.60; Н 7.48; N 9.83. C 34 H 42 N 4 О 4 . Вычислено,%: С 71.55; Н 7.42; N 9.82. M=570
1,1'-(Гексан-1,6-диил)бис(3-(1-(3-бензоилфенил)этил)мочевина) ( 6 ).
Получена аналогично соединению 1 из 0,5 г (2,0 ммоль) (3-(1- изоцианатоэтил)фенил)(фенил)метанона и 0,115 г (1,0 ммоль) 1 гексаметилендиамина 4. Выход 0,519 г (84%). Тпл. 96 °C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.18-1.31 м (8Н, -(СН2)4-), 1.48 c (6H, -СН3), 2.86-3.11 м (4Н, -СН2-NH-), 4.68-4.88 м (2Н, -СН-СН3), 5.76 c (2Н, -СН2-NH-), 6.14 c (2Н, -NH-СН-), 6.94-7.91 м (18Н, СНаром). Найдено,%: С 73.76; Н 6.86; N 9.05. C38H42N4О4. Вычислено, %: С 73.76; Н 6.84; N 9.05. M=618
1,1'-(Гексан-1,6-диил)бис(3-(1-(2-фтор-[1,1’-бифенил]-4-ил)этил) мочевина) (7).
Получена аналогично соединению 1 из 0,5 г (2,0 ммоль) 2-фтор-4-(1- изоцианатометил)-1,1’-бифенила и 0,120 г (1,0 ммоль) гексаметилендиамина 4. Выход 0,454 г (76%). Тпл. 171 °C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 1.17-1.28 м (8Н, -(СН2)4-), 1.34 c (6H, -СН3), 2.90-3.01 м (4Н, -СН2-NH-), 4.69-4.83 м (2Н, -СН-СН3), 5.79 c (2Н, -СН2-NH-), 6.14 c (2Н, -NH-СН-), 7.10-7.55 м (16Н, СНаром). Найдено,%: С 72.24; Н 6.75; N 9.36. C36H40F2N4О4. Вычислено, %: С 72.22; Н 6.73; N 9.36. M=598.
Список литературы Синтез и свойства симметричных димочевин на основе производных пропионовой кислоты - потенциальных мультитаргетных ингибиторов sEH и COX-2
- Дьяченко В.С., Гладких Б.П., Ильина Е.С., Бутов Г.М. Синтез и свойства адамантилсодержащих 1,3-дизамещенных мочевин на основе производных пропионовой кислоты - потенциальных мультитаргетных ингибиторов sEH и COX-2 // Известия ВолгГТУ. - 2023. - № 12 (283). - C. 36-41.
- O'Banion, M.K. Cyclooxygenase-2: molecular biology, pharmacology, and neurobiology // Crit. Rev. Neurobiol. - 1999. - V. 13, № 1. - P. 45-82.
- Rao P., Knaus E.E. Evolution of nonsteroidal anti-inflammatory drugs (NSAIDs): cyclooxygenase (COX) inhibition and beyond //j. Pharm. Pharm. Sci. - 2008. - V. 11, № 2. - P. 81-110.
- Node K., Huo Y., Ruan X., Yang B., Spiecker M., Ley K., Zeldin D.C., Liao J.K. Anti-inflammatory properties of cytochrome P450 epoxygenase-derived eicosanoids // Science. - 1999. - V. 285. - P. 1276-1279. EDN: DBZTJR
- Burmistrov V., Morisseau C., Harris T.R., Butov G., Hammock B.D. Effects of adamantane alterations on soluble epoxide hydrolase inhibition potency, physical properties and metabolic stability // Bioorg. Chem. - 2018. - V. 76. - P. 510-527. EDN: XMPUDJ
- Lipinski С.A., Lombardo F., Dominy B.W., Feeney P.J. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings // Adv. Drug Del. Rev. - 2001. - V. 46, № 1-3. - p. 3-26.


