Синтез и свойства солей 5,5’-азотетразола с азотистыми основаниями
Автор: Левшенкова Людмила Евгеньевна, Левшенков Антон Игоревич
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2015 года.
Бесплатный доступ
Получены и идентифицированы соли 5,5’-азотетразола с азотистыми основаниями: аммиак, гидразин, гидроксиламин, гуанидин, аминогуанидин, диаминогуанидин, триаминогуанидин, этилендиамин, анилин, меламин. Показано влияние химической природы оснований на термическую стойкость солей.
Соли 5, 5'-азотетразола с азотистыми основаниями, гидразин, гидроксиламин, гуанидин, аминогуанидин, диаминогуанидин, триаминогуанидин, этилендиамин, анилин, меламин, термическая стойкость, аммиак
Короткий адрес: https://sciup.org/148182885
IDR: 148182885 | УДК: 536.45
Текст научной статьи Синтез и свойства солей 5,5’-азотетразола с азотистыми основаниями
Энергонасыщенные материалы с высоким содержанием азота привлекают внимание исследователей в качестве новых и перспективных компонентов взрывчатых композиций, газогенерирующих составов и твердого ракетного топлива. Соли 5,5’-азотетразола (AzT) с металлами известны более 100 лет [1, 2], однако в последние годы соли AzT с азотистыми основаниями, содержащие в своем составе значительное количество азота (табл. 1), широко исследуются как перспективные энергетические материалы. Эти соли являются бескислородными системами с положительной энтальпией образования (табл. 2), способными выделять тепло за счет экзотермического распада.
В литературе имеются сведения о синтезе солей AzT с широким рядом азотистых оснований [3–6], свойствах некоторых из синтезированных соединений, а также данные об испытаниях композиций солей AzT с окислителем – CuO в модельных двигателях [7].
Тем не менее, несмотря на то что получение и свойства ряда солей описаны в литературе, систематические исследования термической стабильности солей не проводились. Цель данной работы – анализ литературных данных и исследование способов получения солей AzT с азотистыми основаниями, имеющих высокие энергетические характеристики, их идентификация и исследование их термической стабильности методом дифференциальной сканирующей калориметрии (ДСК).
Основной энергетический вклад в молекулу соли вносит AzT. Поэтому наибольший интерес в качестве энергонасыщенных материалов вызывают соли, содержащие либо основания, имеющие небольшую молекулярную массу, либо основания, содержащие группы атомов, вносящие свой вклад в энергию соли (эксплозифорные группы) – гидразинный, гидроксиламиннный, триазольный, тетра-зольный фрагменты.
Методики, предложенные в [1–6], состоят в следующем: на первой стадии проводят окисление 5-аминотетразола перманганатом в щелочной среде и кристаллизацию натриевой или бариевой соли
AzT с выходом около 50 % (в виде пентагидратов). Вторая стадия – ионный обмен натриевой или бариевой соли AzT в водном растворе с растворимой солью азотистого основания (соли AzT практически нерастворимы в органических растворителях).
Большинство солей было получено через натриевую соль в кипящем водном растворе (натриевая соль хорошо растворима только вблизи температуры кипения воды). Методика подходит для солей, произведение растворимости которых меньше, чем у натриевой соли.
Бариевая соль растворима в кипящей воде хуже, чем натриевая, однако при использовании сульфата азотистого основания сульфат бария количественно выпадает из раствора. Методика используется для получения более растворимых солей AzT с азотистыми основаниями (например, аммониевой соли). Недостатками метода являются большой объем упариваемых растворов и отделение наиболее мелкодисперсной части осадка сульфата бария.
Таблица 1
Свойства полученных солей AzT
|
Вещество |
Выход, % |
Кол-во молекул воды в гидрате [1–6] |
Элементный анализ найдено/вычислено |
ИК |
||
|
C, % |
N, % |
H, % |
||||
|
(NH 4 ) 2 AzT |
72 |
б/в |
12.0 12.0 |
84.1 84.0 |
3.7 4.0 |
3185, 3022, , 1930, 1793, 1706, 1435, 1056, 776, 733 |
|
(N 2 H 5 ) 2 AzT |
75 |
H 2 O |
10.4 |
85.2 |
4.3 |
3278, 3178, 2924, 1639, 1617, |
|
[2 H 2 O] |
10.4 |
85.2 |
4.3 |
1534, 1405, 1118, 970, 736 |
||
|
10.9 10.3 |
72.5 72.4 |
3.1 3.4 |
3252, 2976, 2838, 2715, 2097, |
|||
|
(NH 3 OH) 2 AzT |
54 |
3 H 2 O |
1623, 1560, 1405, 1242, 1203, 1000, 828, 738 |
|||
|
Gu 2 AzT |
75 |
б/в |
16.8 |
78.9 |
4.1 |
3396, 3198, 3092, 1653, 1570, |
|
[б/в] |
16.9 |
78.9 |
4.2 |
1399, 1197, 1050, 737 |
||
|
H 2 O [H 2 O] |
14.9 15.3 |
78.8 80.3 |
4.4 4.5 |
3418, 3334, 3273, 3051, 1672, |
||
|
(AG) 2 AzT |
70 |
1646, 1398, 1203, 1118, 1014, 770, 740 |
||||
|
(DAG) 2 AzT |
56 |
2 H 2 O |
13.8 13.9 |
80.9 81.4 |
4.7 4.7 |
3358, 3318, 3130, 1675, 1393, 1180, 997, 948, 772, 731 |
|
(TAG) 2 AzT |
82 |
б/в |
12.8 |
82.4 |
4.8 |
3335, 3214, 1679, 1387, 1336, |
|
[б/в] |
12.8 |
82.4 |
4.8 |
1187, 1140, 1000, 946, 732 |
||
|
EnAzT |
85 |
2 H 2 O |
21.3 |
74.5 |
4.3 |
3346, 3265, 3163, 1510, 1394, |
|
21.3 |
74.3 |
4.4 |
1355, 1122, 1065, 736 |
|||
|
(PhNH 3 ) 2 AzT |
78 |
б/в |
46.5 |
47.0 |
4.7 |
3412, 2852, 2607, 2050, 1643, |
|
47.7 |
47.7 |
4.6 |
1590, 1550, 1500, 1387, 1200, 730 |
|||
|
(C 3 N 6 H 7 ) 2 AzT |
90 |
б/в |
23.2 |
73.6 |
3.2 |
3389, 3287, 3148, 2851, 2665, |
|
[б/в] |
23.0 |
73.7 |
3.3 |
1645, 1512, 1407, 1179, 1022, 787 |
||
В работе был проведен синтез солей по обеим методикам, соли, для которых в литературе предлагалась методика получения из бариевой соли, были получены из натриевой соли. Было показано, что все полученные соли, кроме аммониевой, обладающей повышенной растворимостью в воде, могут быть синтезированы и по этой методике.
Нами предложена методика получения солей AzT с азотистыми основаниями через калиевую соль AzT. Она хорошо растворима в холодной воде, что, с одной стороны, снижает выход при ее получении, с другой стороны, может позволить получать соли AzT как с повышенной растворимостью, так и с пониженной термостойкостью.
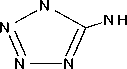
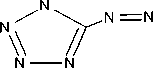
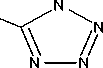
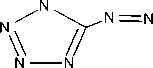
В работе соли получали по всем трем методикам (рис. 1). Соли идентифицировали по данным ИК-спектрометрии по характеристическим пикам поглощения связей и групп C=NH 3400–3200 см-1; – N=N– 1600–1400, 800–700 см-1, тетразольный цикл 1150–950см-1; C=N в цикле 1660–1480см-1; C=N в открытой цепи 1690–1635 см-1. Визуально все соли AzT имеют ярко-желтый цвет.
H
KMnO 4
Me + OH _
+
Me +
+
Me
RNH 2 . HX
+
R N H 3 +
-
+
R NH 3 +
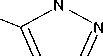
NN
M
e+ = Na+, K+, Ba2+
Na+: N 2 H 4 , NH 2 OH, HN=C(NH 2 ) 2 , HN=C(NH 2 )(NHNH 2 ), HN=C(NHNH 2 ) 2 , H 2 NN=C(NHNH 2 ) 2 , (CH 2 NH 2 ) 2 , C 6 H 5 NH 2 , C g NsWb; K+: NH 3 ; Ba2+: NH 3 , N 2 H 4 , HN=C(NH 2 )(NHNH 2 )
Рис. 1. Схема получения солей 5,5’-азотетразола
Таблица 2
Термодинамические характеристики, рКа сопряженных кислот и температуры экзотермических пиков солей AzT с азотистыми основаниями
|
Вещество |
ΔH f °, кДж/моль (кДж/кг) |
Т АДИАБ . (10 МПа), К |
рКа BH+ [9] |
ДСК Т экз , ° С |
|
(NH 4 ) 2 AzT |
444 (2220) |
1600 |
9.24 |
224 |
|
(N 2 H 5 ) 2 AzT |
708 (3080) |
1940 |
7.88 |
191 |
|
(NH 3 OH) 2 AzT |
468 (2020) |
2060 |
5.97 |
143 |
|
Gu 2 AzT |
452 (1590) |
1340 |
13.3 |
261 |
|
(AG) 2 AzT |
670 (2135) |
1530 |
10.8 |
224 |
|
(DAG) 2 AzT |
890 (2590) |
1700 |
8.28 |
201 |
|
(TAG) 2 AzT |
1075 (2870) |
1810 |
9.75 |
212 |
|
EnAzT |
547 (2420) |
1630 |
9.89 |
203 |
|
(PhNH 3 ) 2 AzT |
804 (2280) |
1520 |
4.63 |
128 |
Соли AzT с азотистыми основаниями малорастворимы в воде и органических растворителях, поэтому анализ и идентификация методами гравиметрии и титрования затруднены. Они разлагаются ниже температуры плавления. Поэтому кроме ИК-спектрофотометрии соли идентифицировались с помощью элементного анализа (CHN – анализатор PerkinElmer модель 2400) (табл. 1).
Однако описанные в литературе [4, 6] соли таких высокоэнергетических оснований, как 5-аминотетразол и 1,5-диаминотетразол, при получении ионным обменом из натриевой соли показывали явные признаки разложения AzT – выделение газа, выпадение светлого неокрашенного осадка и исчезновение характерной ярко-желтой окраски раствора, характерной для солей AzT.
AzT как кислота (двухосновная) является неустойчивым соединением, существует только в виде солей. В кислой среде AzT распадается с образованием 5-тетразолилгидразина и других продуктов [8]. Следовательно, можно предположить, что соли AzT со слабыми основаниями могут разлагаться уже в условиях их получения.
Нами были проведены исследования по синтезу солей AzT со слабыми основаниями. При этом были исследованы не только высокоэнергетические (4-амино-1,2,4-триазол), но и другие модельные основания с рКа сопряженной кислоты (BH+) от 2 до 5 – анилин, 3-нитроанилин, меламин.
Было показано, что в водной среде устойчиво образуются соли с основаниями с рКа более 4.6 (анилин), в случае оснований с меньшими pKa (5-аминотетразол с pKa=1.3 и 1,5-диаминотетразол с pKa=3.3, 3-нитроанилин с pKa=3.54, 4-амино-1,2,4-триазол с pKa=3.92) наблюдаются признаки разложения. Соли получить не удается даже при избытке основания. При использовании в качестве исходных соединений солей кислот средней силы (фосфорная, щавелевая) также наблюдаются признаки разложения, в присутствии слабых кислот (уксусная, 5-аминотетразол) реакция не идет, при охлаждении выпадают исходные соединения. При использовании калиевой соли температура синтеза снижается с 90 до 20 °C, однако и в этих условиях при синтезе солей слабых оснований наблюдаются признаки разложения AzT.
Следует отметить, что ИК-спектральные характеристики продуктов распада тетразольных солей AzT (тетразолилгидразин, исходные аминотетразолы) мало отличаются от таковых для предполагаемых солей AzT с тетразольными основаниями, поскольку имеют в основном одни и те же химические связи. По содержанию С/Н/N они также близки. Таким образом можно предположить, что утверждение о синтезе тетразольных солей [4, 6] является ошибочным.
Полученные соли AzT с азотистыми основаниями сушили на воздухе, затем в вакууме при Т=80 °C. По разнице масс определяли количество молекул воды в полученной соли (табл. 1). Для ИК-спектрофотометрии, элементного анализа и ДСК использовали безводные соли. В литературе [4–6] не всегда указывается наличие гидратной воды в молекуле соли, в некоторых случаях оно определено нами впервые, также литературные данные не всегда согласуются с экспериментальными. В табл. 2 приведены расчетные энтальпии образования солей AzT и температуры термодинамически устойчивых продуктов, рассчитанных с помощью программного комплекса REAL [10].
Термический анализ полученных солей проводился методом дифференциальной сканирующей калориметрии (ДСК) на приборе ДСК-500 (изготовитель – СамГТУ) при скорости нагрева 8 °C/мин. Из полученных данных (табл. 2) видно, что соли с наиболее сильными основаниями являются наиболее термически устойчивыми. Более подробно термический распад солей AzT описан в [11–13].
Na
Gu
NH3
AG
En
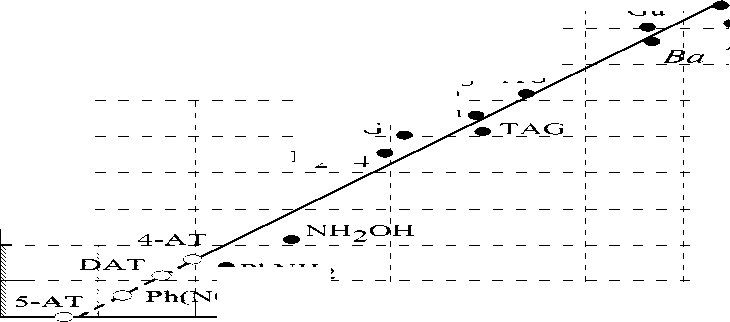
K w PhNH2 O2)NH2
DAG
N2H4
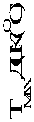
0246810121416 pKa
Рис. 2. График зависимости экзотермического максимума ДСК от рКа [BH+]
На графике зависимости экзотермического максимума ДСК от рКа [BH+] (рис. 2) экспериментальные точки хорошо ложатся на прямую, причем не только для ониевых, но и для ионных солей AzT с металлами. Следовательно, имеет место та же тенденция, что и в условиях синтеза. Таким образом, по силе основания можно прогнозировать как термическую стабильность, так и возможность существования солей AzT с различными основаниями. Установленная нами зависимость термической стабильности от силы основания еще раз позволяет предположить, что в [4, 6] были исследованы не соли AzT, а продукты их химического распада.
Список литературы Синтез и свойства солей 5,5’-азотетразола с азотистыми основаниями
- Thiele J. Ueber Azo-und Hydrazoverbindungen des Tetrazols//Justus Liebs Annalen der Chemie. -1898. -Vol. 303. -P. 57-75.
- Хмельницкий Л.И. Справочник по взрывчатым веществам. -М.: Изд-во Артиллерийской инженерной академии им. Ф.Э. Дзержинского, 1961. -С. 84-85.
- Sivabalan R., Anniyapan M., Pawar S.J. and oth. Synthesis, characterization and thermolysis studies on triazole and tetrazole based high nitrogen content high energy materials//J. of Hazardous Materials. -2006. -A137. -P. 672-680.
- Singh R.P., Gao H., Meshri D.T., Shreeve J.M. Nitrogen-rich heterocycles//Struct. Bond. -2007. -Vol. 125. -P. 35-83.
- Steinhauser G., Klapotke T.M. Pyrotechnik mit dem «Okosiegel»: eine chemische herausforderung//Angew. Chem. -2008. -Vol. 120. -P. 3376-3394.
- Tremblau M. Spektres infrarouges de composes riches en azote//Canadian J. of Chemistry. -1965. -Vol. 43. -P. 5-17.
- Abe M., Ogura T., Miyata Y. and oth. Evaluation of gas generating ability of some tetrazoles and copper (II) oxide mixtures through closed vessel test and theoretical calculation//Sci. Tech. Energetic Materials. -2008. -Vol. 69, № 6. -P. 183-189.
- Разложение солей азотетразола в кислых средах/А.Г. Маянц //Журн. органич. химии. -1991. -Т. 27, вып. 11. -С. 2450-2455.
- Химическая энциклопедия. -М.: Большая Российская Энциклопедия, 1988-1999.
- Belov G.B. Thermodynamic analysis of combustion products at high temperature and pressure//Propellants, explosives, pyrotechnics. -1998. -Vol. 23. -Р. 86-89
- Левшенкова Л.Е., Левшенков А.И., Синдицкий В.П. Термический распад и горение гуанидиниевой соли 5,5'-азотетразола//Энергетические конденсированные системы: материалы VI Всерос. конф. -Черноголовка, 2012. -С. 257-260.
- Levshenkova L.E., Sinditskii V.P., Levshenkov A.I. Study of Thermal Decomposition of Onium 5,5’-Azotetrazole Salts//Proc. 17 Inter. Sem. «New trends in research of energetic materials». -Pardubice, Czech Republic. -2014. -Рart 2. -P. 973978.
- Левшенкова Л.Е., Синдицкий В.П., Левшенков А.И. Исследование термического распада гуанидиновой и аммониевой солей 5,5’-азотетразола//Успехи в химии и химической технологи. -2013. -Т. XXVII, № 2. -С. 131-136.


