Синтез и термическое разложение двойных комплексных соединений, содержащих медь и 1,3-диаминопропан
Автор: Печенюк София Ивановна, Гостева Алевтина Николаевна, Домонов Денис Петрович, Макарова Татьяна Иосифовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Изучены синтез, свойства и продукты термолиза двойных комплексных соединений состава [Cupn] 2[Fe(CN) 6]-4H 2O (I), [Cupn] 3[Fe(CN) 6] 2-8H 2O (II) и [Cu(pn) 2] 3[Fe(CN) 6] 2-5H 2O-KCl (III) (pn - 1,3-диаминопропан) в атмосфере воздуха, Н 2 и Ar в области 150-900 °С. При термолизе на воздухе образуются оксиды металлов. Термолиз I и II в атмосфере Н 2 и Ar приводит к образованию Cu 0 и Fe 0 c примесью их оксидов и FeC. При термолизе III в атмосфере Н 2 и Ar в области 200-500 °С образуется Cu 2[Fe(CN) 6], а при > 500 °С -Cu 0, FeC и KCl, в атмосфере Ar - с примесью оксидов Cu и Fe.
Двойное комплексное соединение, синтез, термолиз, состав, продукт, температура
Короткий адрес: https://sciup.org/147160231
IDR: 147160231 | УДК: 546.56+546.72
Текст научной статьи Синтез и термическое разложение двойных комплексных соединений, содержащих медь и 1,3-диаминопропан
Двойные комплексные соединения (ДКС) представляют большой интерес для получения биметаллических порошков строго стехиометрического состава путем их термического разложения [1]. Многомерные цианомостиковые соединения [Cupn]-M(CN) 6 ” - (pn - 1,3-диаминопропан C3N2H10, M = Fe, Co), синтез и структура которых описаны в работах [2, 3], совершенно не изучены в отношении их термического разложения.
Целью настоящей работы является изучение термолиза ДКС [Cupn х ]-Fe(CN) 6 ” - в атмосфере воздуха, водорода и аргона и получение биметаллических порошков Cu+Fe различного стехиометрического состава (Cu: Fe = 2 : 1 и 3 : 2).
Из числа соединений, которые рассматриваются в данной работе, ранее было синтезировано [Cupn] 2 [Fe(CN) 6 ]·4H 2 O ( I ) [2], о котором известно следующее. I является продуктом взаимодействия катионов [Сирп(Н 2 О) 2 ]2+ и анионов [Fe(CN) 6 ]3-. Реакция включает восстановление Fe(III) —— Fe(II). Согласно [2], I кристаллизуется в моноклинной системе и состоит из асимметрических ячеек, составленных одним анионом [Fe(CN) 6 ]4–, одним ионом [Cupn]2+ и двумя молекулами H 2 O. Атомы меди существуют в координации CuN 5 , создаваемой двумя атомами азота двух равноценных мостиковых молекул pn и тремя атомами азота цианогрупп, в виде искаженной квадратной пирамиды. Ион Fe2+ имеет почти правильную октаэдрическую координацию и связан с 6 ионами меди шестью цианомостиками, тогда как каждый ион меди связан с 3 эквивалентными ионами железа. Структура является трехмерной (3D). В работах [2, 3] описаны также близкие по составу к полученным нами ДКС [Cupn] 2 [Fe(CN) 6 ]·KCl·5H 2 O и [Cupn] 2 [Fe(CN) 6 ]·Na 3 [Fe(CN) 6 ]·12H 2 O, по структуре аналогичные I. Все они содержат бесконечные слои [Cupn] 2 [Fe(CN) 6 ], образующие дефектные кубические единицы Cu4Fe3, включающие мостики Cu–CN–Fe. Межслоевое пространство занято примесными ионами и молекулами воды.
Синтезированное нами соединение II имеет формулу [Cupn] 3 [Fe(CN) 6 ] 2 ·8H 2 O, где pn, вероятно, также является мостиковым лигандом, что согласно [3] должно приводить к образованию такой же слоистой структуры. Третий изученный здесь комплекс [Cu(pn) 2 ] 3 [Fe(CN) 6 ] 2 ·5H 2 O·KCl ( III ) синтезирован взаимодействием заранее полученного согласно [4] [Cu(pn) 2 ]Cl 2 ·2H 2 O c раствором К 3 [Fe(CN) 6 ] и имеет предположительно островную структуру, образованную изолированными катионами и анионами.
Экспериментальная часть
Синтез соединений
[Cupn] 2 [Fe(CN) 6 ]·4(3)H 2 O ( I ). Согласно [3] к 0,024 моля (4,09 г) CuCl 2 ·2H 2 O(х.ч.) в 70 мл дистиллированной воды добавили 0,048 моля pn (фирма «Вектон», пл. 0,888 г/см3) в 20 мл воды и 100 мл воды дополнительно. К полученному темно-фиолетовому раствору при перемешивании добавили 0,016 моля (5,27 г) K 3 [Fe(CN) 6 ] (ч.д.а.) в 24 мл воды. Чернильно-синий раствор оставили упариваться на воздухе при комнатной температуре. Получено 6,04 г темно-синего, почти черного вещества. При кристаллооптическом исследовании кристаллы были охарактеризованы как зеленовато-коричневые плеохроичные. Выход составил 93 % от теоретически возможного.
Для I найдено, %: С – 25,70±0,05; Cu – 23,80±0,26; Fe – 10,77±0,23.
Для C 12 H 26 N 10 O 3 Cu 2 Fe:
вычислено, %: С – 26,62; Cu – 23,49; Fe – 10,32;
внешний вид – темно-синие кристаллы неправильной формы.
[Cupn] 3 [Fe(CN) 6 ] 2 ·8H 2 O ( II ). К 0,024 моля (4,09 г) CuCl 2 ·2H 2 O в 60 мл воды добавили 0,048 моля pn в 20 мл воды и 100 мл воды дополнительно. К полученному темно-фиолетовому раствору добавили 0,016 моля (6,76 г) K 4 [Fe(CN) 6 ]·3H 2 O в 54 мл воды. Образовавшийся темнозеленый раствор оставили упариваться на воздухе при комнатной температуре. Получено 4,67 г темно-зеленого (в массе) вещества. При кристаллооптическом исследовании кристаллы были охарактеризованы как темно-фиолетовые плеохроичные. Выход составил 60 % от теоретически возможного. После дальнейшего упаривания фильтрата выделяется вторая фракция вещества, по составу отличающаяся от первой. Повторные синтезы иногда приводят к получению более обводненного продукта (11 молекул H 2 O).
Для II найдено, %: С – 25,02±0,03; Cu – 19,37±0,18; Fe – 11,61±0,20.
Для C 21 H 46 N 18 O 8 Cu 3 Fe 2 :
вычислено, %: С – 25,70; Cu – 19,45; Fe – 11,40;
внешний вид – темно-зеленые кристаллы неправильной формы.
[Cu(pn) 2 ] 3 [Fe(CN) 6 ] 2 ·5H 2 O·KCl ( III ). Для получения этого соединения предварительно был синтезирован [Cu(pn) 2 ]Cl 2 ·2H 2 O по прописи, данной Хоузом и Кертисом [4]. 0,05 моля (15,23 г) этого комплекса растворили в 150 мл этанола и прибавили к этому раствору 0,033 моля (10,86 г) К3[Fe(CN)6] + 1 мл pn, растворенных в смеси 40 мл воды и 40 мл ацетона, при перемешивании. Был получен темно-зеленый раствор, из которого сразу же выпал темно-коричневый осадок. Осадок промыт спиртом и высушен на воздухе. Получено 14,25 г ДКС, что составляет 70 % от теоретически возможного. При кристаллооптическом исследовании вещество охарактеризовано как сростки коричневато-зеленых столбчатых кристаллов.
Для III найдено, %: С – 29,63±0,26; Cu –15,70±0,17; Fe – 9,24±0,18.
Для C 30 H 70 N 24 O 5 ClCu 3 Fe 2 K:
вычислено,%: С – 29,44; Cu – 15,59; Fe – 9,13;
внешний вид – темно-коричневые игольчатые кристаллы.
Идентификация ДКС
Для идентификации соединений использовали элементный анализ, рентгенодифракционный анализ (РДА), ИК-спектроскопию и кристаллооптический анализ. Для определения содержания металлов навески комплексов и продуктов их термолиза растворяли в HCl или ее смесях с H 2 SO 4 или HNO 3 . Полученные растворы анализировали атомно-абсорбционным методом на спектрометре «Квант-АФА» или на «АAnalyst 400». Анализ веществ на содержание углерода проводили методом автоматического кулонометрического титрования на экспресс-анализаторе «CS-2000». РДА проводили на дифрактометре ДРОН-2 с использованием Cu-K α -излучения (монохроматор – графит). Приводим наиболее интенсивные рефлексы с межплоскостными расстояниями. Аналогичные данные для этих соединений в литературе не приводились.
-
I , ( d/n , нм)/ I : 0,56/100; 0,445/45; 0,41/70; 0,38/50; 0,24/50; 0,22/25.
-
II , ( d/n , нм)/ I : 0,55/90; 0,43/100; 0,41/70; 0,38/75; 0,35/60; 0,276/50; 0,24/60; 0,226/50; 0,20/30.
-
III , ( d/n , нм)/ I : 0,77/100; 0,485/90; 0,45/37; 0,39/29; 0,32/31; 0,28/35; 0,22/41.
ИК-спектры получали на спектрометре Nicolet 6700 FT-IR в таблетках с KBr. Для идентификации полос поглощения в ИК-спектре пользовались источниками [2, 3, 5]. В ИК-спектрах присутствуют следующие характеристические полосы поглощения (см–1).
-
I : ν(OH) 3587; 3512; ν(OH 2 ) 3382; 3324; ν(NH) 3285; 3249; 3168; ν(CH) 2950; 2883; ν(C≡N) 2083; 2054; δ(OH 2 ) 1606; δ(CH 2 ) 1470; ν(C–C) 1068; ρ t (NH 2 ) 1030; ρ r (CH 2 ) 878; δ(MCN) 583; δ(N–C–C–N) 460.
-
II : ν(OH 2 ) 3403; ν(NH) 3305; 3262; 3146; ν(CH) 2937; 2886; ν(C≡N) 2071; δ(NH 2 ) 1592; δ(CH 2 ) 1463; 1438; ρ w (NH 2 ) 1163; ρ t (NH 2 ) 1024; ρ r (CH 2 ) 908; δ(MCN) 589; δ(N–C–C–N) 495.
-
III : ν(OH) 3563; ν(OH 2 ) 3424; 3371; 3305; ν(NH) 3273; 3252; 3150; ν(CH) 2964; 2933; 2888; ν(C≡N) 2108; δ(OH 2 ) 1596; δ(CH 2 ) 1464; 1439; ρ w (NH 2 ) 1323; 1169; ρ t (CH 2 ) 1288; ν(C–C) 1062; ρ t (NH 2 ) 1022; ρ r (CH 2 ) 908; 881; δ(MCN) 588; δ(N–C–C–N) 488.
Кристаллооптический анализ выполняли с помощью микроскопа Leica DM 2500 и стандартного набора иммерсионных жидкостей. Кроме того, определяли плотности ДКС пикнометрическим методом, используя в качестве пикнометрических жидкостей CНCl 3 и этилацетат. Получено, г/см3: I – 2,05 ± 0,05; II – 2,02 ± 0,02; III – 2,11 ± 0,04. Исходя из плотностей, вычислены мольные объемы ДКС, см3/моль: I – 264; II – 485; III – 579.
Изучение термического разложения
Термический анализ ДКС на воздухе проводили на приборе НТР-70 в комплекте с ПРТ-1000 и Pt-PtRh-термопарой и потенциометром ПП-74 в комплекте с торсионными весами ВТ-1000 при скорости нагревания 10°/мин и навесках около 0,2 г. Для обработки результатов пользовались пособием [6]. Термический анализ в атмосфере аргона проводили на приборе NETZSCH STA 409 PC/PG. Примеры кривых термического анализа приведены на рисунке. В обоих случаях кривые ДТА и ТГ снимали синхронно.
Выбор фиксированных температур для изучения состава продуктов термолиза производили следующим образом. Для термолиза в атмосфере воздуха и аргона выбирали температуры в середине интервала, соответствующего наиболее четко выраженным стадиям разложения, и конечной стадии разложения. Для термолиза в атмосфере водорода температуры выбирали ~ на 50 °С выше, чем для атмосферы воздуха, поскольку ранее [7] было установлено, что ДКС металлов I переходного ряда разлагаются в атмосфере водорода при более высоких температурах, чем на воздухе. Комплексы выдерживали при этих температурах в течение 1 часа. Методика, условия и установка для изучения термолиза в токе газа (проточный реактор) подробно описаны в предыдущих работах [7, 8].
Твердые продукты термолиза идентифицировали методом РДА, используя базу данных [9]; все продукты термического разложения ДКС анализировали на содержание металлов и углерода. Как и в работах[7, 8], анализировали газообразные продукты термолиза в атмосфере водорода и аргона. Газообразные продукты кислотного характера отсутствовали. Одним из газообразных продуктов был NH 3 , как и в случае термического восстановления других ранее изученных ДКС, содержащих анионы [Fe(CN) 6 ]3(4)–[8]. Наблюдалось также выделение высококипящих органических продуктов, которые конденсировались в холодном выходном конце реакторной трубки. На основании их ИК-спектров (полосы поглощения валентных колебаний СН-групп в области 3000–2800 см–1 и деформационных колебаний NH 2 - и СН 2 -групп в области 1700–1500 и 1460–1360 см–1 соответственно [5]) эти вещества можно считать pn и продуктами его термической деструкции. Результаты изучения продуктов термолиза представлены в табл. 1–3.
Данные элементного анализа являлись усредненными из нескольких измерений разных синтезов одного и того же ДКС, средние квадратичные отклонения не превышали 0,5 %. В табл. 1–3 приведены средние элементные составы твердых продуктов термолиза, рассчитанные из результатов элементного анализа твердых и газообразных продуктов (брутто-составы), с учетом данных РДА.
Обсуждение результатов
Результаты идентификации исходных ДКС были удовлетворительны. Следует отметить различия, которые имели место между методикой синтеза, использованной нами, и методиками, приведенными в работах [2, 3], и в полученных результатах синтеза. В работах [2, 3] при использовании таких же реактивов, как у нас, было получено только соединение с присоединенной молекулой KCl – [Cupn] 2 [Fe(CN) 6 ]·KCl·5H 2 O, а [Cupn] 2 [Fe(CN) 6 ]·4(3)H 2 O получили только тогда, когда катион K+ во всех реактивах заменили на Et 4 N+ (тетраэтиламмоний)[3]. Однако полученное нами соединение III также содержит присоединенную молекулу KCl. При синтезе III необходимо выполнять все операции как можно быстрее и при как можно более низкой температуре.
а)
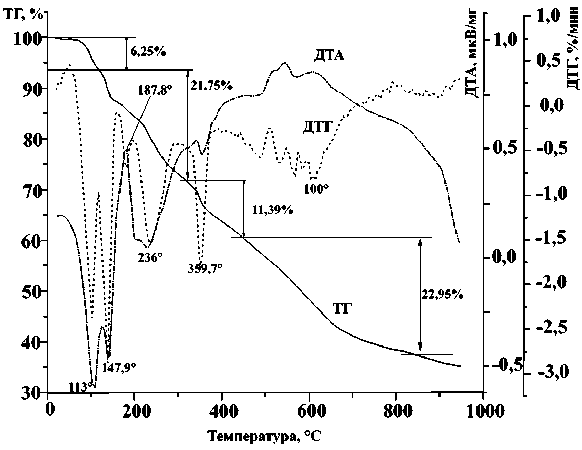
б)
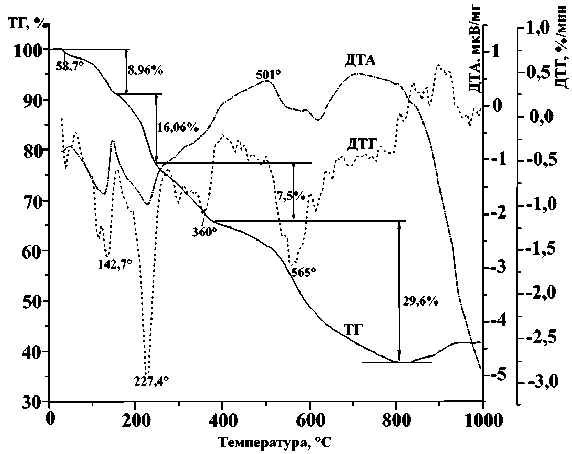
в)
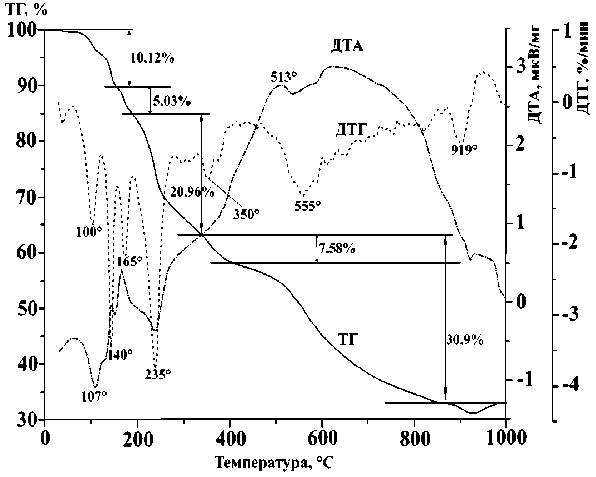
Кривые термического анализа в аргоне ДКС: а – I; б – II; в – III
Таблица 1
Продукты термического разложения I (C 12 H 26 N 10 O 3 Cu 2 Fe)
|
Условия получения, °С |
Брутто-состав |
Остаток от про-калива-ния, % |
Данные РДА |
Содержание С, % |
N в виде NH 3 , % от исходного |
С в твердой фазе, % от исходного |
||
|
Расчетное |
Экспе-римен-тальное |
|||||||
|
В атмосфере воздуха |
220 |
C 10 H 16 N 9 Cu 2 Fe |
75,2 |
CuO, Fe 2 O 3 , аморфная фаза |
26,97 |
27,44 |
– |
80,30 |
|
360 |
O 4 Cu 2 Fe |
43,77 |
CuO, Fe 3 O 4 , аморфная фаза |
– |
0,29 |
– |
0,05 |
|
|
550 |
O 3,5 Cu 2 Fe |
43,90 |
CuO, Fe 3 O 4 , СuFe 2 O 4 |
– |
0,01 |
– |
0,02 |
|
|
В атмосфере водорода |
300 |
C 7,3 H 4 N 6,4 Cu 2 Fe C 6 N 6 Cu 2 Fe |
62,80 57,90 |
Cu, FeC, Fe 3 O 4 , аморфная фаза |
24,06 21,24 |
24,28 20,44 |
19 |
59,33 46,05 |
|
400 |
C 3,5 N 3,5 ОCu 2 Fe |
53,60 |
Cu, FeC, Fe 3 O 4 , СuFe 2 O 4 |
14,49 |
14,00 |
25 |
29,20 |
|
|
600 |
C 0,33 ОCu 2 Fe |
50,17 |
Cu, Fe, Fe 3 O 4 , СuFe 2 O 4 |
1,97 |
2,02 |
35 |
3,90 |
|
|
В атмосфере Ar |
430 |
C 5 N 5 О 1,5 Cu 2 Fe |
57,11 |
Cu, FeC, Fe 3 O 4 , Fe 2 O 3 СuFe2O4, |
17,81 |
18,08 |
37 |
40,18 |
|
950 |
C 0,9 N 0,9 О 2 Cu 2 Fe |
42,00 |
Cu, FeC, Fe 3 O 4 |
4,53 |
4,84 |
34 |
7,91 |
|
Таблица 2
Продукты термического разложения II (C 21 H 46 N 18 O 8 Cu 3 Fe 2 )
|
Условия получения, °С |
Брутто-состав |
Остаток от про-калива-ния, % |
Данные РДА |
Содержание С, % |
N в виде NH 3 , % от исходного |
С в твердой фазе, % от исходного |
||
|
Расчетное |
Экспе-римен-тальное |
|||||||
|
В атмосфере воздуха |
220 |
C 6 N 6 O 4 Cu 3 Fe 2 |
50,25 |
CuO, Fe 2 O 3 , аморфная фаза |
13,79 |
13,29 |
– |
27,22 |
|
300 |
C 0,3 N 0,3 O 8,5 Cu 3 Fe 2 |
39,61 |
CuO, Fe 2 O 3 , Fe 3 O 4 , СuFe 2 O 4 , аморфная фаза |
0,82 |
0,81 |
– |
1,28 |
|
|
500 |
O 3,65 Cu 3 Fe 2 |
39,73 |
CuO, Fe 2 O 3 , Fe 3 O 4 , СuFe 2 O 4 |
– |
<0,01 |
– |
<0,02 |
|
|
В атмосфере водорода |
200 |
C 19 H 21 N 15 Cu 3 Fe 2 |
69,69 |
Кристаллический* |
29,96 |
29,10 |
18 |
81,05 |
|
300 |
C 10 N 10 Cu 3 Fe 2 или C 10 N 9 ОCu 3 Fe 2 |
54,78 |
Cu, Fe, FeC, Fe 2 O 3 , Fe 3 O 4 |
21,34 |
22,15 |
22 |
48,50 |
|
|
400 |
C 5 N 5 О 2 Cu 3 Fe 2 |
42,94 |
Cu, FeC, Fe 2 O 3 , Fe 3 O 4 , СuFe 2 O 4 |
12,93 |
13,23 |
37,5 |
22,70 |
|
|
600 |
C 0,4 О 2 Cu 3 Fe 2 |
31,50 |
Cu, Fe, примесь Fe 3 O 4 |
1,41 |
1,41 |
48,2 |
3,47 |
|
|
В атмосфере Ar |
480 |
C 5,5 N 5,5 О 2 Cu 3 Fe 2 |
45,46 |
Cu, FeС, Fe 3 O 4 |
13,83 |
13,73 |
42 |
24,95 |
|
800 |
C 1,5 О 3 Cu 3 Fe 2 |
36,23 |
Cu, FeС, Fe 2 O 3 , Fe 3 O 4 |
4,89 |
4,70 |
44 |
6,80 |
|
*Неидентифицированный.
В противном случае получаются неоднородные смеси или продукты, близкие по составу к K[Cu(pn) 2 ][Fe(CN) 6 ]· n H 2 O. По-видимому, 1,3-диаминопропан, образующий во внутренней сфере шестичленные циклы, более склонен выполнять роль мостикового лиганда, чем находиться при одном ц.и.
При термическом разложении I в атмосфере воздуха на интегральной кривой ТГ видны только 2 стадии: от 85 до 250 и от 340 до 540 ° С, когда разложение заканчивается. В остатке от прокаливания при 550 ° С РДА фиксирует оксиды меди и железа (см. табл. 1); расчетный остаток от прокаливания 43,86 %. экспериментальный – 44,32 %.
Кривая ТГ для I в атмосфере аргона содержит несколько нечетко выраженных стадий, из которых первая при 80–125 °С соответствует удалению двух молекул воды, вторая, от 125 до 240 ° С, приблизительно соответствует удалению оставшейся воды + одной молекулы pn, третья, от 240 до 360 °С – удалению второй молекулы pn и части CN-групп, и четвертая (> 430 °C) – удалению оставшихся CN-групп. Остаток от прокаливания в аргоне при 950 ° С соответствует смеси металлических железа и меди (34,17 мас. %, расчетное 33,82 мас. %). Восстановление металлов происходит, очевидно, за счет внутримолекулярного окисления лигандов центральным ионом.
На интегральной кривой ТГ II на воздухе отчетливо просматриваются 2 основные стадии разложения, соответствующие остатку от прокаливания 78 и 48 мас. % при 210-250 и >425 ° С соответственно. Конечным продуктом разложения, по данным РДА, является сумма 3CuO+Fe 2 O 3 , которая соответствует остатку от прокаливания, равному 40,64 мас. %, но даже при 960 ° С остаток составлял 44 %. Вероятно, это завышение связано с неполным выгоранием углерода и азота. Небольшое плато на кривой ТГ имеется в области 180-190 ° С для остатка от прокаливания 86 %, что соответствует полному удалению кристаллизационной воды. 78 %-ный остаток соответствует потере всей воды + одной молекулы pn.
Кривая ТГ II в атмосфере аргона содержит 4 четко определимые стадии:
-
1) отщепление пяти молекул воды (8,96 %, расчетные 9,17 %) до 150 ° С (кислород трех остальных молекул воды, по-видимому, входит в состав оксидов в остатке от прокаливания);
-
2) отщепление двух молекул pn (16,08 %, расчетные 15,1 %) до 230 °С;
3)отщепление третьей молекулы pn (7,5 %) до 350 ° С;
-
4) отщепление CN-групп до 800 ° С. Остаток от прокаливания при 800 ° С составляет 37,87 %, что соответствует 1,5 Cu 2 O + 2/3 Fe 3 O 4 . При дальнейшем нагревании до 930 °С этот остаток согласно РДА частично превращается в 3 CuO +Fe 2 O 3 .
Интегральные и дифференциальные кривые ТГ для соединения III в атмосфере воздуха и аргона очень сходны, за исключением ширины температурного интервала: экзотермический пик в атмосфере аргона гораздо шире и сдвинут в область высоких температур (450–900 °С). В атмосфере воздуха от 80 до 190 °С удаляются пять молекул воды и приблизительно одна молекула pn, в интервале 190–350 °С – еще 2 молекулы pn, затем от 350 до 900 °С происходит одновременное разложение pn, удаление CN-групп и выгорание углерода. Остаток от прокаливания составляет 35,50 % (расчетный для 3 CuO + 2/3 Fe 3 O 4 + KCl равен 35,95 %). В атмосфере аргона также от 80 до 190 °С удаляются 5 молекул воды и приблизительно одна молекула pn, от 190 до 330 °С – еще 3,5–4 pn и до 450 °С – остальной pn, и до 925 °С – все остатки лигандов. Остаток от прокаливания при 925 °С составляет 30,93 % (расчетный для 3Cu + 3 Fe + KCl равен 30,81 %). В остатке высушенного при 150 ° С III зафиксированы (по данным РДА) оксиды и Cu2[Fe(CN)6].) Следовательно, ДКС III очень неустойчив к нагреванию.
Анализ продуктов термического разложения ДКС при фиксированных температурах дает следующие результаты (см. табл. 1–3). При нагревании в атмосфере воздуха все три соединения при температуре < 200 °С образуют смеси оксидов ц.и. с аморфными фазами, содержащие еще 80–90 % от исходного содержания С (см. табл.1–3), что согласуется с данными ТГ. В наибольшей степени С удаляется при этом из соединения II . При более высоких температурах (300-500 ° С) все три ДКС превращаются в сумму оксидов Cu и Fe.
ДКС II и III при 200 °С в атмосфере Н2 и 240 ° С в атмосфере Ar соответственно образуют кристаллические фазы очень близкого состава со сходными дифрактограммами, причем эти ди-фрактограммы не соответствуют Cu 2 [Fe(CN) 6 ], основные рефлексы этой фазы ( d / n , нм)/ I : 0,6/30; 0,45/100; 0,37/80; 0,26/30; 0,21/20.
Обращает на себя внимание факт, что в атмосфере водорода для I и II наряду со свободными медью и железом при всех температурах образуется значительная примесь оксидов ц.и. и карбида железа, а для III оксиды не образуются. Уже при 300 ° С I и II теряют ~50 % содержащегося в них углерода; основываясь на ранее полученных данных [7, 8], можно утверждать, что остаточный углерод при 300 ° С принадлежит цианогруппам, которые всегда удаляются при > 400 ° С. При 300 ° С ~ 20 % содержащегося в I и II азота удаляется в виде аммиака; поскольку цианидный углерод в основном остается в твердом остатке, можно считать, что частично своим происхождением этот аммиак обязан гидрированию pn, но потеря углерода и азота при этой температуре происходит главным образом из-за удаления самого pn и высококипящих продуктов его деструкции ( I содержит в составе аниона 50 % всего С и 60 % всего N, а II – 57 и 66,67 % соответственно). При 600 ° С восстановление I и II водородом приводит к образованию смеси Cu+Fe с небольшой примесью оксида железа (магнетита). Образование примесей оксидов при термолизе в атмосфере как водорода, так и аргона, по-видимому, связано с присутствием в структуре ДКС значительного количества кристаллизационной воды.
Поведение III при термолизе в атмосфере водорода значительно отличается от поведения I и II (табл. 3 ) . В результате одночасовой выдержки при 200 ° С в продуктах термолиза III РДА четко фиксирует Cu 2 [Fe(CN) 6 ], а остаточное содержание С соответствует почти полному удалению pn. При 350 и 400 °С удаляется и значительная часть цианогрупп ( III содержит в составе аниона 40 % всего С и 50 % всего N). Это различие можно объяснить тем, что I и II имеют слоистую структуру, а III – островную. Практически те же продукты, что в атмосфере водорода, получаются для III и в атмосфере аргона (см. табл. 3), за исключением того, что в последнем случае присутствует примесь оксидов, преимущественно магнетита. В остатках от прокаливания III содержание остаточного С несколько выше, чем в остатках I и II в аналогичных условиях.
Таблица 3
Продукты термического разложения III (C 30 H 70 N 24 O 5 ClCu 3 Fe 2 K)
|
Условия получения, °С |
Брутто-состав |
Остаток от про-калива-ния, % |
Данные РДА |
Содержание С, % |
N в виде NH 3 , % от исходного |
С в твердой фазе, % от исходного |
||
|
Расчетное |
Экспе-римен-тальное |
|||||||
|
В атмосфере воздуха |
150 |
C 28 H 54 N 22 ClCu 3 Fe 2 K |
84,73 |
Fe 2 O 3 , аморфная фаза |
31,26 |
31,09 |
– |
88,90 |
|
325 |
C 4 N 4 O 7,5 ClCu 3 Fe 2 K |
47,70 |
CuO(тенарит), Fe 3 O 4 , KCl, Cu 0,32 Fe 2,68 O 4 |
7,99 |
7,52 |
– |
12,11 |
|
|
750 |
O 11 ClCu 3 Fe 2 K |
41,75 |
CuO, Fe 3 O 4 , KCl, Cu 0,32 Fe 2,68 O 4 , KFe 11 O 17 |
– |
0,50 |
– |
0,70 |
|
|
В атмосфере водорода |
200 |
C 16,5 H 10 N 14 O 2 ClCu 3 Fe 2 K |
67,60 |
Cu 2 [Fe(CN) 6 ], Cu 3 [Fe(CN) 6 ] 2 |
24,36 |
24,75 |
14,4 |
56,47 |
|
350 |
C 6,5 N 6,5 ClCu 3 Fe 2 K |
50,23 |
Cu 2 [Fe(CN) 6 ], Cu, FeC, KCl |
14,29 |
13,53 |
14,8 |
22,94 |
|
|
400 |
C 4,2 N 4,2 OClCu 3 Fe 2 K |
40,7 |
Cu 2 [Fe(CN) 6 ], Cu, KCl |
10,03 |
9,98 |
25,6 |
13,70 |
|
|
500 |
C 4 N 4 ClCu 3 Fe 2 K |
43,1 |
Cu, FeC, KCl |
9,98 |
9,83 |
35,5 |
14,30 |
|
|
В атмосфере Ar |
240 |
C 18 H 20 N 16 ClCu 3 Fe 2 K |
65,94 |
Кристаллический* |
26,71 |
26,50 |
12 |
58,97 |
|
350 |
C 14 H 5 N 13 O 1,5 ClCu 3 Fe 2 K |
57,50 |
Cu 2 [Fe(CN) 6 ], Cu, FeC, Fe 3 O 4 , KCl |
22,23 |
21,86 |
22 |
42,42 |
|
|
500 |
C 8 N 8 O 2 ClCu 3 Fe 2 K |
48,20 |
Cu 2 [Fe(CN) 6 ], Cu, FeC, Fe 3 O 4 , KCl |
15,56 |
14,94 |
22,5 |
24,30 |
|
|
900 |
C 3 O 3 ClCu 3 Fe 2 K или C 3 NO 2,5 ClCu 3 Fe 2 K |
35,50 |
Cu, Fe, FeC, Fe 3 O 4 , Cu 2 O, KCl |
7,72 |
7,45 |
32,6 |
8,92 |
|
*Неидентифицированный.
Интересно сравнить данные по потере С и азота для III с соответствующими данными для комплексов островной структуры с en – [Cо(еn) 3 ][Fe(CN) 6 ]·2H 2 O и [Cо(еn) 3 ] 4 [Fe(CN) 6 ] 3 ·15H 2 O [10]. В атмосфере водорода в остатках от обоих этих ДКС при 500 ° С содержится < 1 % С, а в атмосфере аргона при 900 ° С - до 25 % С. В случае III содержание С в соответствующих продуктах одного порядка ~ 14 и ~9 % соответственно.
Сравнение состава продуктов термолиза в атмосфере водорода и аргона показывает, что при близких температурах содержание углерода в продуктах термолиза в атмосфере аргона значительно выше. Состав образующихся продуктов близок к составу при соответствующих температурах на термограммах (например, для I C 5,5 N 5,5 OCu 2 Fe по термограмме и C 5 N 5 O 1,5 Cu 2 Fe при 430 °С в атмосфере аргона), хотя содержание С при часовой выдержке несколько снижено. Особенно хорошо это соблюдается для соединения III .
Полученные результаты позволяют записать ход термического разложения III в атмосфере водорода и аргона в виде следующей схемы:
[Cu(pn) 2 ] 3 [Fe(CN) 6 ] 2 ^5H 2 O^KCl (150-200 °С) ^ Cu 3 [Fe(CN) 6h , Cu 2 [Fe(CN) 6 ], pn, KCl (300-500 °С) ^ Cu 2 [Fe(CN) 6 ], Cu, FeC, KCl (> 500 °С) ^ Cu, Fe, FeC, KCl
Заключение
Итак, при термическом разложении ДКС, содержащих медь, 1,3-диаминопропан, железо и цианогруппы, в атмосфере воздуха образуются смешанные оксиды ц.и., а в атмосфере водорода и аргона – медь и карбид железа или железо, с примесью оксидов железа. При термолизе в атмосфере водорода цианогруппы аниона подвергаются гидрированию с образованием аммиака, а большая часть 1,3-диаминопропана выделяется в неизмененном виде или в виде продуктов термической деструкции. Можно считать, что различия в структуре ДКС являются причиной несколько различающейся природы твердых продуктов термолиза I, II и III. Наконец, при термолизе в нейтральной атмосфере (аргон) происходит восстановление ц.и. за счет координированных лигандов, сопровождаемое также выделением аммиака, происхождение которого может быть связано как с 1,3-диаминопропаном, так и с цианогруппами.
Работа выполнена при финансовой поддержке научной школы В.Т. Калинникова НШ – 1937.2012.3.
Список литературы Синтез и термическое разложение двойных комплексных соединений, содержащих медь и 1,3-диаминопропан
- Синтез и структура двойных комплексов платиновых металлов -предшественников металлических материалов/С.В. Коренев, А.Б. Венедиктов, Ю.В. Шубин и др.//Журн. структ. химии. -2003. -Т. 44, №1. -С. 58-73.
- New, multi-dimensional Cu(tn)-[M(CN)6]n-cyano-bridged, bimetallic coordination materials (M = FeII, CoII, CrIII and tn = 1,3-diaminopropane)/S. Triki, J. Sala-Pala, F. Thetiot et al.//Eur. J. Inorg. Chem. -2006. -P. 185-199.
- Two bimetallic layered materials with Cu[4]Fe[3] defective cubane units: syntheses, structures and magnetic properties of {[Cu2+(tn)]2[Fe2+(CN)6]}3 [Na3Fe3+(CN)6]12H2O (1) and {[Cu2+(tn)]2[Fe2+(CN)6]} KCl-5H2O (2)/F. Thetiot, S. Triki, J. Sala-Pala, C.J. Gomez-Garcia//Synthetic Metals. -2005. -Vol. 153. -P. 477-480.
- House, D.A. Transitional metal complex with aliphatic Schiff bases. V. Copper(II) and nickel(II) complex of 1,3-propanediamine and their reactions with acetone/D.A. House, N.F. Curtis//J. Amer. Chem. Soc. -1964. -Vol. 86, no. 2. -P. 223-225.
- Накамото, К. ИК-спектры и спектры КР неорганических и координационных соединений/К. Накамото. -М.: Мир, 1991. -536 с.
- Atlas of thermoanalytical curves. -Budapest: Acad. Kiado, 1976.
- О влиянии природы аниона на процесс термолиза двойных комплексов [Co(NH3)6][Fe(CN)6] и [Co(NH3)6]4[Fe(CN)6]3/С.И. Печенюк, Д.П. Домонов, Д.Л. Рогачев, А.Т. Беляевский//Журн. неорган. химии. -2007. -Т. 52, № 7. -С. 1110-1115.
- Превращения координированных лигандов при восстановительном термолизе некоторых двойных комплексных соединений/С.И. Печенюк, Д.П. Домонов, А.А. Аведисян, С.В. Икорский//Журн. неорган. химии. -2010. -Т. 55, № 5. -С. 788-792.
- Картотека JCPDS-ICDD. -2002.
- Синтез, свойства и термическое разложение соединений [Cо(еn)33][Fe(CN)6]■2H2O и [Cо(еn)3]4[Fe(CN)6]3■15H2O/С.И. Печенюк, Д.П. Домонов, А.Н. Гостева и др.//Коорд. химия. -2012. -(в печати).


