Синтез и термическое разложение двойных комплексных соединений, содержащих анион [FeMn(CN) 6] 2-
Автор: Домонов Денис Петрович, Печенюк София Ивановна, Гостева Алевтина Николаевна, Кривцов Игорь Владимирович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 1 т.6, 2014 года.
Бесплатный доступ
Изучен синтез и термическое разложение двойных комплексных соединений состава [Ni 2(en) 3(H 2O) 6][FeMn(CN) 6] 2·xH 2O (I) и [Cu(en)(H 2O) 2]·[FeMn(CN) 6] 2·xH 2O (II), где en - этилендиамин. Термолиз проводили в окислительной (воздух), инертной (аргон) и восстановительной (водород) атмосферах в области температур 20-1000 °С. Изучен состав твердых и газообразных продуктов термолиза. Показано, что в атмосфере воздуха углерод лигандов удаляется в виде СО и СО 2, в качестве продукта деструкции этилендиамина выделяется аммиак. Твердые остатки представляют собой смеси оксидов центральных ионов. В атмосфере аргона наблюдается незначительное выделение СО и аммиака. Твердыми остатками в атмосфере аргона являются ферроцианиды никеля, марганца и меди, интерметаллид NiFe, Cu, FeC и MnO. В атмосфере водорода большая часть азота выделяется в виде аммиака. Остаточное содержание углерода в остатках от прокаливания при 900 °С меньше 1 %. При термолизе в атмосфере водорода образуются высокодисперсные три- и биметаллические фазы, которые легко окисляются на воздухе до NiFe+MnO и Cu+FeC+FeO+MnO.
Двойное комплексное соединение, синтез, термолиз, остаток от прокаливания, газообразные продукты
Короткий адрес: https://sciup.org/147160286
IDR: 147160286 | УДК: 546.7+546.56
Текст научной статьи Синтез и термическое разложение двойных комплексных соединений, содержащих анион [FeMn(CN) 6] 2-
Двойные комплексные соединения (ДКС), в зарубежной литературе часто называемые гете-роядерными, представляют большой интерес для получения биметаллических оксидных и металлических порошков в качестве композиционных материалов различного назначениях [1]. Систематические исследования по этому направлению проводятся в ИНХ СО РАН [2–6], где изучен термолиз ДКС, содержащих платиновые металлы, а также одновременно благородный и неблагородный металл. Исследовано влияние геометрической конфигурации катиона и аниона ДКС и природы газовой среды (окислительной, восстановительной и инертной), в которой протекает термолиз, на состав и свойства продуктов термолиза. Получено большое количество биметаллических гомо- и гетерогенных наноразмерных материалов [2–6].
В последние годы наш авторский коллектив также занимается изучением термического разложения ДКС с целью получения биметаллических материалов [7–10]. Предметом наших исследований являлись исключительно ДКС 3d-металлов. Мы убедились, что 3d-металлы менее охотно, чем благородные металлы, образуют в результате термолиза ДКС твердые растворы и интер-металлиды. В настоящее время таковые получены нами только при восстановительном термолизе для ДКС с сочетаниями Co–Fe и Ni–Fe, в остальных случаях образуются гетерогенные металлические или металл–оксидные смеси [11–13]. Работа [14] навела нас на мысль о возможности получения триметаллических материалов, в состав которых входит железо и марганец. В ней описаны биметаллические цианомостиковые магнитные ансамбли, содержащие квадратные структурные единицы [Fe(CN) 4 Mn], из которых наиболее устойчив комплекс Na 2 [FeMn(CN) 6 ] с кубической кристаллической решеткой.
Целью настоящей работы был синтез и изучение процесса и продуктов термического разложения двух–триметаллических комплексов Ni–Fe–Mn и Cu–Fe–Mn, содержащих анион [FeMn(CN) 6 ]2–, в атмосфере воздуха, водорода и аргона.
Экспериментальная часть
Синтез и идентификация соединений
Оба соединения отличаются повышенным и переменным содержанием воды.
[Ni 2 en 3 (H 2 O) 6 ][FeMn(CN) 6 ] 2 ⋅ xH 2 O ( I ). 8 мл 0,5 М раствора К 3 [Fe(CN) 6 ] (4 ммоля) разбавили водой до 800 мл (раствор 1). В водно-спиртовой смеси 5:1 (666 мл воды + 133 мл изопропанола) растворили 1,46 г (4 ммоля) [Ni(en) 3 ](NO 3 ) 2 , затем добавили 22 мл 0,18 М раствора Mn(ClO 4 ) 2 (4 ммоля, раствор 2). На дно сосуда с раствором 2 опустили тонкий каучуковый шланг, через который медленно добавили раствор 1 (условием получения биметаллического аниона является медленное смешивание компонентов). Сразу появляется коричневый мелкокристаллический осадок. Реакционную смесь выдержали около 1 ч при ~10 ° C, затем отфильтровали осадок, промыли его 100 мл этанола и высушили в эксикаторе над щелочью до постоянной массы. Было получено две партии продукта.
В первой партии x=0. Выход составил 2,2 г (69 % от теоретически возможного). Соединение обозначается как I-1.
Для I-1 найдено, масс. %: С – 23,4; N – 26,4; Ni – 12,5; Mn – 12,1; Fe – 12,2.
Для C 18 H 36 N 18 O 6 Ni 2 Mn 2 Fe 2 вычислено, %: С – 23,0; N – 26,8; Ni – 12,5; Mn – 11,7; Fe – 11,9.
По данным кристаллооптического анализа, I-1 представляет собой очень мелкие желтокоричневые оптически изотропные кристаллы неправильной формы. Показатель преломления N ср =1,71.
Во второй партии x=3. Выход составил 3,3 г (69 % от теоретически возможного). Соединение обозначается как I-2 .
Для I-2 найдено, масс. %: С – 21,6; Ni – 11,9; Mn – 12,7; Fe – 11,1.
Для C 18 H 42 N 18 O 9 Ni 2 Mn 2 Fe 2 вычислено, %: С – 21,6; Ni – 11,8; Mn – 11,1; Fe – 11,2.
По внешнему виду продукты I-1 и I-2 не отличаются и имеют одинаковые дифрактограммы.
Синтез [Cu(en)(H 2 O) 2 ][FeMn(CN) 6 ] 2 ⋅ xH 2 O (II) проводили аналогично, за исключением того, что в составе раствора 2 четыре моля [Ni(en) 3 ](NO 3 ) 2 были заменены на 4 ммоля [Cu(en) 2 ]Cl 2 . Были также получены 2 партии продукта. Для II-1 x = 1. Выход II-1 составил 1,46 г (74 % от теоретически возможного).
Для II-1 найдено, масс. %: C – 21,6; N – 24,6; Cu – 14,5; Fe – 12,1; Mn – 12,1.
Для C 8 H 6 N 8 O 3 CuFeMn вычислено, %: С – 21,6; N – 25,2; Cu – 14,3; Fe – 12,6; Mn – 12,4.
По данным кристаллооптического анализа, II-1 представляет собой очень мелкие светлокоричневые оптически изотропные кристаллы неправильной формы. Показатель преломления N ср =1,73.
Для второй партии II–2 x=3. Выход II-2 составил 2,8 г (72 % от теоретически возможного).
Для II-2 найдено, масс. %: C – 20,0; Cu – 13,6; Fe – 10,9; Mn – 11,2.
Для C 8 H 10 N 8 O 5 CuFeMn вычислено, %: С – 19,9; Cu – 13,2; Fe – 11,6; Mn – 11,4.
По внешнему виду продукты II-1 и II-2 не отличаются и имеют одинаковые дифрактограммы.
При хранении на воздухе оба соединения выветриваются (теряют воду).
Для идентификации соединений использовали элементный анализ, рентгенодифракционный анализ (РДА), ИК-спектроскопию и кристаллооптический анализ. Для определения содержания металлов навески комплексов и продуктов их термолиза прокаливали для удаления углерода при 700 ° С в течение 1,5 ч и затем растворяли в смеси кислот HCl и HNO 3 . Полученные растворы анализировали атомно-абсорбционным методом на спектрометре «АAnalyst 400». Анализ веществ на содержание углерода проводили методом автоматического кулонометрического титрования на экспресс-анализаторе «CS-2000». РДА проводили на дифрактометрах ДРОН-2 и Shimadzu 6000 с использованием Cu-K a -излучения (монохроматор - графит). ИК-спектры получали на спектрометре Nicolet 6700 FT-IR в таблетках с KBr. Для идентификации соединений пользовались источниками [15, 16]. Кристаллооптический анализ выполняли с помощью микроскопа LeicaDM 2500 и стандартного набора иммерсионных жидкостей.
Приводим наиболее интенсивные рефлексы с межплоскостными расстояниями . Аналогичные данные для этих соединений в литературе не приводились.
-
I , ( d/n , нм)/ I : 0,69/54; 0,51/69; 0,46/69; 0,41/100; 0,36/43; 0,25/33;0,21/32.
-
II , ( d/n , нм)/ I : 0,53/91; 0,50/82; 0,38/100; 0,36/72; 0,31/38; 0,25/59; 0,23/32.
Оба комплекса дают очень сходные ИК-спектры с характеристическими полосами поглоще- –1 ния, см :
I-1 : v (OH 2 ) 3428; v (NH) 3255, 3217, 3094; v (CH) 2972, 2912; v (C = N) 2050, 2028; 8 (NH 2 ) 1567; 5 (CH 2 ) 1464; p w (CH 2 ) 1365; p w (NH 2 ) 1326, 1157; p , (CH 2 ) 1285; v (C-C) 1056; p t (NH 2 ) 1008; p r (CH 2 ) 898; p (OH 2 ) 796; 8 (MCN) 584.
П-1 : v (OH 2 ) 3403; v (NH) 3263, 3215, 3093; v (CH) 2974, 2908; v (C = N) 2050, 2028; § (№ 2 ) 1565; 8 (CH 2 ) 1464; p w (CH 2 ) 1367; p w (NH 2 ) 1325, 1155; p t (CH 2 ) 1284; v (C-C) 1056; p t (NH 2 ) 1003; p r (CH 2 ) 892; p (OH 2 ) 799; 8 (MCN) 584.
Изучение термолиза
Термический анализ ДКС в атмосфере воздуха и аргона проводили на синхронном термическом анализаторе NETZSCH STA 409 PC/PG и NETZSCH STA 449С. Навеску образца массой 9– 11 мг помещали в кварцевый тигель, затем в течение 2 часов выдерживали в атмосфере продувочного газа с целью удаления адсорбированных газов и стабилизации состава атмосферы. Затем образец нагревали со скоростью 10 K/мин от 25 до 900 ºС, при этом регистрировали кривые ТГ, ДТГ и ДСК. Изучали также состав продуктов, соответствующих нескольким температурам, которые отвечали экстремальным точкам на кривых ДТА и ДТГ (отсечки, табл. 1, 2). Комплексы выдерживали при этих температурах в течение 1 часа. Методика, условия и установка для изучения термолиза в проточном реакторе подробно описаны в предыдущих работах [7–10].
Твердые продукты восстановления идентифицировали методом РДА, используя базу данных JCPDS-JCDD-2002; все продукты термического разложения ДКС анализировали на содержание металлов и углерода. Как и в работах [7–10], анализировали газообразные продукты термолиза в атмосфере водорода и аргона. Анализ газообразных продуктов термолиза осуществляли на масс-спектрометре AeolosQMS 403, совмещенном с синхронным термическим анализатором, результаты ТГ-МС экспериментов приведены на рис. 1–4. Кроме триметаллических соединений, делали также ТГ-МС анализ K 3 [Fe(CN) 6 ] в атмосфере аргона. Кроме того, исследовали термическое разложение этих ДКС в токе воздуха и аргона с помощью проточного газоанализатора «МАГ» производства ООО «Мониторинг» (Россия, Санкт-Петербург). Прибор определяет содержание в газовой фазе СО, СО 2 и органического вещества в пересчете на метан. Для эксперимента брали навеску ДКС около 0,2 г в кварцевую лодочку, которую помещали в проточный трубчатый кварцевый реактор, вставленный в трубчатую печь SNOL-0,2/1250. Скорость нагрева печи - 5 ° /мин, скорость газового потока – 1л/мин. По площади выходных кривых в координатах С, моль/л – V, л, находили выход компонентов газового потока в % от общего содержания углерода. Результаты газового анализа представлены в табл. 3.
Обсуждение результатов
В результате анализа и идентификации полученных веществ мы установили, что при образовании ДКС исходные комплексные катионы претерпевают существенные изменения, теряя часть координированного этилендиамина, что довольно необычно для бидентатного лиганда. Объяснить это можно, по-видимому, сильным разбавлением реакционной смеси в соответствии с прописью синтеза [14] (концентрации катиона и аниона порядка 2 ммоль/л). Комплексы показывают почти идентичные ИК-спектры, что обусловлено, очевидно, главным образом, строением аниона. Формулы обоих соединений построены исходя из того, что Ni(II) обычно имеет координационное число (к.ч.) 6, а Cu(II) – 4.
Термолиз в атмосфере воздуха
Найдено, что ДКС I-1 и I-2 устойчивы до 80 °С. Затем в интервале 80-150 °С имеет место потеря массы порядка 5 %, что соответствует отщеплению ~3 молекул координированной воды (рис. 1, а). В интервале 200-380 °С, очевидно, происходит удаление оставшейся воды и полное выгорание этилендиамина и цианида. На кривой ДТГ в этой области имеется два отдельных, но близкорасположенных пика. При ~390 °С разложение I-1 и I-2 полностью заканчивается. На кривых МС (рис. 1, б) наблюдается 2 пика выделения воды (массовое число, m/e = 18). Максимум первого пика находится в области 100 °C, второго около 320 °С. В области 250-390 °С наблюдается выделение некоторого количества аммиака (m/e = 17), который, по-видимому, является го
го
|
^ J 2 -о g 8 к S s а z н Й о 2 о S Ч 5 з m Ы m |
1 |
го и >ч о В го а ф ■9* |
1 |
1 |
го ч о а ч ф ОС ф р ф е н го 03 |
04^ СП 40 |
о^ 04" |
04 |
го в а го а -е н го 03 сч |
сп" |
04" |
|||||
|
ГО S ю" О ф £ ф р ф го к а ф Г^ о и |
о |
О X S® § |
о о |
^г |
1П о |
о" чэ |
оо" СП |
о о |
сч^ оо" 40 |
СП 40 |
04" in |
|||||
|
у о го а |
-О сп" СЧ |
40^ о" |
40^ 40" |
40^ сч |
in^ оо" |
in сч |
1П^ сч" сч |
|||||||||
|
Р о П |
сп" сч |
40 о" |
П1 о" |
,о 'р |
о in сч |
00^ 40" |
о |
40^ сч |
04" |
04^ СЧ |
00^ сч" сч |
|||||
|
с S |
у го а |
СП СЧ |
сч |
40 о" сч |
СЧ |
гг" |
40" |
оо" |
||||||||
|
р |
сч" |
00^ СЧ |
сч" сч |
сч |
сч" Сх| |
сч" |
ш" |
00^ оо" |
04^ о" сч |
|||||||
|
ф а |
у о го Рч |
о^ |
чо сч |
сч" сч |
со сч |
сч" сч |
сч^ |
40" |
о^ 04" |
|||||||
|
р о |
сч^ СЧ" |
сч" сч |
сч" сч |
•п сч |
40^ сч" сч |
оо^ сп" |
in 40" |
04" |
||||||||
|
Z |
У го Рч |
in сч" |
сч" сч |
сч СП сч |
Ог сч" сч |
сч^ сп" сч |
00 |
in" |
in |
о о" сч |
||||||
|
р о Г) |
in сч" |
о н го 03 |
°\ сч" сч |
СП сч |
сч" сч |
^ сп" сч |
04^ |
in |
°\ 04" |
|||||||
|
е ° |
)S ^ о X о к |
3d Ф rj Ь £ О ш Z ь |
3d Ь £ (5 « Z ь |
3d -2 О ш z ь |
3d Ь £ б" ш z ь |
о р 2 % 2 |
о р S % 2 |
DS к ч о X о к |
^5 и S г° Ри Ри сч Z S |
О Р 2 (D Ри 2 |
о р S о" Ри Z |
|||||
|
й н ф о |
го а |
о о |
о 1П |
04^ СП in |
сч" in |
04^ 40" in |
04^ сп" |
<р |
о о |
сч^ оо" |
04^ 40 |
04" in |
||||
|
о |
о о |
1П |
in |
со сп" in |
°ч 40" in |
04^ сп" |
|
о о |
in сч" 40 |
40" in |
||||||
|
о 5 я s ^ 2 U 8 Й ^° н & § с |
ж гр о X о к |
О СП СЧ |
о о СП |
о 04 |
о in СП |
о о |
о о 04 |
)Р ч о X о к |
о о |
О 40 40 |
о о о |
|||||
|
го \ о го § ГО 2 8 ® |
04 сп 04 о щ Z и ф а р 5 5 |
in £ и о IP Р 5 2 |
40 о ш 3 о ф IP р Z |
СЧ 04 ^ о ^ р S 2 |
СП сп" in о о ^ 2 |
40 о in о ^ и р S 2 |
m с IP р S iz |
04 04^ о щ Z о р р S 2 |
о Z и р р 5 2 |
04 40 40 О Z и [р р S 2 |
00 in о и р р 5 2 |
|||||
CM
|
о * 2 щ н Я Я А « о § S 5 m § ” |
1 |
и я л а © -е V © л я |
1 |
1 |
л ч © © ч © © Ри © е* © л я |
04^ 40" СП |
ос" 00 |
я р © р © е V ф л я см НН НН |
1 |
оо" |
00 о" см |
ri см |
|||
|
S Я О © © ч © Я Я * Ри © ч О |
о |
X* о Я о |
о О |
Ч; 40 |
гм^ 04 Ч" |
СП' ri V |
о О |
о" 00 |
СП 40 |
04^ 04" ч- |
|||||
|
я о cd Ри |
40^ СМ |
40^ о" см |
СП |
О' о" см |
О' 04" |
04^ |
°Ч in |
||||||||
|
Я о |
40^ СМ |
o' |
'я |
о о" см |
40" |
V |
о о" см |
ш^ 04" |
4О" |
||||||
|
я S |
Я © cd Ри |
ri |
o' CM |
1П 40 |
oi |
1П^ |
40" |
04" |
|||||||
|
Я |
ri |
04^ o< |
О' oi |
^ |
ОО' |
04^ 40" |
(N 04" |
||||||||
|
© Ян |
Я о cd Ри |
MD ri |
о" CM |
ОО' 40" |
04" |
40^ |
ОО' |
40^ 40" |
04" |
||||||
|
Я о Г) |
ri |
00 pc |
СП 40" |
04" |
04^ о" |
||||||||||
|
Я и |
я cd Ри |
СП |
1П |
2 |
ri CM |
см СП |
ОО' 4о" |
04^ оо" |
ri см |
||||||
|
Я Г) |
in |
o^ я |
04^ ri CM |
40^ |
о,' рГ |
СП ri см |
|||||||||
|
)Я |
)Я Ч О X о S |
о Я ГП о ^ и |
о § о о ^ я о |
о © < q2: я" О |
0 0 2 s 0 ^ © я" Яи U |
<5 я .о q ^ я" и |
)Я й ч о X о к |
о q я и |
© о я ^ U я О |
© ‘Ч Ян я" О' Ян |
|||||
|
й н о |
Я Ри |
о о |
oo^ © 40 |
ОО' in |
°i |
СП 40 |
о" in |
о о |
оо" |
с^ 40 |
о^ о" 40 |
||||
|
Я m |
о о |
°4 о 40 |
ОО' in |
2 |
0" ш |
о о |
in ri 00 |
40^ in |
о^ ri 40 |
||||||
|
1 « cd Я ё й | и © Ч Н о я |
)Я ч о X о К |
о m CM |
о о 04 |
о in |
О О in |
о О 04 |
)Я й ч о X о к |
0 гм |
0 0 |
0 40 |
|||||
|
cd \ о Я § я 2 Н 8 S 6 5 Ри © и Ч |
о к Z и Ян 5 я и |
o' CM q Ян я s и |
°ч 4о" in СМ о Ян я и |
ri СП СП о ^ и Ян я и |
см о ^ о Ян я о |
О СП CN о и Ян 5 я и |
СП о" 00 о о Ян я S я о |
00 СП о Ян я 5 я и |
40 СП о q и Ян я и |
00 00 ГМ о О Ян я 5 я о |
|||||
А.е.
а)
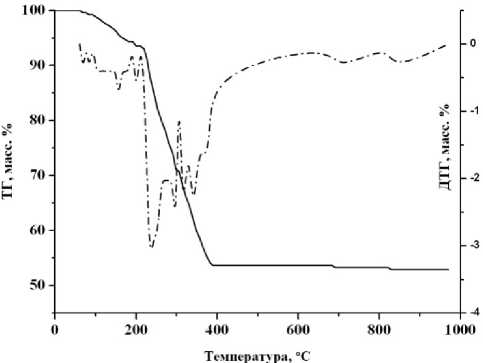
Рис. 1. Термоаналитические кривые (а) и масс-спектрометрический анализ (б) ДКС I в атмосфере воздуха
Температура ° C
б)
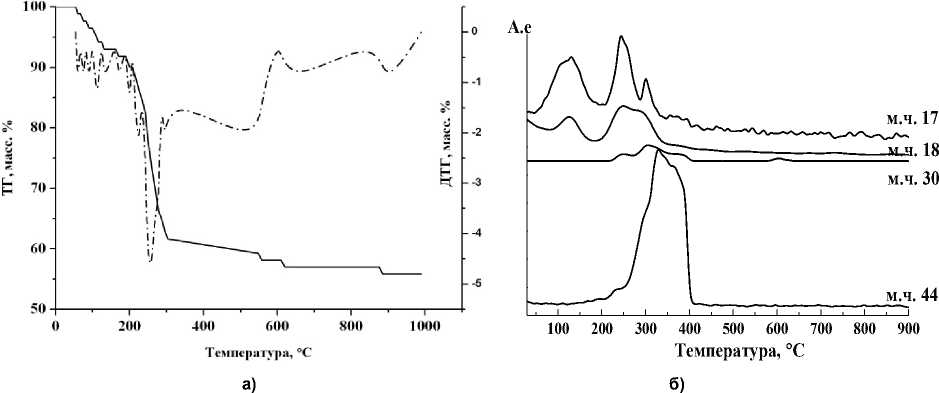
Рис. 2. Термоаналитические кривые (а) и масс-спектрометрический анализ (б) ДКС II в атмосфере воздуха
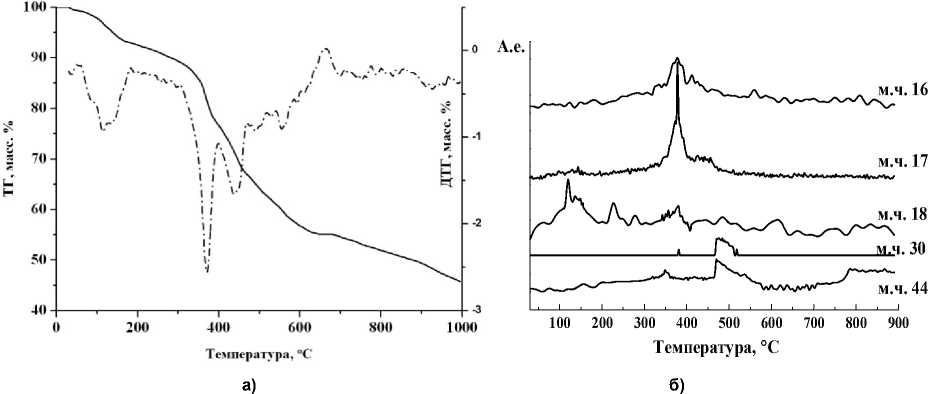
Рис. 3. Термоаналитические кривые (а) и масс-спектрометрический анализ (б) ДКС I в атмосфере аргона
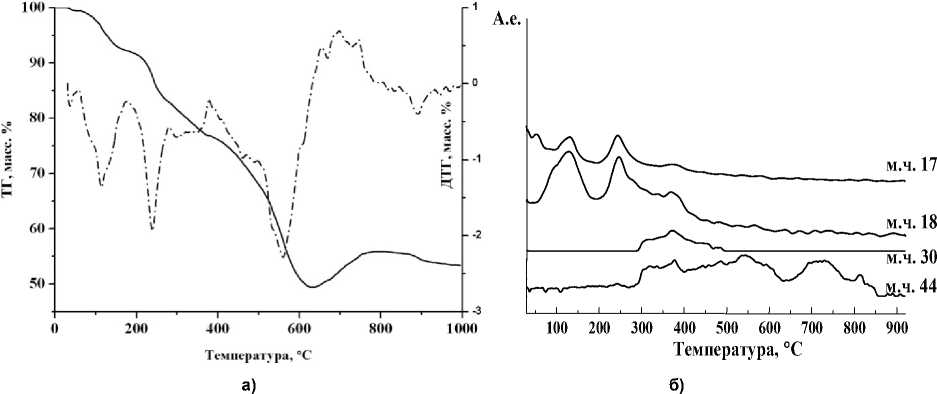
Рис. 4. Термоаналитические кривые (а) и масс-спектрометрический анализ (б) ДКС II в атмосфере аргона продуктом деструкции этилендиамина. Широкий пик выделения СО2 (m/e = 44) находится в области 200-380 °С. Зарегистрирован небольшой пик для m/e = 30, который, вероятно, соответствует NO. По данным газового анализа, при термическом разложении I-2 происходит выделение СО2 и СО в количестве 66,3 и 14,3 % от общего содержания углерода (табл. 3) в интервале температур 300-330 °С.
Опираясь на данные термического анализа, для соединения I-1 делали отсечки при 230, 300 и 900 ° С. РДА продуктов разложения I-1 на воздухе свидетельствует о том, что природа продуктов при всех температурах практически одинакова, но, в отличие от более низких температур, при 900 ° С они лучше кристаллизованы. Результаты РДА и элементного анализа (табл. 1) позволяют утверждать, что продукты термолиза I-1 представляют собой смесь оксидов NiO+Fe 3 O 4 +FeMn 2 O 4 . В отличие от термического анализа, при отсечках степень разложения комплекса значительно больше из-за длительной выдержки. Так, например, при 230 ° С в термическом анализе остаток от прокаливания ДКС составляет 93 %, в то время как после двухчасовой выдержки –55,1 масс. %.
Потеря массы у ДКС II-1 начинается уже при 60 ° С и продолжается вплоть до 880 ° С (рис. 2, а). Наиболее интенсивно этот процесс идёт в области температур 200-300 ° С, что соответствует резкому минимуму на кривой ДТГ. Можно предположить, что до ~216 ° С идет постепенная дегидратация II-1 . Потеря массы на первой стадии составляет ~ 11 %, что соответствует содержанию H 2 O в целом. Далее следует выгорание этилендиамина и CN-групп до ~ 400 ° С. Основная потеря массы заканчивается при 300 ° С, но постепенное выгорание остатков лигандов происходит до 400-500 ° С.
Таблица 3
Результаты газового анализа при термолизе I-II
|
ДКС |
Навеска, г(моль) |
С, г-атом |
CO, моль в температурном интервале, ° С |
S CO, % |
CO2, моль в температурном интервале, ° С |
S CO 2 , % |
|
В атмосфере воздуха |
||||||
|
I |
0,221(2,23·10–4) |
4,01·10–3 |
5,72·10–4 305–335 |
14,3 |
26,54·10–4 300–330 |
66,3 |
|
II |
0,1952(4,06·10–4) |
3,25·10–3 |
0,96·10–4 325–335 |
3,0 |
19,38·10–4 310–340 |
59,6 |
|
В атмосфере аргона |
||||||
|
I |
0,23185(2,33·10–4) |
4,19·10–3 |
1,45·10–4 450–590 |
3,5 |
отсутствует |
|
|
II |
0,20665(4,30·10–4) |
3,44·10–3 |
3,30·10–4 545–710 |
9,6 |
отсутствует |
|
Отсечки для II-1 делали при 250 и 900 ° С. По данным РДА, состав образующихся фаз для обеих температур одинаков, но при 900 ° С продукты термолиза лучше кристаллизованы, и, кроме того, из них полностью удаляются остатки лигандов (табл. 2): если при 250 ° С ещё наблюдается незначительное количество углерода, то при 900 ° С его уже нет. Таким образом, элементный анализ и РДА позволяют считать, что продукты термолиза II-1 при высоких температурах представляют собой следующую смесь оксидов: CuO + Fe 2 O 3 + MnO 2 (табл. 2). Как и в других случаях, выдержка при определенной температуре значительно увеличивает степень разложения ДКС. Для соединения II-2 термическое разложение заканчивается при 400 ° С и происходит в 3 чётко определённых стадии. На кривой ДТГ присутствует пик с максимумом около 120 ° С (потеря ~ 7 % массы), что соответствует удалению 2 молекул воды. Следующая стадия происходит в интервале 200-300 ° С и соответствует потере еще 13 % массы, т. е. отщеплению оставшейся воды и части этилендиамина. На третьей стадии удаляются все остатки лигандов.
Соответственно, на кривых МС для II-2 (рис. 2, б) наблюдаются две стадии дегидратации в области 100-150 и 200-350 ° С и три стадии удаления аммиака в области 100-150, 200-280 и 280340 ° С, а также выделение СО2 в области 250-400 ° С. Регистрируется также небольшой пик NO при 300 ° С. По данным газового анализа для II-2 , в интервале температур 310-340 ° С происходит выделение СО 2 и СО в количестве 59,6 и 3 % от общего содержания углерода (табл. 3). Выгорание остаточного углерода происходит ~ до 600 ° С.
Термолиз в атмосфере аргона
Поскольку одной из задач работы является исследование поведения циангрупп, содержащихся в анионе ДКС, было проведено ТГ-МС исследование красной кровяной соли K 3 [Fe(CN) 6 ]. В атмосфере аргона соединение остается устойчивым примерно до 360 ° С, в интервале 360-370 ° С имеет место потеря массы ~ 5 %. Выделяющийся при этом газообразный продукт представляет собой дициан с m/e = 52, что приблизительно соответствует потере 0,3 моль (CN) 2 на 1 моль K3[Fe(CN)6] и составу остатка 3KCN + Fe(CN)2. Далее до ~ 600 ° С наблюдается плато и, начиная с 650 ° С, происходит интенсивная потеря массы. Таким образом, красная кровяная соль гораздо более термически устойчива, чем ДКС, содержащее ее анион. Эти данные согласуются с ранее опубликованными для гексацианометаллатов [17].
Термолиз в атмосфере аргона выполняли только для соединений I-2 и II-2 .
Для I-2 на кривой ТГ можно выделить несколько стадий (рис. 3, а). На первой стадии в интервале температур 25-200 ° С потеря массы составляет 7,1 %, что можно отнести к отщеплению 3 молекул кристаллизационной воды и 1 молекулы внутрисферной воды, на второй стадии (200-310 ° C) потеря массы 3,8 %, что соответствует потере еще 2 молекул воды, на третьей стадии (310-400 ° С) потеря массы составляет 12,4 % что соответствует отщеплению оставшихся 3 молекул воды и 1 молекулы en. Последующие стадии идентифицировать очень трудно, но в интервале температур 450-600 ° С, согласно данным газового анализа, наблюдается выделение СО в количестве ~ 3 % от общего содержания углерода (табл. 3). Потеря массы прослеживается до 1000 ° С. Остаточная масса при этой температуре составляет 45,6 %. В остатке содержится 22,8 % углерода (табл. 1).
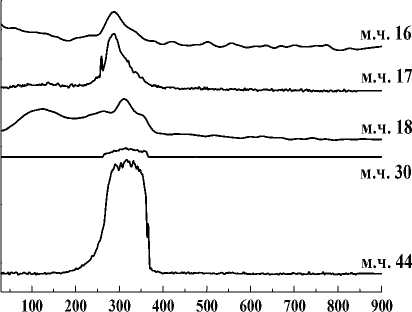
На кривых МС регистрируются несколько пиков, соответствующих удалению Н2О в области 50-450 ° С, и один пик, соответствующий удалению NH 3 - около 380 ° C (рис. 3,б). Небольшой пик, соответствующий NO, наблюдается около 500 ° C. Кроме того, в атмосфере как воздуха, так и аргона, наблюдается выделение производного с m/e = 16, которое, согласно [18], является радикалом NH2 – продуктом деструкции NH3.
Для II-2 на кривой ТГ можно выделить 5 стадий потери массы (рис. 4, а), первая и вторая из которых в области 50-150 ° С и 150-250 ° С соответствуют потере воды и частично этилендиамина (расчетное содержание воды – 18,7 %, этилендиамина 12,5 %). Выделение воды и этилендиамина продолжается примерно до 400 ° С. Остальные лиганды удаляются в интервале 400-700 ° С.
Для II-2 МС зарегистрированы производные с m/e = 17, 18 и 30 (рис. 4, б), т. е. Н 2 О, NH 3 и NO. Продукт деструкции аммиака здесь отсутствует, в отличие от I-2 . По данным газового анализа в широком интервале (545-710 ° С) наблюдается выделение СО в количестве 9,6 % от общего содержания углерода (табл. 3). Потеря массы прослеживается до 630 ° С. Остаток составляет 49,5 %. Содержание С в остатке 16,1 % (табл. 2).
В атмосфере аргона для обоих комплексов наблюдается выделение неразложившегося этилендиамина.
Термолиз I-1 и II-1 в атмосфере водорода
Восстановление I-1 проводили при температурах 350, 500 и 900 ° С. Результаты элементного анализа твердых остатков и поглотительной жидкости представлены в табл. 1. Следует отметить, что в отличие от других ДКС [7–10] продукт восстановления I-1 обладает хорошо выраженными пирофорными свойствами. Лодочка с твердыми продуктами термолиза после извлечения из реактора на воздух самопроизвольно нагревается до 80-90 ° С. РДА продуктов термолиза показывает-наличие оксидных фаз. Температуры 350 и 500 ° С явно недостаточно высоки для полного разложения ДКС. Даже при 500 ° С в остатках содержится ~ 40 % углерода от содержания в исходном комплексе. Металлическая фаза – твердый раствор NiFe – появляется, начиная с 500 °С. Что касается марганца, то во всех продуктах восстановления он присутствует в виде оксида. Предположительно, пирофорность продуктов восстановления обусловлена окислением металлического марганца. Примечательно, что координированный этилендиамин гидрируется и удаляется в виде аммиака (табл. 1), а не в неизменном состоянии, как можно было ожидать, учитывая результаты, полученные для других ДКС [7–13].
Восстановление II-1 проводили при температурах 350, 500 и 900 ° С. Как и в случае с ДКС I-1 , после вынесения лодочки с продуктами термолиза на воздух, у последних также наблюдаются пирофорные свойства, выражающиеся в самопроизвольном нагревании на 20-30 ° С. На дифрак-тограмме для продуктов, полученных при 350 и 500 °С, наблюдаются рефлексы оксидных продуктов и металлической меди (табл. 2). Даже при 500 ° С в твердых остатках присутствует ~ 50 % от исходного количества углерода и азота. При 900 ° С, по данным РДА, образуются металлическая медь и железо, а марганец, как и в случае соединения I-1 , по-видимому, окисляется на воздухе до MnO.
Как уже было указано, в числе газообразных продуктов термолиза I и II во всех атмосферах обнаружен аммиак. Количественно определить его в атмосфере воздуха нам не удалось, в атмосфере аргона в виде аммиака выделяется до 20 % от общего содержания N и до 97 % в атмосфере водорода. В твердом остатке от прокаливания в атмосфере аргона остается 50–60 % от исходного содержания углерода. Образующийся аммиак может быть продуктом как термолиза этилендиамина, так и продуктом гидрирования цианогрупп. Учитывая, что в составе координированного этилендиамина в соединении I находится 33 %, а в соединении II 25 % от общего содержания азота, очевидно, что в атмосфере водорода в обоих случая имеют место оба эти процесса, так как количество азота, выделяющегося в виде аммиака, близко к 100 %, а в атмосфере воздуха и аргона только первый. Остаточный углерод в твердых продуктах прокаливания в атмосфере аргона, согласно [17], принадлежит цианидам, которые образуются в результате термического разложения цианометаллатов. В случае ДКС II (табл. 2), содержание остаточных цианидов значительно ниже, чем для I (табл. 1). Различие в термическом поведении I и II объясняются, возможно, наличием в структуре I мостиковой молекулы этилендиамина.
Заключение
Полученные нами триметаллические соединения отличаются очень низкой термической устойчивостью, что характерно для комплексов, содержащих внутрисферную воду. При термолизе в инертной атмосфере образуются оксидные фазы, очевидно, за счет внутрисферной воды. При этом высоко содержание остаточного углерода, который, по-видимому, образует отдельную аморфную фазу. При термолизе в атмосфере водорода образуются высокодисперсные три- и биметаллические фазы, которые легко окисляются на воздухе.
Список литературы Синтез и термическое разложение двойных комплексных соединений, содержащих анион [FeMn(CN) 6] 2-
- Печенюк, С.И. Свойства двойных комплексных соединений/С.И. Печенюк, Д.П. Домонов//Журн. структур. химии. -2011. -Т. 52, № 2. -С. 419-435.
- Коренев, С.В. Восстановительный термолиз [Rh(NH 3) 5Cl][PdCl 4]хН 2О/С.В. Коренев, Ю.В.Шубин, А.В. Беляев//Журн. неорган. химии. -2001. -Т. 46, № 1. -С. 70-72.
- Синтез [Rh(NH3)5Cl][MCl6] (M=Re, Os, Ir), изучение продуктов их термолиза. Кристаллическая структура [Rh(NH3)5Cl][OsCl6]/С.А. Громилов, С.В. Коренев, И.А. Байдина и др.//Журн. структур. химии. -2002.-Т. 43, № 3. -С. 527-533.
- Шубин, Ю.В. Исследование комплексных солей [Ru(NH3)5Cl][PtCl4] и [Ru(NH3)5Cl][PdCl4]xH2O и продуктов их термического разложения/Ю.В. Шубин, С.В. Коренев//Журн. неорган. химии. -2002. -Т. 47, № 11. -С. 1812-1816.
- Шубин, Ю.В. Рентгенографическое исследование двойных комплексов [M(NH3)5Cl][M′Cl4] -предшественников металлических порошков (M = Ir, Rh, Co; M′ = Pt, Pd)/Ю.В. Шубин, С.В. Коренев, К.В. Юсенко и др.//Изв. АН. Серия хим. -2002. -№ 1. -С. 39-43.
- Синтез и структура двойных комплексов платиновых металлов -предшественников металлических материалов./С.В. Коренев, А.Б. Венедиктов, Ю.В. Шубин и др.//Журнал структур. химии. -2003. -Т. 44, № 1. -С. 58-73.
- О влиянии природы аниона на процесс термолиза двойных комплексов [Co(NH3)6][Fe(CN)6] и [Co(NH3)6]4[Fe(CN)6]3/С.И. Печенюк, Д.П. Домонов, Д.Л. Рогачев и др.//Журн. неорган. химии. -2007. -Т. 52, № 7. -С. 1110-1115.
- О влиянии природы лигандов на процесс термолиза двойных комплексов [Co(NH3)6]2C2O4[Cu(C2O4)2]2 и [Co(NH3)6]Cl[Cu(C7H4O3)2]/Д.П. Домонов, С.И. Печенюк, Н.Л. Михайлова и др.//Журн. неорган. химии. -2007. -Т. 52, № 7. -С. 1104-1110.
- Печенюк, С.И. Термическое разложение [Со(NH3)6][Cr(C2О4)3]/С.И. Печенюк, Д.П. Домонов, А.Т. Беляевский//Журн. неорган. химии. -2008. -Т. 53, № 8. -С. 1313-1319.
- Домонов, Д.П. Термическое разложение некоторых двойных комплексов, содержащих катион [Ni(NH3)6]2+/Д.П. Домонов, С.И. Печенюк, А.Т. Беляевский. -Деп. в ВИНИТИ 31.07.2007, № 797-В2007.
- Термическое разложение двойных комплексных соединений, содержащих катион [Cr(ur)6]3+/С.И. Печенюк, Д.П. Домонов, А.Н. Гостева и др.//Изв. СПбГТИ(ТУ). -2012. -№ 15(41). -С. 18-22.
- Синтез и термическое разложение двойных комплексных соединений, содержащих медь и 1,3-диаминопропан/С.И. Печенюк, Д.П. Домонов, А.Н. Гостева, Т.И. Макарова//Вестник ЮУрГУ. Серия хим. -2012. -№ 3(26). -С. 4-12.
- Синтез, свойства и термическое разложение соединений [Co(en)3][Fe(CN)6]x2H2O и [Co(en)3]4[Fe(CN)6]3·15H2O/С.И. Печенюк, Д.П. Домонов, А.Н. Гостева и др.//Коорд. химия. -2012. -Т. 38, № 9. -С. 618-625.
- Synthesis, structure and magnetic properties of a series of cyanobridges Fe-Mn bimetallic complexes/Jiang Long, Feng Xiao-Long, Lu Tong Bu a.o.//Inorg. Chem. -2006. -V. 45, no. 13. -P. 5018-5026.
- Накамото, К. ИК-спектры и спектры КР неорганических и координационных соединений/К. Накамото. -М.: Мир, 1991. -536 с.
- Atlas of thermoanalytical curves. -Budapest: Acad. Kiado, 1976.
- Mohai, Von B. Uber die thermischen Zersetzungsreaktionen der Hexacyanokobalte (III); Ligandenumlagerungen bei der Thermolyse/Von B. Mohai//Z. anorg. Allg. Chem. -1972. -V. 392. -P. 287-294.
- Rejitha, K.S. Thermal decomposition studies of [Ni(NH3)6]X2 (X=Cl, Br) in the solid state using TG-MS and TR-XRD/K.S. Rejitha, T. Ishikawa, S. Mathew//J. Therm. Anal. Calorim. -2011.-V. 103. -P. 515-523.

![Синтез и термическое разложение двойных комплексных соединений, содержащих анион [FeMn(CN) 6] 2- Синтез и термическое разложение двойных комплексных соединений, содержащих анион [FeMn(CN) 6] 2-](/file/cover/147160286/sintez-i-termicheskoe-razlozhenie-dvojnyh-kompleksnyh-soedinenij-soderzhashhih.png)
