Синтез кристаллов серебросодержащих оксидных фаз на основе молибдена, изучение их структуры и свойств
Автор: Балсанова Л.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Биологические науки
Статья в выпуске: 5 (56), 2015 года.
Бесплатный доступ
Изучена электропроводность тройных и двойных молибдатов в интервале температур от 200 до 550 °С. Показано, что исследованные керамические образцы молибдатов обладают смешанной электронно-ионной проводимостью с преобладанием ионной составляющей при высоких температурах эксперимента. Электрические свойства тройных молибдатов связаны с их структурными особенностями. В структурах Me 5(Li 1/3Hf 5/3)(MoO 4) 6 и Me 3LiHf 2(MoO 4) 6 имеются обширные каналы, в которых могут свободно мигрировать ионы. Величина удельной электрической проводимости а и энергии активации проводимости Е а исследованных молибдатов позволяют отнести их к разряду твердых электролитов.
Молибдаты, кристаллическая структура, синтез, ионная проводимость
Короткий адрес: https://sciup.org/142143117
IDR: 142143117 | УДК: 546.57
Текст научной статьи Синтез кристаллов серебросодержащих оксидных фаз на основе молибдена, изучение их структуры и свойств
Важной задачей физики и химии твердого тела остается поиск и создание новых функциональных материалов. Это предполагает исследование природы диэлектрических свойств известных соединений, а также изыскание новых диэлектрических веществ, в том числе с ценными для техники свойствами. Изучение сложнооксидных соединений на основе молибдена является перспективным, так как многие молибдаты известны в качестве функциональных материалов с лазерными, сегнетоактивными, люминесцентными и другими физическими свойствами, важными в современной технике [1]. В связи с этим целью данной работы явилось изучение фазообразование в системах Li 2 MoO 4 – Me 2 MoO 4 – Hf(MoO 4 ) 2 (Me = Na, K, Rb, Cs, Tl), Ag – Fe – Mo – O и исследование физико-химических свойств полученных соединений.
Ранее были изучены тройные солевые системы Li 2 MoO 4 -Mе 2 MoO 4 -Hf(MoO 4 ) 2 (Me = одновалентные элементы) и получены тройные молибдаты следующих составов Me 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 (Me = K, Rb, Tl), Me 3 LiHf 2 (MoO 4 ) 6 (Me = Na, K, Rb, Tl) и
RbLiHf(MoO 4 ) 3 [2]. При исследовании системы Ag – Fe – Mo – O были получены двойные молибдаты a-AgFe 2 (MoO 4 )3 и AgFe 4 (MoO 4 ) 5 [3].
Экспериментальная часть
Соединения получены твердофазным синтезом из стехиометрических количеств средних молибдатов при 450–600°С. Идентификацию соединения проводили методом рентгенофазового анализа (РФА) на дифрактометре D8 Advance фирмы Bruker AXS GmbH с Bragg-Brentano геометрией (Cu К а-излучение, 20 = 5-70°, шаг сканирования 0,02°).
Спектры ЯМР 7Li и 6Li записаны при температурах 25 и 100°С на импульсном спектрометре Agilent VNMR 400 на частоте 155,44 МГц и 58,87 МГц соответственно при вращении под магическим углом (MAS). Скорость вращения ротора 10 кГц, величины химических сдвигов ядер 7Li и 6Li определены относительно 9,7 M раствора LiCl. Анализ спектров осуществляли при помощи программы Dmfit.
Электрофизические измерения проводились в Лаборатории оксидных систем Байкальского института природопользования СО РАН. Изучение температурной зависимости проводимости а, образцов полученных соединений проводили по поляризационной методике Веста и Таллана [4]. Для всех образцов керамику получали, спрессовывая мелкодисперсный порошок в таблетки диаметром 5-10 мм, высотой 4-5 мм, с последующим отжигом при температуре 2/3 Т пл соответствующего соединения. На торцевые поверхности таблеток наносили электроды путем вжигания пасты, содержащей коллоидную платину. Для каждого исследуемого образца проводились измерения диэлектрической проницаемости и электропроводности на трех частотах: 100 Гц, 10 кГц и 100 кГц.
Измерение удельного сопротивления a-AgFe2(MoO4) 3 и AgFe4(MoO4)5 проводили двухконтактным методом на постоянном токе в интервале температур от жидкого N 2 до 400°С (Институт информатики МИРЭА).
Исследование элементного состава и пространственного распределения элементов по объему образцов изучали методами рентгеноспектрального анализа, сканирующей электронной микроскопии (система с электронным и сфокусированным ионным пучками Quanta 200 3D).
Исследование топографии поверхности образцов, электрических и электростатических характеристик проводили с использованием атомно-силового микроскопа (NT-NTD Ntegra).
Результаты и обсуждение
Электропроводность тройных молибдатов изучена в интервале температур от 200 до 550 0С. Экспериментальные значения Е а и о для тройных молибдатов приведены в таблицах 1 и 2.
Таблица1
Удельная электрическая проводимость о и энергия активации проводимости Еа молибдатов Me5(Li1/3Hf5/3)(MoO4)6
|
Соединение |
Удельная проводимость, Ом-1 - см-1 |
Энергия активации, эВ |
||
|
400 0С |
450 0С |
500 0С |
||
|
Rb 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 |
2,5 - 10 —6 |
1,23 - 10-4 |
1,32 - 10-3 |
1,80 |
|
Tl 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 |
1,2 - 10-2 |
1 - 10-1 |
1,63 |
|
Таблица 2
Удельная электрическая проводимость о и энергия активации проводимости Еа молибдатов Me3LiHf2(MoO4)6
|
Соединение |
Удельная проводимость, Ом-1 - см-1 |
Энергия активации, Эв |
||
|
400 0С |
450 0С |
500 0С |
||
|
Rb 3 LiHf 2 (MoO 4 ) |
1,5·10-6 |
- |
- |
0,54 |
|
Tl 3 LiHf 2 (MoO 4 ) |
2,29·10-3 |
7,25·10-3 |
2,5·10-2 |
0,92 |
Зависимости электропроводности от функций обратной температуры и температурные зависимости диэлектрической проницаемости приведены на рисунках 1-4.
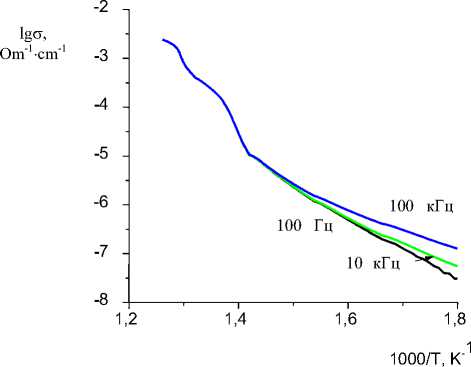
Рисунок 1 ‒ Температурная зависимость электропроводности Rb 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6
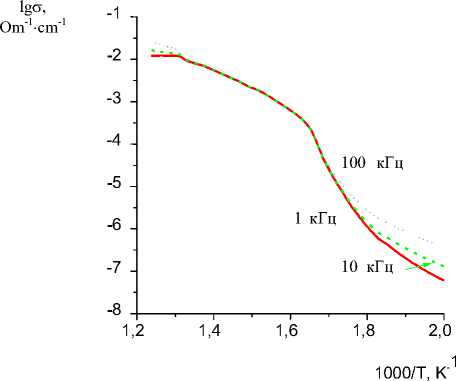
Рисунок 2 ‒ Температурная зависимость электропроводности Tl3LiHf2(MoO4)
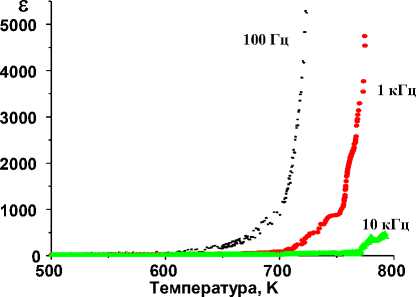
Рисунок 3 ‒ Температурная зависимость диэлектрической проницаемости Rb5(Li1/3Hf5/3)(MoO4)6
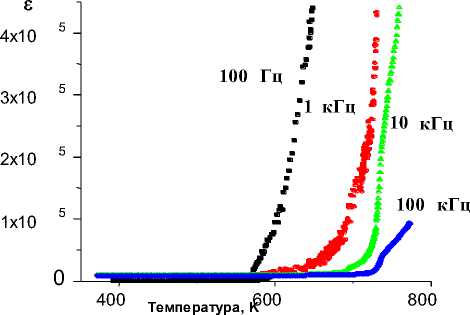
Рисунок 4 ‒ Температурная зависимость диэлектрической проницаемости Tl 3 LiHf 2 (MoO 4 )
Как видно из графиков и табличных данных, величина электропроводности при 500 0С достигает значений ~ 10-3 – 10-1 Ом-1⋅см-1, характерных для суперионных проводников. Для полученных соединений характерна преимущественно ионная проводимость. Высокая электропроводность связана со структурными особенностями данной группы соединений. Соединения состава Me 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 образуют изоструктурный ряд с Rb 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 , структура которого установлена в [2]. Основа кристаллической структуры ‒ ажурный смешанный каркас из (Hf, Li)O 6 -октаэдров и MoO 4 -тетраэдров, в крупных пустотах которого располагаются атомы рубидия.
Тройные молибдаты состава Me 3 LiHf 2 (MoO 4 ) 6 (Me = K, Rb) изоструктурны KAl(MoO 4 ) 2 с вероятным статистическим замещением атомов Al на атомы Li и Hf в пропорции 1:2. Как известно, кристаллическая структура данного молибдата слоистая, в его структуре кроме тетраэдрических, заполненных атомами Мо, и октаэдрических пустот, в которых статистически распределяются атомы Li и Hf, имеются большие полости, вероятно, заселенные атомами щелочного металла. Соединение Na 3 LiHf 2 (MoO 4 ) 6 изоструктурно триклинному NaIn(MoO 4 ) 2 , структура которого представляет собой трехмерный каркас, построенный из соединенных по вершинам Мо-тетраэдров и (Li-Hf)-октаэдров, в пустотах которого располагаются атомы Na. Дифрактограмма Tl 3 LiHf 2 (MoO 4 ) 6 успешно проиндицирована в предположении реализации у данного тройного молибдата сверхструктуры типа ромбического KIn(MoO 4 ) 2 c утроением наименьшего параметра с . Структура KIn(MoO 4 ) 2 каркасного типа, состоящая из In, Mo- полиэдров, кроме того, в ней имеются прямолинейные двухполосные ленты, составленные К-одинадцативершинниками, которые проходят через большие полости в каркасе. В соединении Tl 3 LiHf 2 (MoO 4 ) 6 утроение параметра связано с упорядочением расположения Li и Hf по позициям In в структуре KIn(MoO 4 ) 2 . В этой структуре на ячейку приходится 4 атома In, поэтому ее объем должен увеличиться в 3 раза, чтобы упорядоченным образом разместить Li и Hf в отношении 1:2. В связи с этим электропроводность таллиевого соединения значительно больше его изоструктурных аналогов.
Тройные молибдаты одно-одно-четырехвалентных металлов кристаллизуются в четырех типах структур (табл. 3, 4). Из этого следует, что на проводимость влияет и состав и структура. Молибдаты Ме 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 (табл. 3) кристаллизуются в одном структурном типе (тригональная, пр. гр. R3c), несмотря на это, они имеют различные величины проводимости, и их можно расположить по возрастанию проводимости в такой последовательности Rb 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 → Tl 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 .
Изоформульные молибдаты Ме3LiHf2(MoO4)6 в зависимости от структуры по возрастанию проводимости можно расположить в следующий ряд: трикл. Р1 → тригон. R3c → тригон. P3m1 → ромб. Pnam.
Таблица 4
|
Соединение |
Пр. гр. |
Параметры элементарных ячеек, Å |
Z |
Т пл., ° С |
|||
|
a |
b |
с |
а , в , у |
||||
|
Na 3 LiHf 2 (MoO 4 ) 6 |
Р 1 |
18,288(3) |
7,987(1) |
7,247(1) |
91,77 84,68 75,97 |
4 |
560 |
|
K 3 LiHf 2 (MoO 4 ) 6 |
P 3m1 |
5,807(3) |
- |
7,169(4) |
- |
1 |
610 |
|
Tl 3 LiHf 2 (MoO 4 ) 6 |
Pnam |
14,970(2) |
8,764(6) |
17,484(2) |
- |
4 |
600 |
|
Rb 3 LiHf 2 (MoO 4 ) 6 |
P 3m1 |
5,801(1) |
- |
7,533(2) |
- |
1 |
610 |
Кристаллографические характеристики и температуры плавления соединений Ме5(Li1/3Hf5/3)(MoO4)6 (Mе = K, Tl, Rb)
Таблица 3
|
Соединение |
Пр. гр. |
Параметры элементарных ячеек, А |
Z |
Плотность, г/см3 |
Т пл., о ° С |
||
|
а |
с |
расч. |
эксп. |
||||
|
K 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 |
R3c |
10,567(1) |
37,441(9) |
6 |
4,004 |
3,98 |
610 |
|
Tl 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 |
R3c |
10,623(1) |
37,961(1) |
6 |
6,125 |
6,11 |
560 |
|
Rb 5 (Li 1/3 Hf 5/3 )(MoO 4 ) 6 |
R3c |
10,660(2) |
38,241(5) |
6 |
4,467 |
4,45 |
600 |
Кристаллографические характеристики и температуры плавления соединений Mе3LiHf2(MoO4)6 (Mе = Na, K, Tl, Rb)
Высокая ионная проводимость тройных молибдатов и особенно Tl3LiHf2(MoO4)6 соединения позволяет отнести их к перспективным материалам для использования в качестве твердых электролитов [5].
Спектры ЯМР 6Li и 7Li (MAS) наблюдаются для соединения LiRb 3 Hf 2 (MoO 4 ) 6 (рис. 5), отметим, что для данного образца форма линий ЯМР (MAS) на ядрах 6Li и 7Li близка, аналогичны и температурные изменения спектров. Линии ЯМР 7Li с химическими сдвигами δ 1 = +3,7 и δ 2 = +3,6 м.д. можно отнести к ионам лития в смешанных позициях Hf1 и Hf2 в октаэдрах HfO 6 , а линии со сдвигами δ 3 = +0,4 м.д. и δ 4 = -0,2 м.д. – к трем типам ионов лития, расположенных в смешанных по заселенности позициях Rb. Поскольку в структуре имеется до 25% вакансий вследствие наличия переходного металла Hf в степени окисления +4, то с повышением температуры ионы лития участвуют в перескоках между позициями в каналах структуры, о чем свидетельствует сдвиг линий ЯМР 6Li и 7Li с δ, близким к нулю, в сторону уменьшения значений химического сдвига [6].
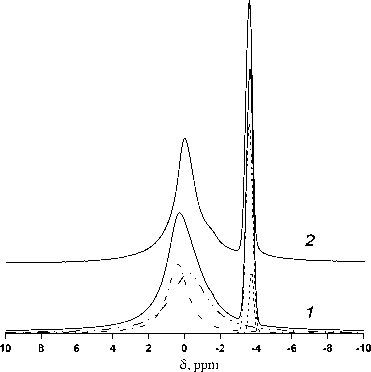
Рисунок 5 ‒ Спектры ЯМР 7Li (MAS) образца LiRb 3 Hf 2 (MoO 4 ) 6 при температурах 25 (1) и 100°С (2) Пунктиром обозначены компоненты экспериментального спектра ЯМР.
При измерении удельного сопротивления a-AgFe 2 (MoO 4 )3 и AgFe 4 (MoO 4 ) 5 показано, что с увеличением температуры сопротивление уменьшается (р25=33кОм-см, р 6 00=10,3кОм-см) (рис. 6-8), что также позволяет их отнести к классу твердых электролитов. Электропроводность a-AgFe 2 (MoO 4 )3 и AgFe 4 (MoO 4 ) 5 обусловлена, по-видимому, переносом электронов между двух- и трехзарядными ионами железа и миграцией однозарядных катионов серебра.
5 ■
О

r01 r200 r100 r10 r1
ад
100 200 300
T, K
Рисунок 6 ‒ Температурная зависимость удельного сопротивления AgFe2(MoO4)3
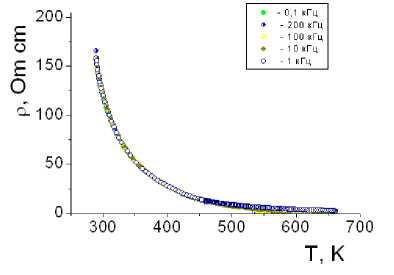
Рисунок 7 ‒ Температурная зависимость удельного сопротивления AgFe2(MoO4)3
r01 r200 r100 r10 r1
6x106
Е =
5x106
4x106
3x106
2x106
1x106
100 200 300 400
T, K
Рисунок 8 ‒ Температурная зависимость удельного сопротивления AgFe4(MoO4)5
В индивидуальном состоянии фаза AgFe4(MoO4)5 получена твердофазным синтезом (отжиг проводился в течение 50 ч при 850 0С), второе соединение a-AgFe 2 (MoO 4 ) 3 было получено при синтезе AgFe 4 (MoO 4 )5 в количестве 25%. В чистом виде (100%) фаза а-AgFe 2 (MoO 4 ) 3 получена прокаливанием стехиометрических количеств исходных компонентов при 700 ° С в течение 50 ч.
В структуре AgFe 4 (MoO 4 ) 5 (P 1, а = 6,928(3), b = 7,010(6), c = 17,819(6) А, а = 87,66(1), в = 87,35(1), у = 79,27(1)°) к каждому FeO6-октаэдру присоединяются по общим вершинам шесть MoO 4 -тетраэдров, образуя, таким образом, ажурный смешанный каркас. Ионы серебра, имеющие значительно деформированную кислородную координацию, располагаются в крупных пустотах тетраэдро-октаэдрического каркаса.
Соединение a-AgFe 2 (MoO 4 ) 3 , полученное в данной системе, также кристаллизуется в тригональной сингонии (P 1, а = 6,9253(4), b = 6,9168(5), c = 10,9001(11) A, a = 81,57(1), в = 83,56(1), у = 81,45(1)°). Структура состоит из сети FeO6-октаэдров и МоО4-тетраэдров. Все MoO 4 -тетраэдры изолированы друг от друга так, чтобы этот состав принадлежал к классу орто(оксо-)молибдатов. Ионы Ag координированы четырьмя атомами кислорода (2,263 – 2,508 Ǻ), расстояние до ближайшего атома кислорода ‒ 2,998 Ǻ. Оба соединения имеют ажурную пористую структуру, в крупных пустотах которой находятся катионы, что способствует ионному транспорту.
Методом сканирующей электронной микроскопии проведен качественный и количественный энергодисперсионный химический микроанализ исследуемых образцов и получены карты и профили распределения химического состава в анализируемых объектах. Показано, что соединения однофазные, что хорошо согласуется с данными атомно-силовой микроскопии.
Результаты исследований АСМ показали, что вещества беспористые, равномерные, состоящие из одной фазы с упорядоченной фрактальной структурой в виде стержневых образований, расположенных слоями, ширина слоя находится в переделах ~ 10-25 нм.
Таким образом, в результате исследований выявлена взаимосвязь между составом, условиями получения, структурой и физико-химическими свойствами сложнооксидных соединений на основе молибдена.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 09-03-90757) и Германской службы академических обменов DААD.
Список литературы Синтез кристаллов серебросодержащих оксидных фаз на основе молибдена, изучение их структуры и свойств
- Мохосоев М.В., Базарова Ж.Г. Сложные оксиды молибдена и вольфрама с элементами I-IV групп. -М.: Наука, 1990. -256 c.
- Солодовников С.Ф., Балсанова Л.В., Базаров Б.Г. и др. Фазообразование в системе Rb2MoO4 -Li2MoO4 -Hf(MoO4)2 и кристаллическая структура Rb5(Li1/3Hf5/3)(MoO4)6//Журн. неорган. химии. -2003. -Т. 48. -С. 1197-1201.
- Balsanova L., Mikhailova D., Senyshyn A. et al. Structure and properties of a-AgFe2(MoO4)3//J. Solid State Science. -2009. -Vol. 11. -P. 1137-1143.
- Vest R.W., Tallan N. W.//J. Appl. Phys. -1965. -Vol. 35. -P. 543.
- Балсанова Л.В., Базаров Б.Г. Синтез и электрические свойства тройных молибдатов//Журнал прикладной химии. -2008. -Т. 81, № 5. -С. 1213-1215.
- Невмывако Р.Д., Журавлев Н.А., Цыренова Г.Д. и др. ЯМР (MAS) 6Li, 7Li в молибдатах лития Li2Zn2(MoO4)3 и LiRb3Hf2(MoO4)6//Известия РАН. Серия физическая. -2014. -Т. 50, № 5. -С. 989-990.


