Синтез наноматериалов с использованием пав
Автор: Жеребцов Дмитрий Анатольевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Нанотехнологии и наноматериалы
Статья в выпуске: 3 т.19, 2019 года.
Бесплатный доступ
Рассмотрены методы синтеза наноматериалов с применением поверхностно-активных веществ. Приведен краткий анализ и классификация ПАВ. Одним из методов является синтез нанопористых трехмерно упорядоченных оксидных, халькогенидных или металлических наноматериалов в структуре лиотропных жидких кристаллов, формирующихся в высококонцентрированных водных растворах ПАВ. Отмечена пионерская работа 1992 г. по созданию первого мезопористого силикатного материала, послужившая инициатором широкой волны исследований в этой области. Другим методом является использование обратных мицелл ПАВ в углеводородных средах, что позволяет проводить реакции в объеме микрокапель растворов реагирующих компонентов и тем самым уменьшать размер образующихся наночастиц. Для целенаправленного использования ПАВ необходимо знание двойных и тройных диаграмм состояния вода - ПАВ и вода - масло - ПАВ, которые строятся согласно классическим представлениям физической химии о равновесии в двух- и многокомпонентных системах. В обзоре приведены наиболее подробно охарактеризованные двойные и тройные диаграммы состояния, имеющие значение для матричного синтеза. Обсуждены методы исследования диаграмм состояния. Затронуты также близко родственные системы на основе блок-сополимеров, ряд которых также может быть рассмотрен как высокомолекулярные ПАВ. Отдельно рассмотрены оксидные и оксигидроксидные наноматериалы, включающие соединения Si, Al, Ti, Zr, Hf, Nb, Ta, Mn, W, Sn, Ce и смешанных материалов, с матрицей из SiO2, на которую нанесено некоторое количество оксида другого металла: Al, V, Cr, Fe, Zr, Mo, Ni, либо металлические частицы катализаторов: Ag, Pt или Pd, полученные с применением ПАВ в процессе осаждения неорганической фазы. Приведены примеры наиболее упорядоченных мезопористых наноматериалов, образующих трехмерно периодические структуры с открытой пористостью. Предложены пути дальнейшего развития метода матричного синтеза наноматериалов с использованием ПАВ.
Поверхностно-активные вещества, наноматериалы, матричный синтез
Короткий адрес: https://sciup.org/147233927
IDR: 147233927 | УДК: 54.057 | DOI: 10.14529/met190308
Текст научной статьи Синтез наноматериалов с использованием пав
Одним из первых мезопористых (нанопо-ристых) материалов, созданным и многосторонне изучаемым в настоящее время, стал MCM-41. Активное изучение мезопористых фаз на его основе началось после открытия и патентования в 1992 г. компанией Mobile Oil Corporation материала под торговой маркой МСМ-41 (Mobil Composition of Matter-41) [76, 13]. Ключевым элементом метода получения МСМ-41 является введение в раствор силиката натрия, из которого осаждают твердую фазу SiO2, поверхностно-активного вещества (бромида цетилтриметиламмония), причем концентрация ПАВ составляет от 10 до 30 мас. %. В такой системе образуется двухфазная смесь из истинного раствора и лиотропной жидкокристаллической гексагональной фазы, в которой молекулы ПАВ образуют плотноупако- ванные цилиндрические мицеллы, ориентированные параллельно друг другу. После кислотного гидролиза в межмицеллярной водной микрофазе жидкого кристалла образуется золь SiO2, который через некоторое время превращается в гель. Полученный силикагель может быть прокален на воздухе для удаления воды и ПАВ. При этом силикагель наследует структуру раствора (точнее, лиотропного жидкого кристалла), в котором он был получен. Диаметр цилиндрических пор можно изменять (от 1,5 до 10 нм), варьируя состав исходного раствора [13]. Такие размеры пор обусловливают высокую удельную площадь поверхности (400–1200 м2/г) и позволяют проникать внутрь каналов силикагеля молекулам газообразных веществ.
Материалы с монодисперсной открытой пористостью используются в качестве носи- телей катализаторов в органическом и неорганическом синтезе. Наиболее ярким примером использования МСМ-41 стало внедрение его в производство высокооктановых бензинов путем каталитической изомеризации нормальных алканов в разветвленные [111]. Это привело к увеличению доли таких бензинов, производимых из тонны нефти, и заметно приостановило потребление нефти в мире в конце 1990-х и снизило рост цен на нефть.
Этот успех показал перспективность использования ПАВ в получении наноматериалов. В дальнейшем работы по матричному синтезу привели к созданию подобных наноматериалов на основе оксидов, гидроксидов и оксигидратов других элементов.
-
1. Применение поверхностно-активных веществ для синтеза наноматериалов 1.1. Коллоидная химия как часть
нанохимии
Многие наносистемы являются термодинамически неустойчивыми, коагулируют или расслаиваются. Поэтому особого внимания заслуживают термодинамически устойчивые наносистемы; отдельное внимание в данном обзоре уделено самоорганизующимся наносистемам. К ним можно отнести лиотропные жидкие кристаллы и микроэмульсии, а также некоторые блок-сополимеры. При осаждении твердых веществ в водной фазе подобных систем можно получить наноматериалы, наследующие структуру исходных растворов ПАВ. В английском языке для подобных материалов утвердился термин «templated», то есть «построенный по шаблону», задаваемому частицами другого вещества, называемого «template», шаблон. Для систем с ПАВ, являющимися жидкими, часто используется уточняющий термин «soft template», акцентирующий внимание на их жидком состоянии, в отличие от матриц на основе твердых материалов, например, целлюлозы. В русскоязычной литературе многие исследователи используют кальку с английского произношения, называя метод и материалы «темплетными», а вещество, задающее морфологию – «темпле-том». Вместе с тем встречается и термин «матричный синтез», достаточно точно передающий содержание метода. Важной отличительной чертой самоорганизующихся наносистем является их однородность, в частности – узкое распределение размеров наночастиц по величине, высокая упорядоченность их взаимного расположения и единообразие их формы.
Для рассмотрения наноструктурирован-ных материалов и матричного синтеза необходимо начать с коллоидной и физической химии и диаграмм состояния с участием ПАВ.
Поверхностно-активные вещества (ПАВ) – это вещества, адсорбция которых на поверхность раздела фаз приводит к значительному понижению поверхностного натяжения . В наиболее общем случае молекулы ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала. Применение ПАВ имеет ключевое значение для синтеза наноматериалов в растворах.
ПАВ делят на четыре основных класса: анионактивные, катионактивные, неионогенные и амфотерные.
Анионактивные ПАВ содержат в молекуле одну или несколько полярных групп и диссоциируют в водном растворе с образованием длинноцепочечных анионов, определяющих их поверхностную активность.
Катионактивными называют ПАВ, молекулы которых диссоциируют в водном растворе с образованием поверхностно-активного катиона с длинной гидрофобной цепью и аниона – обычно галогенида. Преобладающими среди катионактивных ПАВ являются азотсодержащие соединения.
Неионогенные ПАВ не диссоциируют в воде на ионы. Их растворимость обусловлена наличием в молекулах гидрофильных эфирных и гидроксильных групп, чаще всего полиэтиленгликолевой цепи (рис. 1). Полярность одной оксиэтиленовой группы значительно меньше полярности групп ионогенных ПАВ.
нон НОН
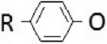
СН2СН2ОСН2СН2О -СН2СН26-йон
Рис. 1. Пример молекулы неионогенного ПАВ с гидрофобным «хвостом» R и сольватирующими молекулами воды вокруг гидрофильного полиэтиленгликольного конца молекулы
Поэтому для придания молекуле требуемой гидрофильности в зависимости от гидрофобного радикала требуется от 7 до 50 оксиэтиленовых групп. Отдельную группу неионогенных ПАВ составляют блоксополимеры этилен- и пропи-леноксидов НО(C2H4O)x(C3H6O)y(C2H4O)хH, где х и у варьируют от нескольких единиц до нескольких десятков. Наиболее изучены высокомолекулярные ПАВ в виде блок-сополимеров этиленоксида и гидрофобных групп, таких как пропиленоксид [1, 10], изопрен [132, 63], полистирол [20]. Неионогенные ПАВ менее чувствительны к солям в растворе, чем анионактивные и катионактивные ПАВ, благодаря этому они чаще используются в мат- ричном синтезе. Большинство неионогенных ПАВ являются вязкими жидкостями при комнатной температуре.
-
1.2. Диаграммы состояния систем вода – ПАВ и вода – масло – ПАВ.
Мезофазы и лиотропные жидкие кристаллы
Помимо простых диаграмм состояния с ограниченной или полной взаимной растворимостью жидкостей (типа вода–спирты), в системах вода – неионогенное ПАВ обнаруживаются промежуточные фазы или мезофазы, находящиеся по составу между водой и чистым ПАВ. Эти фазы термодинамически устойчивы, обладают дальним порядком
а)
б)
а)
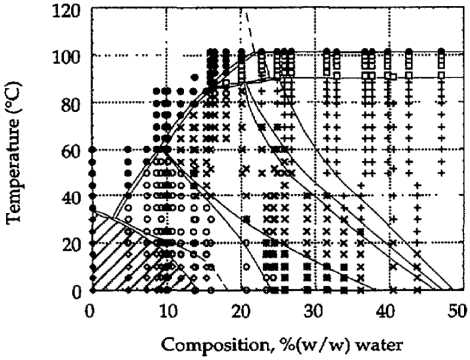
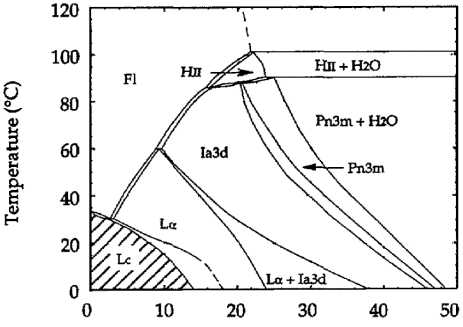
Рис. 3. Состав образцов и температуры съемки рентгенограмм (а). Полученная диаграмма состояния вода – моноолеилглицерат [19] (б): L α – ламеллярная фаза, Ia3d и Pn3m – кубические фазы, H II – обращенная гексагональная фаза, Fl – изотропная жидкость, L с – твердый моноолеилглицерат
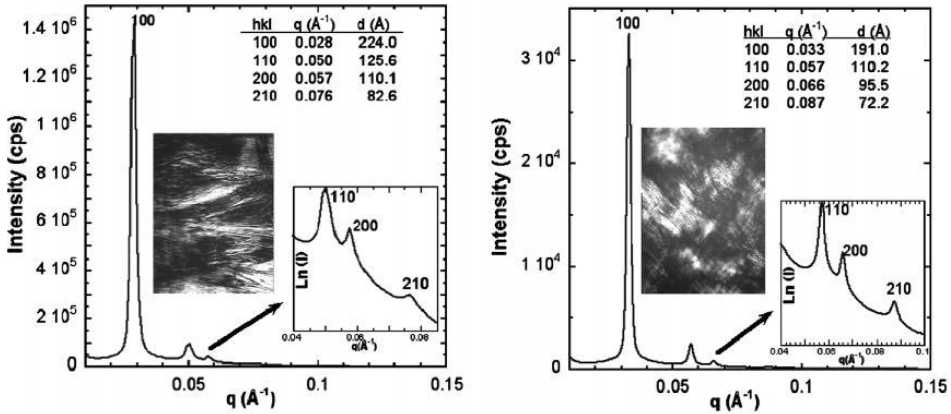
Рис. 2. Рентгенограммы малоуглового рентгеновского рассеяния мезофаз с различными ПАВ [121]: а, б – гексагональная фаза. На вставках – фотографии этих фаз (поляризационная микроскопия)
Composition, %(w/w) water
б)
структуры и называются также лиотропными жидкими кристаллами. Их структуры разнообразны и могут быть изучены рентгеновскими методами. Ввиду того, что параметры структур лежат в диапазоне 5–50 нм, их структура исследуется в первую очередь с помощью малоуглового рентгеновского рассеяния [121] (рис. 2). Известны более 20 различных пространственных групп [43], в которых могут кристаллизоваться лиотропные жидкие кристаллы.
Информацию о структуре двойных и тройных фаз получают по данным светорассеяния и поляризационной микроскопии [159, 121, 112, 155], малоуглового рассеяния рентгеновских лучей [18, 121, 112, 140, 19, 155] (рис. 2, 3) и нейтронов [49], ЭПР [158], ЯМР [18, 65, 144], электропроводности [159, 101, 18, 96, 65] и вязкости [159, 36, 155]. Постепенно увеличивается число полностью или частично построенных двойных диаграмм состояния [137, 19, 118, 91, 46, 93] (рис. 3–9)
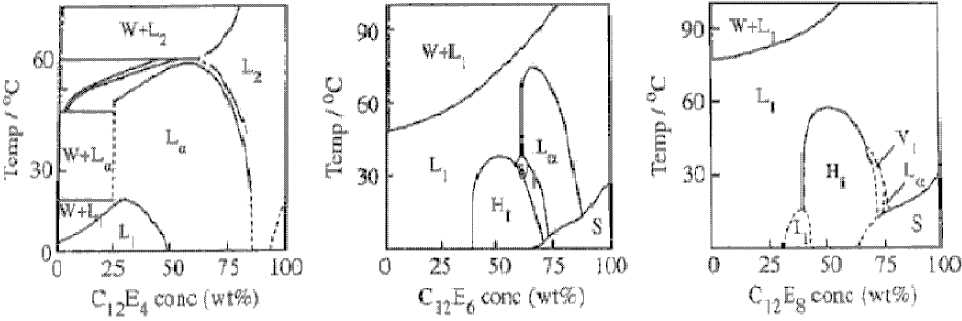
Рис. 4. Диаграммы состояния вода–полиэтиленоксидные эфиры додеканола (узкие двухфазные области не показаны) [91]: W – водная фаза, L 1 и L 2 – прямая и обращенная мицеллярная фаза, L α – ламеллярная фаза, I – кубическая фаза, V 1 – биконтинуальная фаза, S – твердая фаза, Н I – гексагональная фаза
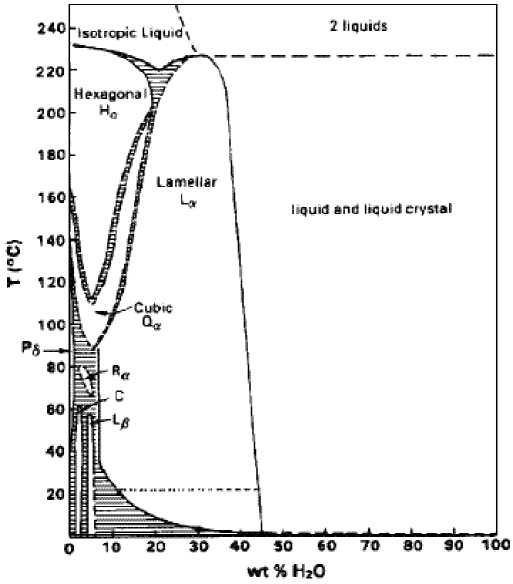
Рис. 5. Диаграмма состояния вода –яичный лецитин [118]: С – кристаллическая фаза, Н α – гексагональная фаза, L α – ламеллярная фаза, L β – ламеллярный гель, Q α – кубическая разупоря-доченная фаза, R α – ромбоэдрическая разупорядоченная фаза
а) б)

а)
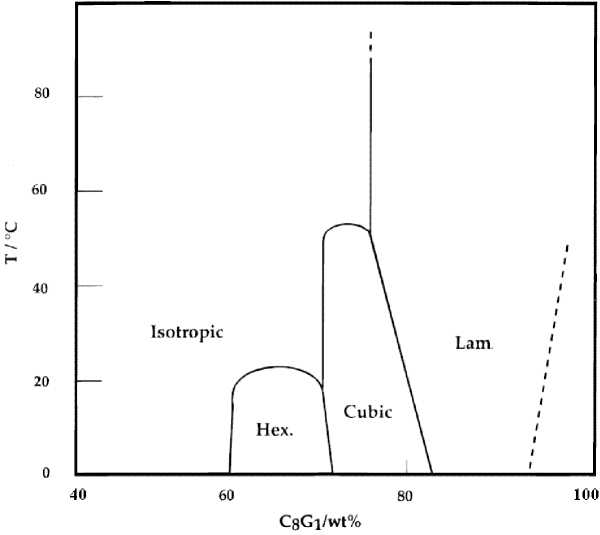
Рис. 7: а – встречная диффузия воды и н-октил-β-D-глюкозида (поляризационная микроскопия; цифры соответствуют температуре, °С). Видны двулучепреломляющие гексагональная (центральная область на фотографиях) и ламеллярная (правая область на фотографиях) фазы, между которыми находится кубическая фаза. Стрелкой показан пузырек воздуха; б – схема диаграммы состояния вода-н-октил-β-D-глюкозид [97] (узкие двухфазные области не показаны): Lam. – ламеллярная фаза, Нex. – гексагональная фаза, Isotropic – изотропная жидкость, Сubic – кубическая фаза. За штриховой линией справа – область равновесия ламеллярной фазы и гидратированных кристаллов
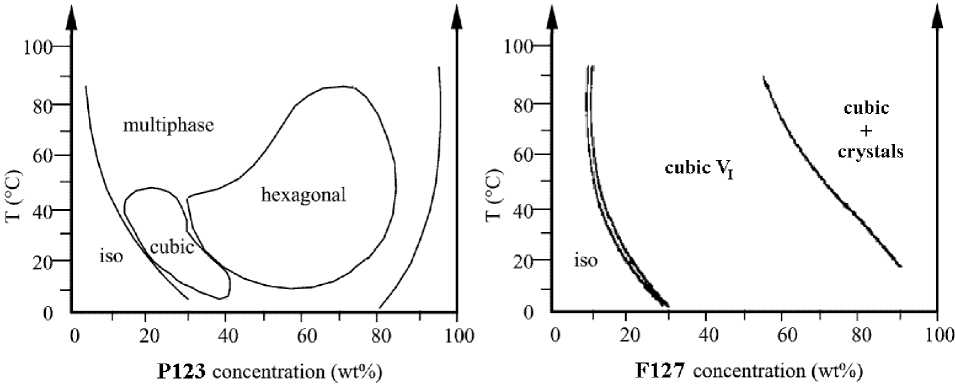
Рис. 6. Схемы диаграмм состояния вода–плюроник Р123 (EO 20 PO 70 EO 20 ) (а) и вода–плюроник F127 (EO 106 PO 70 EO 106 ) (б) [137]
б)
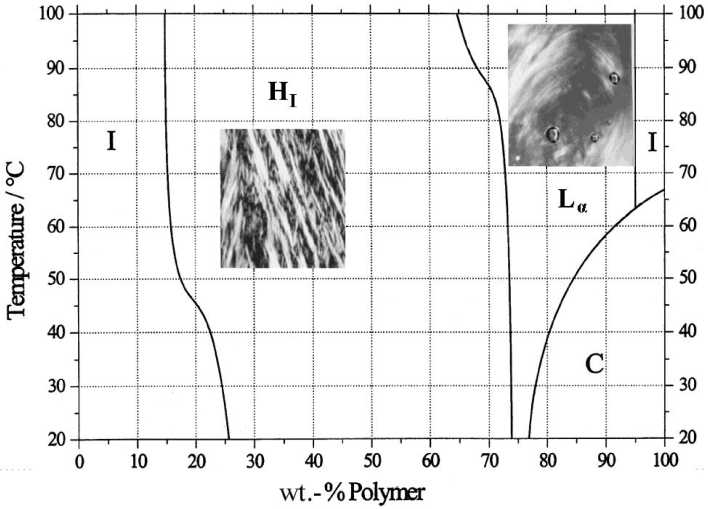
Рис. 8. Схема диаграммы состояния вода–полибутадиен-блок-полиэтиленоксид [46] (узкие двухфазные области не показаны): L α – ламеллярная фаза, Н I – гексагональная фаза, I – изотропная жидкость, С – кристаллическая фаза
а)
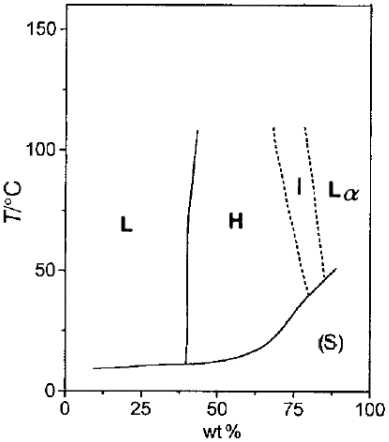
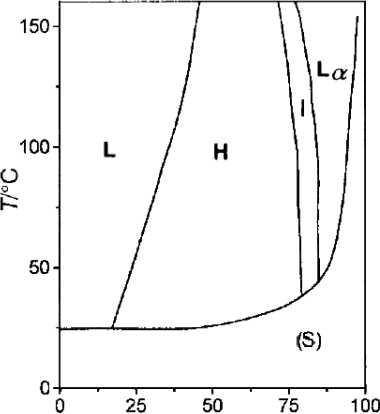
Рис. 9. Схемы диаграмм состояния вода–бромид тетрадецилтриметиламмония (а) и вода–бромид гексадецилтриметиламмония (сокращенно CTAB) (б) [73] (узкие двухфазные области не показаны): Lα – ламеллярная фаза, Н – гексагональная фаза, I – кубическая фаза, L – изотропная жидкость, S – кристаллические фазы
wt%
б)
и изотермических сечений тройных диаграмм [159, 143, 157, 5, 1, 119, 92, 2, 21, 142, 4, 155] (рис. 10–15). В обозначении С 12 Е n символ С 12 означает линейную молекулу спирта С 12 Н 25 ОН, а n означает число звеньев присоединенного к нему этиленоксида (Е) С 2 Н 4 О.
С появлением криогенных держателей для просвечивающих электронных микроскопов начинает развиваться прямое наблюдение структур в замороженных образцах [76, 50, 156]. Быстрое охлаждение жидким азотом позволяет избежать кристаллизации воды и перевести образец в стеклообразное состояние (рис. 16).
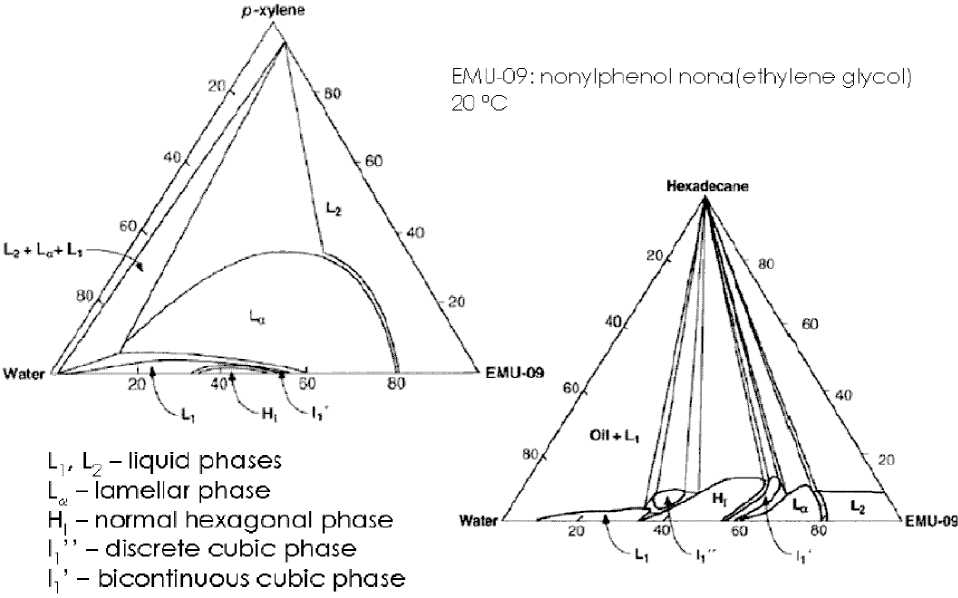
Рис. 10. Изотермические сечения диаграмм состояния вода – параксилол – ЕMU-9 и вода – гексадекан – ЕMU-9 при 20 °С [143]: ЕMU-9 – полиэтиленгликольный (9) эфир нонилфенола, L 1 , L 2 – изотропные жидкости, L α – ламеллярная фаза, Н I – прямая гексагональная фаза, I l " – дискретная кубическая фаза, I l ' – биконтинуальная кубическая фаза
C1SE5
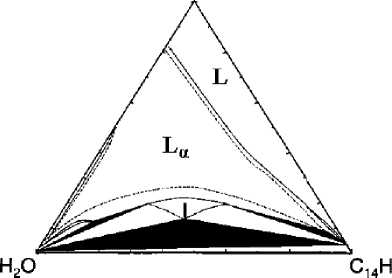
Рис. 11. Изотермическое сечение диаграммы состояния вода – С 12 Е 5 – С 14 Н 30 при 47,5 °С [142]: L – изотропная жидкость, Lα – ламеллярная фаза
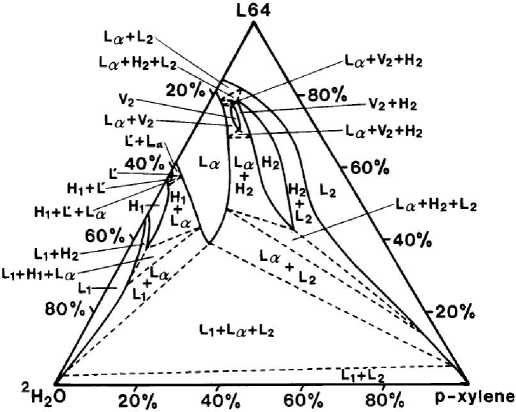
Рис. 12. Изотермическое сечение диаграммы состояния вода–параксилол–L64 при 25 °С [1]: L64 – высокомолекулярное ПАВ – EO 13 PO 30 EO 13 (ЕО и РО – этиленоксид и пропиленоксид), L 1 , L 2 – изотропные жидкости, L' – биконтинуальная жидкость, L α – ламеллярная фаза, Н 1 и Н 2 – прямая и обращенная гексагональные фазы, V 2 – биконтинуальная кубическая фаза (Ia3d, гироидная)
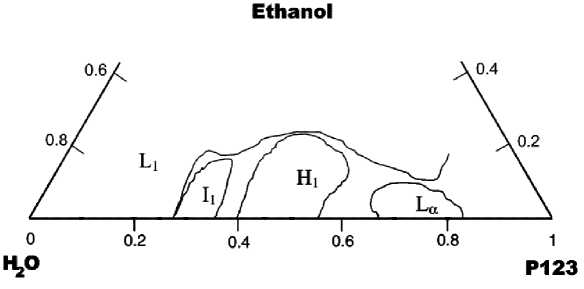
Рис. 13. Схема изотермического сечения диаграммы состояния вода – плюроник Р123 (EO 20 PO 70 EO 20 ) при 23 °С [119]: L 1 – изотропная жидкость, L α – ламеллярная фаза, Н 1 – гексагональная фаза, I 1 – кубическая фаза
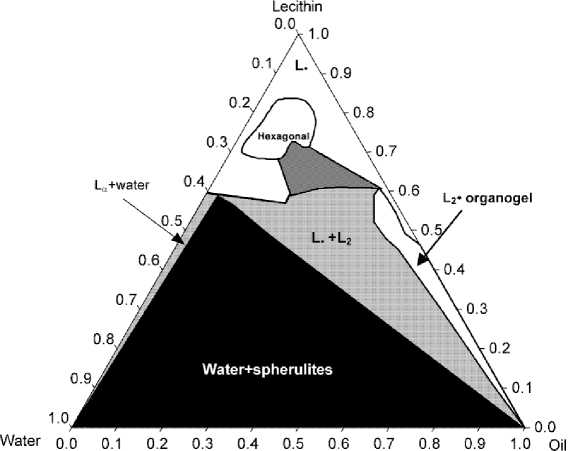
Рис. 14. Схема изотермического сечения диаграммы состояния вода–лецитин– изопропилпальмитат при 25 °С [5] (концентрации приведены в молярных долях)
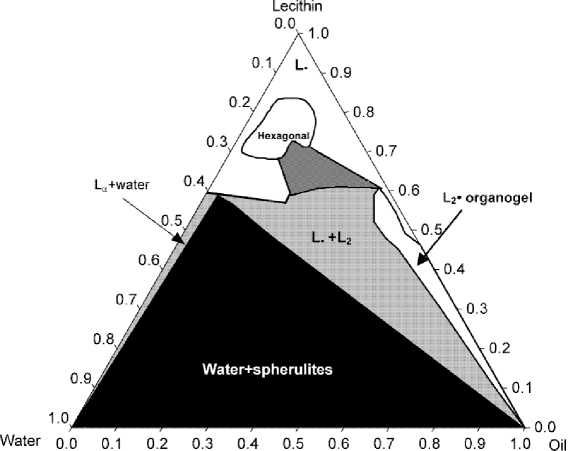
Рис. 15. Схема изотермического сечения диаграммы состояния вода–паракси-лол–P84 при 25 °С [2]: P84 – высокомолекулярное ПАВ – EO 19 PO 44 EO 19 (ЕО и РО – этиленоксид и пропиленоксид), L 1 , L 2 – изотропные жидкости, L α – ламеллярная фаза, Н 1 и Н 2 – прямая и обращенная гексагональные фазы, I 1 и I 2 – прямая и обращенная кубическая фаза (Im3m и Fd3m соответственно), V 1 и V 2 – прямая и обращенная биконтинуальные кубические фазы (обе Ia3d, гироидные)

а)
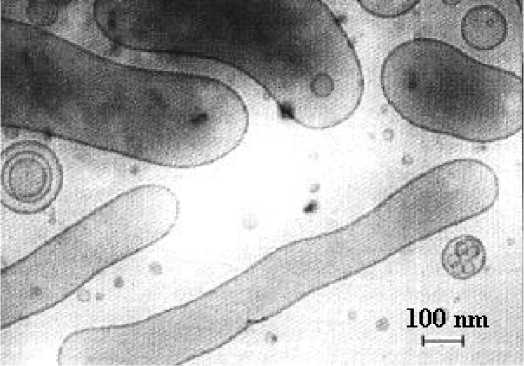
Рис. 16. Мицеллы (а) в быстрозамороженном растворе вода–плюроник F127 (5 мас. %) [76] и капли эмульсии яичного лецитина (б) в воде (1,2 мас. %) [136] (просвечивающая электронная микроскопия при 90К)
б)
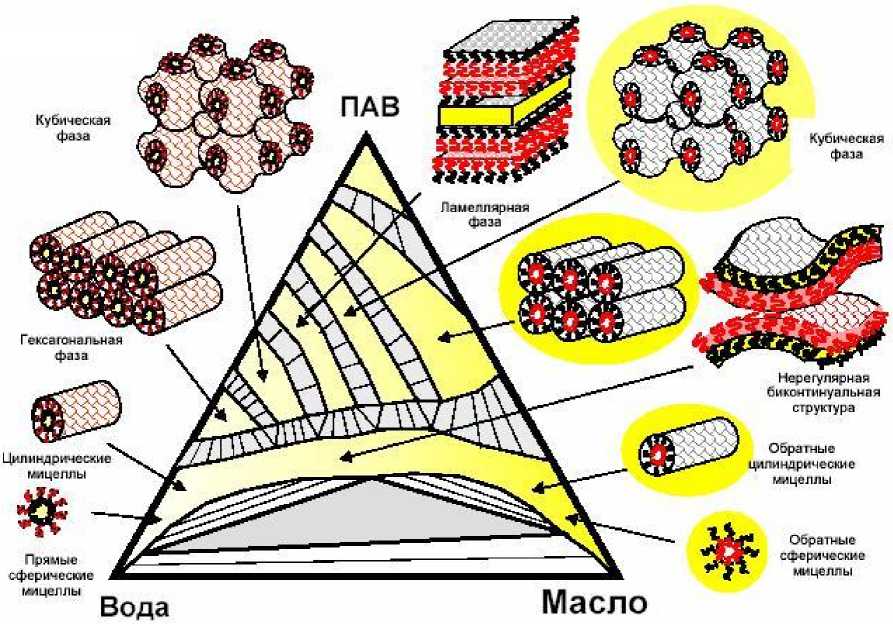
Рис. 17. Схема изотермического сечения системы вода–масло–ПАВ в общем виде [29]
В обобщенном виде рассмотренные выше варианты диаграмм состояния систем вода– масло – ПАВ представлены на рис. 17. Тем не менее следует отметить, что на схеме не обозначены все известные типы жидкокристаллических структур, которых известно более 20 [43].
В синтезе мезопористых матричных материалов наиболее часто используемыми ПАВ являются бромид цетилтриметиламмония C16H33N(CH3)3Br [33], плюроники: Р123 [10], F127 [76, 137, 78], L64 [1], Triton X-114 C8H17C6H4O(C2H4O)8H [47].
Бромид цетилтриметиламмония (CTAB) был исторически первым ПАВ, примененным для матричного синтеза, и остается наиболее употребительным и сейчас. У этого вещества есть шесть важных преимуществ, вытекаю- щих из диаграммы состояния его с водой (см. рис. 9б). Во-первых, жидкокристаллические фазы, им образуемые, устойчивы до температур более 150 °С. Это важно в случае гидротермального синтеза или гидротермальной упрочняющей обработки материалов, полученных при комнатной температуре. Во-вторых, фаза, равновесная с водным раствором, – гексагональная, и мезопористые материалы, получаемые на ее основе, имеют практически важную морфологию с открытой пористостью и высокой механической прочностью. В-третьих, эта фаза – единственная равновесная с водным раствором, что важно при проведении синтеза при нескольких температурах, когда на разных этапах тип структуры не должен изменяться.
В-четвертых, при изменении температуры концентрационные границы области гомогенности гексагональной фазы изменяются незначительно. В-пятых, область гомогенности очень широкая (30–50 % мас.), что косвенно свидетельствует о термодинамической устойчивости гексагональной фазы. И в-шестых, образование этой фазы начинается уже при 20 % мас. СТАВ в воде, что обусловливает его меньший расход и, с другой стороны, обеспечивает обилие воды в межмицеллярном пространстве. В случае матричного синтеза монолитных материалов высокая доля воды в гексагональной фазе позволяет ввести в нее больше реагентов для образования золя, которые смогут образовать более плотный и механически прочный гель.
Исходя из этих критериев, высокоперспективны для матричного синтеза гексагональных материалов и другие длинноцепочечные гомологи СТАВ, кроме них – полибу-тадиен-блок-полиэтиленоксид (см. рис. 9), а также, вероятно, другие аналоги этого блок-сополимера с участием полностью углеводородного блока и блока с высокой гидрофильностью. Блок-сополимеры пропиленоксида и этиленоксида недостаточно изучены, однако некоторая доля гидрофильности пропиленоксидной группы, по-видимому, ответственна за более узкие области гомогенности гексагональных фаз и более высокие концентрации полимера (30–60 % мас.) в воде, необходимые для существования ЖК фаз. В противоположность им полибутадиен-блок-полиэтилен-оксид образует в воде гексагональную фазу уже при его содержании 15–20 % мас., причем область ее существования простирается до
65–75 % мас., а по температуре – от 20 до 100 °С (см. рис. 8).
Блок-сополимеры различного состава имеют больше перспектив для матричного синтеза, чем низкомолекулярные ПАВ, еще и в силу их способности сохранять свою архитектуру в разнообразных растворителях. Жидкокристаллические фазы на основе низкомолекулярных ПАВ при разбавлении, к примеру этанолом, быстро теряют дальний порядок и переходят в изотропную жидкость. Полимерные ПАВ к воздействию неводных растворителей намного более устойчивы. Так, например, ряд успешных синтезов мезопори-стых материалов был проведен на основе неводных растворов [55, 146, 139, 99, 106, 70, 131, 114, 78, 32, 44, 105, 115, 84, 85]. Плюро-ники P123 или F127 растворялись в этаноле, к растворам добавлялся легко гидролизующийся хлорид металла (TiCl 4 , ZrCl 4 , SnCl 4 , TaCl 5 , WCl 6 ), после чего тонкий слой раствора (пленка) гидролизовался и гелировался при взаимодействии с влагой воздуха [146]. При использовании вместо этанола воды гидролиз этих хлоридов происходит настолько быстро и экзотермично, что никакого гомогенного раствора или золя получить не удается [78].
Многие авторы склоняются к тому, что полученные при комнатной температуре гели увеличивают свою механическую прочность и температурную устойчивость при старении в мягких гидротермальных условиях (60–120 °С) [54, 153]. Процессы упрочнения межчастичных контактов в геле при этом схожи с таковыми, происходящими при прокаливании его при 150–200 °С. Вместе с тем гидротермальная обработка при слишком высокой температуре (150–250 °С) или при слишком большой выдержке приводит к превращению аморфного или нанокристаллического мезопористого оксигидратного материала в намного более плотные и крупнокристаллические макропористые оксидные тела с потерей дальнего порядка мезопор [16]. Аналогично и прокаливание при 250–500 °С приводит к подобным результатам. Ввиду очень малых размеров зерен материала и соответственно высокой площади поверхности рекристаллизация их начинается при гораздо более низких температурах, чем крупных порошков.
-
1.3. Эмульсии и микроэмульсии
При рассмотрении возможных равновесных фаз в системах вода–масло–ПАВ нельзя обойти вниманием микроэмульсии. Микро- эмульсии – это многокомпонентные жидкие коллоидные системы (микрогетерогенные жидкости), характеризующиеся термодинамической устойчивостью. Обычно микроэмульсии прозрачны или слабо опалесцируют и образуются самопроизвольно при смешении двух жидкостей с ограниченной взаимной растворимостью (в простейшем случае – воды и углеводорода) в присутствии мицеллообразующих ПАВ. Размер частиц дисперсной фазы (микрокапель) обычно составляет 10–100 нм.
В плоскости треугольника составов (рис. 18) кривая отделяет область I существования однородной (в макроскопическом смысле) микроэмульсии от областей, где система расслаивается.
Однородная фаза может представлять собой либо равномерную смесь (ко-солюбили-зат) всех компонентов (рис. 18а), либо бикон-тинуальную микроэмульсию MI (рис. 18б). Микроэмульсия MI представляет собой на- бухшую мицеллярную систему вода–масло– ПАВ, которая в зависимости от условий (состав, температура, природа компонентов) способна равновесно сосуществовать с растворами I’ и I” (область трехфазного равновесия II).
Мицеллярные системы на основе воды и масла (области I’ и I”) хорошо описываются моделью сферических монодисперсных невзаимодействующих микрокапель, равномерно распределенных в дисперсионной среде, а микроэмульсии MI не описываются сферической моделью. Для них предложено несколько моделей, из которых наибольшее распространение получила модель губчатой структуры с хаотическим распределением микрообластей воды и масла, разделенных тончайшими пленками (бислоями) ПАВ (рис. 19).
Применение микроэмульсий обусловлено их способностью поглощать большие объемы воды и углеводородной жидкости. Микро-
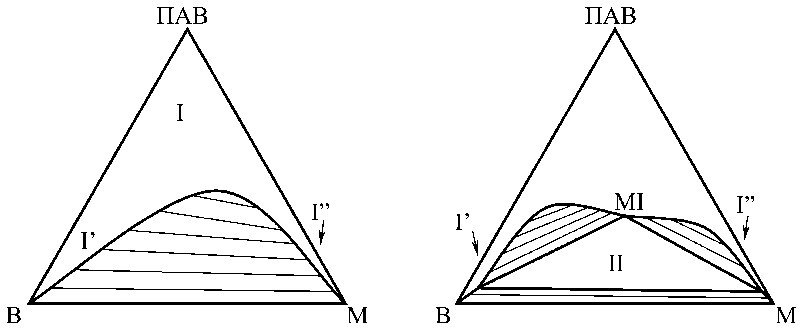
Рис. 18. Схемы изотермических сечений в системах вода–масло–ПАВ: В – вода, М – масло
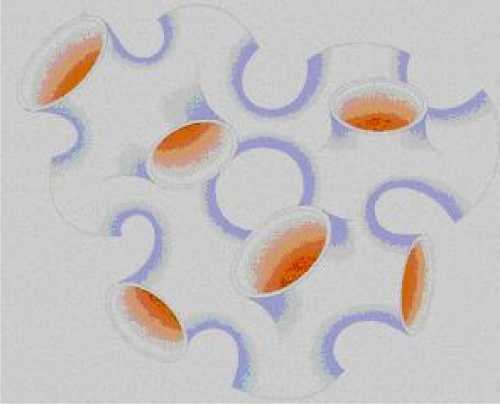
Рис. 19. Биконтинуальная модель микроэмульсии [28]
эмульсии обладают эффективным моющим действием, являются удобной формой для диспергирования лекарственных средств, растворителей, служат средой для проведения химических реакций. Ввиду большой научной и практической значимости тройные (и более сложные) системы типа вода–масло–ПАВ активно изучаются во всем мире экспериментально [157, 34, 13, 100, 160, 53, 112, 21, 40, 104, 30, 17] и теоретически [52, 28] (рис. 19, 21).
В системах, состоящих из двух несмеши-вающихся жидкостей типа вода–масло, ненулевое поверхностное натяжение между двумя жидкостями обуславливает уменьшение энергии системы с уменьшением площади поверхности, их разделяющей. Это приводит к стремлению капель приобрести сферическую форму, а также к их стремлению сливаться. В обоих случаях уменьшается удельная, приходящаяся на единицу массы, площадь границы раздела фаз.
При добавлении третьего, поверхностноактивного компонента, в системе вода– масло обычно увеличивается взаимная растворимость, уменьшается величина поверхностного натяжения. Поверхностное натяжение достигает нуля при концентрации, соответствующей полному взаимному растворению компонентов. При приближении к этой концентрации эмульсия не только не расслаивается, но и наблюдается явление самопроизвольного эмульгирования при контакте жидкостей. В системах с очень низким межфазным натяжением на форму капель эмульсии оказывают ранее не учитываемые слабые пространственные факторы, такие как форма молекул, их ассоциация в предпочтительном направлении, сольватация. Размер капель более не стремится к увеличению, принимая определенный размер (несколько единиц нанометров), а сами капли организуются в фазу микроэмульсии.
-
1.4. Блок-сополимеры
Со структурами лиотропных жидких кристаллов тесным образом связаны структуры блок-сополимеров (рис. 20, 21). Между этими двумя классами веществ сложно провести границу: высокомолекулярные ПАВ (плюро-ники), являясь в водном растворе основой для образования лиотропных жидких кристаллов, сами являются блок-сополимерами. С другой стороны, добавление к блок-сополимерам растворителей в небольших количествах не разрушает их архитектуру, а приводит к набуханию, увеличению объема одного (или обоих) из блоков. В лиотропных жидких кристаллах также в определенных пределах возможно добавлением масла (воды) увеличивать размер (диаметр, толщину) мицелл без изменения типа структуры. В обоих случаях наблюдаются достаточно широкие области гомогенности. Однако при превышении концентрации растворителя в одной из микрофаз (или изменении температуры [27, 109]) происходит образование новой архитектуры блок-сополимера [79, 125, 132, 45, 62, 63, 135, 56], чаще всего в последовательности, соответствующей схеме на рис. 20 (см. также рис. 24). Практически та же последователь-
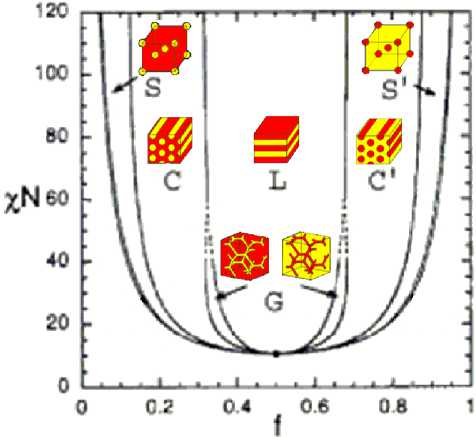
Рис. 20. Обобщенная структурная диаграмма блок-сополимеров [79]
а) б)

в)
Рис. 21. Биконтинуальная двойная алмазная структура (а), биконтинуальная гироидная структура (б), наблюдаемые в блок-сополимерах и жидких кристаллах [161], и гексагональная фаза (в) в полистирол-блок-полиэтилене [88]
ность смены структуры с изменением состава наблюдается и в системах вода–ПАВ (см. рис. 17). На способности лиотропных жидких кристаллов и блок-сополимеров включать в свой состав посторонние низкомолекулярные вещества основаны методы матричного синтеза.
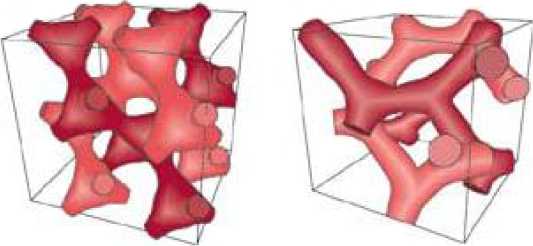
Разнородные блоки в блок-сополимерах стремятся образовать микродомены из звеньев одного сорта, формирующие специфическую надструктуру. На тенденцию к микросепарации влияют многие факторы, прежде всего молекулярная масса блоков, их соотношение и величина сродства друг к другу. Архитектура блоков в различных системах мономеров обнаруживает значительную схожесть (см. рис. 20). На гипотетической диаграмме блок-сополимера, состоящего из звеньев А и В, в координатах f–χN, где f – объемная доля мономера, χ – параметр, характеризующий взаимодействие А и В, N – число звеньев в молекуле, нанесены области существования гомогенного раствора (внизу), а также фаз со сферическими (S, S’), цилиндрическими (C, C’), гироидными блоками (G, G’, рис. 21) и ламеллярной (L) морфологией. Между однофазными областями существуют узкие двухфазные переходные области, на рисунке для простоты опущенные. Размеры составляющих одного блока (диаметр цилиндра или сферы, толщина ламеллы) могут составлять от 5 до 300 нм. Кроме показанных наиболее типичных структур известны и другие, например, кубическая структура, шутливо названная первооткрывателями «кошмар сантехника» (plumber nightmare) [63, 42] (рис. 22). Она состоит из бесконечных взаимно перпендикулярных «труб», идущих вдоль ребер куба и соединяющихся в его вершинах, причем материал состоит из двух таких взаимнопроникающих трехмерных сеток.

Рис. 22. Модель кубической структуры «кошмар сантехника» [63]
Структура «кошмар сантехника» образуется в многокомпонентной системе на основе блок-сополимера полиизопрен-б-полиэтилен-оксид (PI-b-PEO) и низкомолекулярных прекурсоров (INORG) неорганической основы будущего скелета (рис. 23).
Для более сложных блок-сополимеров, например, с тремя блоками А, В и С, могут наблюдаться и другие структуры [123] (рис. 24). Химия полимеров себя далеко не исчерпала и продолжает развиваться [6].
Наиболее широко для получения блок-сополимеров используют анионную или свободнорадикальную полимеризацию [3, 48, 31], например, при синтезе ПС-б-ПИ (полистирол-блок-полиизопрена) [113], ПИ-б-ПЭО (поли- изопрен-блок-полиэтиленоксида) [3], ПБ-б-ПЭО (полибутадиен-блок-полиэтиленоксида) [30], ПГМА-б-ПЭО (полигексилметакрилат-блок-полиэтиленоксида) [87]. Подобные сополимеры с характерной архитектурой используют для синтеза неорганических и гибридных ор-ганическо-неорганических материалов [125, 132, 45, 62, 63, 135, 107].
Наиболее изучены из них мезопористые силикаты. Схема синтеза представлена на рис. 25. Блок-сополимер ПИ-б-ПЭО растворяется в органическом растворителе, смешивается с эпоксидным мономером, содержащим триметоксисилановую группу, после чего растворитель испаряют, а мономер полимеризуют. В зависимости от соотношения ПИ-б-ПЭО и
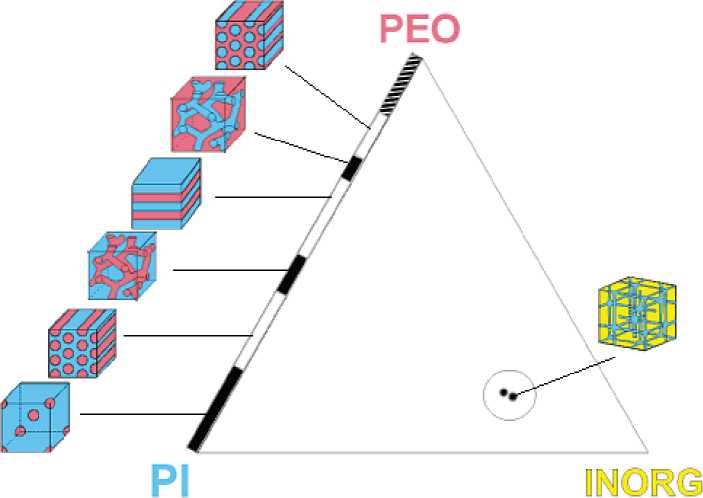
Рис. 23. Схема псевдотройной диаграммы с областью образования структуры «кошмар сантехника»

Рис. 24. Возможные структуры три-блок-сополимеров [123]
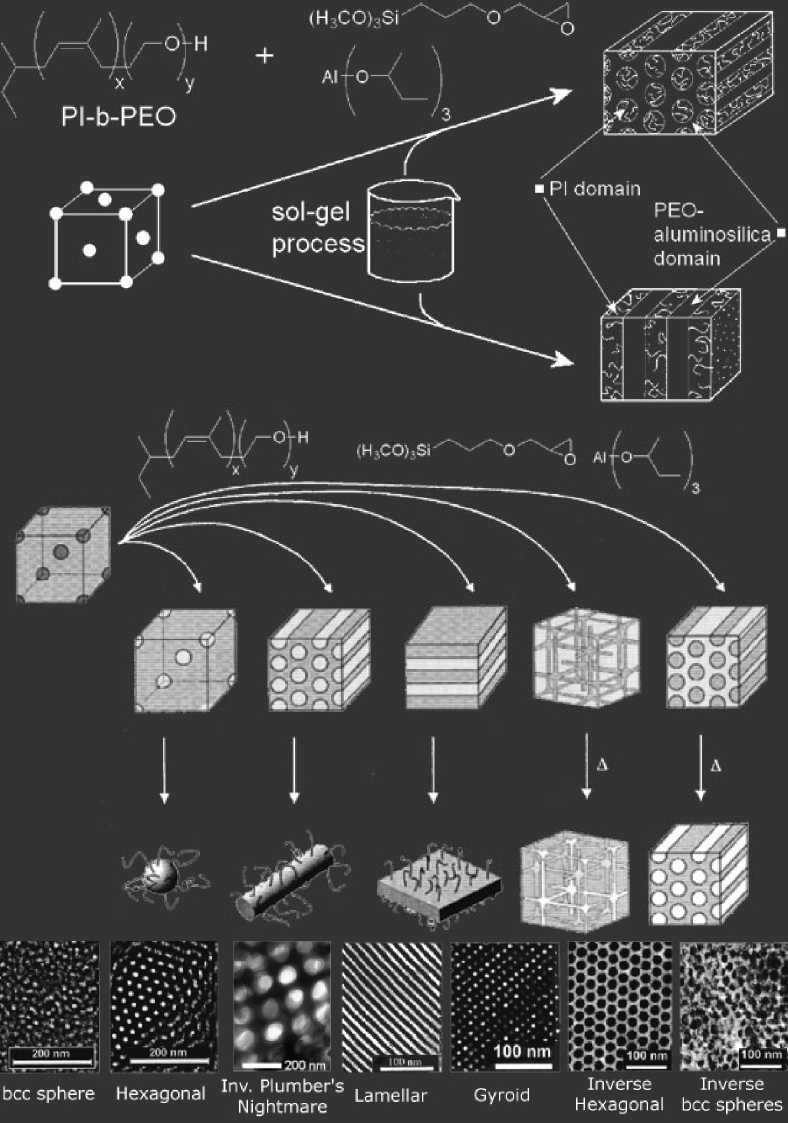
Рис. 25. Схема получения алюмосиликатных мезопористых материалов внутри блоков полиэтиленгликоля блок-сополимера полиизопрена и полиэтиленгликоля [132]
эпоксида можно получить различные структуры. В качестве дополнительного модифицирующего компонента, растворяемого в смеси, можно использовать алкоксиды алюминия. Далее материал гидролизуется во влажном воздухе. Две микрофазы, образующие теперь блок-сополимер, – это почти чистый полиизопрен и полиэтиленоксид с эпоксид- ными олигомерами с силанольными группами, способными к поликонденсации с соседними силанольными группами. Высушенная и гидролизованная пленка блок-сополимера прокаливается на воздухе при медленном нагревании до 300–500 °С для образования силикатного каркаса, наследующего морфологию блок-сополимера. Молекулы алкоксидов алюминия позволяют модифицировать кремниевые звенья и образовывать после прокаливания алюмосиликаты. Удельная площадь поверхности полученного после прокаливания материала составляет 295 м2/г.
Из материалов, перспективных для матричного синтеза, следует отметить полисти-рол-блок-полиэтиленоксид, появление которого на рынке, по мнению экспертов Евросоюза, должно было произойти в 2008 г.
Дальнейшее развитие данного направления может быть связано с получением материалов с высокоориентированной текстурой. Ориентация термотропных жидких кристаллов изучена достаточно подробно (в постоянных электрическом или магнитном поле), однако в изучении лиотропных жидких кристаллов делаются только первые шаги. Так, были предприняты малоуспешные попытки ориентирования механическим продавливанием через капилляр или вращением в зазоре между ротором и статором [41, 94, 86, 11, 102], пропусканием постоянного электрического тока через фазу на основе термотропного ЖК [69, 122]. Однако твердых наноматериалов с выраженной текстурой почти нет. В отличие от термотропных лиотропные жидкие кристаллы позволяют модифицировать свой состав, включая соли, кислоты, щелочи, органические соединения в общем количестве до 70 % мас.
Тем не менее есть положительный опыт текстурирования лиотропных фаз и материалов, получаемых на их основе. При приложении постоянного электрического поля напряженностью 150 В/мм к заключенному в тонкий капилляр (сечением 1×1 мкм) раствору ПАВ–ТЭОС–Н 2 О удалось ориентировать гексагональную фазу и выделяющийся в ней гель SiO2 в материал с величиной разориентировки доменов менее 20° [130].
В другой работе [129] приложением сильного магнитного поля (11,7 Тл) удалось ориентировать гексагональную фазу в аналогичном растворе объемом 3×5×10 мм со степенью совершенства текстуры 78 %. Для ламеллярной фазы в 50 % мас. растворе перфто-роктаноата калия в капилляре диаметром 0,5 мм удалось достичь высокой текстуры в относительно слабом поле 0,4 Тл [66].
Медленное охлаждение изотропного жидкого раствора до температуры существования жидкокристаллической фазы в сильном магнитном поле (1,4 Тл) способствует ориенти- рованию всей массы ЖК вдоль поля [64]. Иногда прибегают к многократному нагреву и охлаждению в пределах 0,5–1 °С выше и ниже температуры плавления ЖК при постоянном воздействии поля. Известен случай, когда такой метод не привел к текстурированию материала, но длительная выдержка (2 месяца) в поле ЯМР-спектрометра привела к ориентации всего объема (несколько миллилитров) гексагональной лиотропной ЖК фазы, даже несмотря на охлаждение на 26 К ниже точки ее плавления [14].
При медленном гидролизе водного раствора силиката натрия и ПАВ в сочетании с интенсивным перемешиванием была продемонстрирована возможность получать вытянутые вдоль оси гексагональной фазы жидкокристаллические «нити» диаметром 200– 300 нм [82].
Введение металлических элементов непосредственно в состав цепи блок-сополимера возможно при использовании специальных мономеров. Так был получен полистирол-блок-полиферроценилэтилметилсилан с цилиндрическими доменами последнего в матрице из полистирола [80].
Еще одним способом получения высокоупорядоченных наноматериалов служит полимеризация в кристаллах. В качестве мономера в составе лиотропной жидкокристаллической фазы могут выступать сами молекулы ПАВ, если они, например, содержат двойную углерод-углеродную связь, способную к полимеризации [110].
-
1.5. Метод матричного синтеза
Лиотропные жидкие кристаллы (и имеющие сходную пространственную архитектуру блок-сополимеры) могут быть использованы как трехмерная матрица, в домены которой возможно вводить дополнительные вещества и проводить с ними химические превращения, приводящие, в частности, к образованию твердых фаз. Твердыми фазами могут быть неорганические вещества, а также полимеры, которые наследуют морфологию исходной матрицы (жидкого кристалла, блок-сополимера или микроэмульсии). Вследствие этого метод создания таких материалов называется матричным (или темплетным) синтезом.
Одним из первых мезопористых (нанопо-ристых) матричных материалов, созданных и многосторонне изучаемых в настоящее время, стал MCM-41 [76, 13]. Полученный силикагель был прокален для удаления воды и ПАВ.
Важным оказалось то, что материал унаследовал морфологию раствора (точнее, лиотропного жидкого кристалла), в котором он был получен. Диаметром пор можно управлять (от 1,5 до 10 нм), изменяя состав исходного раствора [13]. Эти размеры обусловливают высокую удельную площадь поверхности материала (400–1200 м2/г).
В дальнейшем работы по матричному синтезу [75] привели к созданию подобных наноматериалов на основе оксидов и гидроксидов Si [82], Al [146, 26, 117, 47, 10, 147, 78, 105, 115], Ti [146, 57, 106, 148, 71, 44, 103, 128], Zr [55, 98, 146, 24, 67, 99, 57, 120, 128, 58, 84, 85], Hf [146], Nb [7, 146], Ta [8, 146], Mn [127], W [146], Sn [146], Ce [67] и смешанных материалов с матрицей из SiO 2 , на которую нанесено некоторое количество оксида другого металла: Al [83], V [38], Cr [116], Fe [77], Zr [32, 51], Zr, Mo и Ni [51], либо металлические частицы катализаторов: Ag [138], Pt или Pd [81, 90].
Сообщалось также о матричном синтезе совместным осаждением алюмосиликатных [151], алюмотитанатных [131, 134], алюмо-цирконатных [72], цирконосиликатных [124], титаносиликатных [152], титаноцирконатных [71], церийцирконатных [126, 67], титанфосфатных материалов [15].
Полученный матричным синтезом мезо-пористый Al 2 O 3 успешно модифицировали нанесением Cu 2 O [133], оксидов V [25], наночастиц Au [147], Pt [22], введением NiO [70]. На мезопористый ZrO 2 также наносили наночастицы Au [57, 58], Pd [128, 67], вводили Na 2 O [84], MnO 2 [24], V 2 O 5 [57], WO 3 /Fe 2 O 3 /Pt
[111], H 2 SO 4 [55, 108]. На TiO 2 наносили Au и V 2 O 5 [57], Pd [128].
Поверхность МСМ-41 можно модифицировать не только неорганическими, но и прививаемыми к ней органическими группами. Так, с помощью обработки триметилхлорси-ланом поверхность покрывается Si(CH 3 ) 3 -группами, что придает ей гидрофобность [149]. Обзор мезопористых материалов дан в работах [81, 90], материалов на основе Al 2 O 3 – в работе [22].
Остроумие проявили исследователи [9], применив матричный синтез на основе гомогенной гексагональной фазы для получения мезопористой платины. Создав в ЖК фазе высокую концентрацию H 2 PtCl 4 , они провели ее электрохимическое восстановление на золотом катоде. Полученная пленка платиновой губки толщиной 300 нм сохранила структуру жидкого кристалла, в котором она росла, с порами диаметром 2,5 ± 0,15 нм и толщиной стенок 2,5 ± 0,2 нм (рис. 26). Температура электроосаждения составляла 25 °C, а раствор содержал 42 мас. % C 16 E 8 , 29 мас. % воды и 29 мас. % H 2 PtCl 6 .
В свою очередь, можно сделать вывод, что гальваническое осаждение благородных металлов может служить новым методом для подтверждения структурных характеристик жидкокристаллических фаз, в которых они были получены. Альтернативой платине может быть предложено более дешевое серебро, восстановленное из нитрата, хорошо растворимого в воде и многих органических жидкостях. Еще более дешевой альтернативой может оказаться электрохимическое травление

а)
б)
Рис. 26. Платиновая губка (просвечивающая электронная микроскопия): а – вид вдоль каналов, б – вид поперек каналов
полированной поверхности анода, например, из никеля, меди, серебра или нержавеющей стали в лиотропном жидком кристалле, содержащем поваренную соль. Во всех случаях после отмывки катода (или анода) дистиллированной водой возможно изучить расположение и размеры гальванически нанесенных выступов (или ямок травления) с помощью сканирующего электронного или туннельного микроскопа.
Помимо перечисленных применений ме-зопористые темплетные материалы исследуются для применения в качестве мембран [150], сенсоров влажности [60, 12], диэлектрических покрытий для электрических и оптических микросхем [61, 74].
Известные матричные способы получения нанопористых оксидных материалов можно разделить по условиям приготовления и по типу исходных реагентов. Первые материалы типа МСМ-41 были получены специалистами по цеолитам в автоклавах при температурах до 150 °С. Многие последователи также прибегают к высоким температурам и давлениям. Однако поскольку силикагель образуется и при более низкой температуре, множество работ выполнено с использованием стандартной стеклянной посуды при комнатных температурах. Более того, при рассмотрении диаграмм состояния вода –ПАВ очевидно, что многие жидкокристаллические фазы переходят в изотропную жидкость при температуре выше 100 °С. Напротив, наибольшее число различных ЖК фаз образуется при низких температурах.
По форме образцов можно выделить работы с монолитными материалами, гелирую-щими в сосуде (пробирке, стакане, колбе, кювете), и на образцы, подготовленные для специфических физических измерений. В большинстве случаев это пленки и покрытия, получаемые окунанием стеклянной пластинки в золь.
Чтобы освободить поры полученного материала, ПАВ после окончания матричного синтеза удаляют выжиганием или выжиганием после отмывки. Во втором случае качество материала получается выше, в первую очередь по величине удельной поверхности, однородности пор по размеру, наличию дальнего порядка в расположении пор, т. е. по меньшему разрушению структуры. Действительно, известно, что при сушке гелей большие капиллярные силы, действующие на стенки пор, вызывают сжатие и коллапс исходных агрегатов дисперсной фазы и значительное уменьшение кажущегося объема геля (иногда в десятки раз). Для уменьшения разрушений воду (поверхностное натяжение 72,0 мН/м при 25 °С), присутствующую в порах, замещают промывкой на жидкость с меньшим поверхностным натяжением, например, этанол (22,0 мН/м) или ацетон (22,7 мН/м) [ХЭ]. Еще более кардинальное решение заключается в применении сверхкритической сушки геля.
Для удаления ПАВ из геля обычно применяют длительное промывание этанолом (несколько суток) в экстракторе Сокслета с обратным холодильником. Тем не менее значительная часть ПАВ (веществ, известных хорошей сорбируемостью) не удаляется полностью из гелей (веществ, известных как хорошие сорбенты). Поэтому остающиеся количества ПАВ окисляют до воды и СО2 при нагревании на воздухе до 350–500 °С, иногда в течение нескольких суток. Для более эффективного удаления органических веществ из неорганических гелей при сравнительно низких температурах 150–250 °С иногда применяют их обработку в атмосфере, содержащей озон.
По типу исходных веществ – прекурсоров твердой фазы – синтез можно разделить на проводимый из солей и из алкоксидов. В первом случае источником золя является соль соответствующего элемента (например, силикат натрия, алюминат натрия, сульфат алюминия, хлорид цирконила, нитрат марганца). При реакции с осадителем (кислотой, щелочью, раствором аммиака) выделяются необходимые оксид, гидроксид или оксигидрат, а в качестве побочного продукта – соль натрия или аммония. При последующей очистке и удалении этой соли могут возникать дополнительные сложности. Например, при промывке водой гель может пептизироваться, кроме того, многократная промывка потребует много времени, а конечная чистота все равно может оказаться недостаточной и негативно повлиять на свойства материала. В силу этих причин во многих случаях авторы стремятся использовать более дорогие соединения, как, например, тетраэтилортосиликат Si(OEt) 4 – ТЭОС [37, 60, 23, 150, 152, 151, 12, 141 95, 154, 116, 73], тетраметилортосиликат Si(OМе) 4 [73, 39, 33, 35, 145], Si(OBut) 4 [74], тетрабутоксититан Ti(OBut) 4 – ТБТ [148, 44,
103], Ti(OiPr) 4 [15, 106, 57, 131, 134, 114, 71], Ti(OEt) 4 [128], триизопропилалюминат Al(OiPr) 3 [72, 147, 83], Al(Osec-But) 3 [47, 25, 70, 131, 134, 78, 105, 115], пентаэтилтанталат [8], Zr(OPr) 4 [55, 72, 98, 99, 57, 58, 128, 51, 84, 85], Zr(OBut) 4 [71]. Продуктами гидролиза данных эфиров являются соответствующие спирты, легко удаляемые из материала при сушке. Определенным ограничением для использования данных веществ служит слишком высокая скорость реакции их с водой, приводящая к разогреву раствора (вплоть до кипения), а также к выпадению требуемых гелей слишком быстро (за доли секунды), так что относительно медленно образующаяся мицеллярная высокоупорядоченная матрица не успевает сформировать в материале дальний порядок. Понизить скорость гидролиза в ряде случаев удается разбавлением раствора нейтральным растворителем (обычно этанолом), однако это снижает устойчивость мицеллярной (ЖК) структуры вплоть до образования изотропного раствора. Иногда альтернативой может служить замена алкоголятов с короткими алкильными радикалами (метильными, этильными) на более устойчивые бутильные, трет-бутильные, фенильные. Однако единого решения для всех материалов нет и в каждом случае необходимы индивидуальные исследования. Иногда возможно применение уникальных для каждого элемента растворимых в воде исходных соединений, например, (NH 4 ) 2 [Zr(CO 3 ) 3 ] для синтеза мезопористого ZrO 2 [124].
Альтернативой алкоголятам могут быть легко гидролизующиеся до гидроксида под действием воды хлориды металлов (TiCl4, ZrCl4, SnCl4, TaCl5, WCl6 и др.) с проведением синтеза в неводных растворах, например, этанольных [146]. Однако в неводных растворителях многие низкомолекулярные ПАВ чаще всего образуют изотропные растворы без образования ЖК фаз. Поэтому в таких случаях используют высокомолекулярные ПАВ.
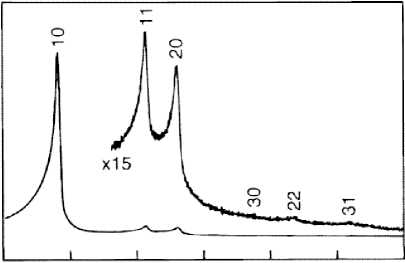
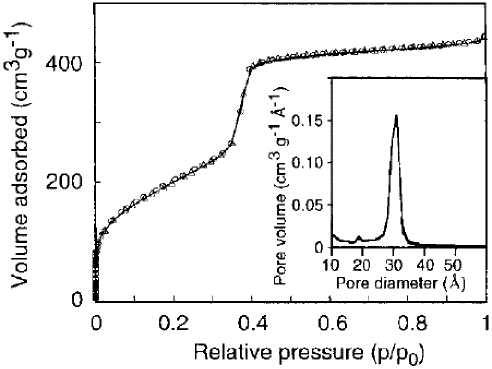
Применение вместо ТЭОС 1,2-бис(триме-токсисилил)этана [59, 89] и 1,4-бис(триэто-ксисилил)бензола [68] позволило авторам создать материал, включающий в структуру кремнийкислородного скелета прочно химически связанные с ним группы –CH 2 –CH 2 – или бензольное (пара-фениленовое) кольцо –С 6 Н 4 –. Такой материал окисляется до SiO 2 только выше 400 °С [68]. При использовании вместо ТЭОС 3-аминопропилтриэтоксисилана также может быть получен материал с привитой аминоалкильной группой [154]. Эти работы расширили класс гибридных (органическо-неорганических) материалов. Медленное проведение синтеза (более 20 ч) позволило авторам работы [59] получить высокоупорядоченный материал с четкими картинами электронной микроскопии, рентгеновской и электронной дифракции (рис. 27, 28), с характерной ступенью на кривой адсорбции, соответствующей конденсационному заполнению пор одинакового диаметра (см. рис. 28).
Морфология получаемых матричным синтезом материалов характеризуется зернами размером от 1 мкм до поликристалличе-ских монолитов 10–50 мм. Анализ составов реакционных смесей показывает, что зернистые образцы были получены в растворах с

а)
Рис. 27. Изображения материала типа МСМ-41, полученные с помощью просвечивающей (а) и растровой (б) электронной микроскопии. На врезке – данные электронной дифракции [59]

б)
1 2 3 4 5 6 7
26 (degrees) а)
б)
Рис. 28. Рентгеновская дифрактограмма материала типа МСМ-41 [59] (а) и изотерма адсорбции азота на нем при температуре кипения азота (б). На врезке – рассчитанная кривая распределения пор по размеру
низким содержанием ПАВ (1–5 м ас . %) [ 59 ] , тогда к а к мон о ли тн ые мате ри а лы п о лу че н ы в растворах с 10– 7 5 ма с . % ПАВ [ 39] . При с рав н ени и с соответс тву ющ и ми фа зов ыми д иаграммами вода – ПАВ о че в и д н о, что п ервая г руп п а ма те ри а л ов п олу че н а в д ву хфа зн ой о б ла с ти ( и зотроп ный ра ств ор + жи д к и е к ри ста ллы ) , п ри че м п ри ма лом с од е р жа н и и ЖК ф а зы и ча с то п ри н е прерыв н ом п е рем е ш и в ании, а вторая – в обла с ти, б ли зк ой к од нофаз н ой , и бе з пе ре меш и в а н ия в п ери од гелирова- н и я. Отча с ти п ри ме н е н и е п е рем еш и ван ия и н али чи е о д н оф а зног о л и отроп н ого жи дк ог о криста лл а в за и моиск л ю ч а ю т д ру г дру га , по ск оль к у в яз к ость б о льши н с тв а ЖК фа з на стольк о в ысок а , что п р и ме н е н и е меш а л ок, н апри ме р м агн итны х, не в оз мож но. Вы падение геля в ме ж м и ц е л лярном простра н с тв е е ще больше повышает вязкость.
Другая п ричи н а приме нени я раз ба в ле н н ы х рас тв оров за клю ч а етс я в том, что ме з о- п ори с ты е ма те риа лы ча ще в с е го п ре д н а зн а ч е н ы д ля и с п ыта н и я в к аче с тв е а д с о рб е н тов, ка та ли за то ров и н ос и те ле й к а т а ли за торов. Для этого предпочтительна м елк озе рн и с т ая (размер зерен 1–50 мк м ), а не мон оли тн ая ф орм а п род у к та , обе с пе чи в а ю щ а я н а ли чие круп н ых по р и б ол е е бы с трый д о с ту п жи д ко сте й и га зов ме ж ду зе рн ам и . Б ол ее того, по л у ча е ма я отн ос и те льн о в ыс ок а я мон о д и с п ерс н ос ть оса д ков п озволяе т отк а за тьс я о т о п ера ц и й раз мол а и рас с ев а п о фрак ц и ям.
Подавляющее большинство работ по матричному синтезу представляют собой попытки на основании литературных данных о со- ставах реакционных смесей и условиях синтеза получить один-два образца при каких-либо модификацированных условиях. Лишь небольшая часть работ посвящена физикохимическому исследованию зависимостей «состав исходного раствора – свойство продукта» на ряде из более чем 4 составов. И совсем немногие авторы [9, 26, 145, 17] пытаются связать результаты синтеза наноматериалов с диаграммами состояния вода –ПАВ и вода – масло– ПАВ, используемых в синтезе. Отчасти это вызвано тем, что таких диаграмм состояния построено еще очень мало.
Для образования твердых нанообъектов в растворе необходима малая растворимость введенного компонента. Высокая растворимость быстро приводит к рекристаллизации в более крупные частицы. Малая растворимость не обязательно должна быть таковой изначально. Так, при введении в воду Si(OH)4 (например, пропусканием 1%-ного раствора Na2SiO3 через катионообменную колонку в Н-форме) вначале образуется идеальный раствор Si(OH)4, в котором вскоре начинается полимеризация мономерных звеньев с образованием все более крупных молекул, имеющих все меньшую растворимость в воде и образующих глобулы золя кремниевой кислоты. Аналогично растворимость фенола и формальдегида в воде достаточно высока, однако по мере образования олигомеров и полимеров фенолоформальдегидных смол, имеющих все меньше и меньше гидрофильных групп (–OH и –CHO) на единицу массы, их растворимость в воде быстро падает, что вызывает образова- ние эмульсии. Эмульсионная полимеризация широко используется в производстве полимеров, например, поливинилацетата, водоэмульсионных красок и латексов. Во всех перечисленных случаях образование эмульсии начинается со стадии образования гомогенного раствора мономера в воде.
Наночастицами в растворах могут быть не только органические и неорганические полимеры, но и частицы любых других элементов и соединений: металлов (например, коллоидные растворы золота, серебра, платины), неметаллов (сера, получаемая кислым гидролизом тиосульфатов), солей (галогениды серебра, халькогениды кадмия), оксидов и гидроксидов. Общим критерием для синтеза наночастиц может служить величина их растворимости. Чем она меньше, тем более мелкие частицы можно получить. Как в случаях рав- новесных, так и неравновесных реакций, необходимы высокая степень пересыщения, обусловливающая высокую плотность образующихся зародышей, и малая скорость их роста, вызванная, например, низкой скоростью диффузии (высокой вязкостью среды). Обоими факторами можно управлять в широких пределах, изменяя концентрации реагентов, температуру и вязкость.
Заключение
Из обзора литературы следует высокий потенциал методов матричного синтеза нано-пористых материалов с управляемой упорядоченной структурой при использовании ПАВ и блок-сополимеров. Данное направление находится в начале развития и претерпевает подъем интереса со стороны как органической, так и неорганической химии.
Список литературы Синтез наноматериалов с использованием пав
- P. Alexandridis, U. Olsson, B. Lindman. Self-Assembly of Amphiphilic Block Copolymers: The (E0)13(P0)30(E0)13-Water-p-Xylene System // Macromolecules (1995), 28, 7700-7710. DOI: 10.1021/ma00127a016
- P. Alexandridis, U. Olsson, B. Lindman. A Record Nine Different Phases (Four Cubic, Two Hexagonal, and One Lamellar Lyotropic Liquid Crystalline and Two Micellar Solutions) in a Ternary Isothermal System of an Amphiphilic Block Copolymer and Selective Solvents (Water and Oil) // Langmuir. 14. (1998) 2627-2638. DOI: 10.1021/la971117c
- Allgaier J., Poppe A., Willner L., Richter D. Synthesis and Characterization of Poly[1,4-isoprene-b-(ethylene oxide)] and Poly[ethylene-co-propylene-b-(ethylene oxide)] Block Copolymers // Macromolecules. 30. (1997) 1582. DOI: 10.1021/ma961311q
- I. Amar-Yuli, N. Garti. Transitions induced by solubilized fat into reverse hexagonal mesophases // Colloids and Surfaces B: Biointerfaces. 43. (2005) 72-82. DOI: 10.1016/j.colsurfb.2005.03.011
- R. Angelico, A. Ceglie, G. Colafemmina, F. Lopez, S. Murgia, U. Olsson, G. Palazzo. Biocompatible Lecithin Organogels: Structure and Phase Equilibria // Langmuir. 21. (2005) 140-148. DOI: 10.1021/la047974f


