Синтез новых диарилацетамидных производных 2-тиоурацила в качестве потенциальных антивирусных агентов
Автор: Лысенко К.Н., Гейсман А.Н., Озеров А.А., Новиков М.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 4 (52), 2016 года.
Бесплатный доступ
Конденсацией N-диарилзамещенных 2-хлорацетанилидов с производными 2-тиоурацила были получены новые аналоги 2-S-замещенных 2-сульфанилпиримидинонов. Изучены физико-химические и спектральные свойства полученных веществ. Данные соединения рассматриваются в качестве ингибиторов вирусной репродукции.
Синтез, 2-тиоурацил, противовирусные агенты
Короткий адрес: https://sciup.org/142149200
IDR: 142149200 | УДК: 615.3:547.854.4
Текст научной статьи Синтез новых диарилацетамидных производных 2-тиоурацила в качестве потенциальных антивирусных агентов
Заболевания вирусной этиологии представляют глобальную проблему здравоохранения в связи с крайне высокой скоростью репродукции вирусных частиц и быстрым возникновением резистентности вирусов [3]. В связи с этим разработка новых антивирусных агентов является актуальной задачей медицины и фармации.
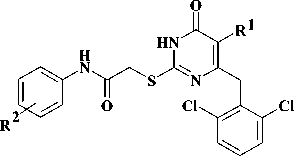
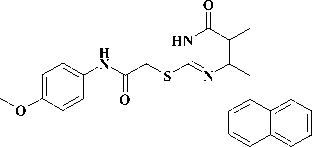
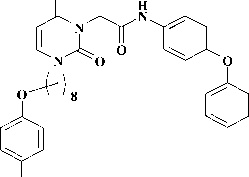
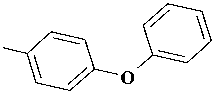
Производные 2-тиоксо-2,3-дигидропирими-дин-4(1H)-она (2-тиоурацила), содержащие у атома серы арилацетамидный фрагмент, зарекомендовали себя как эффективные мультитар-гетные противовирусные агенты, активные в отношении ВИЧ-1 (1) [6, 10, 12], вируса гриппа (2) [11]. С другой стороны, известно, что соединения, включающие N-(4-феноксифенил) ацетамидный фрагмент, описаны в литературе как ингибиторы РНК-содержащих вирусов семейства Flaviviridae, таких, как вирусы гепатита С (3) [7], а также лихорадки Денге и лихорадки Западного Нила (4) [9].
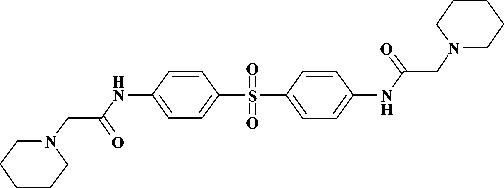
Недавно была описана серия бис-N-ацетамидных производных диарилсульфона ( 5 ), обладающих высокой активностью в отношении протеазы аденовируса [8]. В связи с этим модификация арилацетамидного фрагмента может являться отправной точкой для создания поливалентных противовирусных соединений.
Ранее нами был описан ряд производных 6-замещенного 2-тиоурацила, содержащих у атома серы N-(4-феноксифенил)ацетамидный фрагмент [1]. В настоящей работе нами описаны и синтезированы соединения, являющиеся результатом модификации мостика между арильными циклами, а также содержащие различные заместители в положении 6 гетероциклического ядра.
* Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 15-44-02651 р_поволжье_а.
O
Br
O
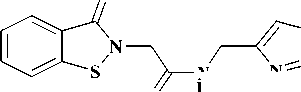
O
H N
N OH
ЦЕЛЬ РАБОТЫ
Структурная
модификация диарилацета-
капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
мидных производных тиоурацила, заключающаяся в изменении характера мостикового фрагмента между ароматическими циклами, а также модификация положения 6 гетероциклического фрагмента для расширения ряда потенциальных антивирусных агентов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н- и 13С-регистрировали на спектрометре Bruker Avance-400 (400 для 1Н- и 100 МГц для 13С) в ДМСО- d 6 , внутренний стандарт ТМС.
Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах Merck TLC Sili-cagel 60 F254 (Германия), проявление в УФ-свете с помощью УФ-лампы VL-6.LC (Франция). Температуры плавления измеряли в стеклянных
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
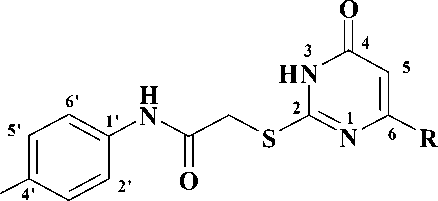
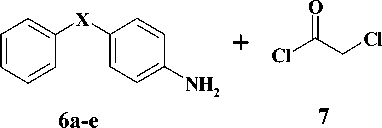
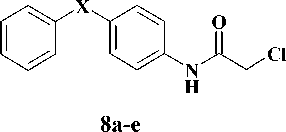
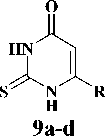
На первом этапе взаимодействием соответствующих анилинов, содержащих в качестве мостика между ароматическими циклами ( X ) атом кислорода ( 6a ), карбонильную ( 6b ), окси-метильную ( 6c ) и метиленовую группы ( 6d ), а также 2-аминобифенила ( 6e ), с 2-хлорацетил-хлоридом ( 7 ) в среде безводного дихлорэтана в присутствии калия карбоната были получены соответствующие хлорацетанилиды [2, 5]. Полученные анилиды ( 8a-e) на второй стадии синтеза конденсировали с производными 2-тиоурацила ( 9a-d ) в среде безводного N,N-диметилфор-мамида и калия карбоната в качестве основания [4]. Выходы целевых соединений ( 10a-g ) составили 55–83 %. Выходы и физико-химические характеристики синтезированных веществ представлены в таблице.
3''
5''
4''
2''
Свойства синтезированных соединений
3'
|
Соед. |
X |
R |
R f * |
Tпл |
Выход, % |
|
10a |
O |
H |
0,57 |
209,5-211,5 |
79 |
|
10b |
O |
Et |
0,68 |
220-221 |
83 |
|
10c |
O |
i-Pr |
0,75 |
211-212 |
82 |
|
10d |
Связь |
Me |
0,70 |
267-268,5 |
75 |
|
10e |
C=O |
Me |
0,49 |
209-210 |
55 |
|
10f |
CH 2 O |
Me |
0,54 |
246-247 |
72 |
|
10g |
СН 2 |
Me |
0,59 |
220-222 |
79 |
* – этилацетат: метанол 10:1
K2CO3
DCE
K2CO3 DMF
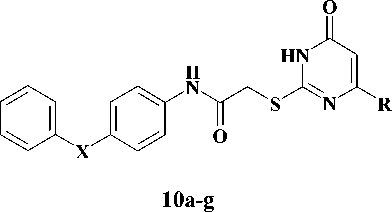
X = O, C=O, OCH2, CH2, связь; R = H, Me, Et, i-Pr
Схема синтеза S-диарилацетамидных производных 2-тиоурацила
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-[(6-Оксо-1,6-дигидропиримидин-2-ил) сульфанил]-N-(4-феноксифенил)ацетамид (10a). К раствору 1,00 г (7,80 ммоль) 2-тиоу-рацила ( 9a ) в 15 мл безводного N,N-диметил-формамида добавляли 1,30 г (9,40 ммоль) карбоната калия.
Смесь перемешивали 1 час при 75 ºС, охлаждали до комнатной температуры и добавляли 2,14 г (8,20 ммоль) 2-хлор-N-(4-фе-ноксифенил)ацетамида ( 8a ).
Полученную смесь перемешивали в течении 16 часов, фильтровали, фильтрат упаривали при пониженном давлении, к остатку добавляли 50 мл воды и 5 мл ледяной уксусной кислоты.
Выпавший осадок отфильтровали, сушили на воздухе и перекристаллизовывали из смеси N,N-диме-тилфор-мамид: изопропанол. Получили 2,18 г (выход 79 %) соединения ( 10a ) в виде белого мелкокристаллического вещества. Тпл = 209,5–211,5 ºC. R f = 0,57. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 4,11 с (2H, CH 2 ), 6,14 д (1H, J = 6,50, H-5), 6,95–7,01 м (4H, H-3′, H-5′, H-2’’, H-6’’), 7,09 т (1H, J = 7,31, H-4’’), 7,33– 7,37 м (2H, H-3’’, H-5’’); 7,59 д (2H, J = 9,06, H-2’, H-6’); 7,87 д (1H, J = 6,50, H-6), 10,27 с (1H, CO-NH); 12,73 уш. с (1H, NH).
Соединения 10b-g были получены аналогично из соответствующих N-диарилзаме-щенных 2-хлорацетанилидов 8a-e и тиоурацилов 9b-d.
2-[(4-Этил-6-оксо-1,6-дигидропиримидин-2-ил)сульфанил]-N-(4-феноксифенил)ацета-мид (10b). Тпл = 220–221 ºC. R f = 0,68. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 1,06 т (3H, J = 7,55, CH 3 ); 2,40 квартет (2H, J = 7,47, CH 2 ); 4,06 с (2H, CH 2 CO); 5,96 с (1H, H-5); 6,94– 7,00 м (4H, H-3’, H-5’, H-2’’, H-6’’); 7,09 т (1H, J = 7,39, H-4’’); 7,35 т (2H, J = 7,95, H-3’’, H-5’’); 7,58 д (2H, J = 8,90, H-2’, H-6’); 10,24 с (1H, CO-NH); 12,51 уш. с (1H, NH).
2-{[4-(1-метилэтил)-6-оксо-1,6-дигидро пиримидин-2-ил]сульфанил}-N-(4-фенокси-фенил)ацетамид (10c). Тпл = 211–212 ºC. R f = 0,75. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 1,06 c (3H, CH 3 ); 1,08 c (3H, CH 3 ); 2,61 септет (1H, J = 6,81, CH); 4,05 с (2H, CH 2 CO); 5,93 с (1H, H-5); 6,93-6,99 м (4H, H-3’, H-5’, H-2’’, H-6’’); 7,08 т (1H, J = 7,39, H-4’’); 7,35 т (2H, J = 7,95, H-3’’, H-5’’); 7,59 д (2H, J = 8,90, H-2’, H-6’); 10,23 с (1H, CO-NH); 12,49 уш. с (1H, NH).
2-[(4-Метил-6-оксо-1,6-дигидропирими-дин-2-ил)сульфанил] -N -(4-фенилфенил)-аце-тамид (10d). Тпл = 267–268,5 ºC. R f = 0,70. 1Н
ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 2,15 с (3H, CH 3 ); 4,09 с (2H, CH 2 CO), 6,00 c (1H, H-5); 7,30-7,34 м (1H, H-4’’); 7,44 т (2H, J = 7,63, H-3’’, H-5’’); 7,62–7,68 м (6 H, H-2’, H-3’, H-5’, H-6’, H-2’’, H-6’’); 10,34 с (1H, CO-NH); 12,52 уш. с (1H, NH).
2-[(4-Метил-6-оксо-1,6-дигидропирими-дин-2-ил)сульфанил]- N -([4-бензоилфенил) ацетамид (10e). Тпл = 209–210 ºC. R f = 0,49. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 2,18 c (3H, CH 3 ); 4,13 с (2H, CH 2 CO); 6,01 с (1H, H-5); 7,52–7,79 м (9H, ароматические H); 10,64 с (1H, CO-NH); 12,53 уш. с (1H, NH).
N-[4-(бензилокси)фенил]-2-[(4-метил-6-оксо-1,6-дигидропиримидин-2-ил)сульфанил] ацетамид (10f). Тпл = 246–247 ºC. R f = 0,54. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 2,14 с (3H, CH 3 ); 4,03 c (2H, CH 2 CO); 5,06 c (2H, OCH 2 ); 6,01 c (1H, H-5); 6,95-6,97 м (2H, H-3’, H-5’); 7,29–7,48 м (7H, H-2’, H-6’, H-2’’-H-6’’); 10,09 c (1H, CO-NH); 12,53 уш. с (1H, NH).
N-(4-бензилфенил)-2-[(4-метил-6-оксо-1,6-дигидропиримидин-2-ил)сульфанил]аце-тамид (10g). Тпл = 220–222 ºC. R f = 0,59. 1Н ЯМР-спектр (400 МГц, ДМСО- d 6 ), δ, ppm, J , Гц: 2,13 c (3H, CH 3 ); 3,87 c (2H, CH 2 ); 4,06 с (2H, CH 2 CO); 5,99 с (1H, H-5); 7,14-7,20 м (5H, H-3’, H-5’, H-2’’,H-4’’,H-6’’); 7,24–7,28 м (2H, H-3’’, H-5’’); 7,49 д (2H, J = 8,42, H-2’, H-6’); 10,18 с (1H, CO-NH); 12,51 уш. с (1H, NH).
ЗАКЛЮЧЕНИЕ
Осуществлен синтез 7 новых, не описанных ранее в литературе, S-арилацетамидных производных 2-тиоурацила, содержащих различные заместители в пиримидиновом и ароматических циклах.
Изучены их спектральные и физикохимические свойства. Полученные соединения можно рассматривать как потенциальные противовирусные агенты.
Список литературы Синтез новых диарилацетамидных производных 2-тиоурацила в качестве потенциальных антивирусных агентов
- Гейсман А. Н., Лысенко К. Н.//Фундам. исслед. -2015. -№ 2 (19). -С. 4225-4230.
- Cho S.-D., Park Y.-D., Kim J.-J., et al.//J. Org. Chem. -2003. -Vol. 68, № 20. -P. 7918-7920.
- Dye C.//Philos. Trans. R. Soc. B Biol. Sci. -2014. -Vol. 369, № 1645. -P. 20130426.
- Fargualy A. M., Habib N. S. Ismail K. A, et al.//Eur. J. Med. Chem. -2013. -Vol. 66. -P. 276-295.
- Gataullin R. R., Kazhanova T. V., Davydova V. A., et al.//Pharm. Chem. J. -1999. -Vol. 33, № 5. -P. 255-258.
- Li W., Huang B., Kang D., et al.//Chem. Biol. Drug Des. -2016. -Vol. 88, № 3. -P. 380-385.
- Magri A., Ozerov A. A., Tunitskaya V. L., et al.//Sci. Rep. -2016. -Vol. 6. -P. 29487.
- McGrath W. J., Graziano V., Zabrocka K., et al.//FEBS Lett. -2013. -Vol. 587, № 15. -P. 2332-2339.
- Tiew K.-C., Dou D., Teramoto T., et al.//Bioorg. Med. Chem. -2012. -Vol. 20, № 3. -P. 1213-1221.
- Yu M., Li Z., Liu S., et al.//ChemMedChem. -2011. -Vol. 6, № 5. -P. 826-833.
- Yu M., Liu A., Du G., et al.//Chem. Biol. Drug Des. -2011. -Vol. 78, № 4. -P. 596-602.
- Yu M., Liu Z., Li X., et al.//Bioorg. Med. Chem. -2009. -Vol. 17, № 22. -P. 7749-7754.


