Синтез порошков CdO разложением термически нестабильных солей для материалов разрывных электроконтактов
Автор: Иванов В.В., Шубин А.А., Иртюго Л.А.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 4 т.2, 2009 года.
Бесплатный доступ
Изучен процесс синтеза порошка оксида кадмия термическим разложением азотнокислого и уксуснокислого кадмия методами термогравиметрии и сканирующей калориметрии для композиционных материалов коммутирующих электроконтактов с высокодисперсной и однородной микроструктурой. Порошки охарактеризованы при помощи рентгенофазового анализа и сканирующей электронной микроскопии. При одинаковых условиях разложения синтезируемые из указанных солей порошки CdO существенно отличаются по морфологии и дисперсности.
Оксид кадмия, порошок, синтез, термическое разложение, микрокомпозит, электроконтакт
Короткий адрес: https://sciup.org/146114516
IDR: 146114516 | УДК: 620.22
Текст научной статьи Синтез порошков CdO разложением термически нестабильных солей для материалов разрывных электроконтактов
Оксид кадмия, обладая рядом специфических свойств (высокие электропроводность и давление паров), уже в течение 70 лет является незаменимой гетерофазной добавкой в материалах разрывных электрических контактов низковольтной коммутационной аппаратуры на средние токи (известный материал СОК-15 состава 85Ag-15CdO) [1]. Тем не менее работы по совершенствованию этого композита, а также аналогичных материалов на медной основе продолжаются как в направлении совершенствования их технологии, так и улучшения однородности, измельчения фазовых составляющих [2].
Композиционные материалы с микро- и наноструктурой, вследствие своих уникальных функциональных свойств, в последние десятилетия получают практическое использование и привлекают внимание исследователей [3-5]. Метод синтеза индивидуальных оксидов через процесс термического разложения соответствующих термически нестабильных солей – распространенный метод получения наноразмерных оксидных порошков, пленок, а также композиционных материалов типа металл-оксид с высокой дисперсностью включений оксида. Он представляет практический интерес и как метод введения таких включений в традиционные материалы электроконтактов на основе серебра и, в особенности, в бессеребряные композиты на медной основе.
Литературные данные по термическому разложению солей-прекурсоров часто ограниченны и противоречивы. Кроме того, известно, что характерные температуры протекания процессов разложения в том, что соединения зависят от условий приготовления соли, характера ее дореак-ционной обработки, газовой среды. В связи с этим изучение процессов разложения применяемых соединений в конкретных условиях предполагаемого процесса синтеза оксидов настоятельно необходимо для сознательного осуществления синтеза целевого композиционного материала.
Наиболее широко в качестве прекурсоров для синтеза оксидных фаз используются соответствующие нитраты, а также некоторые соли органических кислот, в частности ацетаты. Для получения CdO термическим разложением нитрат кадмия, наряду с ацетатом, также является наиболее приемлемым соединением как вследствие доступности и низкой стоимости, так и относительно низкой температуры термического разложения.
Экспериментальная часть
Экспериментальные исследования процессов синтеза CdO были проведены с использованием прибора синхронного термического анализа Netzsch STA 449C Jupiter путем снятия термогравиметрических (ТГ) кривых и кривых дифференциальной сканирующей калориметрии (ДСК) в проточной инертной атмосфере несущего газа аргона (скорость потока 10-25 мл/мин) при скоростях нагрева образцов 5 и 10 К/мин в алундовых и платиновых тиглях.
Использованы товарные реактивы ацетата кадмия дигидрата Cd(CH3COO)2 - 2H2O и нитрата кадмия тетрагидрата Cd(NO3)2 - 4H2O (оба реактива квалификации «хч»).
Образцы продуктов термического разложения охарактеризованы методом порошковой дифракции и сканирующей электронной микроскопии. Рентгенофазовый анализ проводился с использованием XPERT-PRO (Институт химии и химической технологии СО РАН) с излучением Cu Kα (λ = 0,15406 Å). Спектр записывался в диапазоне углов 2θ от 5 до 80° с шагом 0,001°. Микрофотографии регистрировались на электронном сканирующем микроскопе JEOL JSM-7001F.
Синтез CdO разложением ацетата кадмия
На рис. 1 представлены результаты изменений массы образца и тепловых эффектов в процессе нагревания Cd(CH3COO)2 - 2H2O. Обе кривые свидетельствуют о том, что дегидратация соединения идет в два этапа с общей потерей массы около 13 % (при теоретическом значении порядка 13,5 %) в интервале температур 350-473К. В справочной литературе указывается температура дегидратации 403 К, а температура плавления безводного ацетата - 529 К, что практически совпадает с соответствующим острым пиком на ДСК-кривой (рис. 1). При дальнейшем повышении температуры идет разложение по сложному механизму, о чем говорит наличие нескольких эндо- и экзотермических пиков. Основной процесс разложения заканчивается по достижении температуры порядка 583 К. Масса образца полностью стабилизируется около 643 К, изменившись на 50,5 % при теоретическом значении 51,9 % относительно исходного гидрата.
Расчет изменения массы образца проведен в соответствии с уравнением, учитывающим образование оксида кадмия в качестве конечного продукта разложения:
Cd(CH 3 COO) 2 - 2H 2 O = Cd(CH 3 COO) 2 + 2^O t = CdO + C^COCH t +1/2 О 2 Т (1)
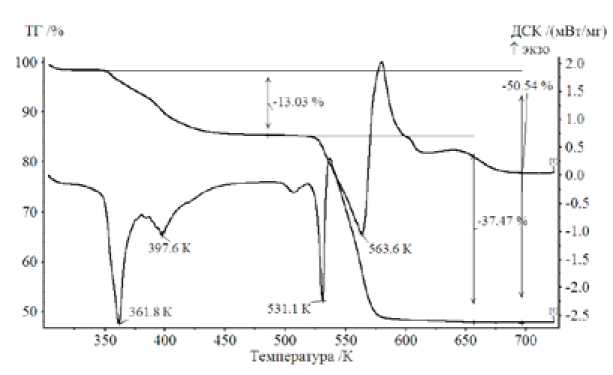
Рис. 1. ТГ и ДСК кривые термического разложения Cd(CH 3 COO)2 - 2H2O. Тигель (Pt) с перфорированной крышкой, скорость нагрева 10 К/мин, проточный газ Ar, скорость потока защитного газа 15 мл/мин, скорость продувки 25 мл/мин, масса образца 9,14 мг
Состав газообразных продуктов может быть значительно сложнее, чем представлено в уравнении (ацетон и кислород), однако это обстоятельство не влияет на выход твердого продукта и поэтому не представляется существенным в данном контексте.
Таким образом, с большой степенью вероятности можно утверждать, что единственным твердым остатком после термического разложения ацетата кадмия в изученных условиях является оксид кадмия, причем температурный интервал, где в основном формируется эта фаза, лежит в области 533-588 К. Эти значения представляются важными с точки зрения оценки реакционной способности оксида в дальнейшем твердофазном синтезе. Кроме того, по этой же причине важным моментом в установленной последовательности стадий суммарного процесса в неизотермических условиях является наличие стадии плавления безводного соединения до его разложения.
Исследованию процесса термического разложения ацетата кадмия на воздухе и в гелии, с одновременным масспектрометрическим контролем газообразных продуктов, посвящен ряд публикаций, в частности [6]. Кривые ТГ и ДТА из этой работы представлены на рис. 2. Очевидно, что наши результаты близки к результатам работы [6], полученным на воздухе, особенно в отношении процессов дегидратации, температуры плавления и температурных пределов разложения безводной соли: дегидратация протекает в два этапа, что подтверждается соответствующими эндотермическими пиками, температура плавления порядка 526 К, основной интервал разложения около 523-583 К. Рентгенофазовым анализом однозначно подтверждено, что на воздухе разложение реализуется с образованием оксида кадмия в соответствии с суммарным уравнением (1).
Весьма существенно отличается процесс в атмосфере гелия как по форме кривых, так и по значениям характерных температур. Это представляется труднообъяснимым в отношении процесса дегидратации, для которого, казалось бы, нет оснований ожидать различия параметров дегидратации в газах, не содержащих паров воды. Эта ситуация не нашла убедительного объяснения в рассматриваемой работе [6].
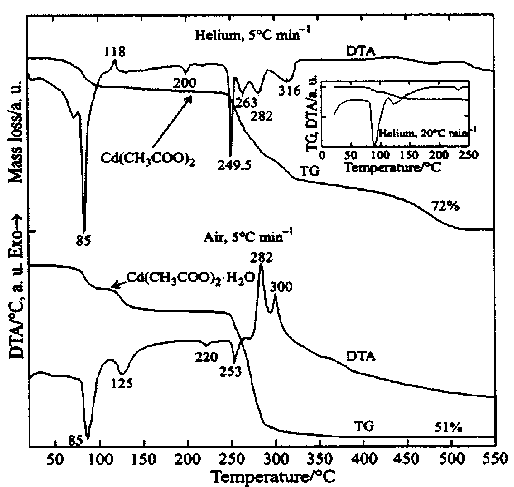
Рис. 2. Разложение Cd(CH3COO)2 - 2H2O в гелии и воздухе [6]. Скорость нагрева 5 К/мин (вставка - 20 К/мин)
Весьма важный факт установлен при анализе процесса разложения ацетата кадмия в инертном газе: частичное образование металлического кадмия предположительно по реакции
Cd(CH 3 COO) 2 = Cd + СН з СОСН з Т +1/2 C t + CO2 t (2)
Активный кадмий, образовавшийся в одних стадиях процесса, частично окисляется далее кислородом реакции (2) до оксида, а другая часть испаряется при температурах выше плавления (321 ° С) и удаляется.
Предполагается также [6], что кроме металлического кадмия при разложении в атмосфере гелия частично образуется карбонат кадмия
Cd(CH 3 COO) 2 = CdCO 3 + СИ;СОСИ а (3)
являющийся промежуточным продуктом и разлагающийся при температурах 723-773 К (основанием для такого заключения является наличие небольшого масс-спектрометрического СО2-пика и соответствующих сигналов на кривых ТГ и ДТА). Указанные значения температуры (723-773 К) заметно превышают справочные данные по разложению CdCO3, которые колеблются от точного значения 630 К [16] до >673 К [9].
Образование металлической фазы при термическом разложении некоторых солей органических кислот в неокислительной атмосфере – известный факт и его возможное проявление следует учитывать при разработке технологических процессов. Так, например, разложение малоната кадмия CdC3H2O4 как в инертной атмосфере, так и в воздухе приводит к частичному образованию металлического кадмия [7], что может представлять серьезное осложнение, например, при синтезе композита металл/оксид кадмия в инертной среде.
Обнаружение металлического кадмия в продуктах при разложении в атмосфере гелия может быть связано с кинетическими особенностями, а именно, со значительно более интенсив-

Рис. 3. Снимки CdO, синтезированного из ацетата кадмия: а - х 500; б - х 10000
ными процессами диффузии в этом легком газе, когда кислород (реакция (2)) быстро удаляется из реакционной зоны и не окисляет кадмий. Коэффициенты взаимной диффузии в газовых смесях Ar-CO2 и He-CO2 при температурах порядка 300 К составляют, соответственно, 0,14 и 0,6 см2/с [8].
Отдельный эксперимент по синтезу оксида кадмия из обеих изучаемых солей был проведен в печи сопротивления в открытом тигле, в атмосфере аргона при нагревании по следующему режиму: нагрев до 523 К, выдержка 0,5 ч, нагревание до 873 К, выдержка 1 ч, остывание с печью. Далее продукты разложения подверглись рентгенофазовому и электронно-микроскопическому анализу. Рентгенограммы показали, что образцы состоят из кристаллического оксида кадмия, другие фазы в регистрируемом количестве отсутствуют.
На рис. 3 представлены снимки порошка оксида кадмия, синтезированного разложением ацетата кадмия. Порошок при небольшом увеличении представляет собой частицы округлой нерегулярной формы в широком диапазоне дисперсности от единиц до нескольких десятков микрометров. Большее увеличение показывает, что эти достаточно крупные частицы представляют собой рыхлые агломераты из частиц и сростков размером порядка 100-300 нм и весьма развитой удельной поверхностью.
Синтез CdO из нитрата кадмия
Результаты термического анализа Cd(NO3)2 - 4H2O представлены на рис.4. Известно [9], что кадмия нитрат тетрагидрат плавится в своей кристаллизационной воде при 332,6 К (59,5 ° С), кипит при 405 К и при этом расплав остается прозрачным до тех пор, пока не выкипит 75 % воды. В результате длительного нагревания при 463 К переходит в безводную соль. Около 623 К соль плавится с одновременным разложением.
Наши результаты показывают количественное совпадение только по температуре плавления гидрата и, по-видимому, в отношении непрерывного испарения трех молекул воды из имеющихся четырех (удалению оставшейся воды соответствует изгиб на ТГ и минимум на ДСК-кривой при температуре около 498 К). Обезвоживание соли заметно начинается уже при 373 К и заканчивается лишь около 533 К. Экспериментальное изменение массы образца при этом составило -23,6 %, при теоретическом значении -23,36 %, что можно признать хорошим соответствием.
Температура плавления безводной соли оказалась, однако, заметно выше: около 683 К. Одновременно начинается эндотермический процесс разложения соли, заканчивающийся при температуре около 753 К. Изменение массы в этом процессе, вычисленное на единственный твердый продукт в соответствии с уравнением
Cd(NO 3 ) 2 = CdO + 2 NO 2 T +1/2 O2 t (4)
дает величину 34,36 % (относительно массы исходного гидрата), что также хорошо совпадает с экспериментальным значением на рис.4: 34,68 %.
Выше температуры 1223 К термогравиметрическая кривая начинает слабо отклоняться вниз, т.е. проявляется процесс, вызывающий уменьшение массы образца. Это явление связано, очевидно, с сублимацией оксида кадмия, что согласуется с литературными данными [10]: уравнение температурной зависимости давления пара (гПа)
12310,5 lgp=9,685- T , справедливое в интервале 594-1520 К, дает при 1223 К уже вполне заметную величину давления 0,416 гПа (около 0,3 мм рт.ст.).
Эксперимент по разложению нитрата кадмия, но до более низкой температуры, был повторен в платиновом тигле (рис. 5). Характерные значения температур на ДСК-кривой, а также величины изменения массы образца вполне удовлетворительно совпадают. Некоторое видимое различие в форме кривых на рис. 4 и рис. 5 может быть вызвано различием условий теплообмена в керамическом и металлическом тиглях. В частности, эндотермический пик второй стадии дегидратации значительно слабее первого и имеет сложное строение, что связано, по-видимому, с наложением процессов эндотермической дегидратации и экзотермической кристаллизации. Аналогичный характер этого пика регистрировали авторы работы [11], объясняя его подобным же образом.
Следовательно, и в этом случае термического разложения нитрата кадмия единственным твердым остатком в изученных условиях является оксид кадмия, причем температурный интервал формирования этой фазы лежит заметно выше, чем для ацетата кадмия: 683-753 К. Это означает: активность оксида кадмия в твердофазных взаимодействиях смещается в более высокие температуры, что может благоприятно сказаться на синтезе сложных оксидов. Нитрат, так же как и ацетат, предварительно плавится, что может быть важным с точки зрения достижения наилучшей однородности целевого композита и понижения температуры синтеза сложного оксида.
Термическому разложению нитрата кадмия посвящен ряд работ, выполненных тщательно и на современном оборудовании. Работы, выполненные в последние годы [11-14], публикуют количественно близкие результаты и могут рассматриваться, по-видимому, как наиболее точные. К этому же списку следует отнести и позднюю работу [15] по термическому разложению гексааммиачных комплексов нитрата кадмия ([Cd(NH3)6](NO3)2) в аргоне, промежуточным продуктом которого после деаминирования остается безводный нитрат. В этой работе также отмечается, что замена атмосферы азота на воздух не сказывается на результатах. Во всех случаях полное разложение нитрата приводит к формированию оксида кадмия.
Результаты, полученные в этих работах и в наших экспериментах, совпадают качественно (включая выводы по виду суммарного уравнения (4) разложения безводной соли), но наблюда- – 414 –
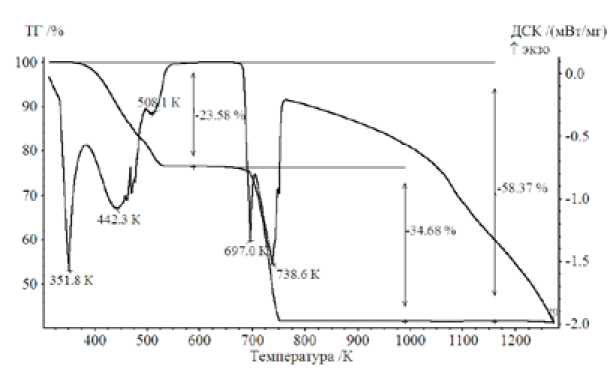
Рис. 4. ТГ и ДСК кривые термического разложения Cd(NO 3 )2 - 4H2O. Тигель (Al2O3) с перфорированной крышкой, скорость нагрева – 10 К/мин, проточный газ – Ar, скорость потока защитного газа – 10 мл/мин, скорость продувки – 15 мл/мин, масса образца 73,16 мг
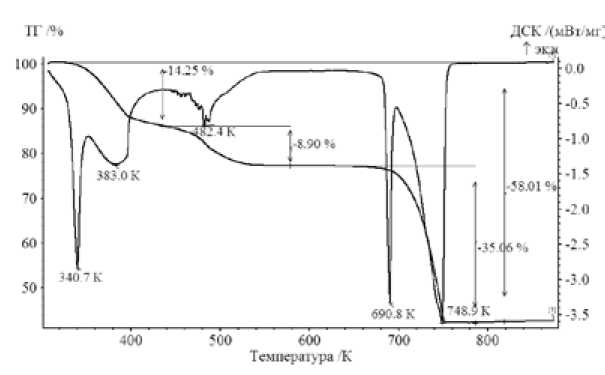
Рис. 5. ТГ и ДСК кривые термического разложения Cd(NO3)2 - 4H2O. Тигель (Pt) с перфорированной крышкой, скорость нагрева 10 К/мин, проточный газ Ar, скорость потока защитного газа 15 мл/мин, скорость продувки 25 мл/мин, масса образца 11,79 мг

Рис. 6. Снимки CdO, синтезированного из нитрата кадмия; а - х 50; б - х 1000
ются некоторые количественные различия в характерных температурах на термоаналитических кривых: начало разложения безводной соли – 580-650 К (наше значение – ~670 К), конец разложения – 723-743 К (наше значение – ~753 К). Эти различия не носят принципиального характера и являются следствием разных условий экспериментов – скорости нагрева, материала тигля и пр.
Порошок оксида кадмия, полученный разложением нитрата по сравнению с ацетатом кадмия, имеет другую морфологию и дисперсность (рис.6). Это хорошо ограненные кристаллические частицы, имеющие распределение в достаточно узком диапазоне размеров порядка 3-10 мкм. Последние могут образовывать слабосвязанные крупные агрегаты, которые легко разрушаются.
Наблюдаемая существенная разница проявляется в морфологии и размерах частиц порошков CdO, которые синтезированы из изученных солей. Она определяется различиями в механизме, температуре разложения безводного прекурсора, параметрах диффузии и теплопередачи в соответствующих системах. Так, приведенные данные термического анализа показывают, что температура разложения ацетата заметно ниже, по сравнению с нитратом. Диффузионные процессы при росте зародышей новой фазы в первом случае заторможены, образуются нано-размерные частицы, которые в процессе дальнейшего подъема температуры только спекаются, образуя относительно прочные агрегаты, но практически не растут в размерах.
Температура разложения нитрата достаточна для формирования ограненных, более крупных частиц, спекание которых при температуре отжига (873 К) не происходит.
Заключение
Процесс термического разложения азотнокислого и уксуснокислого кадмия в инертной среде приводит к формированию кристаллического оксида кадмия. Характерные параметры процессов разложения на ТГ и ДСК-кривых в основном соответствуют литературным данным. При одинаковых условиях разложения синтезируемые из указанных солей порошки CdO существенно отличаются по морфологии и дисперсности: ацетат дает рыхлые агломераты из частиц и сростков размером порядка 100-300 нм и весьма развитой удельной поверхностью, в то время как нитрат – хорошо ограненные частицы, имеющие распределение в достаточно узком диапазоне размеров порядка 3-10 мкм. Использование ацетата в процессах синтеза композиционной шихты для электроконтактного материала предпочтительно.
Авторы благодарят С.Д.Кирика и Г.М.Зеер за проведение рентгенофазового и электронномикроскопического анализа.


