Синтез, структура, ЭПР спектры и теплоемкость кубического оксифторида CsZnMoO 3F 3
Автор: Молокеев М.С., Петраковская Э.А., Бондарев В.С., Колесникова Е.М., Иванов Н.А.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 3 (49), 2013 года.
Бесплатный доступ
Оксифторид CsZnMoO 3F 3 получен методом твердофазного синтеза. Установлено, что кристалл изоструктурен пирохлору и уточнена его кристаллическая структура при T = 298 K методом Ритвельда. Несмотря на то, что основным структурным элементом в этом соединении является искаженный полиэдр, реализовалась кубическая фаза. Стабильность кубической фазы подтверждена исследованием теплоемкости в температурном интервале T = 110-293 K. Проанализированы ЭПР спектры исследуемого соединения в диапазоне температур T = 77-295 K. Установлено наличие дефектов в структуре. Проведено сравнение исследуемого соединения с родственным оксифторидом CsMnMoO 3F 3. Отмечено лишь небольшое изменение тепловых параметров и параметров ячеек.
Оксифторид, рентгеноструктурный анализ, эпр спектры, теплоемкость
Короткий адрес: https://sciup.org/148177112
IDR: 148177112 | УДК: 548.736.5
Текст научной статьи Синтез, структура, ЭПР спектры и теплоемкость кубического оксифторида CsZnMoO 3F 3
Исследуемое соединение принадлежит широкому классу оксифторидов с шестикоординированным полиэдром MO x F 6–x . Среди них можно выделить два семейства: 1) эльпасолиты-криолиты с общей формулой A+ 2 B+MO 3 F 3 (Fm-3m, Z = 4) [1]; 2) пирохлоры A+B2+MO3F3, имеющие дефектную структуру типа RbNiCrF6 (Fd-3m, Z = 4) [2; 3]. Несмотря на то, что основным структурным элементом в них является искаженный полиэдр MO x F 6–x , в обоих этих семействах реализуются кубические фазы, благодаря разупо-рядочению фтор- кислородного полиэдра. Существует немало примеров, когда при определенных внешних условиях в эльпасолитах происходит упорядочение полиэдров, сопровождающееся понижением симметрии [4–7], и даже появлением полярной фазы [8–11]. Наличие у некоторых из них существенных барических коэффициентов dT/dр приводит к проявлению больших интенсивных и экстенсивных барокалорических эффектов, что в перспективе может быть использовано в твердотельных охладителях [12].
К сожалению, информация о пирохлорах со структурной единицей MO x F 6-x , и особенно о фазовых переходах в них, практически отсутствует. Ранее нами проведен комплекс исследований по поиску фазовых переходов в соединении CsMnMoO 3 F 3 [13], однако было установлено, что кубическая фаза остается стабильной в изученном интервале температур 110–293 K. С другой стороны, недавно обнаружен ряд фазовых переходов во фтористом соединении CsFe2F6 со структурой пирохлора [14], что косвенно указывает на потенциальную возможность искажения кубической структуры в результате фазовых переходов и в оксифторидных пирохлорах. Именно это обстоятельство, а также вероятность обнаружения сегнетоэлектрических фаз, и привлекают к ним внимание. Особый интерес соединения этого структурного класса представляют в связи с возможностью варьирования химического давления в структуре за счет катионного замещения, в частности, магнитных ионов. Исследование CsZnMoO 3 F 3 является логическим продолжением исследования фторкислородных пирохлоров с целью выявления влияния замещения магнитного катиона Mn2+ в CsMnMoO3F3 на немагнитный ион Zn2+, имеющий существенно меньший ионный радиус.
Исследуемое соединение получено в виде мелкокристаллического порошка. В качестве исходных реагентов были выбраны (NH 4 ) 3 MoO 3 F 3 , CsCO 3 и ZnCO 3 . Синтез проводился в соответствии с реакцией:
(NH 4 ) 3 MoO 3 F 3 + 0.5 CsCO 3 + ZnCO 3 →
→ CsZnMoO 3 F 3 + 3 NH 3 + 1.5 CO 2 + 1.5 H 2 O.
Структура соединения CsZnMoO3F3 уже исследовалась ранее в работе [2]. Однако структурные данные были не полными, так как отсутствовали коорди- наты атомов кислорода и фтора. Перед нами стояла задача получить полную информацию о структуре и ее устойчивости к температуре.
Рентгенограмма поликристаллического образца CsZnMoO 3 F 3 для последующего уточнения структуры методом Ритвельда получена на дифрактометре D8-ADVANCE (Cu-Kα – излучение, θ-2θ сканирование) с использованием линейного детектора VANTEC. Эксперимент проведен при комнатной температуре. Шаг сканирования по углу 2θ равен 0.016º, экспозиция составляла 1 секунду на шаг. Параметры ячеек взяты из работы [2] и уточнены в ходе подгонки профилей с использованием программы TOPAS 4.2 [15]. Основные параметры сбора данных и уточнения структуры представлены в табл. 1.
Таблица 1
Параметры сбора данных и уточнения структуры
|
Пространственная группа |
Fd 3 m |
|
a, Å |
10.43818(7) |
|
V, Å3 |
1137.30(2) |
|
2θ-интервал углов, º |
5 – 120 |
|
Число брэгговских рефлексов |
58 |
|
Число уточняемых параметров |
26 |
|
R B , % |
1.735 |
|
R wp , % |
8.228 |
|
R p , % |
6.324 |
|
R exp , % |
5.670 |
|
χ |
1.451 |
Все расчеты и обработка массивов экспериментальных данных проводились по программе TOPAS 4.2. Для описания формы пиков была выбрана функция Пирсона VII.
Анализ погасаний отражений подтвердил, что пространственная группа соединения CsZnMoO 3 F 3 действительно Fd 3 m . Поиск и уточнение структуры проведены тем же путем, что и для CsMnMoO 3 F 3 [13]. Координаты атомов, изотропные тепловые параметры и заселенности позиций приведены в табл. 2. Экспериментальные (точки) и теоретические (сплошные линии) рентгенограммы соединения представлены на рис. 1.
Структура является каркасной, в которой октаэдры Zn(Mo)O3F3 связаны друг с другом вершинами, а ионы Cs находятся в межоктаэдрических полостях (рис. 2, а ). Полиэдры Zn(Mo)O 3 F 3 представляют собой почти идеальные октаэдры, так как длины связей Zn(Mo)-O(F) все одинаковые и равны 1.977(2) Å, а углы O(F)-Zn(Mo)-O(F)* (* – операция симметрии y-1/2, z, x+1/2) находятся в пределах 87.8–92.2°. Ион Cs координирован 6 ионами O(F) с расстоянием d(Cs–O(F)) = 3.205Å и 12 ионами O(F) с расстоянием
d(Cs–O(F)) = 3.738Å, поэтому полная координация иона Cs ионами O(F) равна 18. Таким образом, оказалось, что ион Cs координирован 12 октаэдрами Zn(Mo)O3F3 (рис. 2, б ).
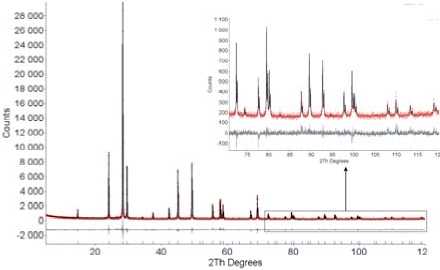
Рис. 1. Разностная рентгенограмма CsZnMoO3F3
Сравнение структур CsZnMoO 3 F 3 и CsMnMoO 3 F 3 не выявило заметных отличий кроме закономерного изменения параметров ячеек: a = 10.59151(4)Å (CsMnMoO 3 F 3 ) и a = 10.43818(7)Å (CsZnMoO 3 F 3 ) и длин связей d(Zn(Mo)-O) = 1.977Å, d(Mn(Mo)-O) = = 2.011(2)Å. Тепловые параметры тяжелых атомов в этих структурах также близки друг к другу. Лишь тепловой параметр атома F(O) в соединении
CsMnMoO 3 F 3 B = 4.6(1)Å2 немного больше, чем в оксифториде CsZnMoO3F3 B = 3.46(5)Å2.
Стабильность кубической фазы к изменению температуры проверялась путем измерений теплоемкости порошкового образца CsZnMoO 3 F 3 массой 0.1 г на дифференциальном сканирующем микрокалориметре ДСМ-10М. Термоциклирование в режимах нагрев-охлаждение со скоростью 8 К/мин в температурном интервале 110-293 K не привело к обнаружению аномалий, связанных фазовыми переходами.
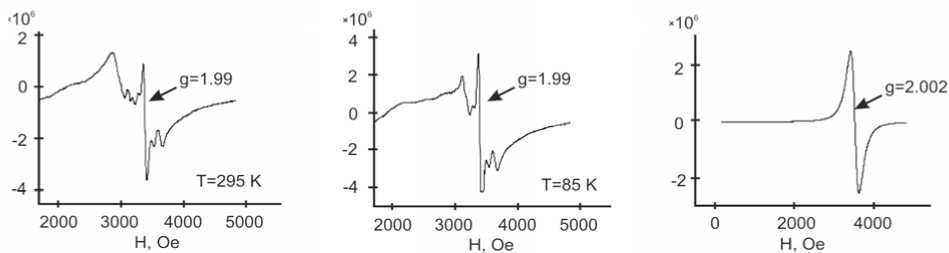
Спектры ЭПР сняты на спектрометре Bruker Elexys E580(295K-85K) в Х-диапазоне (рис. 3). Расшифровка спектра была выполнена моделированием с помощью производных линий формы Лореца и Гаусса (табл. 3). Наиболее удачно спектр модулируется четырьмя линиями. В спектре наблюдается узкая ( Δ H = 40Э) достаточно интенсивная линия с g = 1,99 и сопровождается близлежащими слабыми линиями, которые можно отнести к сверхтонкой структуре (СТС), связанной с электронно-ядерным взаимодействием. По этим признакам линию можно отнести к Мо5+ [16]. Линии СТС – несколько «размазаны», что можно объяснить наличием двух различных констант для ядер Мо и малого (~ 20 %) содержания атомов Мо, имеющих ядерные магнитные моменты. Так как в кристалле присутствует Мо6+, появление указанной линии говорит о наличии изолированных дефектов.
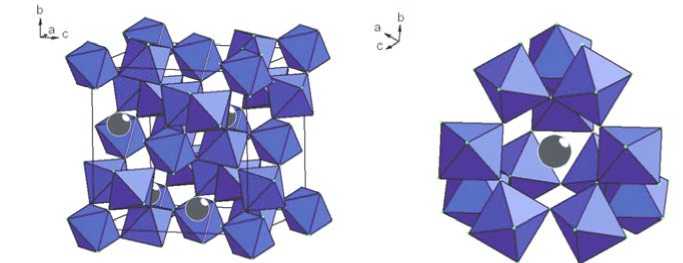
Рис. 2. Структура CsZnMoO 3 F 3 : Zn(Mo)O 3 F 3 – октаэдры ( а ); координация иона Cs 12 октаэдрами Zn(Mo)O 3 F 3 ( б )
Таблица 2
Координаты атомов, изотропные тепловые параметры (Biso) и заселенности позиций(p) структуры CsZnMoO3F3
|
Атом |
p |
X |
Y |
Z |
B iso. ,Å2 |
|
Cs |
1.0 |
3/8 |
3/8 |
3/8 |
4.15(5) |
|
Zn |
0.5 |
0 |
0 |
0 |
3.46(5) |
|
Mo |
0.5 |
0 |
0 |
0 |
3.46(5) |
|
F |
0.5 |
1/8 |
5/8 |
0.4321(3) |
3.2(1) |
|
O |
0.5 |
1/8 |
5/8 |
0.4321(3) |
3.2(1) |
Таблица 3
Параметры спектра ЭПР CsZnMoO 3 F 3 для температуры 295К
|
Нрез., Ое |
g-фактор |
ΔΗ, Ο e |
M, произв. един. |
Форма линии |
|
3248 |
1,99 |
40 |
3854 |
Лоренц |
|
3192 |
2,032 |
410 |
185961 |
Гаусс |
|
2831 |
2,26 |
69 |
2423 |
Гаусс |
|
2810 |
2,299 |
255 |
49025,6 |
Гаусс |
б
Рис. 3. Спектры ЭПР: CsZnMoO 3 F 3 (а – 295 K: б – 85 К); CsMnMoO 3 F 3 (в – 295 K)
Три другие линии можно приписать примесям случайно внесенных 3d-элементов. Линия g = 2,26 может принадлежать Сu2+, так как при 85К на низкополевом крыле есть следы СТС, характерные для этого иона. Линия g = 2,032 возможно связана с Mn2+ или Fe3+. А самая низкополевая линия может принадлежать Ni или Co. Ее магнитный момент сильно возрастает при 77К. Но количество этих примесей по величине сигнала ЭПР очень мало.
Снижение температуры несколько изменяет вид спектра (рис. 3, б ). Происходит усиление линии 1, что соответствует парамагнитному поведению центра Мо. Для линий 2 и 3 магнитный момент тоже увеличивается. Наибольшее увеличение этого параметра наблюдается для 4-й компоненты. Возможно, она ответственна за рост намагниченности образца при близкой к 4К температуре.
Спектр ЭПР CsMnMoO 3 F 3 (рис. 3, в ) представлен одной интенсивной линией формы Лоренца. Это может свидетельствовать о наличии обменного взаимодействия между ионами Mn2+, которым она принадлежит. Параметры спектра: g = 2,002; Δ H = 184Э. Температурное поведение парамагнитное, магнитный порядок должен наступить при температуре ниже 85 К.
Определены и уточнены все координаты атомов CsZnMoO3F3. Сравнение двух структур CsZnMoO3F3 и CsMnMoO3F3 не выявило заметных отличий, кроме закономерного изменения параметров ячеек. Установлено существование кубической фазы в температурном интервале T = 110-293 K. Анализ спектров ЭПР показал изменение их вида при понижении температуры, что соответствует парамагнитному поведению центра Мо.


