Система бета-глюкуронидазы, кишечная микрофлора и развитие опухолей толстой кишки
Автор: Хумаири Ахмед Хамид, Аль-Газали Мояд Имран, Новочадов Валерий Валерьевич, Корчагина Анастасия Александровна
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 4 т.9, 2019 года.
Бесплатный доступ
Настоящий обзор посвящен вопросам участия кишечной микрофлоры и связанных с ее жизнедеятельностью особенностей люминального метаболизма в возникновении и последующем развитии опухолей толстой кишки, прежде всего колоректального рака. В работе проанализированы проблемы повышения частоты этого заболевания в последнее время, участие генетических факторов в формировании высокого риска прогрессирования опухолей толстой кишки. Отдельное значение, по мнению авторов, имеют микробные ассоциации и последствия взаимодействия между отдельными видами микроорганизмов. Роль кишечной микрофлоры во многом может быть сведена к активности секретируемых ей ферментов, изменяющих соотношение ключевых метаболитов в просвете кишки и ее проницаемость, что отражается на скорости метаболизма и обновлении клеток эпителия. С этих позиций детально рассмотрены особенности строения и биохимические характеристики бета-глюкуронидазы, как ключевого фермента, участвующего в канцерогенезе рассматриваемой локализации. Приведены основные сведения о роли бета-глюкуронидазы в клиренсе ксенобиотиков, физиологические и патологические последствия активности этого фермента в просвете толстой кишки. Кратко описаны современные методы определения активности, выделения и очистки бета-глюкуронидазы, в том числе с использованием хромогенных субстратов. В конце обзора авторы приводят ряд подходов, основанных на использовании бета-глюкуронидазы, для адресной системы доставки терапевтических средств к опухоли, как элемента комплексной химиотерапии колоректального рака.
Бета-глюкуронидаза, кишечная микрофлора, толстая кишка, колоректальный рак, канцерогенез
Короткий адрес: https://sciup.org/149131467
IDR: 149131467 | УДК: 615.011 | DOI: 10.15688/nsr.jvolsu.2019.4.5
Текст научной статьи Система бета-глюкуронидазы, кишечная микрофлора и развитие опухолей толстой кишки
DOI:
Рак толстой кишки (колоректальный рак, колоректальная карцинома, CRC) является одной из наиболее распространенных злокачественных опухолей человека с тенденцией к возрастанию числа заболеваний и смертельных случаев во многих странах мира. Показатели заболеваемости у мужчин выше, чем у женщин с примерной 1,4-кратной и 1,5-кратной разницей по заболеваемости (23,6 против 16,3 случая на 100 000 человек в год) и смертности (10,8 против 7,2 случаев смерти на 100 000 человек в год) соответственно. Данные показатели связаны с тем, что мужчины являются подверженными влиянию окружающих факторов больше, чем генетическим, по сравнению с женщинами, при этом наследственность CRC для женщин составляет 45 %, а для мужчин – 28 % [9; 10].
Риск развития CRC увеличивается после 50 лет, при этом 90 % случаев заболевания регистрируются именно у лиц старше этого возраста. Помимо возраста, основными факторами риска возникновения CRC являются наличие случаев заболевания в семье, ожирение, сахарный диабет, малоподвижный образ жизни, курение, высокое потребление алкоголя, принятие пищи с высоким содержанием жиров и низким содержанием клетчатки. 42
Более 75–95 % случаев рака толстой кишки встречаются у пациентов с незначительными или отсутствующими генетическими отклонениями [33; 35].
Люди с воспалительным заболеванием кишечника, таким как язвенный колит и болезнь Крона, подвержены высокому риску CRC, который тем выше, чем больше длительность воспалительной патологии. У людей с болезнью Крона было выявлено до 2 % новых случаев CRC через 10 лет, 8 % – через 20 лет и 18 % – через 30 лет [33].
С точки зрения этнических различий наиболее подверженными заболеванию являются чернокожие, а менее подверженными выходцы из Азии и островов Тихого океана. Это справедливо как в отношении заболеваемости (43,2 против 28,8 случаев на 100 000 человек в год), так и смертности (18,6 против 9,9 случаев смерти на 100 000 человек в год). В данном различии могут играть роль генетические факторы, например, у чернокожих было найдено несколько однонуклеотидных полиморфизмов, связанных с риском CRC [18; 26].
Значительная роль принадлежит низкой информированности населения о факторах риска и их профилактике, а также о ранней диагностике CRC. Так, в 2018 г. в США лишь 65,2 % взрослых в возрасте 50–75 лет были в курсе скрининга CRC (тремя годами ранее – 47,4 %). Но среди индейского населения, латиноамериканцев и выходцев из Азии величина показателя находилась в пределах 55–57 %, а среди лиц без медицинской страховки – только 29,7 % [8; 36].
Участие микрофлоры в образовании рака толстой кишки
Кишечная флора, эпителиальные клетки слизистой оболочки, пищевые пробиотические компоненты и малые молекулы – включая гормоны, ферменты, слизь и желчные соли – составляют сложную кишечную микроэкосистему, которая является устойчивой системой в физиологических условиях [32; 42].
В этом обзоре мы обобщаем известные данные о влиянии кишечной микробиоты на фенотип CRC, описываем факторы, которые способны повлиять на состав кишечной микробиоты и показываем стратегии, которые могут быть применены в экспериментальных проектах, с учетом влияния микробиоты на развитие CRC. Тщательное планирование на основе вышесказанного, будет способствовать продвижению исследований, направленных на профилактику и лечение CRC [20].
Механизм углеводного обмена играет важную роль в развитии CRC. Во-первых, кислород участвует в углеводных метаболичес- ких путях, а СО2 и H2O основами метаболитами углеводного обмена, и они связаны с развитием CRC [22; 37; 42]. Во-вторых, АТФ вырабатывается во время углеводного обмена и снабжает все живые клетки энергией. Фосфорибоза, образующаяся при метаболизме пентозофосфата, необходима для синтеза ДНК и РНК, а это в свою очередь является основным компонентом для быстрой пролиферации бактериальных и раковых. В-третьих, НАДФН является промежуточным метаболитом, который участвует в фосфорилировании белков и генов, и может быть вовлечен в микробную изменчивость и эпигенетическую регуляцию CRC. В-четвертых, митохондрии являются ключевым местом для углеводного обмена, а митохондриальная дисфункция является одной из наиболее важных особенностей при CRC и дисбалансе кишечной флоры [32].
Высокое содержание жиров способствует развитию CRC, так как происходит увеличение секреции желчи и желчных кислот в толстой кишке, а некоторые клостридии могут ускорять превращение желчной кислоты во вторичные кислоты с канцерогенным действием (рис. 1) [30]. Аминокислотный обмен также играет роль в канцерогенезе. Многие токсичные вещества, такие как сера, нитраты, сероводород, аммиак и амины, образуются под влиянием аминокислотного обмена и могут привести к развитию CRC [9; 31].
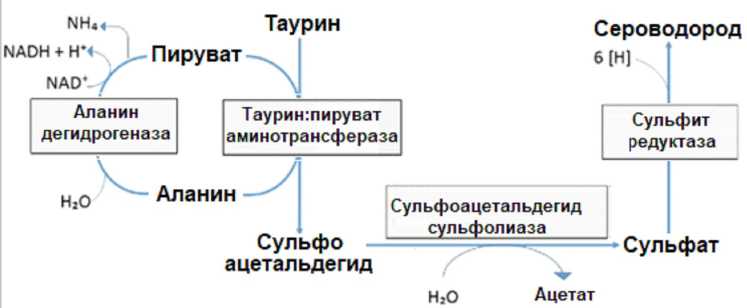
Рис. 1. Окисление таурина в Bilophila wadsworthia
Примечание. Процесс проходит в 3 ферментативных этапа. Вначале таурин трансанимируется с помощью фермента таурин:пируватаминотрансферазы с получением аланина и сульфоацетальдегида. Затем сульфоацетальдегид под действием сульфоацетальдегид-сульфолиазы с образованием ацетата и сульфата. На последнем этапе сульфат восстанавливается диссимиляционной сульфитредуктазой до сероводорода с использованием электронных доноров, таких как водород и формиат. Для завершения цикла аланин превращается обратно в пируват с помощью аланин-дегидрогеназы [30].
К настоящему времени, за более, чем 50летний период изучения участия кишечной микрофлоры в развитии опухолей данной локализации, приведено достаточно большое число доказательств того, что микроорганизмы кишечника играют ключевую роль в канцерогенезе. Среди представителей микрофлоры по значимости в возникновении и прогрессировании CRC играют такие виды, как как Bacteroides, Escherichia, Fusobacterium и Porphyromonas [13–15; 40].
Кроме того, было обнаружено, что численность некоторых видов, таких как F. nucleatum и Solobacterium moorei , была увеличена на ранней и поздней стадии развития рака, а некоторых, таких как Atopobium parvulum и Actinomyces odontolyticus , только на ранней, что может быть потенциально использовано в качестве биомаркеров для ранних аденоматозных поражений [12]. Некоторые специфические бактерии, такие как Bacteroides fragilis , Streptococcus bovis , Escherichia coli , Enterococcus faecalis и Streptococcus gallolyticus , очень тесно связаны с CRC [14; 15; 17]. Недавние исследования на людях выявили новые штаммы бактерий, участвующие в CRC канцерогенезе, к ним относятся бактерии таких родов, как Parvimonas , Peptostreptococcus , Porphyromonas и Prevotella , а также Fusobacterium nucleatum [23; 24; 29; 41].
Роль β-глюкуронидазы при раковых заболеваниях
β -глюкуронидаза относится к семейству гликозидаз, стимулирующих расщепление сложных углеводов. Глюкуронидаза человека, находящаяся в лизосоме, катализирует остаток d-глюкуроновой кислоты из не восстанавливающего конца гликозаминогликанов, например гепарансульфата. В кишечнике она превращает конъюгированный билирубин в не конъюгированную форму для реабсорбции. в-глю-куронидаза человека соответствует ферменту β -галактозидазы Escherichia coli . На данном основании, а также с учетом того, что гликозидазы выполняют гидролиз, вызванный кислотными остатками, была предложена гипотеза, которая гласит о том, что остатки глутаминовой кислоты Glu540 и Glu451 являются кислотными и нуклеофильными остатками, а остаток тирозина Tyr504 участвует в катализе.
На основе анализа меченных gl-глюкуронидазой пептидов исследователи установили, что Glu540 является внутриядерным отходом, возникающим в ходе реакции нуклеофильного замещения SN2 с участием оксикарбе-ниевого иона.
Человеческая β -D-глюкуронидаза (GUSB) состоит из 651 аминокислотного остатка (приблизительно 78 кДа), куда также входит сигнальный пептид длиной 22 аминокислотных остатка и четыре N-связанных сайта гликозилирования. Четыре субъединицы образуют энзиматически-активный гомотетрамер. Структура мономера GUSB включает три структурных домена. Первый домен, который представляет собой бочкообразную структуру вместе с двумя вставками с b-шпилькой, обеспечивает механизм лизосомального нацеливания. Структура второго домена аналогична константному домену иммуноглобулина. Третий домен представляет собой мотив бочкового домена a / b или TIM и обладает активным сайтом фермента, характерным ферментам гликозилгидро-лазы. Активный сайт мономера располагается на границе раздела олигомера и, следовательно, тетрамерный комплекс содержит четыре активных центра [25].
Глюкуронирование является основным путем детоксикации в печени млекопитающих, где происходит конъюгация гидрофобных ксенобиотиков и эндобиотиков с глюкуроновой кислотой, что приводит к увеличению их растворимости. Попавший в кишечник глюкуронид подвергается воздействию бактериальной β -глю-куронидазы, которая удаляет глюкуроновую кислоту, высвобождая исходные молекулы, что приводит к увеличению активных токсинов в кишечнике и увеличению времени жизни этих веществ в кровотоке (см. рис. 2) [2; 27; 28; 39].
Следовательно, активность GUSB влияет на физиологическую активность и токсичность различных лекарств и ксенобиотиков [7]. Кроме того, бактериальная активность GUSB в слепой кишке задерживает элиминацию эндокриноразрушающего агента, бисфенола A.
Кроме отрицательного воздействия, GUSB необходим для рециркуляции важных эндогенных молекул. Например, из глицирри-зина, диглюкуронидного конъюгата глицирре- тиновой кислоты можно получить глицирре-тиновую кислоту и моноглюкуронид глицирре-тиновой кислоты, чья биологическая активность выше, чем у соответствующих глюкуронидов [1]. Также известно, что эффективность церамид-глюкуронида против рака толстой кишки была связанна с активность GUSR, так как она продуцирует биоактивные церамиды (рис. 3) [6].
В кишечной микрофлоре GUS представляет собой лизосомальную экзогликозидазу, участвующую в деградации гликозаминогликанов клеточных мембран и внеклеточного матрикса нормальных и раковых тканей слизистой толстой кишки. Ее активность обычно увеличивается при различных катаболических состояниях. При легком окислительном стрессе некоторые лизосомы разрушаются и выделяют в цитозоль гидролитические ферменты, что сопровождается апоптозом и дальнейшим выделением гидролитических ферментов из клеток [38].
Сывороточная активность GUS у человека определяется поступлением собственно- го фермента из тканей и деятельностью кишечных бактерий (Escherichia coli, Peptostreptococcus, Bacteroides и Clostridia) (рис. 3) [38]. Оценка активности лизосомальных гидролаз в сыворотке и моче может быть полезна в диагностике колоректальной аденокарциномы [3; 16; 21]. Например, у пациентов, потребляющих большое количество мяса, активность β-глюкуронидазы выше, чем у людей на вегетарианской диете [34].
Методы выделения, очистки и определение активности β -глюкуронидазы
Tamura и др. проводили оценку активности фермента со следующими модификациями: кишечные суспензии (1:100) в фосфатном буфере с рН 7 и добавляли 0,05 мл 0,12 М п-нитрофенил-в-D-глюкуронида и инкубировали при 37 °С в течение 1 часа, реакцию останавливали с помощью 0,4 М глицин-NaOH буфера (рН 10,5) и далее центрифуги-
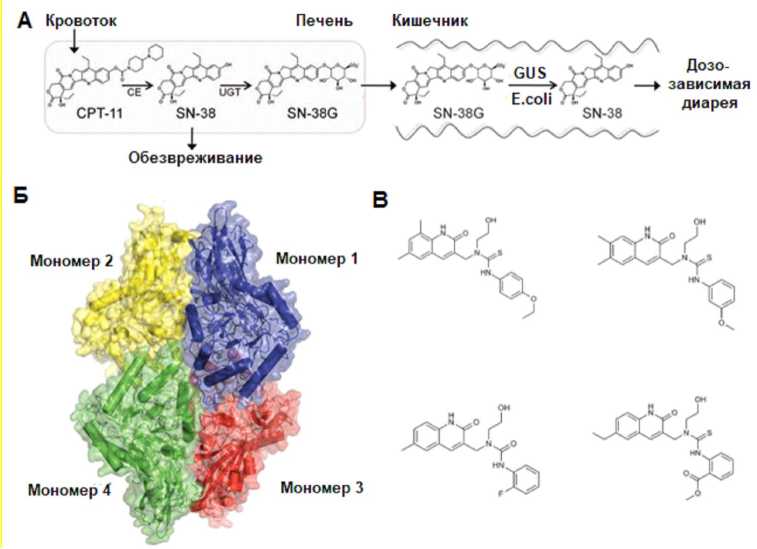
Рис. 2. Метаболизм CPT-11 и β -глюкуронидаза E. coli
A. Внутривенно введенный CPT-11 активируется карбоксилэстеразами (CE) до SN-38. В печени СН-38 инактивируется путем глюкуронирования, и SN-38G отправляется в кишечник, где бактерии вновь удаляют глюкуронид, а свободный активный SN-38 в просвете кишечника вызывает дозозависимую диарею.
о
B. Кристаллическая структура тетрамера b-глюкуронидазы E. coli с разрешением 2,5 Α C. Четыре селективных бактериальных ингибитора b-глюкуронидазы, идентифицированных с помощью высокопроизводительного скрининга [2]
ровали при 4500 g в течение 5 минут. Абсорбцию надосадочной жидкости оценивали спектрометрически при длине волны 400 нм. Калибровочный график был построен с использованием п-нитрофенола. Анализ концентрации белка в гомогенатах, полученных путем разрушения клеток аналогичного количества кишечного содержимого, проводился с использованием метода Брэдфорда. Активность β -глюкуронидазы регистрировали в виде микромолей п-нитрофенола, высвобождаемых через 60 минут на грамм белка кишечного содержимого [4].
Для анализа активности β-глюкуронида-зы также применялись хромогенные субстраты такие как индоксил-β-D-глюкуронид (IBDG). Изменения ферментативной активно- сти проводили спектрофотометрическим методом с использованием Microplate Reader ELx 808 (Biowhittaker, Walkersville, MA, USA) при 44,5 °C и 450 нм. Показания оптической плотности снимали сразу после добавления субстрата, а именно в момент времени 0 и при увеличении времени инкубации (2, 3, 5, 7, 21 часа), чтобы оценить влияние периода инкубации на экспрессию фермента [5].
Применение β-глюкуронидазыв лечении колоректального рака
Условно-патогенные бактерии локализованные в желудочно-кишечной тракте часто возбудителями некоторых заболеваний, но фармацевтические компании разрабатывают
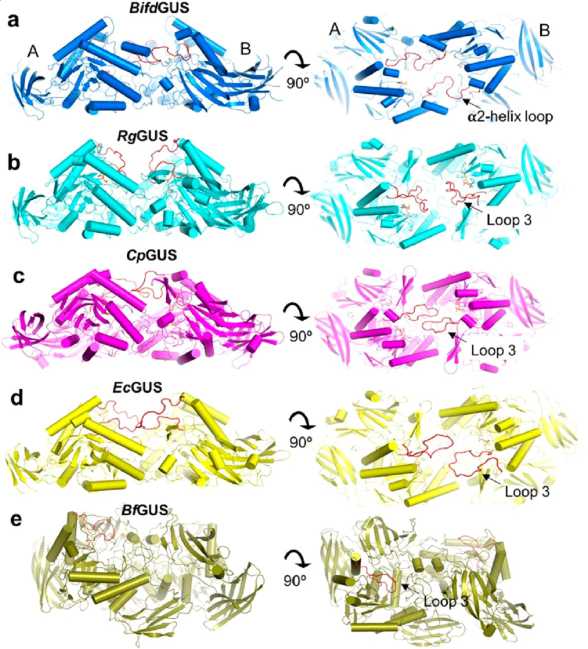
Рис. 3. Сравнение димерных структур GUSs у основных представителей бактерий
Примечание . Вид с верху и сбоку (a) Bifd GUS – Bifidobacterium dentium ; (b) Rg GUS – Ruminococcus gnavus ; (c) Cp GUS – Clostridium perfringens; (d) Ec GUS – Escherichia coli and (e) Bf GUS – Bacteroides fragilis . Красным цветом выделены петли, расположенные на периферии TIM-ствола (loop 3), либо в области скопления альфа-спиралей (a2-helix loop). Каждая петля альфа спирали у Bifd GUS (а) достигает участка соседней субъединицы. Петли (loop 3) у Cp GUS (c) и Ec GUS (d) простирается от своей до соседней субъединицы. И в тоже время у Rg GUS (b) не контактирует с соседней субъединицей. Димерная структура Bf GUS (e) ориентирована иначе, чем у других, поскольку активный участок двух мономеров направлен в противоположные стороны [6].
новые подходы по их использованию для лечения некоторых видов рака, что может стать «революцией» в медицинской сфере. Недавние результаты показали, что пациенты с высоким уровнем условно-патогенных кишечных бактерий более чувствительны к современной иммунотерапии вследствие чего биотехнологические компании начали конкурировать в разработке лекарств для борьбы с раком на основе использования микроорганизмов. Одним из таких примеров является PD-1, способствующий борьбе с раком, стимулируя клетки иммунной системы организма.
Бактерии, которые были модифицированы для селективной противоопухолевой активации проактивных противораковых агентов, были исследованы как перспективный подход для достижения более селективной терапии CRC [11; 19]. В данном исследовании была рассмотрена возможность усиления действия противоопухолевого препарата CPT-11 путем систематического введения Е.coli, которые были сконструированы для экспрессии β -глю-куронидазы, которая может превращать SN-38G в SN-38 и увеличивать противораковую активность от SN-38G до культивируемых раковых клеток примерно в 100 раз.
Существует два основных преимущества использования E. coli в качестве средства доставки и активации пролекарства. Во-первых, кишечная палочка способна избирательно колонизировать солидные опухоли, обеспечивая высокий коэффициент колонизации опухоли/нор-мальной ткани примерно в 10000 раз. Во-вторых, в отличие от липосом, антител или вирусов с недостаточной репликацией, бактерии могут размножаться в опухолях. Длительная колонизация опухолей может позволить многократное введение пролекарства после одной инъекции E.coli. Также было выявлены и недостатки, а именно снижение эффективности терапия с использованием b-глюкуронидазы: 1) медленное поглощение глюкуронидных соединений в E. coli может снижать скорость гидролиза пролекарства; 2) преимущественное накопление E. coli в некротических областях опухолей может препятствовать эффективному контакту систематически назначаемых препаратов с b-глюкуронидазой. Данное исследование показывает, что как клеточное, так и пространственное распределение b-глюкуронидазы и, возможно, других терапевтических ферментов может быть важным барьером для эффективной терапии рака основе использования бактерий.
Заключение
Колоректальный рак является третьим по частоте заболеваемости в мире и поэтому изучение данной темы является актуальной проблемой. Данное заболевание может развиваться из-за нарушений кишечной микрофлоры, в том числе и из-за повышения активности β -глю-куронидазы. Поэтому использование ее в качестве биомаркера для обнаружения и предотвращения развития CRC на ранних этапах является важным шагом в борьбе с этой болезнью. Помимо этого, были проведены исследования по применению бактериальной GUSB E. coli для борьбы с раком, как элемент комплексной химиотерапии, который усиливал действие противоопухолевого препарата CPT-11, переводя его в активную форму. Дальнейшее изучение β -глюкуронидазы и ее роль в развитии колоректального рака может поспособствовать снижению уровня заболеваемости и смертности по данному заболеванию.
Список литературы Система бета-глюкуронидазы, кишечная микрофлора и развитие опухолей толстой кишки
- A Metagenomic Р-Glucuronidase Uncovers a Core Adaptive Function of the Human Intestinal Microbiome / K. Gloux [et al.] // Proc. Natl. Acad. Sci. USA. - 2010. - Vol. 108, suppl. 1. - P. 4539-4546. DOI: https://doi.org/10.1073/pnas. 1000066107.
- Alleviating Cancer Drug Toxicity by Inhibiting a Bacterial Enzyme / B. D. Wallace [et al.] // Science. -2010. - Vol. 330, iss. 6005. - P. 831-835. DOI: https:// doi.org/10.1126/science. 1191175.
- Altobelli, E. Role of Urinary Biomarkers in the Diagnosis of Adenoma and Colorectal Cancer: a Systematic Review and Meta-Analysis / E. Altobelli, P. M. Angeletti, G. Latella // J. Cancer. 2016. - Vol. 7, № 14. - P. 1984-2004. DOI: https://doi.org/10.7150/ jca. 16244.
- Р-Glucuronidase Activity Determination as an Indirect Estimate of Escherichia Coli: Development of a Miniaturized Assay and Its Application to Seawater Samples / G. Caruso [et al.] // J. Clin. Microbiol. Biochem. Technol. - 2017. - Vol. 3, № 3. - P. 46-50. DOI: https://doi.org/10.17352/jcmbt.000027.
- Р-Glucuronidase Activity in Germ-Free, Monoassociated and Conventional Mice / M. E. Cardona, E. Norin, T. Midtvedt // Mcrob. Ecol. Health Dis. - 2009. -Vol. 18, № 1. - P. 38-41. DOI: https://doi.org/10.1080/ 08910600600733264.
- ß-Glucuronidases of Opportunistic Bacteria are the Major Contributors to Xenobiotic-Induced toxicity in the Gut / P. Dashnyam, R. Mudududdla, T.J. Hsieh // Sci. Rep. - 2018. - Vol. 8, № 1. - P. e16372. DOI: https:/ /doi.org/10.1038/s41598-018-34678-z.
- Carmody, R. N. Host-Microbial Interactions in the Metabolism of Therapeutic and Diet-Derived Xenobiotics / R. N. Carmody, P. J. Turnbaugh // J. Clin. Invest. - 2014. - Vol. 124, № 10. - P. 4173-4181. DOI: https://doi.org/10.1172/JCI72335.
- Colorectal Cancer Screening in the United States: Trends from 2008 to 2015 and Variation by Health Insurance Coverage / J. S. de Moor [et al.] // Prev. Med. -2018. - Vol. 112. - P. 199-206. DOI: https://doi.org/ 10.1016/j.ypmed.2018.05.001.
- Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health / N. Ma [et al.] // Curr. Protein Pept. Sci. - 2017. -Vol. 18, № 8. - P. 795-808. DOI: https://doi.org/10.2174/ 1389203718666170216153505.
- Familial Risk and Heritability of Colorectal Cancer in the Nordic Twin Study of Cancer / R. E. Graff [et al.] // Clin. Gastroenterol. Hepatol. - 2017. - Vol. 15, № 8. - P. 1256-1264. DOI: https://doi.org/10.1016/ j.cgh.2016.12.041.
- Forbes, N. S. Engineering the Perfect (Bacterial) Cancer Therapy / N. S. Forbes // Nat. Rev. Cancer. - 2010. - Vol. 10. - P. 785-794. DOI: https:// doi.org/10.1038/nrc2934.
- Fusobacterium is Associated with Colorectal Adenomas / A. N. McCoy [et al.] // PLoS One. - 2013. - Vol. 8, № 1. - P. e53653. DOI: https://doi.org/10.1371/ journal.pone.0053653.
- Fusobacterium Nucleatum Infection is Prevalent in Human Colorectal Carcinoma / M. Castellarin [et al.] // Genome Res. - 2012. - Vol. 22, №2. - P. 299-306. DOI: https://doi.org/10.1101/ gr.126516.111.
- Gut Bacteria and Their Metabolites: Which One is the Defendant for Colorectal Cancer? / S. Tarashi [et al.] // Microorganisms. - 2019. - Vol. 7, № 11. - P. e561. DOI: https://doi.org/10.3390/ microorganisms7110561.
- Gut Microbiome Development Along the Colorectal Adenoma-Carcinoma Sequence / Q. Feng [et al.] // Nat Commun. - 2015. - Vol. 11. - P. e6528. DOI: https://doi.org/10.1038/ncomms7528.
- Häuselmann, I. Altered Tumor-Cell Glycosylation Promotes Metastasis / I. Häuselmann, L. Borsig // Front. Oncol. - 2014. - Vol. 4. - P. e28. DOI: https://doi.org/10.3389/fonc.2014.00028.
- Human Gut Microbiome and Risk for Colorectal Cancer / J. Ahn [et al.] // J. Natl. Cancer Inst. - 2013. - Vol. 105, №24. - P. 1907-1911. DOI: https://doi.org/10.1093/jnci/djt300.
- Identification of Novel Mutations by Exome Sequencing in African American Colorectal Cancer Patients / H. Ashktorab [et al.] // Cancer. - 2015. - Vol. 121, № 1. - P. 34-42. DOI: https://doi.org/10.1002/cncr.28922.
- Lehouritis, P. Bacterial-Directed Enzyme Prodrug Therapy / P. Lehouritis, C. Springer, M. Tangney // J. Control Release. - 2013. - Vol. 170. -P. 120-131. DOI: https://doi.org/10.1016/ j.jconrel.2013.05.005.
- Leystra, A. A. Gut Microbiota Influences Experimental Outcomes in Mouse Models of Colorectal Cancer / A. A. Leystra, M. L. Clapper // Genes (Basel). -2019. - Vol. 10, № 11. - P. e900. DOI: https://doi.org/ 10.3390/genes10110900.
- Lysosomal Exoglycosidases and Cathepsin D in Colon Adenocarcinoma / N. Waszkiewicz, B. Zalewska-Szajda [et al.] // Pol. Arch. Med. Wewn. -2012. - Vol. 122, № 11. - P. 551-556.
- Major Anaerobic Bacteria Responsible for the Production of Carcinogenic Acetaldehyde from Ethanol in the Colon and Rectum / A. Tsuruya [et al.] // Alcohol Alcohol. - 2016. - Vol. 51, № 4. - P. 395-401. DOI: https://doi.org/10.1093/alcalc/agv135.
- Meta-Analysis of Fecal Metagenomes Reveals Global Microbial Signatures That are Specific for Colorectal Cancer / J. Wirbel [et al.] // Nat. Med. -2019. - Vol. 25, № 4. - P. 679-689. DOI: https://doi.org/ 10.1038/s41591-019-0406-6.
- Metagenomic and Metabolomic Analyses Reveal Distinct Stage-Specific Phenotypes of the Gut Microbiota in Colorectal Cancer / S. Yachida [et al.] // Nat. Med. - 2019. - Vol. 25, № 6. - P. 968-976. DOI: https://doi.org/10.1038/s41591-019-0458-7.
- Human ß-Glucuronidase: Structure, Function, and Application in Enzyme Replacement Therapy / H. Naz [et al.] // Rejuvenation Res. - 2013. -Vol. 16, № 5. - P. 352-363. DOI: https://doi.org/10.1089/ rej.2013.1407.
- Novel Colon Cancer Susceptibility Variants Identified from a Genome-Wide Association Study in African Americans / H. Wang [et al.] // Int. J. Cancer. -2017. - Vol. 140, № 12. - P. 2728-2733. DOI: https:// doi.org/10.1002/ijc.30687.
- Pellock, S. J. Glucuronides in the Gut: Sugar-Driven Symbioses Between Microbe and Host / S. J. Pellock, M. R. Redinbo // J. Biol. Chem. - 2017. -Vol. 292, № 21. - P. 8569-8576. DOI: https://doi.org/ 10.1074/jbc.R116.767434.
- Pharmacological Targeting of Bacterial ß-Glucuronidase Alleciates Nonsteroidal Anti-Inflammatory Drug-Induced Enteropathy in Mice / A. LoGuidice [et al.] // J. Pharmacol. Exp. Ther. - 2012. -Vol. 341, № 2. - P. 447-454. DOI: https://doi.org/ 10.1124/jpet. 111.191122.
- Potential of Fecal Microbiota for Early-Stage Detection of Colorectal Cancer / G. Zeller [et al.] // Mol. Syst. Biol. - 2014. - Vol. 10. - P. e766. DOI: https:/ /doi.org/10.15252/msb.20145645.
- Ridlon, J. M. Taurocholic Acid Metabolism by Gut Microbes and Colon Cancer / J. M. Ridlon, P. G. Wolf, H. R. Gaskins // Gut Microbes. - 2016. -Vol. 7, №№ 3. - P. 201-215. DOI: https://doi.org/10.1080/ 19490976.2016.1150414.
- Role of Intestinal Flora in Colorectal Cancer from the Metabolite Perspective: a Systematic Review / S. Han [et al.] // Cancer Manag. Res. - 2018. - Vol. 10. -P. 199-206. DOI: https://doi.org/10.2147/ CMAR.S153482.
- Saint-Georges-Chaumet, Y. Microbiota-Mitochondria Inter-Talk: Consequence for Microbiota-host Interaction / Y. Saint-Georges-Chaumet, M. Edeas // Pathog. Dis. - 2016. - Vol. 74, №№ 1. - P. ftv096. DOI: https://doi.org/10.1093/femspd/ftv096.
- Serum Beta-Glucuronidase in Colon Cancer Patients Dependent on Alcohol and Nicotine: Preliminary Report / N. Waszkiewicz [et al.] // Prog. Health Sci. - 2012. - Vol. 2, №№ 2. - P. 64-69. DOI: https:/ /doi.org/10.5604/17322693.1064081.
- Serum ß-Glucuronidase as a Potential Colon Cancer Marker: a Preliminary Study / N.Waszkiewicz [et al.] // Post^py Hig. Med. Dosw. - 2015. - Vol. 69. -P. 436-439. DOI: https://doi.org/10.5604/ 17322693.1148704.
- Shuwen, H. Can Mitochondria DNA Provide a Novel Biomarker for Evaluating the Risk and Prognosis of Colorectal Cancer? / H. Shuwen, Y. Xi, P. Yuefen // Dis. Markers. - 2017. - P. e5189803. DOI: https://doi.org/10.1155/2017/5189803.
- Siegel, R. L. Cancer Statistics, 2019 / R. L. Siegel, K. D. Miller, A. Jemal // C. A. Cancer J. Clin. - 2019. - Vol. 69. - P. 7-34. DOI: https://doi.org/ 10.3322/caac.21551.
- Superoxide-Hydrogen Peroxide Imbalance Interferes with Colorectal Cancer Cells Viability, Proliferation and Oxaliplatin Response / V. F. Azzolin [et al.] // Toxicol. In Vitro. - 2016. - Vol. 32. - P. 8-15. DOI: https://doi.org/10.1016/j.tiv.2015.12.001.
- The Biological Role of D-Glucaric Acid and its Derivatives: Potential Use in Medicine / R. Zoltaszek [et al.] // Post^py Hig. Med. Dosw. - 2008. - Vol. 62.-P. 451-462.
- The Microbial Pharmacists Within Us: a Metagenomic View of Xenobiotic Metabolism / P. Spanogiannopoulos [et al.] // Nat. Rev. Microbiol. -2016. - Vol. 14, №№ 5. - P. 273-287. DOI: https://doi.org/ 10.1038/nrmicro.2016.17.
- The Role of Fusobacterium nucleatum in Colorectal Cancer: from Carcinogenesis to Clinical Management / C. H. Sun [et al.] // Chronic Dis. Transl. Med. - 2019. - Vol. 5, №№ 3. - P. 178-187. DOI: https:// doi.org/10.1016/j.cdtm.2019.09.001.
- Thomas, A. M. Metagenomic Analysis of Colorectal Cancer Datasets Identifies Cross-Cohort Microbial Diagnostic Signatures and a Link with Choline Degradation / A. M. Thomas, P. Manghi, F. Asnicar // Nat. Med. - 2019. - Vol. 25, №№ 4. - P. 667-678. DOI: https://doi.org/10.1038/s41591-019-0405-7.
- Vinke, P. C. The Role of Supplemental Complex Dietary Carbohydrates and Gut Microbiota in Promoting Cardiometabolic and Immunological Health in Obesity: Lessons from Healthy Non-Obese Individuals / P. C. Vinke, S. El Aidy, G. van Dijk // Front Nutr. - 2017. - Vol. 4. - P. e34. DOI: https://doi.org/ 10.3389/fnut.2017.00034.


