Система биотехнологических методов в селекционной технологии моркови (daucus carota L.)
Автор: Тюкавин Г.Б.
Журнал: Овощи России @vegetables
Рубрика: Современные направления селекции овощных культур
Статья в выпуске: 1 (3), 2009 года.
Бесплатный доступ
Разработана система биотехнологических методов для селекционной технологии моркови, включающая: способы стерилизации исходных эксплантов; регенерационную систему из каллусов; культуру зиготических зародышей; культуру неопыленных семяпочек; культуру пыльников и генетическую трансформацию. Теоретические разработки были использованы при получении сорта моркови столовой Соната, перспективных гибридов F 1 и трансгенных семей с повышенной устойчивостью к Fusarium avenaceum.
Морковь, гаплоиды, андрогенез. гиногенез, экспланты, зиготические зародыши. трансгеноз
Короткий адрес: https://sciup.org/14024764
IDR: 14024764 | УДК: 573.66:631.52:635.132
Текст научной статьи Система биотехнологических методов в селекционной технологии моркови (daucus carota L.)
М орковь служила одним из важнейших модельных объектов при изучении фундаментальных вопросов физиологии и генетики культивируемых клеток и тканей растений, которые, в свою очередь, способствовали пониманию процессов, происходящих на уровне организма. При изучении морфогенеза в каллус-ных культурах моркови была установлена двухфазность органогенеза и обоснована гипотеза о том, что направление морфогенеза определяется концентрацией и соотношением внесенных в среду стимуляторов роста ауксиновой и цитокининовой природы (Бутенко, 1964). Суспензионная культура моркови позволила вскрыть механизмы образования и развития зародышей в культуре in vitro , что было трудно, а порой и невозможно, сделать при изучении эмбриогенеза in vivo (Ammirato, 1986). В прикладном отношении использование методов биотехнологии растений ограничивалось возможностью использования соматического эмбриогенеза для размножения родительских инбредных линий и отбора in vitro для получения новых источников устойчивости к болезням (Meredith, Lawrence, 1981). Использование соматического эмбриогенеза позволило разработать технологию производства искусственных семян, что открыло новый путь к сохранению и поддержанию ценных селекционных линий (Kitto, Janick, 1985;
Kamada et al., 1989; Liu et al., 1992). Нерешенными оставались вопросы культуры зародышей, завязей и семяпочек, пыльников in vitro и получения трансгенных растений моркови с новыми хозяйственно полезными признаками. Решению этих вопросов были посвящены исследования, проводимые во ВНИИССОК с 1983 года.
В результате проведенных исследований разработан ряд основополагающих биотехнологических методов, использование которых позволяет получать за короткое время исходный материал для селекции моркови с нужными для селекционера признаками.
Важным условием при разработке биотехнологических методов является выбор исходного экспланта и его стерилизация. Из литературных источников следовало, что для стерилизации различных эксплантов моркови (корнеплоды, семена) использовали 0,1% раствор сулемы (Бутенко, 1964; Калинин и др., 1980), 0,4% раствор гипохлорита Na (Masuda et al., 1981) и этанол (Плащев, 1982). В наших исследованиях был изучен широкий спектр стерилизующих веществ, в результате чего были предложены следующие способы стерилизации различных эксплантов моркови.
-
1. Для получения стерильной культуры зародышей; а) из семян – предварительная стерилизация 96% этанолом в
-
2. Для получения стерильной культуры пыльников и семяпочек стерилизация зонтичков и/или бутонов 10% водным раствором хлорамина «Б» в течение 2030 мин. Для стерилизации бутонов весьма эффективным способом является обработка их 0,5% водным раствором сулемы.
течение двух минут, а затем стерилизация 0,5% водным раствором сулемы в течение 20-30 минут; б) из завязей – предварительная стерилизация 96 % этанолом в течение 1 минуты, а затем стерилизация 0,1% водным раствором сулемы в течение 20-30 минут. Прорастание выделенных зародышей моркови на питательных средах в условиях in vitro составило в среднем 83,2 + 1,5% при доверительном интервале 80,286,0%. Существенных морфологических изменений у растений, полученных в условиях in vitro , не отмечалось.
Последнее время для стерилизации эксплантов нами используются шприцы. На наш взгляд при этом достигается ряд преимуществ:
-
а) снижается расход стерилизующих растворов;
-
б) обеспечивается максимальное смачивание эксплантов;
-
в) происходит лучшая промывка эксплантов.
Ключевым моментом практической ре- ализации решения тех или иных задач в селекционно-генетических исследованиях с использованием методов биотехнологии растений является разработка систем регенерации целых растений из отдельных клеток и/или их групп, а также различных органов.
В ранних исследованиях по изучению органогенеза в каллусных тканях моркови было показано, что переход ткани к образованию корней, а затем почек наблюдался после переноса ткани со среды с ИУК или аденином на среду без добавления активных веществ. Органогенезу предшествовало появление определенного градиента в активности ауксиноксидазы между верхней частью ткани и нижней. В верхней части активность ауксиноксидазы была значительно выше, и именно здесь наблюдалось образование стеблевых почек (Pilet, 1961).
Более детально и целенаправленно исследования по органогенезу в культуре каллусных тканей моркови были проведены в ИФР. Наиболее интересным обстоятельством этих исследований явилось установление факта фазности процесса органогенеза. Первая фаза органогенеза – переход недифференцированно растущей ткани к образованию регенерационной меристемы и закладке «зародышеподобных» структур – происходит под влиянием добавления к питательной среде производных нуклеинового обмена и аминокислот. Эта фаза может быть названа фазой меристематизации и дифференциации зачатков органов. Вторая фаза органогенеза – переход возникших образований к активному росту стеблевых органов и корней – происходит у моркови при введении в питательную среду антиметаболитов нуклеиново-белкового обмена или ауксинов (Бутенко, 1964). В настоящее время для индукции каллуса из корнеплодов используют среду МС с добавлением 2,0 мг/л 2,4-Д и 0,2 мг/л кинетина. Для индукции стеблевого органогенеза используют среду МС, содержащую 0,2 мг/л БАП (Калашникова, 1996).
Для индукции каллуса и последующего получения растений в качестве эксплантов также используются гипокотили проростков (Masuda et al., 1981; Sv imkova', 1998; Ипатова, 2004) и сегменты листовых черешков (Ипатова, 2004).
В наших исследованиях каллусные культуры получали из зиготических зародышей моркови на основной среде МСм (Masuda et al., 1981) В результате была разработана регенерационная система, заключающаяся в следующем:
-
1 – индукция каллуса проводится
на среде МСм с 0,2 мг/л 2,4-Д;
-
2 – регенерация проростков из каллусов – на среде
МСм с 0,1 мг/л кинетина;
-
3 – подращивание
и укоренение растений-регенерантов моркови – на фильтровальных мостиках в жидкой среде МСм без гормонов или с добавлением 0,1 мг/л кинетина.
Разработанная нами регенерационная система была с успехом использована при генетической трансформации моркови репортерным геном GUS, геном растительного дефензина из семян редьки Rs и геном Тауматин II (Шушкова и др.,1998), а также геном итерлейкина-18 человека (Дейнеко и др., 2004).
Культура изолированных зиготических зародышей широко используется у различных культур для решения ряда генетико-селекционных задач. Основными из них являются: 1 – управление первыми этапами онтогенеза – эмбриогенеза (например, использование генетического признака – автономности); 2 – сокращение и снятие периода покоя семян; 3 – создание банка растительных тканей ценных видов растений; 4 – преодоление нескрещиваемости при прогамной и постгамной несовместимости; 5 – получение апомиктичных растений и т.д.
Исследования по культуре зиготических зародышей моркови in vitro не проводились. В этом плане наши исследования являются оригинальными. В результате исследований был разработан состав питательной среды, позволяющий получать растения из изолированных зародышей на разных стадиях развития. Установлено, что пороговым сроком отделения завязей от материнского растения для культивирования завязей, семяпочек и зародышей in vitro является четыре недели после опыления. К этому времени зародыш достигает 1/3-1/2 своего окончательного размера in vivo . Разработанные методические приемы были использованы для культивирования апомиктичных зародышей. В результате было получено 30 линий, две из которых были отобраны как перспективные формы для селекции (Тюкавин др., 1988).
Культура зиготических зародышей моркови in vitro может быть также использована для получения межвидовых и межродовых гибридов в тех случаях, когда гибридные зародыши полностью не развиваются на материнском растении, и требуется их доращивание и получение растений в условиях in vitro .
Гаплоидия – одно из важнейших прикладных направлений генетики и селекции. Путем удвоения числа хромосом у гаплоидов можно сразу создать гомозиготные линии, на выделение которых при селекции на гетерозис у перекрестноопыляющихся культур приходится затрачивать до 7-10 лет (однолетние растения) и/или 14-20 лет (двулетние растения). Экспериментально гаплоидные растения можно получить разными методами: 1 – отбор близнецов; 2 – межвидовые скрещивания; 3 – радиологи- ческий метод; 4 – гибридизация на разных уровнях плоидности. В последнее время для этой цели широко используются методы биотехнологии растений, а именно анд-рогенез и гиногенез in vitro.
Морковь имеет довольно мелкие генеративные органы и в начале 80-х годов ХХ века высказывалось скептическое мнение о возможности получения гаплоидов с использованием метода андрогенеза in vitro (Sung, Dudits, 1981). Тем не менее, с 1983 года нами были начаты исследования в этом направлении. Разработка современных методов для ускоренного создания гомозиготных линий является весьма актуальной задачей в селекции моркови (Stein, Nothnagel, 1995; Simon, 1997). Разработкой метода андрогенеза in vitro для моркови занимались исследователи Дании (Andresen et al., 1990), Японии (Hu et al., 1993) и Польши (Go' recka, Krzyz'anowska, 2001). В этих исследованиях для индукции андрогенных структур использовалась основная среда Б5 с высоким содержанием сахарозы 10-14 г/л и низким содержанием фитогормонов (Andresen et al., 1990; Go' recka, Krzyz'anowska, 2001) и основная среда МС с высоким содержанием ауксинов (Hu et al., 1993). Кроме того, в этих работах не отражены вопросы цитоэмбриологии образования андрогенных структур и не дается оценка полученных андрогенных растений современными методами молекулярного анализа. Также проблематичным остается вопрос адаптации андрогенных растений-регенерантов (Go' recki et al., 2001).
В наших исследованиях изучены все аспекты метода андрогенеза in vitro и разработана технология получения удвоенных гаплоидов моркови.
Было установлено, что пыльники моркови являются гормонозависимыми. Первичными эксплантами служат бутоны, в пыльниках которых содержатся одноядерные микроспоры, находящиеся на стадии развития, предшествующей их поляризации, и на начальной стадии поляризации. Выращивание донорных растений следует проводить в контролируемых условиях, что является залогом воспроизводимости результатов экспериментов.
Цитоэмбриологическими исследованиями установлено, что развитие андрогенных структур происходит как при равном, так и при неравном делении микроспор. При равном делении микроспор закладку проэмбрио отмечали как в обеих клетках, так и в одной. В последнем случае вторая клетка не развивалась. При неравном делении микроспор, когда в результате митоза образуются генеративная и вегетативная клетки, но размеры первой больше обычных, возможны три пути образования эмбриоидов:
-
1. Эмбриоиды развиваются из вегетативной клетки; генеративная клетка при этом деградирует.
-
2. Эмбриоиды развиваются из генеративной клетки; развитие вегетативной клетки при этом подавлено.
-
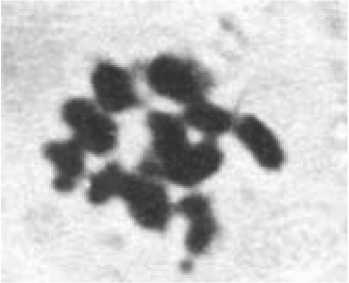
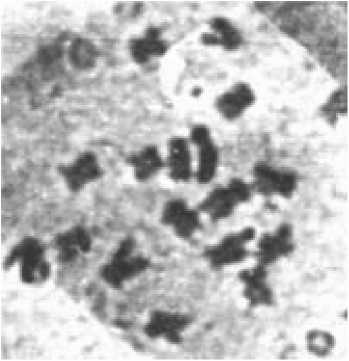
3. Одновременное развитие эмбриоидов из вегетативной и генеративной клеток; генеративная клетка отличается меньшими размерами по сравнению с вегетативной. В процессе вторичного эмбриогенеза и регенерации растений в системе in vitro происходит смена плоидности от n до 2n (рис. 1).
А
А
Рис. 1. А - гаплоидная метафаза (n=9) и
Б - диплоидная (2n=18) метафазы в меристеме клеток корня растений-регенерантов моркови R0 ( х 90)
Технология получения андрогенных растений-регенерантов в культуре пыльников моркови заключается в следующем:
-
1 – стерилизацию бутонов моркови проводят 10% водным раствором хлорамина «Б» в течение 20-30 мин или 0,5% водным раствором сулемы с добавлением к нему в качестве эмульгатора твин-20 (Serva, США) в количестве 1 капля на 100 мл раствора в течение 20 мин;
-
2 – бутоны в течение 2-4 недель культивируют в темноте (в термостате при 25°С) на агаризованной среде МСм с 0,2 мг/л 2,4-Д;
-
3 – разросшиеся пыльники выделяют из бутонов, переносят в пробирки на
свежую среду того же состава и культивируют на этажерочной светоустановке с люминесцентными лампами при освещенности 2-3 клк, фотопериоде 16 ч и температуре 20…25°С до образования эмбриоидов и/или эмбриогенного каллуса (5-6 нед);
-
4 – эмбриоиды и/или эмбриогенный каллус переносят на фильтровальные мостики в стеклянные пробирки с жидкой средой МСм, содержащей 0,1 мг/л кинетина, где начинается процесс образования проростков либо из первичных, либо из вторичных эмбриоидов;
-
5 – подращивание и укоренение растений-регенерантов проводят на фильтровальных мостиках в стеклянных пробирках с жидкой безгормональной средой МСм;
-
6 – для адаптации in vivo растения-регенеранты моркови высаживают в торфяные или пластмассовые горшочки с почвосмесью и накрывают слегка перфорированными полиэтиленовыми пакетами или стеклянными (пластиковыми) стаканчиками. Период адаптации составляет 3-4 недели. Далее растения RА0 хорошо развиваются в типичных условиях выращивания защищенного и/или открытого грунта.
-
7 – хранение и яровизация корнеплодов
Рис. 2. Схема получения сорта моркови столовой Соната

-
R А0 осуществляют в обычных условиях;
-
8 – во время цветения растений R0 проводят самоопыление каждого андрогенного растения в отдельности;
-
9 – из полученных семян выращивают растения R А1 и проводят молекулярногенетический анализ;
-
10 – отобранные дигаплоидные линии в последующем используют в селекционных программах по получению сортов и F1 гетерозисных гибридов моркови.
Разработанная нами технология получения удвоенных гаплоидов позволяет получать генетически выровненный исходный материал для селекции F1 гетерозисных гибридов моркови за 2-3 года. Технология легко воспроизводима. Эффективность данной технологии подтверждена с использованием RAPD-технологии, основанной на амплификации геномной ДНК (Дорохов и др., 1996; Лаптева, 1999; Тюка-вин и др., 2001).
Использование метода андрогенеза in vitro моркови позволило получить исходный материал, который был использован при создании сорта моркови столовой Соната (рис.2; табл.1) и получении гибридов F1 во ВНИИО (Семенова и др., 2003).
1. Хозяйственные и биологические показатели нового сорта моркови столовой Соната в сравнении со стандартом – сортом Нантская 4 (Тюкавин и др., 2005; Тюкавин 2007а, 2007б)
|
Показатель |
Сорт |
+/-к к стандарту |
|
|
Нантская 4 |
Соната |
||
|
Ранняя урожайность корнеплодов, т/га |
37,30 |
36,90 |
- 0,40 |
|
Общая урожайность корнеплодов, т/га |
72,23 |
78,70 |
+ 6,47 |
|
Урожайность товарных, хозяйственно годных корнеплодов, т/га |
48,23 |
56,87 |
+ 8,64 |
|
Масса товарного корнеплода, г |
71,27 |
89,63 |
+ 18,36 |
|
Урожайность семян с одного растения, г |
27,00 |
30,05 |
+ 3,05 |
|
Развитие бактериоза на искусственном инфекционном фоне, % |
68,60 |
54,30 |
* - 14,30 |
|
Развитие бактериоза на естественном инфекционном фоне, % |
63,80 |
47,77 |
* -16,03 |
|
Вкусовая оценка корнеплодов, балл |
3,85 |
4,85 |
* +1,00 |
|
Содержание сухого вещества в корнеплодах, % |
10,74 |
12,59 |
* + 1,85 |
|
Сумма сахаров, % |
6,64 |
8,62 |
* + 1,98 |
|
Каротин, % |
12,15 |
18,48 |
* + 6,33 |
|
Содержание нитратов, мг/кг |
178,18 |
143,37 |
- 34,81 |
Примечание: * Указывает статистически значимые различия при НСР 05 .
Культура неоплодотворенных завязей и семяпочек (гиногенез in vitro ) является альтернативным методом получения гаплоидов и/или удвоенных гаплоидов по сравнению с культурой пыльников. Несмотря на то, что этот метод широко используется у ряда важных сельскохозяйственных культур, в доступной нам литературе о разработке этого метода у моркови нет никакой информации.
В процессе наших исследований, проводимых с 1988 года, был разработан метод гиногенеза in vitro для моркови с использованием неопыленных завязей и семяпочек. Было установлено, что женские генеративные органы так же, как и пыльники, являются гормонозависимыми. Первичными эксплантами служат бутоны, в которых семяпочки содержат семиклеточный или зрелый зародышевый мешок. Стадию развития зародышевого мешка можно определить по стадии развития микроспор или по размерам завязи.
Разработанная нами технология получения гиногенных растений в культуре не-опыленных семяпочек in vitro заключается в следующем:
-
1 – бутоны в течение двух недель культивируют в темноте (в термостате при 25 С) на агаризованной среде MСм с 0,2 мг/л 2,4-Д;
-
2 – из разросшихся завязей выделяют семяпочки и помещают на среду MСм с 0,2 мг/л 2,4-Д и культивируют до образования эмбриоидов (рис. 3) и/или эм-бриогенного каллуса которые, как правило, образуются у микропилярного конца семяпочек.
Последующие элементы технологий аналогичны с технологией для андрогене-за in vitro моркови.
Эффективность данной технологии подтверждена с использованием RAPD-технологии, основанной на амплификации геномной ДНК (Лаптева, 1999; Тюкавин и др., 2001).
С использованием метода гиногенеза был получен исходный материал для создания гибридов F1 во ВНИИО (Семенова и др., 2003)
Одним из приоритетных направлений современной биотехнологии растений является создание трансгенных растений. Хотя ведущими трансгенными культурами в мировом масштабе являются трансгенные соя, кукуруза, рапс и хлопчатник (ISAAA, 2004), с каждым годом растет и число испытаний овощных культур. К 2003 году общее количество полевых испытаний трансгенных овощных культур превысило 1200. Более 50% из них приходилось на томаты и только 1,3 % – на морковь.
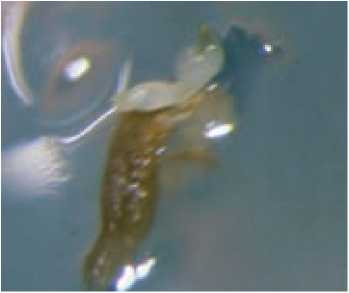
Рис. 3. Образование эмбриоидов в культуре неопыленных семяпочек моркови (гиногенез in vitro).
По моркови в период с 1993 по 2004 годы было проведено 17 полевых испытаний трансгенных форм. В первую очередь испытывали формы с повышенной устойчивостью к фитопатогенам (11 испытаний), 4 испытания проводили с формами, обладающими улучшенным качеством урожая и с 1999 года начаты полевые испытания трансгенных растений моркови, устойчивых к гербицидам.
Во второй половине 90-х годов ХХ века голландской фирмой Mogen на рынок были предложены трансгенные формы моркови с повышенной устойчивостью к грибным фитопатогенам Alternaria, Cercospora и Erysiphe. Повышенная ус- тойчивость к грибным фитопатогенам позволяет проводить механизированную уборку урожая.
В наших исследованиях была проведена модификация метода бактериальной трансформации моркови. В результате исследований было установлено, что лучшим вариантом для совместного культивирования агробактерий и каллуса моркови является использование фильтровальной бумаги для «подсушивания» и последующего культивирования. Установлено так же, что для трансформации каллусов моркови необходимо совместное культивирование их с агробактериями в течение 2-3 суток (Шушкова и др., 1998).
Разработана методика отбора трансгенных растений RТ1, …, n моркови с селективным геном npt II, суть которой заключается в следующем: семена стерилизуют коммерческим препаратом «Белизна» в течение 20-30 мин; помещают на фильтровальные мостики в стеклянные пробирки (21 200 мм) с жидкой безгормональной средой МСм (Masuda et al., 1981), содержащей кана-мицин в концентрации 100 мг/л; проращивание семян и выращивание растений проводят на свету; отбор растений проводят через четыре недели; растения, имеющие 2-3 настоящих листа и хорошо развитую корневую систему, высаживают в вазоны с почвой для адаптации in vivo; в течение 2-3 недель растения выдерживают при повышенной влажности воздуха (для этого растения закрываются перфорированными пластиковыми пакетами или стаканчиками); после адаптации проводится молекулярно-биологический анализ включения и экспрессии генов.
В результате исследований впервые получены трансгенные растения (аналоги сорта Нантская 4) с геном Таума-тин II, устойчивые к Fusarium ave-naceum.
Таким образом, во ВНИИССОК разработан ряд современных биотехнологических методов, направленных на ускоренное получение исходного селекционного материала моркови с заданными признаками.
Список литературы Система биотехнологических методов в селекционной технологии моркови (daucus carota L.)
- Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. -М.: Наука, 1964. -272 с.
- Дейнеко Е.В., Филипенко М.Л., Храпов Е.А., Загорская А.А., Филипенко Е.А., Тюкавин Г.Б., Шмыкова Н.А., Сенников С.В., Шумный В.К. Создание трансгенных растений табака и моркови с геном интерлейкина-18 человека//Биотехнология в растениеводстве, животноводстве и ветеринарии: Тез. докл. III международной научной конференции 19 октября 2004. -Москва, 2004. -С. 130-131.
- Дорохов Д.Б., Тюкавин Г.Б., Лаптева М.Н., Помозглова Г.Е., Соханова Н.М., Литвиненко М.В. Морфологическая, биохимическая и молекулярная оценка андрогенных растений моркови//Актуальные проблемы биотехнологии в растениеводстве, животноводстве и ветеринарии: Тез. конф. -М., 1996. -С. 24.
- Ипатова Н.В. Оценка исходного материала столовой моркови на устойчивость к фузариозу и альтернариозу с использованием методов традиционной и клеточной селекции: Автореф. дис.. канд. с.-х. наук. М., 2004 -21 с.
- Калашникова Е.А. Клеточная инженерия//Лабораторно-практические занятия по сельскохозяйственной биотехнологии. -М., -1996. -С. 3-57.
- Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. -Киев: Наукова думка, 1980. -488 с.
- Лаптева М.Н. Разработка методов молекулярной оценки селекционного материала основных овощных культур (лук, морковь, капуста белокочанная) на основе RAPD технологии: Автореф. дис.. канд. с.-х. наук. -М., 1999. -25 с.
- Плащев В.М. Действие нистатина на внутреннюю инфекцию семян моркови//Тр. по прикл. ботан., генет. и селекции ВНИИ растениеводства. -1982. -Т.71, Вып. 3. -С. 145-146.
- Семенова В.А., Тюкавин Г.Б., Клыгина Т.Э. Морфологическая характеристика гиногенных и андрогенных растений моркови//Селекция, семеноводство и биотехнологии овощных и бахчевых культур: Докл. III Междунар. конф. посв. памяти Б.В. Квасникова. -М., 2003. с. 404-408.
- Тюкавин Г.Б. Биотехнологические основы селекционной технологии моркови (Daucus carota L.): Автореф. дис.. д-ра биол. наук. -М., 2007а. -50 с.
- Тюкавин Г.Б. Основы биотехнологии моркови: Монография/ВНИИССОК. -М., 2007б. -480 с., цв. илл. -8 с.
- Тюкавин Г.Б., Рыбалко А.А., Шмыкова Н.А., Селянин И.Г. Андрогенез in vitro -метод ускоренного получения сорта столовой моркови Соната//Состояние и проблемы научного обеспечения овощеводства защищенного грунта: Материалы II Междунар. науч. конф. 21-23 ноября 2005 г. -М., 2005. -С. 144-147.
- Тюкавин Г.Б., Супрунова Т.П., Шмыкова Н.А., Домблидес А.С., Дорохов Д.Б., Клыгина Т.Э. Изучение гаметоклональной изменчивости у моркови сорта Нантская 4//Овощеводство -состояние, проблемы перспективы: Научные труды (к 70-летию ВНИИО) В. 2 т. -М., 2001. -Т1. -С. 157-161.
- Тюкавин Г.Б., Тимин Н.И., Валеева З.Т., Буракова И.А. Эмбриокультура в создании константных линий моркови//Биология культивируемых клеток и биотехнология: Тез. докл. Междунар. конф., 2-6 авг. 1988. -Новосибирск, 1988. -Ч. 2. -С. 239-240.
- Шушкова Т.В., Тюкавин Г.Б., Долгов С.В. Генетическая трансформация моркови (Daucus carota L.)//Новые направления биотехнологии: Тез. докл. VIII конф. 27 -29 апреля 1998. -М., 1998а. -C. 34.
- Ammirato P.V. Carrot//Handbook of plant cell culture/Eds D.A. Evans et al. -New York: Macmillan, 1986. -V.4. -P. 457-499.
- Andersen S.B., Christiansen J., Farestveit D. Carrot (Daucus carota L.): In vitro production of haploids and field trials//Biotechnology in agriculture and forestry: Haploids in crop improvement/Ed. YP.S. Bajaj -Berlin Heidelberg.: Springer-Verlag, 1990. -V.12. -P. 393-402.
- Gorecka, Krzyzanowska D. The use androgenesis in vitro to obtain homozygous lines of vegetable plants//Vegetable Crops Bull. -2001. -V.54. -P. 7-11.
- Gorecki R., Gorecka, Krzyzanowska D., Kozik E., Nowak R., Adasik B. Rooting and adaptation of androgenic carrot plants//Vegetable Crops Bull. -2001. -V.54. -P. 25-28.
- Hu K.L., Matsubara S., Murakami K. Haploid plant production by anther culture in carrot (Daucus carota L.)//J. Japan Soc. Hort. Sci. -1993. -V.62, N. 3. -P. 561-565.
- Kamada H., Kobayashi K., Kiyosue T., Harada H. Stress induced somatic embryogenesis in carrot and its applications to synthetic seed production//In vitro Cell Div. Biol. -1989. -V.25. -P. 1163-1168.
- Kitto S.L., Janick J. Production of synthetic seeds by encapsulating embryos of carrot//J. Am. Soc. Hortic. Sci. -1985. -V.110. -P. 277-282.
- Liu J.R., Jeon J.H., Yang S.G., Lee H.S., Song N.M., Jeong W.J. Dry type of carrot (Daucus carota L.) artificial seeds//Scientia Horticulture. -1992. -V.51. -P. 1-11.
- Masuda K., Kikuta Y., Okazava Y. A. Revision of the medium for somatic embryogenesis in carrot suspension culture//J. Fac. Agr. Hokkaido Univ. -1981. -V.60. -P. 183-193.
- Meredith C.P., Lawrence R.H. Report of the vegetable crops round-table//Environ and Exp. Bot. -1981. -V.21, N. 3-4. -P. 401-405.
- Pilet P.E. Auxins and the process of aging in root cells//Plant growth regulation/4th Internet. Conf. -Iowa, Univ. Press, 1961. -P. 167-179.
- Simkova H. Methylation of mitochondrial DNA in carrot (Daucus carota L.)//Plant Cell Reports. -1998. -V.17. -P. 220-224.
- Simon P.W. Improvement of carrots for U.S. production with classical and modern techniques//J. Appl. Genet. -1997. -38A. -P. 1-4.
- Stein M., Nothnagel T. Some remarks on carrot breeding (Daucus carota sativus Hoffm.)//Plant Breed. -1995. -V. 114. N. 1. -P. 1-11.
- Sung Z.R., Dudits D. Carrot Somatic Cell Genetics//Genetic engineering in the plant sciences/Ed. N.J. Panopoulos -N. Y., 1981. -P. 11-37.


