Система неинвазивного контроля морфогенеза планарий как альтернативный подход к биотестированию
Автор: Воробьева Ульяна Максимовна, Новиков Кирилл Николаевич, Бурлакова Ольга Владимировна, Емельяненко Виктор Иванович, Тирас Харлампий Пантелеевич
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 1 т.8, 2018 года.
Бесплатный доступ
В публикуемом исследовании была протестирована собственная хемилюминесценция планарий, сопровождающая процессы регенерации, в комплексе с методиками прижизненной фиксации их структуры с помощью неинвазивной компьютерной морфометрии. По итогу была предложена новая система online дистанционного контроля морфогенеза при регенерации планарий. Данная система представляется перспективной для первичного скрининга лекарственных препаратов - регуляторов пролиферации.
Биомониторинг, биотестирование, молекулярная токсикология
Короткий адрес: https://sciup.org/149129613
IDR: 149129613 | УДК: 577, | DOI: 10.15688/jvolsu11.2018.1.3
Текст научной статьи Система неинвазивного контроля морфогенеза планарий как альтернативный подход к биотестированию
DOI:
Регенерация пресноводных плоских червей – планарий – давно используется как тест-система для альтернативного биотестирования лекарственных препаратов – регуляторов клеточной пролиферации [2]. Она основывалась на неинвазивной регистрации регенерации методом прижизненной компьютерной морфометрии (ПКМ) [2; 3]. В настоящей работе эта тест-система дополнена регистрацией собственной сверхслабой фотонной эмиссии (ССФЭ).
Собственная хемилюминесценция или ССФЭ сопровождает различные функциональные процессы в живых системах. Ранее был описан феномен ССФЭ при регенерации пла-нарий [4].
Целью данной работы была апробация новой тест-системы, сочетающей регистрацию ССФЭ и ПКМ на одной и той же группе регенерирующих планарий.
Материалы и методы
Работа проведена на бесполой лабораторной расе планарий Girardia tigrina, которых содержали в комнатных условиях при температуре 20–210 °C. Животных кормили еженедельно личинками двукрылых, а перед экспериментами планарии голодали в течение недели.
Регистрацию ССФЭ проводили с помощью люминометра Биотокс-7а. Пpибоp оcнащен фотоумножителем 9750QB/1 (9750QB/1, EMI Electronics LTD, Middlesex, UK) с областью спектральной чувствительности 380–710 нм, с максимумом в сине-зеленой области, 420-500 нм. Измеpения пpоводили пpи темпеpатуpе 21,0 ± 0,2 °C, в pежиме cчета фотонов c интеpвалом запиcи данныx 1 c. Дальнейший анализ результатов проводили по ранее описанному методу [4].
Группу из 30 планарий сразу после декапитации помещали во флакон для сцинцил- ляционного счета в 10 мл водного раствора люцигенина (10-9М) и начинали регистрацию ССФЭ.
В специальных экспериментах регистрацию ССФЭ у планарий в контрольной и экспериментальной группе проводили параллельно на двух люминометрах Биотокс-7а.
Также на двух люминометрах сравнивали ССФЭ при одно- и многократной перерезке планарий.
Регенерацию регистрировали методом прижизненной компьютерной морфометрии (ПКМ). Метод базируется на регистрации фотоконтраста между старыми (пигментированными) и новыми (непокрытыми пигментом) частями тела регенерирующих планарий. Для получения изображений планарий применяли бинокулярный компьютерный микроскоп Stemi 2000C, оборудованный видеокамерой AxioCam MRc (Zeiss). Регенерацию вызывали ампутацией головной части тела планарии и регистрировали через 72 и 120 часов после перерезки.
Оцифрованные изображения регенерирующих планарий обрабатывали в программе Plana 5.0, которая позволяет анализировать электронные изображения планарий и определить площади проекции тела регенеранта и бластемы. В качестве критерия регенерации использовали отношение площади бластемы к общей площади планарии на определенный день регенерации [3].
Митотический индекс в ходе регенерации определяли путем подсчета митотических фигур в суспензии клеток планарий [5]. Подсчитывали число метафаз на 1000 клеток (митотический индекс) в течение 24 часов после перерезки на фоне действия колхицина. Для визуализации митотических фигур использовали краситель Hoehst 33342. Метафазы регистрировали с помощью флюоресцентного микроскопа AxioVert 200M (Zeiss).
Статистический анализ результатов определения митотического индекса проводили по критерию Манна–Уитни для малых групп. Результаты анализа изображений методом ПКМ проводили с помощью пакета программ SygmaPlot 9.0 [1].
Определяли величину средней (M), ошибку средней (m), вычисляли доверительный интервал для уровня значимости 0,95. Сравнение средних величин проводили с помощью Т-критерия Стьюдента [2].
Результаты и их обсуждение
Работу проводили на одной и той же группе планарий. Были последовательно исследованы два явления, которые сопровождают процессы регенерации: собственная хемилюминесценция (ССФЭ) и морфогенез в течение 120 часов после декапитации.
После операции декапитации контрольную и экспериментальную группы помещали в лю-минометр на 24 часа. Всплеск ССФЭ наблюдали сразу после перерезки в ходе регенерации, затем в течение примерно 2–4 часов ССФЭ релаксировала до уровня излучения интактного животного. Через 10–12 часов после декапитации наблюдали второй всплеск ССФЭ.
Далее регистрировали динамику роста бластемы у экспериментальной и контрольной групп через 72 и 120 часов после декапитации методом ПКМ. Метод базируется на регистрации фотоконтраста между пигментированными и непокрытыми пигментом частями тела регенерирующего животного [3].
Для апробации системы было изучено действие биологически активного пептида CLV3 в концентрации 10-9 М – стимулятора роста растений, выделенного из корней резу-ховидки Таля Arabidopsis thaliana . Исследование ССФЭ проводили параллельно на двух группах (экспериментальной и контрольной) из 30 декапитированных животных на двух лю-минометрах Биотокс-7а. Результаты представлены на рисунке 1.
В первые два часа пептид ускорял выход в релаксацию уровня ССФЭ в два раза по сравнению с контролем. Также вдвое был выше уровень ССФЭ на 12-й час после операции под действием пептида. Эффект стимуляции пролиферации был подтвержден методом подсчета митотического индекса (МИ) в суспензии клеток планарий. МИ под действием пептида (10-9 М) вырос на 17 % по сравнению с контролем.
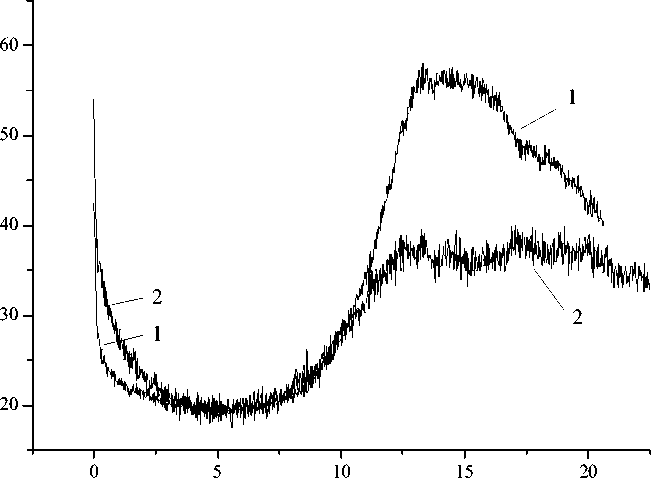
Рис. 1. Действие пептида CLV3 на ССФЭ планарий G. tigrina в первые сутки после декапитации.
По оси абсцисс – время регенерации в часах. По оси ординат – интенсивность сверхслабой фотонной эмиссии (ССФЭ) в фотонах в сек. 1 – динамика ССФЭ в ходе регенерации головного конца тела планарий под действием пептида CLV3 (10-9М). 2 – динамика ССФЭ в ходе регенерации головного конца тела планарий в контроле.
Далее эффект стимуляции регенерации пептидом CLV3 был зарегистрирован на 72 и 120 час после перерезки в пяти сериях экспериментов методом ПКМ (табл.).
В первые 24 часа после перерезки в теле планарий регистрировали 1–2 пика пролиферации стволовых клеток – необластов [6]. Мы предположили, что всплеск ССФЭ на 10–12 час регенерации связан с пиком пролиферации необластов в ходе морфогенеза.
Для подтверждения этой связи были проведены дополнительные эксперименты. Были проведены эксперименты по многократной перерезке планарий для увеличения числа раневых поверхностей, поскольку количество делящихся клеток прямо зависит от их числа.
Сравнивали величину фотонной эмиссии у планарий после одно- и троекратной перерезки, при которых формируется 2 и 6 регенерационных бластем. В результате было зарегистрировано удвоение уровня ССФЭ на 13–15 час после перерезки при многократной перерезке. Тем самым, была показана прямая корреляция пика ССФЭ с числом раневых поверхностей, что прямо связано с числом пролиферирующих необластов.
Об этом же свидетельствовали эксперименты по прямому измерению митотического индекса (МИ), под действием пептида CLV3 в первые 24 часа после декапитации. При этом также рост МИ в среднем на 17 % выше по сравнению с контролем.
Таким образом, была протестирована новая система последовательного дистанционного контроля процесса морфогенеза при регенерации планарий. Данная система представляется перспективной для первичного скрининга лекарственных препаратов – регуляторов пролиферации.
Список литературы Система неинвазивного контроля морфогенеза планарий как альтернативный подход к биотестированию
- Влияние слабого магнитного поля на скорость регенерации планарий Dugesia tigrina / Х. П.Тирас [и др.] // Биофизика. - 1996. - Т. 41, № 4. - С. 826-831.
- Новиков, Д. А., Статистические методы в медико-биологическом эксперименте (типовые случаи) / Д. А. Новиков, В. В. Новочадов. - Волгоград: Изд-во ВолГМУ, 2005. - 84 c.
- Собственная хемилюминесценция необластов планарии в процессе регенерации / Х. П. Тирас [и др.] // Биофизика. - 2015. - Т. 60, № 5. - С. 975-980.
- Тирас, Х. П. Тест-система для доклинического исследования медицинской и экологической безопасности на основе регенерации планарий / Х. П. Тирас, К. Б. Асланиди // Труды Тульского государстевнного университета. - Тула: Изд-во ТулГУ, 2013. - С. 63.
- Тирас, Х. П. Регламентация условий культивирования планарий и параметров морфометрического эксперимента / Х. П. Тирас, К. Б. Асланиди // Современные проблемы науки и образования. - 2016. - № 6.


