Система тиоредоксина в регуляции пролиферации клеток линии MCF-7 при модуляции редокс-статуса
Автор: Степовая Елена Алексеевна, Шахристова Евгения Викторовна, Рязанцева Наталья Владимировна, Носарева Ольга Леонидовна, Чильчигашев Роман Игоревич, Егорова Мария Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (76), 2016 года.
Бесплатный доступ
Введение. Несмотря на имеющиеся данные о функционировании опухолевых клеток в условиях свободнорадикального окисления, остается открытым вопрос о механизмах редокс-регуляции, управления пролиферацией клеток и «ускользания» от апоптотической гибели. Цель исследования - выявить участие системы тиоредоксина в регуляции пролиферации клеток аденокарциномы молочной железы линии МСF-7 при модуляции редокс-статуса блокатором SH-групп белков и пептидов N-этилмалеимидом и протектором тиоловых групп - 1,4-дитиоэритритолом. Материал и методы. Исследования были выполнены с использованием опухолевой клеточной линии МСF-7, культивируемой адгезионным методом. Редокс-статус клеток модулировали с помощью 5 мМ N-этилмалеимида, блокатора SH-групп белков и пептидов, и 5 мМ 1,4-дитиоэритритола, протектора тиоловых групп. Оценку содержания активных форм кислорода и клеточного цикла проводили методом проточной цитофлуориметрии. Концентрацию восстановленного окисленного глутатиона и активность тиоредоксинредуктазы определяли спектрофотометрическим методом. Внутриклеточное содержание тиоредоксина, циклина Е и циклинзависимой киназы 2 определяли методом вестерн-блоттинга. результаты. Показана важная роль системы тиоредоксина в регуляции пролиферации клеток линии МСF-7. Остановка клеточного цикла в S фазе при действии N-этилмалеимида и в G0/G1 фазе при действии 1,4-дитиоэритритола связана с изменениями активности редокс-чувствительных белковых комплексов, регулирующих пролиферацию (циклинов и циклинзависимых киназ). Заключение. Редокс-зависимая модуляция функционирования внутриклеточных белков, регулирующих пролиферацию, осуществляется при участии системы тиоредоксина. Данное направление исследований представляется перспективным для поиска молекулярных мишеней опухолевой трансформации клеток молочной железы.
Окислительный стресс, редокс-статус клеток, тиоредоксин, аденокарцинома молочной железы, пролиферация
Короткий адрес: https://sciup.org/140253949
IDR: 140253949 | УДК: 577.112+576.32/.36+616-092.4 | DOI: 10.21294/1814-4861-2016-15-4-50-55
Текст научной статьи Система тиоредоксина в регуляции пролиферации клеток линии MCF-7 при модуляции редокс-статуса
Исследование механизмов опухолевой прогрессии остается актуальной задачей трансляционной медицины, патофизиологии и онкологии. Большое внимание уделяется механизмам дизрегуляции и повреждения клеточных систем при иммортализации клеток, что связано с развитием окислительного стресса, сопровождающегося изменением редокс-статуса и дизрегуляцией пролиферации и апоптоза [1–4]. Опухоли молочной железы занимают первое место в структуре онкологической заболеваемости и смертности среди женщин во всем мире, в том числе и в России. Активация свободно-радикального окисления с продукцией активных форм кислорода (АФК) в опухолевых клетках молочной железы приводит к повреждению макромолекул, в частности
белков, участвующих в регуляции пролиферации и программированной клеточной гибели [1–6]. В поддержании внутриклеточного редокс-гомеостаза важную роль играют системы глутатиона, тиоре-доксина, глутаредоксина и другие, функционирование которых приводит к снижению уровня АФК, изменению активности факторов транскрипции и экспрессии ряда генов при адаптивных реакциях клеток на изменяющиеся условия [1, 6, 7]. При свободнорадикальном окислении глутатион посредством глутатионилирования защищает SH-группы белков, в том числе транскрипционных факторов (NF-κB, p53, Nrf2 и АР-1), под контролем которых находятся участки генов, кодирующие ключевые белки-регуляторы апоптотической гибели клеток [8].
Несмотря на имеющиеся данные о функционировании опухолевых клеток в условиях свободнорадикального окисления [1–6], остается открытым вопрос о механизмах редокс-регуляции, управления пролиферацией клеток и «ускользания» от апоптотической гибели. Тиоредоксин способен взаимодействовать с АФК, восстанавливать окисленный глутатион, пероксиредоксины, выступать кофактором рибонуклеотид- и метионинсульфок-сидредуктаз, участвуя в репарации ДНК, сохранять дитиол/дисульфидную структуру белков [7], способствуя редокс-модуляции функционирования внутриклеточных протеинов, что дает возможность предположить его важную роль в регуляции прогрессии фаз клеточного цикла.
Цель исследования – выявить участие системы тиоредоксина в регуляции пролиферации клеток аденокарциномы молочной железы линии МСF-7 при модуляции редокс-статуса блокатором SH-групп белков и пептидов N-этилмалеимидом и протектором тиоловых групп – 1,4-дитиоэритритолом.
Материал и методы
Исследование выполнено с использованием опухолевой клеточной линии МСF-7 (эпителиоподоб-ная аденокарцинома молочной железы человека), полученной из Российской коллекции клеточных культур Института цитологии Российской академии наук (г. Санкт-Петербург). Опухолевые клетки линии МСF-7 культивировали адгезионным методом в полной питательной среде, содержащей 90 % EMEM («ПанЭко», Россия), 10 % эмбриональной телячьей сыворотки («Invitrogen», США), 1 % заменимых аминокислот («ПанЭко», Россия), 10 мкг/мл бычьего инсулина («ПанЭко», Россия), 0,3 мг/мл L-глутамина («ПанЭко», Россия) и 100 мкг/мл гентамицина («ICN», США). Жизнеспособность клеток оценивали микроскопическим методом с трипановым синим («Serva», США). Редокс-статус клеток аденокарциномы молочной железы модулировали с помощью N-этилмалеимида (NEM) («Sigma Aldrich», США), необратимо связывающего SH-группы белков и пептидов, в конечной концентрации 5 мМ [9] и 1,4-дитиоэритритола (DTE) («Sigma Aldrich», США), протектора тиоловых групп протеинов и пептидов, в конечной концентрации 5 мМ [10].
Оценку содержания АФК проводили методом проточной цитофлуориметрии на проточном лазерном цитометре «FaCSCanto II» («Becton Dickinson», США), клетки предварительно инкубировали с 2,7-дихлорфлуоресцеиндиацетатом. В основе метода лежит способность 2,7-дихлорфлуоресцеиндиацетата проникать в цитоплазму клеток и приобретать способность флуоресцировать после взаимодействия с гидро- и липопероксидами. Концентрацию восстановленного (GSH) и окисленного (GSSG) глутатиона в клетках линии МСF-7 определяли методом, предложенным M.E. Anderson [11] в мо- дификации I. Rahman et al. [12]. Принцип метода основан на способности GSH взаимодействовать с 5,5-дитиобис-2-нитробензойной кислотой с образованием тионитрофенольного аниона, имеющего характерный максимум поглощения при длине волны 412 нм. При этом образуется GSSG, который восстанавливался специфически глутатионредуктазой, и восстановленная форма трипептида вновь взаимодействовала с 5,5-дитиобис-2-нитробензойной кислотой. Скорость образования окрашенного продукта пропорциональна содержанию общего глутатиона. Для определения GSSG пробы предварительно инкубировали с блокатором SH-групп – 2-винилпиридином («Wako», Япония), который необратимо связывал в пробе восстановленный глутатион, и поэтому в данном случае скорость образования окрашенного продукта была пропорциональна содержанию GSSG. Активность тиоредоксинредуктазы (КФ 1.8.1.9) определяли спектрофотометрическим методом, основанным на способности фермента катализировать НАДФН-зависимое восстановление дисульфидных связей субстратов, реагирующих с 5,5-дитиобис-2-нитробензойной кислотой, образуя тио-2-нитробензойную кислоту, раствор которой имеет максимум поглощения при длине волны 412 нм [13]. Содержание белка в клетках определяли по взаимодействию красителя Кумасси голубого G-250 с остатками аргинина и лизина белковых молекул [10]. Внутриклеточное содержание тиоредоксина, циклина Е и циклинзависимой киназы 2 определяли методом вестерн-блоттинга с использованием моноклональных антител («Thermo Scientific», США; «Abcam», США; «Sigma Aldrich», США соответственно) по протоколу фирмы производителя. Расчет содержания исследуемых белков проводили относительно концентрации референсного протеина β-актина. Оценку распределения клеток линии МСF-7 по фазам клеточного цикла проводили методом проточной цитофлуориметрии по протоколу Cycle Test Plus («Becton Dickinson», США). Статистическую обработку полученных результатов проводили при помощи программы SPSS 11.0. Проверка на соответствие выборок нормальному закону распределения проводилась по критерию Шапиро – Уилка. В связи с отсутствием согласия данных с нормальным распределением на уровне значимости p<0,01 и р<0,05 вычисляли средневыборочные характеристики: медиана (Ме), первый и третий квартили (Qj-Q3). Достоверность различий независимых выборок оценивали с помощью непараметрических критериев Краскала – Уолиса и Манна – Уитни для малых групп.
Результаты и обсуждение
Важную роль в поддержании внутриклеточного редокс-гомеостаза играют тиоредоксин- и глута-редоксинзависимые системы, включающие в себя тиоредоксин, НАДФН-зависимую тиоредоксин- таблица редокс-статус опухолевых клеток линии Mcf-7, содержание циклина Е и циклинзависимой киназы 2 при действии блокатора sH-групп белков n-этилмалеимида (neM) и протектора тиоловых групп – 1,4-дитиоэритритола (dte), Ме (Q1-Q3)
|
Показатели |
Интактные MCF-7 (n=6) |
Группы MCF-7 + NEM (n=6) |
MCF-7 + DTE (n=6) |
|
Активные формы кислорода, условные единицы |
0,81 (0,80–0,83) |
2,35 (2,25–2,50) р=0,009 |
1,16 (0,81–1,17) |
|
Восстановленный глутатион (GSH), нмоль/мг белка |
3,67 (3,60–3,72) |
1,87 (1,61–1,92) р=0,009 |
4,73 (4,58–4,87) Р=0,009 |
|
Окисленный глутатион (GSSG), |
0,38 |
0,44 |
0,41 |
|
нмоль/мг белка |
(0,37-0,43) |
(0,43-0,49) |
(0,39-0,43) |
|
Величина отношения GSH/ GSSG |
9,71 (9,55–9,73) |
4,45 (3,66–4,47) р=0,009 |
10,65 (10,26–12,48) р=0,016 |
|
Тиоредоксин, условные единицы |
1,73 (1,71–1,74) |
1,86 (1,83–1,87) р=0,001 |
1,80 (1,79–1,81) р=0,001 |
|
Тиоредоксинредуктаза, нмоль НАДФН/мин×мг белка |
3,23 (3,17–3,26) |
2,62 (2,57–2,88) р=0,011 |
3,03 (2,43–3,52) |
|
Циклин Е, условные единицы |
1,18 (1,14–1,21) |
0,97 (0,93–1,01) |
0,59 (0,56–0,64) р=0,001 |
|
Циклинзависимая киназа 2, условные единицы |
0,96 (0,94–1,12) |
0,85 (0,80–0,91) |
0,66 (0,55–0,71) р=0,001 |
Примечание: р – уровень значимости различий по сравнению с интактными клетками MCF-7.
редуктазу, глутатион, глутатионредуктазу и глутатионпероксидазу [1, 6, 7]. Обе эти системы вносят существенный вклад в антиоксидантную защиту клеток от деструктивного воздействия окислительного стресса (ОС), вызывающего образование внутри- и межмолекулярных дисульфидных связей в белках, окисление функциональных SН-групп с последующей протеосомальной деградацией протеинов [1, 7, 8].
Нами установлено, что NEM в клетках линии MCF-7 вызывает развитие ОС, сопровождающееся увеличением внутриклеточной продукции АФК в 2,9 раза (р=0,009), снижением концентрации GSH в 2,0 раза (р=0,009) и уменьшением величины отношения GSH/GSSG в 2,2 раза (р=0,009)
по сравнению с интактной культурой (таблица). Помимо системы глутатиона, редокс-гомеостаз клеток поддерживает тиоредоксинзависимая система, однако функционирование этой системы и ее редокс-потенциал в конечном итоге тесно связаны с работой системы глутатиона и величиной отношения GSH/GSSG [7]. Так, нами было установлено, что при действии NEM активность тиоредоксинредуктазы в клетках линии MCF-7 снижалась в 1,2 раза (р=0,011) по сравнению с интактной культурой (таблица), что может быть связано с недостатком НAДФH вследствие его интенсивного расхода в реакциях, катализируемых редуктазами, или уменьшением продукции в пен-тозофосфатном пути. Смещение редокс-статуса в
Тиоредоксин
Циклин Е
Циклинзависимая киназа 2
р-актин
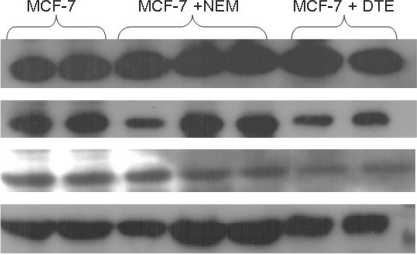
Рис. 1. Фотографии вестерн-блотта белков тиоредоксина, циклина Е и циклинзависимой киназы 2 в клетках линии MCF-7 при действии блокатора SH-групп белков N-этилмалеимида (NEM) и протектора тиоловых групп – 1,4-дитиоэритритола (DTE)
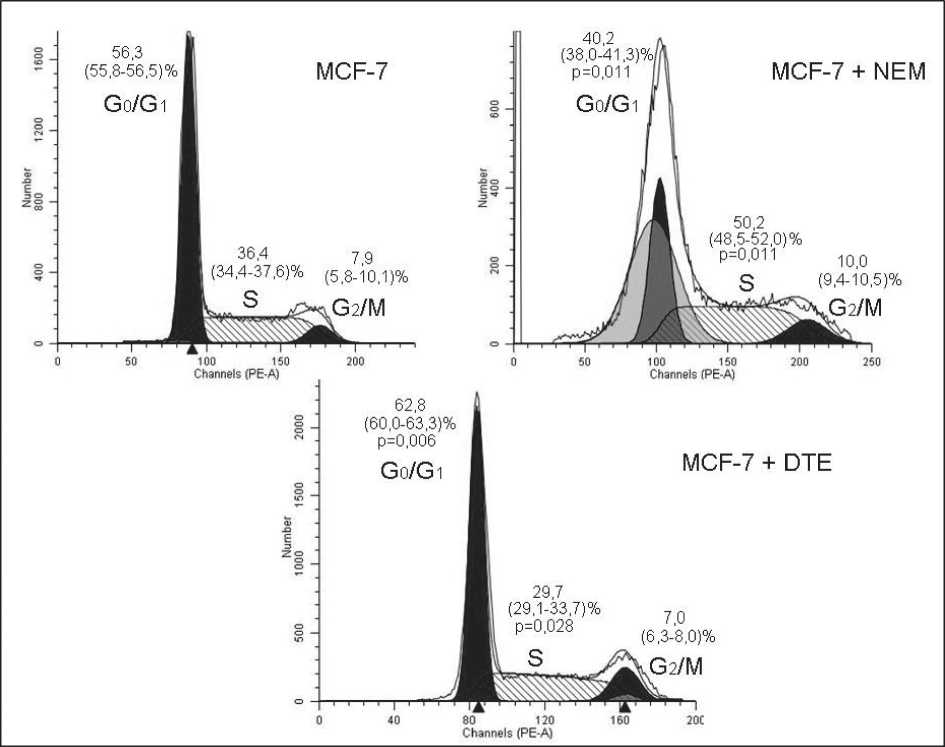
Рис. 2. Распределение клеток аденокарциномы молочной железы по фазам клеточного цикла при действии блокатора SH-групп белков N-этилмалеимида (NEM) и протектора тиоловых групп – 1,4-дитиоэритритола (DTE); р – уровень значимости различий по сравнению с интактными клетками MCF-7
клетках линии MCF-7 под действием NEM в сторону окисления приводило к увеличению содержания тиоредоксина (р=0,001) по сравнению с интактной культурой (рис. 1), что отражало высокую потребность опухолевых клеток в антиоксидантах, необходимых для защиты макромолекул от АФК и выживания, и сопровождалось нарушением в прохождении клеток аденокарциномы молочной железы по фазам клеточного цикла: их увеличение в S фазе в 1,4 раза (р=0,011) и снижение в G 0 /G 1 фазах в 1,3 раза (р=0,011) по сравнению с интактной культурой (рис. 2).
Содержание циклинзависимой киназы 2 (CDK2) и циклина Е в клетках линии MCF-7, культивируемых с NEM, достоверно не отличалось от интактных клеток. Можно предположить, что остановка клеточного цикла в S фазе при действии NEM является результатом изменения активности белковых комплексов, регулирующих пролиферацию: циклина А/CDK2 и циклина D/CDK4, либо изменений концентрации и структуры этих протеинов в отдельности.
При культивировании клеток линии MCF-7 с DTE увеличивались концентрации GSH в 1,3 раза (р=0,009), тиоредоксина – в 1,1 раза (р=0,001) и величины отношения GSH/GSSG – в 1,1 раза (р=0,016) (таблица). Тиоредоксин является необходимым компонентом для поддержания редокс-гомеостаза клеток и репликации молекул ДНК. В клетках линии MCF-7, культивируемых в присутствии DTE и имеющих более высокое соотношение GSH/GSSG, нами выявлено уменьшение концентрации CDK2 в 1,5 раза (р=0,001) и циклина Е в 2,0 раза (р=0,001) (по сравнению с интактной культурой (рис. 1)), необходимых для инициации репликации молекул ДНК, что приводило к снижению пролиферативной активности опухолевой линии MCF-7 (рис. 2): количество клеток в G0/G1 фазе увеличилось в 1,1 раза (р=0,006), а в S фазе – снизилось в 1,2 раза (р=0,028).
Заключение
Редоксзависимая модуляция функционирования внутриклеточных белков, регулирующих пролиферацию, осуществляется при участии системы тиоредоксина. Таким образом, наши исследования показали важную роль редокс-белков, в частности компонентов системы тиоредоксина, в регуляции пролиферации клеток линии МСF-7. Можно предположить, что остановка клеточного цикла в S фазе при действии NEM и в G 0 /G 1 фазе при действии DTE связана с изменениями активности редокс-чувствительных белковых комплексов, регулирующих пролиферацию (циклинов и циклинзависимых киназ). Данное направление исследований представляется перспективным для поиска молекулярных мишеней опухолевой трансформации клеток молочной железы.
Исследование выполнено при финансовой поддержке Российского гуманитарного научного фонда в рамках научного проекта «Тиоредоксин и глутаредоксин – как молекулярные маркеры возникновения и развития опухолей молочной железы». № 15-36-01289.
Список литературы Система тиоредоксина в регуляции пролиферации клеток линии MCF-7 при модуляции редокс-статуса
- Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс: Патологические состояния и заболевания. Новосибирск; 2008. 284 с.
- Murphy M.P., Holmgren A., Larsson N.G., Halliwell B., Chang C.J., Kalyanaraman B., Rhee S.G., Thornalley P.J., Partridge L., Gems D., Nyström T., Belousov V., Schumacker P.T., Winterbourn C.C. Unraveling the biological roles of reactive oxygen species. Cell Metab. 2011; 13 (4): 361-366 DOI: 10.1016/j.cmet.2011.03.010
- Ryazantseva N.V., Stepovaya E.A., Nosareva O.L., Konovalova E.V., Orlov D.S., Naumova A.I., Didenko S.A., Vesnina O.N., Shakhristova E.V., Zima A.P., Novitskii V.V. Role of heat shock protein 27 in regulation of glutathione system and apoptosis of Jurkat tumor cells and blood lymphocytes. Bull Exp Biol Med. 2015; 158 (3): 377-379. doi: 10.1007/s10517-015-2766-3.
- Shakhristova E.V., Stepovaya E.A., Ryazantseva N.V., Nosareva O.L., Yakushina V.D., Ivanov V.V., Novitskii V.V. Role of Glutathione System Redox Potential in Apoptosis Dysregulation in MCF-7 Breast Adenocarcinoma. Bull Exp Biol Med. 2016; 160 (3): 364-367 DOI: 10.1007/s10517-016-3172-1
- Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение): физиологические и клинико-биохимические аспекты. СПб., 2006. 397 с.
- Калинина Е.В., Чернов Н.Н., Алеид Р., Новичкова М.Д., Саприн А.Н., Березов Т.Т. Современные представления об антиоксидантной роли глутатиона и глутатионзависимых ферментов. Вестник Российской академии медицинских наук. 2010; 3: 46-54.
- Калинина Е.В., Чернов Н.Н., Саприн А.Н. Участие тио-, перокси-и глутаредоксинов в клеточных редокс-зависимых процессах. Успехи биологической химии. 2008; 48: 319-358.
- Ray P.D., Huang B.W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling. Cell Signal. 2012; 24 (5): 981-990 DOI: 10.1016/j.cellsig.2012.01.008
- Sahaf B., Heydari K., Herzenberg L.A. Lymphocyte surface thiol levels. Proc. Natl. Acad. Sci. USA. 2003; 100 (7): 4001-4005.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt. Biochem. 1976; 7 (1, 2): 248-254.
- Anderson M.E. Determination of glutathione and glutathione sulfide in biological samples. Methods Enzymol. 1985; 113: 548-555.
- Rahman I., Kode A., Biswas S.K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat. Protoc. 2006; 1 (6): 3159-3165.
- Tamura T., Stadtman T.C. A new selenoprotein from human lung adenocarcinoma cells: рurification, properties, and thioredoxin reductase activity. Proc. Natl. Acad. Sci. USA. 1996; 93: 1006-1011.
- Anderson M.E. Determination of glutathione and glutathione sulfide in biological samples. Methods Enzymol. 1985; 113: 548-555.
- Rahman I., Kode A., Biswas S.K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat. Protoc. 2006; 1 (6): 3159-3165.
- Tamura T., Stadtman T.C. A new selenoprotein from human lung adenocarcinoma cells: рurification, properties, and thioredoxin reductase activity. Proc. Natl. Acad. Sci. USA. 1996; 93: 1006-1011.


