Системная красная волчанка, антифосфолипидный синдром: фокус на поражения нервной системы
Автор: Юсупов Ф.А., Юлдашев А.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 11 т.9, 2023 года.
Бесплатный доступ
Системная красная волчанка и антифосфолипидный синдром - это два редких и сложных заболевания, которые могут поражать различные органы и системы человеческого организма. Системная красная волчанка является прототипом заболеваний соединительной ткани, которые могут проявляться полным спектром неврологических и психических нарушений. Установить точный этиологический диагноз - системная красная волчанка с преимущественной нейропсихиатрической симптоматикой - довольно сложно. До сих пор остается спорным вопрос о точном времени возникновения неврологических проявлений: либо центральная нервная система является начальной мишенью аутоиммунных нарушений, либо неврологические симптомы являются частью мультисистемного поражения. Антифосфолипидный синдром представляет собой протромботическое системное аутоиммунное заболевание с гетерогенными клинико-патоморфологическими проявлениями и является достоверно установленной причиной ишемического инсульта и транзиторной ишемической атаки, особенно у пациентов молодого возраста. Растет признание более широкого спектра цереброваскулярных поражений, связанных с антифосфолипидным синдромом, включая гиперинтенсивность белого вещества, атрофию коры и лакунарные инфаркты, которые могут иметь клинически важные нейрокогнитивные последствия. В статье дается обзор литературы, рассматривающей спектр неврологических расстройств у больных антифосфолипидным синдромом и воспалительные и цитокиновые механизмы, играющие важную роль в патогенезе поражения нервной системы при системной красной волчанке.
Системная красная волчанка, антифосфолипидный синдром, неврологические расстройства, инсульт, нейровоспаление, цитокины, патогенез
Короткий адрес: https://sciup.org/14129258
IDR: 14129258 | УДК: 616-008:-009:-092 | DOI: 10.33619/2414-2948/96/30
Текст обзорной статьи Системная красная волчанка, антифосфолипидный синдром: фокус на поражения нервной системы
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-008:-009:-092
Поражение нервной системы при системной красной волчанке (СКВ) может проявляться различными способами [1]. Это могут быть головные боли, парезы, судороги, нарушения сенсорных функций, а также психические расстройства, такие как депрессия и психозы [2]. Эти симптомы могут быть связаны с воспалительным процессом, который затрагивает нервные структуры, или с проклоном кровяных сосудов, что приводит к недостатку кислорода и питательных веществ в нервных тканях [3]. Воспалительные и цитокиновые механизмы поражения нервной системы у больных СКВ являются сложной и пока не полностью исследованной областью. Однако, существует некоторое количество информации, которая позволяет увидеть общие тенденции и понять основные механизмы, лежащие в основе этого процесса [1].
Воспаление — это биологический процесс, который динамически изменяет окружающую микросреду, включая участвующие в нем иммунные клетки. ЦНС жестко регулирует иммунные реакции, будучи хорошо защищенным органом, окруженным специализированными барьерами и обладающим иммунными привилегиями [4]. Нейровоспаление — это ответная воспалительная реакция со стороны нервных структур в ответ на бактериальные и вирусные инфекции, черепно-мозговые травмы, воздействие токсических веществ, аутоиммунные процессы и другие факторы [5]. Микроглия и астроциты наиболее распространенные иммунные клетки головного мозга, участвующие в патогенезе воспаления при СКВ. Оба изменяют свою морфологию и способствуют выработке медиаторов воспаления при системных заболеваниях, микробных инфекциях, которые можно определить как нейровоспаление инфекционного генеза. Как правило, нейровоспаление играет защитную роль; однако некоторые патогены вызывают патологические воспалительные изменения, которое может привести к повреждению синапсов, потере клеток и нарушению нейрогенеза. Микроглия и астроциты являются наиболее распространенными иммунными клетками головного мозга, которые в основном способствуют нейровоспалительным процессам при аутоиммунных заболеваниях. Оба изменяют свою морфологию и способствуют выработке воспалительных цитокинов в условиях болезни или инфекции. Поляризация микроглии и астроцитов и их роль в возникновении нейродегенерации при микробной инфекции представлена в Рисунке 1 [6, 7]. Степень поражения нервной системы у пациентов с СКВ может варьироваться от легких неврологических симптомов, таких как головная боль и слабость, до серьезных осложнений, включая мозговые инсульты, судороги и психические расстройства. Воспаление, вызванное активацией цитокинов и других воспалительных медиаторов, может способствовать развитию этих симптомов и осложнений [8].
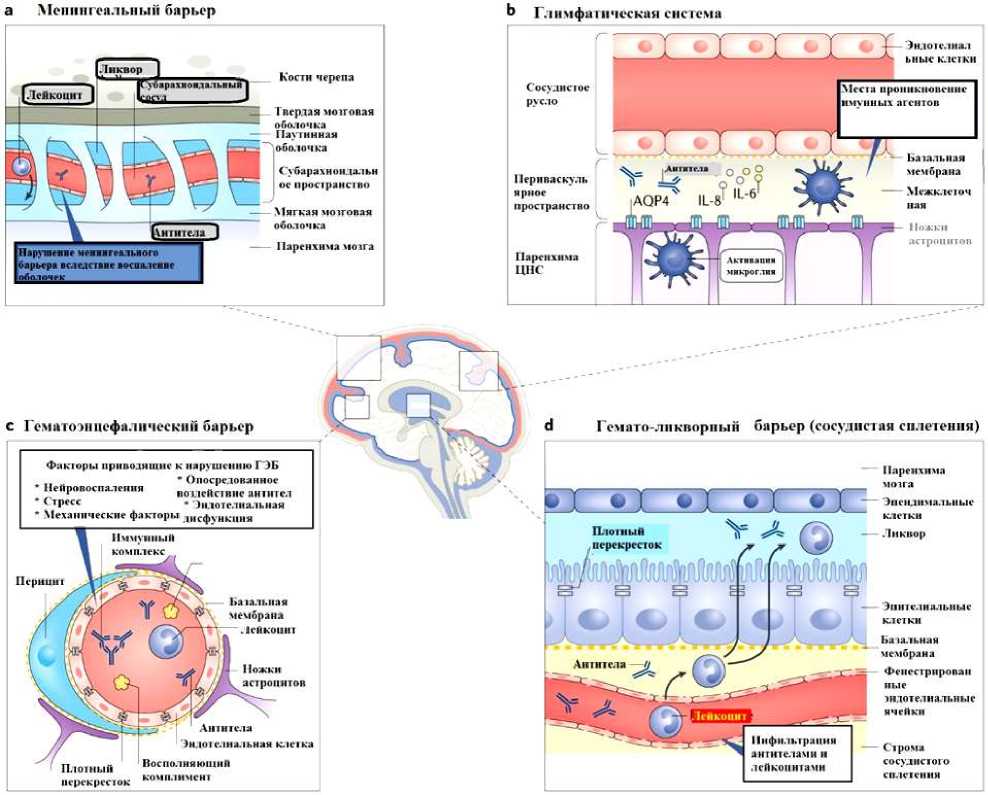
Рисунок 1. Механизмы поражение нервной системы при аутоиммунных заболеваниях
В случае поражения нервной системы, воспалительные и цитокиновые механизмы играют важную роль в развитии симптомов и осложнений. Одним из центральных игроков воспалительного процесса являются цитокины — белковые молекулы, выполняющие роль медиаторов воспаления и иммунных реакций. При СКВ происходит активация иммунной системы, в результате чего происходит высвобождение различных цитокинов, таких как интерлейкины (IL), интерфероны (IFN), факторы некроза опухоли (TNF) и другие. Два распространенных цитокина, обнаруженных при нейровоспалении, интерлейкин (ИЛ)-1β и фактор некроза опухоли -α (ФНО-α), индуцируют активацию постсинаптических рецепторов и активируют путь ядерного фактора (NF-kB), что приводит к потере синапсов и гибели нейронов. Кроме того, у пациентов с СКВ повышен уровень некоторых воспалительных цитокинов в спинномозговой жидкости. В частности, экспрессия TGF-β, MCP-1 и YKL-40 в спинномозговой жидкости индуцируется у пациентов с СКВ в дополнение к TGF-β1, ИЛ-6 и ИЛ-1β у пациентов с нейродегенеративными заболеваниями. Кроме того, у пациентов с СКВ и неродегенеративными заболеваниями наблюдается значительная индукция уровней G-CSF, ИЛ-2, ИЛ-15, ИЛ-17, MCP-1, MIP-1α, ФНО-α и VEGF. С другой стороны, высвобождение различных противовоспалительных цитокинов, таких как ИЛ-4/10, может играть роль в ослаблении чрезмерного хронического нейровоспаления при системных и нейродегенеративных заболеваниях. Кроме того, у пациентов с СКВ по сравнению с контрольной группой наблюдается повышение уровня периферических воспалительных цитокинов, включая ИЛ-6, ФНО и ИЛ-1β. В совокупности периферические цитокины и цитокины могут служить биомаркерами для системных и нейродегенеративных заболеваний [9].
Цитокины, в частности интерлейкины, играют роль в регуляции различных аспектов воспаления и иммунного ответа. Они являются мощными сигнальными молекулами, влияющими на функцию и активацию различных типов клеток в организме. В случае поражения нервной системы, некоторые цитокины могут быть высвобождены в повышенных концентрациях, что может привести к повреждению нервных клеток и тканей. Кроме цитокинов, другие воспалительные механизмы также могут быть вовлечены в поражение нервной системы при СКВ. Например, активация воспалительных клеток, таких как макрофаги и лимфоциты, может способствовать высвобождению различных воспалительных медиаторов, а также повреждению нервной ткани.
Таблица 1
РАСПРОСТРАНЕННОСТЬ И СПЕКТР ПОРАЖЕНИЯ НЕРВНОЙ СИСТЕМЫ
У БОЛЬНЫХ СКВ [10]
|
Клинические формы поражения |
Частоты встречаемости |
|
Психоз |
0,6–11,0 |
|
Тревожное расстройство |
6,4–40,0 |
|
Острое спутанность сознание |
0,9–7,0 |
|
Перепады настроения |
7,4–65,0 |
|
Когнитивные расстройства |
6,6–80,0 |
|
Головная боль (включая мигрень и доброкачественную внутричерепную гипертензию) |
12,2–28,3 |
|
Судороги |
7,0–20,0 |
|
Цереброваскулярные заболевания |
8,0–15,0 |
|
Двигательное расстройство (хорея) |
0,9 |
|
Миелопатия |
0,9–3,9 |
|
Демиелинизирующий синдром |
0,9–2,7 |
|
Асептический менингит |
0,3–2,7 |
|
Острая воспалительная демиелинизирующая полирадикулопатия (синдром Гийена-Барре) |
0,08–1,20 |
|
Вегетативное расстройство |
0,08–1,30 |
|
Моно- и полинейропатии |
0,9–6,9 |
|
Полинейропатия |
1,5–5,4 |
|
Миастения гравис |
0,2 |
|
Нейропатия ЧМН |
1,0 |
Каждый из вышеупомянутых цитокинов может оказаться перспективной мишенью для лечения психоневрологических и системных проявлений СКВ. В головном мозге резидентные микроглии являются преобладающими иммунными клетками ЦНС и являются мощными продуцентами цитокинов. Уровни интерферонов типа I повышены в сыворотке и гиппокампе пациентов с СКВ и индуцируют активацию микроглии и аберрантное синаптическое сокращение в мышиных моделях [12].
СКВ часто проявляется в раннем возрасте, пока мозг еще созревает. В это время структурные изменения мозга, вероятно, будут особенно разрушительными и даже изменят жизни пациентов. Поэтому крайне важно, чтобы патогенетические механизмы, лежащие в основе этих процессов, были дополнительно выяснены, по возможности, остановлены, как только они будут диагностированы. Кроме того, более глубокое понимание этих изменений улучшает раннюю диагностику и различать острые нейропсихиатрические проявления СКВ, связанные с воспалением, которые можно лечить с помощью иммунодепрессантов, и хронические процессы, которые могут возникать независимо от активности системного заболевания. Хотя считается, что СКВ обладает сильным генетическим компонентом, СКВ определенно не подвержена менделевскому наследованию у подавляющего большинства пациентов, наблюдаемых в клинической практике.
Таблица 2 ЦИТОКИНЫ УЧАСТВУЮЩИЕ
В МЕХАНИЗМЕ ПОРАЖЕНИЯ НЕРВНОЙ СИСТЕМЫ ПРИ СКВ [11]
|
Цитокины |
Действие |
|
ФНО |
*Противоречивые данные о повышенных уровнях спинномозговой жидкости при NPSLE. *Лечение ингибиторами ФНО может вызывать симптомы, подобные СКВ. *Повышенные уровни могут ухудшить ГЭБ из-за усиления местного воспаления. |
|
BAFF (В-клеточный активационный фактор) |
*Опосредует выживание В-клеток и способствует переключению класса иммуноглобулинов (важно в патогенезе СКВ) *Лечение антителами против BAFF (белимумаб) одобрено для лечения СКВ, но эффективность при NPSLE не установлена. |
|
Интерферон альфа (IFNα) |
*Важное значение в патогенезе СКВ *Сильная системная интерфероновая сигнатура у пациентов с NPSLE *Индуцированный in vitro ликвором у пациентов с NPSLE *Активирует микроглию, что приводит к синаптической обрезке *Может вызывать депрессию (наиболее частый побочный эффект), психотические симптомы, спутанность сознания, очаговый неврологический дефицит и судороги. |
|
TWEAK (TNF-подобный слабый индуктор апоптоза) |
*Опосредует нарушение ГЭБ, клеточную инфильтрацию сосудистого сплетения и повреждение нейронов *Повышен в ЦСЖ больных СКВ |
|
Интерферон гамма (IFNγ) |
*В основном продуцируется Т-клетками и обнаруживается в высоких концентрациях в сыворотке пациентов с СКВ. *Повышен в спинномозговой жидкости пациентов с НПВВ, что позволяет отличить НПВВ от демиелинизирующих неврологических состояний. |
|
ИЛ-6 |
*Секретируется преимущественно миелоидными клетками, активированными астроцитами и эндотелиальными клетками. *Стимулирует В-клетки, способствует секреции иммуноглобулина плазматическими клетками, способствует дифференцировке клеток TH - 17 и ингибирует дифференцировку регуляторных Т-клеток. *Повышен в ЦСЖ у пациентов с НПВВ, но аналогично повышен в ЦСЖ у пациентов с демиелинизирующими неврологическими состояниями и септическим менингитом. |
|
ИЛ-8 |
*Секретируется несколькими типами клеток, включая активированные эндотелиальные клетки. *Повышен в ЦСЖ у пациентов с НПВВ, но аналогично повышен в ЦСЖ у пациентов с демиелинизирующими неврологическими состояниями и септическим менингитом. |
Кроме того, значительная вариабельность его проявления вместе с разнообразием факторов окружающей среды, которые, вероятно, играют важную роль в возникновении заболевания, его проявлениях и тяжести, затрудняют отслеживание генетических драйверов СКВ. НПСКВ с его иногда расплывчатыми проявлениями и трудностями диагностики также сложно определить. Тем не менее, некоторые исследования [13] аллелей риска СКВ, идентифицированных в полногеномных ассоциативных исследованиях, обнаружили доказательства нескольких однонуклеотидных полиморфизмов (SNP), которые чаще встречаются у пациентов с НПСКВ, чем в общей популяции СКВ. Основной причиной ухудшение состояние пациентов и смертности у пациентов с СКВ является симптомы поражение нервной системы, однако в патогенезе НПСКВ и его клинического ведения остается много проблем для дискуссии. Поскольку признаки и симптомы НПСКВ сильно различаются и часто могут быть неспецифическими, часто сложно с уверенностью отнести их к СКВ; действительно, не существует «золотого стандарта» диагностического метода. Кроме того, патогенез нервно-психических синдромов у пациентов с СКВ, вероятно, многогранен, сложен и, возможно, уникален для конкретных лиц или групп пациентов. В патогенезе поражение нервной системы при СКВ огромное роль отводится воспалительным и аутоиммунным механизмам которое приводить к нарушение глимфатической системы, менингеального, гематоликворного, гематоэнцефалитических барьеров. Многие цитокины остается наиболее ранними биологическими маркерами поражение ЦНС при СКВ.
Мозг и нервная система являются важными мишенями иммуноопосредованного повреждения при системной красной волчанке (СКВ), что приводит к сложному спектру неврологических синдромов. Определение заболевания нервной системы при волчанке представляет собой серьезную проблему. Среди трудностей, которые предстоит решить, — разнообразие клинических проявлений и непонимание их механистической основы. Полногеномные исследования ассоциаций больших групп пациентов с волчанкой выявили растущее число ассоциаций с путями, вовлеченными как в врожденную, так и в адаптивную иммунную систему [14].
Антитела являются основным медиатором повреждения органов при СКВ, и часто вырабатываются антитела, направленные против нескольких антигенов головного мозга [15]. Степень, в которой такие антитела вызывают неврологические заболевания, еще предстоит полностью определить. В некоторых случаях, например, антитела, направленные против аквапорина-4 астроцитарного водного канала (AQP4), есть доказательства, подтверждающие причинную связь с воспалением спинного мозга и зрительного нерва [16, 17].
Биопсия головного мозга у людей с волчанкой проводится редко. Следовательно, большая часть нашего понимания патологической основы нейроволчанки основана на посмертных исследованиях, которые вносят предвзятость в сторону тяжелого заболевания. Первые специализированные исследования выявили в большинстве случаев выраженное заболевание мелких сосудов головного мозга как основной нейропатологический признак [18]. Важно помнить, что неврологические симптомы могут быть не вызваны волчанкой, а могут просто представлять собой широко распространенное неврологическое заболевание, такое как мигрень или головная боль напряжения. Более того, неврологические симптомы могут быть прямо или косвенно вызваны медикаментозной терапией [19, 20].
Самые ранние признаки поражения со стороны центральной нервной системы это микрососудистые поражения. В исследованиях авторы показали, что инсульт возникает чаще у людей с СКВ, чем в общей популяции, при этом ишемический инсульт развивается у 20% пациентов с волчанкой [21-24]. Признанные факторы риска инсульта такие как, гипертония, курение и гиперхолестеринемия, могут играть немаловажную роль [2, 25].
Таким образом, устранение модифицируемых факторов риска инсульта, таких как курение, диета и артериальное давление, является важным приоритетом для пациентов с волчанкой. Болезнь малых сосудов (БМС) представляет собой заболевание перфорантных артериол головного мозга с типичными признаками МРТ-изображения головного мозга, включающими гиперинтенсивность белого вещества которые является ранними нейрососудистыми проявлениями СКВ предшествующий больших цереброваскулярных катастроф как инсульт. Судороги могут возникать примерно у 5% больных волчанкой. Они часто генерализованы, хотя могут также иметь очаговое начало [26, 27]. Миелопатия является редким, но серьезным неврологическим осложнением у людей с волчанкой. За последнее десятилетие идентификация патогенных антител против глиальных антигенов, таких как водный канал AQP4, продемонстрировала, что «волчаночный миелит» можно частично объяснить сопутствующим расстройством спектра оптиконевромиелита [28].
Аутоантитела вместе с антителами к миелин-олигодендроцитарному гликопротеину (MOG) следует тестировать при поражениях спинного мозга, особенно в контексте «продольно обширного поперечного миелита», когда воспаление распространяется как минимум на три сегмента позвонка [29].
Заболевания спинного мозга при СКВ неоднородны, также могут возникать короткий поперечный миелит и ишемический поперечный миелит. Менингит при СКВ как правило относится к аутоиммунному асептическому менингиту. Это может произойти у пациентов с волчанкой изолированно, но может также сопровождаться поперечным миелитом [30]. Среди двигательных расстройств с поражением экстрапирамидной и пирамидной системы при СКВ сообщалось о хорее и других форм гиперкинетическоих расстройств у пациентов с СКВ [31] хотя также были описаны обратимые формы паркинсонизма [32] эти расстройства может быть ранними признаками СКВ с с неврологическими проявлениями. Была высказана гипотеза о связи между волчанкой и изменениями головного мозга, подобными рассеянному склерозу, которые иногда называют «волчаночным склерозом» [33].
Истинное сосуществование волчанки и рассеянного склероза встречается редко. Головная боль является широко распространенным заболеванием у людей с СКВ [34] но нет убедительных доказательств того, что эта заболеваемость выше, чем среди населения в целом [35]. Термин «волчаночный психоз» использовался для описания одиночных или повторяющихся эпизодов расстройств мышления, таких как галлюцинации и бред, возникающих у людей с СКВ [36, 37]. Люди с волчанкой при лечении подвергаются воздействию ряда биологических веществ, которые могут вызвать психоз, в частности кортикостероидов и циркулирующих антител, направленных против NMDA-R [37]. Также была выявлена связь между психозом при волчанке и антителами к рибосомальному P [38].
Депрессия и тревога распространены среди населения в целом и чаще наблюдаются при хронических заболеваниях. Поэтому неудивительно, что примерно у 15% пациентов с диагнозом волчанка развиваются расстройства настроения, а у 5% — тревожное расстройство [26, 39]. Синдром задней обратимой энцефалопатии представляет собой клинико-рентгенологический синдром головной боли, судорог и энцефалопатии, связанный с изменениями белого вещества, которые происходят преимущественно в задних отделах мозга [40]. Следует отметить, что примерно у 10% пациентов с СКВ может встречаться целый спектр воспалительных мышечных заболеваний, включая миозит и васкулит, иногда требующий подтверждения биопсией [41, 42].
Периферическая нейропатия может возникать примерно у 8% пациентов с волчанкой, проявляясь в основном как симметричная полинейропатия [43, 44].
Множественный мононеврит также может иногда возникать при волчанке и связан с васкулитными изменениями мелких сосудов при биопсии нерва, часто развивающимися в периоды высокой активности волчанки [45, 46].
Среди нейропатий, связанных с волчанкой, идентификация демиелинизирующих воспалительных нейропатий имеет особое значение, учитывая продемонстрированный ответ таких нейропатий на внутривенный иммуноглобулин [47].
Очень редко наблюдался синдром Гийена-Барре и также миастения [48]. При СКВ наблюдаются оптические невропатии, манифестирующие либо невритом зрительного нерва, либо ишемической оптической невропатией [49]. Функциональные расстройства при СКВ реальны и нередкие, но не вызваны основным неврологическим заболеванием [50]. Функциональные неврологические расстройства являются распространенной причиной неврологических симптомов, как в общей медицине, так и в неврологических клиниках, и поэтому часто могут сосуществовать с системными и аутоиммунными заболеваниями, таких как СКВ. Лечение поражения нервной системы у пациентов с СКВ нацелено на контроль воспалительного процесса и снижение активности иммунной системы. Глюкокортикостероиды и иммуносупрессивные препараты могут быть назначены для снижения воспаления и подавления аутоиммунной активности. Кроме того, другие медикаментозные терапии, такие как противовоспалительные препараты и плазмаферез, могут использоваться с целью снижения симптомов и предотвращения осложнений.
Антифосфолипидный синдром (АФС) является системным аутоиммунным заболеванием, которое характеризуется наличием антифосфолипидных антител (АФЛ) и повышенной склонностью к тромбозам. Однако, АФС также может приводить к неврологическим проявлениям, которые могут быть разнообразными и серьезными. АФС является одной из наиболее частых приобретенных причин гиперкоагуляции. Его основными проявлениями являются тромботические (артериальные, венозные или микрососудистые) и осложнения беременности (выкидыши, поздняя внутриутробная гибель плода и тяжелая преэклампсия) [51]. Поскольку антифосфолипидные антитела гетерогенны, они могут иметь несколько механизмов действия. Например, волчаночный антикоагулянт можно разделить на два подтипа: те, которые нацелены на бета-2 гликопротеин 1, и те, которые нацелены на протромбин. Некоторые волчаночные антикоагулянты действуют через аннексин А5. Блокируя (создавая «дыры») в аннексиновом щите, фосфолипидный бислой подвергается воздействию и становится уязвимым для сгустка (включая плаценту). Распространенность АФС оценивается от 40 до 50 случаев на 100 000 человек, а заболеваемость составляет около пяти новых случаев на 100 000 человек в год. Расчетная связь между положительным результатом на АФЛ и ежегодным риском тромбоза у людей без тромбоза в анамнезе составляет до 4% [52]. Антифосфолипидный синдром можно разделить на два типа: первичную форму без сопутствующего системного заболевания и вторичную форму, при которой присутствует системная красная волчанка (СКВ) или связанное с ней заболевание соединительной ткани.
В критериях классификации антифосфолипидного синдрома перечислены три вида осложнений беременности. Первый, привычный ранний выкидыш, неспецифичен. В общей акушерской популяции 10–15% беременностей заканчиваются преждевременной потерей. У 1-2% женщин случаются повторные выкидыши на ранних сроках. Большинство женщин с рецидивирующим выкидышем на ранних сроках не имеют известной причины. В 25–60% случаев повторного выкидыша на ранних сроках один из партнеров будет иметь аномальный кариотип. У большинства может быть успешная беременность без какого-либо специального лечения [53]. Поздние потери (гибель плода) происходят в 1-2% в общей акушерской популяции. Частота ранних выкидышей (<10 недель гестации) или поздней гибели плода при нелеченом акушерском АФС неизвестна. Частота живорождения составляет 70–80% в исследованиях лечения акушерского АФС (хотя в исследованиях в основном учитывались привычные ранние выкидыши, и они не соответствовали строгим современным критериям АФС). Тяжелая преэклампсия может возникать идиопатически и, в частности, при СКВ является проблематичной, поскольку активная волчанка и заболевание почек также могут способствовать тяжелой преэклампсии [54].
Таблица 3
СИДНЕЙСКИЕ КРИТЕРИИ КЛАССИФИКАЦИИ АНТИФОСФОЛИПИДНОГО СИНДРОМА SAPPORO (2006 г.)
Клинический критерий
Лабораторный критерий
Волчаночный антикоагулянт присутствует в плазме ≥2 раз с интервалом не менее 12 недель.
≥1 Клинический эпизод артериального, венозного тромбоза или тромбоза мелких сосудов в любой ткани или органе. Клинические критерии должны быть представлены в течение 5 лет после положительного анализа на АФЛ.
Сосудистый тромбоз
-
a) артериальный
-
b) Венозный
-
c) Небольшое судно
-
d) Другие причины тромбоза должны быть пожилых пациентов.
Антикардиолипиновые антитела изотипа IgG и/или IgM в среднем или высоком титре (>40 GPL или MPL или >99-го процентиля) более исключены у чем в двух случаях с интервалом не менее 12 недель.
Патология связанную с беременностью
Антитело к β2 -гликопротеину I изотипа IgG и/или IgM в среднем или высоком титре (>99-го процентиля) в ≥2 случаях с интервалом не менее 12 недель.
≥1 Необъяснимая смерть морфологически нормального плода на 10-й неделе беременности или позже.
≥1 Преждевременные роды морфологически нормального новорожденного до 34 недель беременности из-за эклампсии, преэклампсии или признанной плацентарной недостаточности, или
≥3 необъяснимых последовательных спонтанных аборта до 10й недели беременности, при этом исключены анатомические или гормональные аномалии матери и отцовские и материнские хромосомные причины.
-
a) Одна или несколько потерь плода после 10-й недели
-
b) Один или несколько преждевременных родов (<34 недель)
-
c) Преэклампсия
-
d) Плацентарная недостаточность
-
e) Три и более самопроизвольных аборта подряд
Характеристики катастрофического антифосфолипидного синдрома. Третий тип тромбоза по классификационным критериям — микрососудистый, который характеризует катастрофический антифосфолипидный синдром. Это разрушительная, но очень редкая форма АФС, встречающаяся только у 1% всех пациентов с АФС. Недавний обзор Международного реестра CAPS показал, что смертность составляет 37%. Сорок восемь процентов пациентов с катастрофическим антифосфолипидным синдромом будут иметь первичный антифосфолипидный синдром, 40% - СКВ и 12% — другие предрасполагающие причины. Тромботический АФС обычно проявляется тромбозом глубоких вен, легочной эмболией, инсультом или потерей плода. Катастрофический антифосфолипидный синдром, однако, проявляется поражением почек в 73%, легких в 60% (например, острый респираторный дистресс-синдром), головного мозга в 56% (включая энцефалопатию), сердца в 50% и кожи в 47% (например, кожный некроз) [55].
Критерии катастрофического антифосфолипидного синдрома были разработаны и требуют вовлечения трех или более органов (или систем или тканей), проявлений, которые развились в течение одной недели, гистопатологии окклюзии мелких сосудов и подтверждения антифосфолипидных антител [55, 56].
Катастрофический антифосфолипидный синдром может возникнуть как у больного, у которого уже есть антифосфолипидный синдром, так и de novo . Интересно что, хотя это может повториться рецидивы очень редки.
Таблица 4
НЕВРОЛОГИЧЕСКИЕ ПРОЯВЛЕНИЯ АФС
|
Формы |
Частота |
|
Инсульт |
19,8% |
|
Миелопатия |
менее 1% |
|
Головные боли |
20,2% |
|
Судороги |
7% |
|
Хорея |
1,3% |
|
Когнитивные расстройства |
2,5% |
|
Поражение ЧМН особенно 2 пары |
15-88% |
|
Рассеянный склероз и другие демиелинизируеющие заболевания |
3-8% |
Патогенез АФС включает активацию моноцитов, тромбоцитов, эндотелиальных клеток и комплементов, которые вызывают тромбоз. Первичный АФС диагностируется в 53,1% случаев, тогда как вторичный АФС — связанный с другими аутоиммунными заболеваниями, особенно с системной красной волчанкой, или СКВ приходится на 36,2%. В общей популяции оценки распространенности антител к фосфолипидам колеблются от 1% до 5% относительно здоровых людей в до 10% [57].
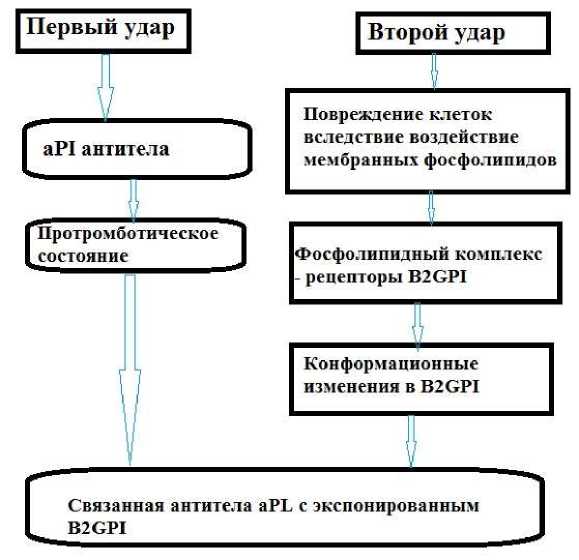
Рисунок 2. Гипотеза двух ударов в патогенезе АФС (aPL: антифосфолипиды, β2GPI: бета-2 гликопротеин I, aPI: антифосфолипиды) [25]
Неврологические проявления АФС. Депрессия. Депрессия является наиболее частой нейропсихиатрической жалобой у пациентов с АФС и может проявляться за несколько недель или месяцев до начала тромботических событий. Его часто не оценивают в свете аутоиммунной патологии, и диагноз ставится с задержкой. Наиболее распространенной гипотезой является влияние АФЛ на дофаминергические и серотонинергические нейроны, что приводит к изменениям настроения. Депрессия может быть единственным психоневрологическим симптомом АФС или может сопровождаться острым психозом или головными болями. Было проведено исследование [59] случай-контроль с участием пациентов с депрессией, из которых 22 были незначительными, 23 — большими и 20 — меланхолическими депрессиями.
У большого количества депрессивных субъектов была выявлена положительная реакция на АФЛ, что указывает на некоторую роль присутствия АФЛ в депрессии. Деменция. Обнаружено, что деменция у молодых людей связана с положительной реакцией на АCL. Внезапное начало деменции может быть признаком АФС у здорового пациента. Острое начало тяжелой или быстро прогрессирующей деменции требует немедленной оценки аутоиммунной этиологии, особенно у молодых людей. В европейском исследовании из 1000 субъектов мультиинфарктная деменция поражала 2,5% пациентов, как с первичным, так и с вторичным АФС, включенных в когорту Евро-АФС. Этот тип деменции улучшается при лечении АФС. Внезапное начало деменции у молодых пациентов без какой-либо известной причины или семейного анамнеза должно быть подвергнуто тестированию на АФЛ, чтобы исключить АФС как причину [60].
Психоз — одно из наиболее часто встречающихся психических проявлений при АФС-бреде, а галлюцинации — наиболее часто встречающийся психотический симптом. В системном обзоре, проведенном C. M. Yelnik, который включал 23 статьи, психоз был представлен как паранойя, слуховые и зрительные галлюцинации, а иногда и кататония [60].
Точная патофизиология психоза при АФС остается неизвестной. Психоз может быть симптомом первичного АФС даже в более молодых возрастных группах. Всестороннее исследование АФЛ АТ в крови и ЦСЖ у 100 пациентов с психозом показало специфичность и изотипическую изменчивость между АФЛАТ в крови и ЦСЖ, что указывает на независимый от ЦНС аутоиммунный процесс с интратекальным синтезом [61].
Заболевания, подобные рассеянному склерозу: существует широкий спектр от рассеянного склероза (РС) до заболеваний, подобных рассеянному склерозу, и синдрома перекрытия РС-СКВ, который трудно дифференцировать клинически, если не проводится тестирование на антифофолипидные антитела. Демографические данные между РС и АФС перекрываются, что еще больше затрудняет диагностику и дифференциацию. Сообщалось о позитивности по антителам у 2–88% пациентов с РС, при этом увеличивалась титр антител с рецидивами РС при вторично-прогрессирующем РС по сравнению с рецидивирующе-ремиттирующим РС. РС можно отличить от АФС, имитирующего РС, с помощью МРТ на основе характера поражений. Поражения, вызванные АФС, имеют тенденцию сохранять свою форму и размер при повторной визуализации, имеют меньшие объемы, обычно являются субкортикальными по сравнению с перивентрикулярными при РС и не имеют типичной овоидной формы или склонности к вовлечению мозолистого тела. Поражения могут вовлекать другие области мозга, такие как скорлупа, таламус, субталамические ядра Льюиса [61, 62].
Патофизиология, посредством которой антифосфолипидные антитела вызывает проявления, подобные рассеянному склерозу, способствовала молекулярной мимикрии с миелином или другими белками ЦНС. АPL продемонстрировал перекрестную реактивность с миелином, родственным миелину белком и фосфолипидами головного мозга (цефалином и сфингомиелином). Нарушения спектра оптиконейромиелита (НСОНМ): редко присутствуют при АФС и иногда могут накладываться на тромботические явления, маскируя его проявления. НСОНМ представляет собой группу демиелинизирующих заболеваний с аутоиммунной патологией, нацеленной на астроциты, которые связаны с наличием анти-аквапорин-4-IgG (AQP4-IgG). НСОНМ может быть связан с другими аутоиммунными заболеваниями, такими как ревматоидный артрит, СКВ и синдром Шегрена [60].
Антитела к АPL обнаруживаются у 19-46% пациентов с НСОНМ, и у этих пациентов проводится плазмаферез, который может показать некоторое улучшение. Следовательно, пациенты с НСОНМ должны быть обследованы на наличие антифосфолипидных антител. Хорея: Хорея определяется как «продолжающаяся случайная последовательность одного или нескольких дискретных непроизвольных движений или фрагментов движений». Это редкое проявление АФС с распространенностью 1,3% в группе проекта «Еврофосфолипид». Это происходит из-за поражения базальных ганглиев. Это чаще встречается у женщин, с соотношением 2:1 [63, 64].
Гормональные влияния могут играть роль триггера, поскольку заболеваемость хореей увеличивается во время беременности или при терапии эстрогенами, как предположили A. Hallab [66], в котором говорится, что прекращение триггерного лечения, такого как терапия, эстрогенами, и индукция антикоагулянтной или антитромбоцитарной терапии в большинстве случаев приводит к ремиссии.
Пациентам, хорея которых дополнительно связана с тромботическими событиями, предлагается длительное лечение варфарином. Традиционные нейролептики, такие как галоперидол, показали результаты при хорее, связанной с АФС и СКВ, наряду с иммуносупрессией для лечения основного АФС. Ренье и др. в своем ретроспективном анализе 30 пациентов продемонстрировали одинаковую эффективность стероидов и нейролептиков при добавлении к предшествующей терапии [64, 65].
Патогенез хореи при АФС в значительной степени обусловлен двухфазным процессом, при котором сначала эндотелиальная дисфункция приводит к микротромбам и воспалению в кровеносных сосудах, что приводит к нарушению ГЭБ, что приводит к проникновению нервных токсинов, которые изменяют линии дофаминергических нервных клеток и также чрезмерная активация рецептора глутамата N-метил-D-аспартата (NMDA) [66].
Нейросенсорная тугоухость (НСТ) является редким явлением при АФС, но в настоящее время она широко изучается в рамках широкого термина «аутоиммунная НСТ», или «аутоиммунная кохлеопатия», или «аутоиммунное заболевание внутреннего уха». На его долю приходится менее 1% случаев НСТ. При отсутствии надежных маркеров аутоиммунные заболевания уха определяются соответствующей клинической картиной и положительным ответом на стероидную терапию. Несколько сообщений о случаях и серии случаев указывают на наличие легкой или тяжелой потери слуха, вторичной по отношению к АФС [67].
Аутоиммунное поражение внутреннего уха (АПВУ) обусловлена как клеточноопосредованным, так и гуморальным иммунитетом. После неустановленных триггеров кохлеарные белки подвергаются воздействию системного иммунитета, который затем преодолевает гемато-лабиринтный барьер и достигает эндолимфатического мешка, который является основным модулятором местного иммунитета слухового анализатора [68].
У пациентов с АФС также часто наблюдаются судороги, особенно эпилептические судороги, которые могут быть вызваны тромбозами мозговых сосудов. Наиболее серьезным неврологическим осложнением АФС является ишемический инсульт. Инсульт может быть артериальным или венозным, и оба типа требуют немедленного и эффективного лечения. У пациентов с АФС также может возникать тромбоз мозговых вен и синдром антифосфолипидных антител при беременности. Также известно о связи между АФС и демиелинизирующими заболеваниями, такими как множественная склероза и миелит [63].
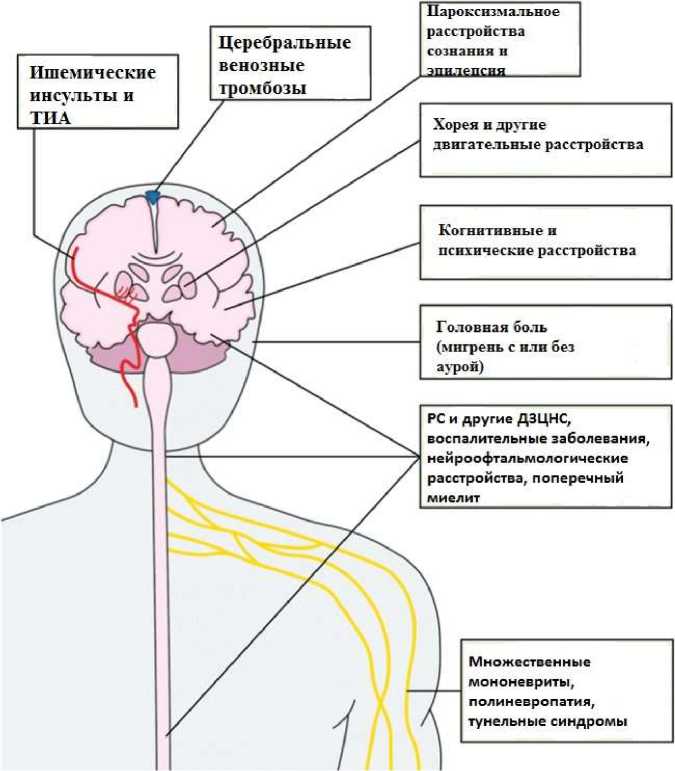
Рисунок 3. Спектр неврологических расстройств при АФС [67]
Антифосфолипидный синдром охватывает широкий спектр проявлений во всех областях медицины. Он характеризуется повторяющимися тромботическими событиями, затрагивающими как артериальную, так и венозную системы. Вовлекаются крупные артерии и вены, а также микроциркуляторное русло. Рецидивирующие инсульты, инфаркт миокарда, тромбоэмболия легочной артерии, гангрена пальцев и др. вызывают большую заболеваемость и смертность пораженных больных. Это признано важной причиной невынашивания беременности. Риск во время беременности распространяется на склонность к преэклампсии, отслойке плаценты и задержке внутриутробного развития. Он часто проявляется бессимптомной тромбоцитопенией, а иногда и опасной для жизни формой, называемой катастрофическим антифосфолипидным синдромом. Несмотря на успехи в диагностике, правильная идентификация пациентов с повышенным риском является сложной задачей. «Тройная положительная реакция» на критерии антифосфолипидные антитела связана с самым высоким риском клинических событий, хотя из отдельных тестов на специфические волчаночные антикоагулянты связаны с самым высоким риском. β 2 GPI-специфическая LA и анти-β 2Антитела к GPI-домену 1 могут быть более чувствительными маркерами тромботического риска, но на практике они малодоступны. Необходимы дальнейшие механистические и клинические исследования для разработки улучшенных
Бюллетень науки и практики / Bulletin of Science and Practice Т. 9. №11. 2023 методов ранней диагностики поражения нервной системы и определение факторов риска развития фатальных тромботических осложнений.
Таблица 5
НЕКРИТЕРИАЛЬНЫЕ АФА И ИХ СВЯЗЬ С ПРОЯВЛЕНИЯМИ АФС [67] [
|
APL без критериев |
Сопутствующее проявление АФС |
|
Антитела против протромбина (АПТ) |
*Артериальный тромбоз и тяжесть заболевания *Проявления ЦНС (совместное присутствие аПТ, аПГ, аАН и аПИ) *Значительно чаще встречается у мужчин |
|
aB2GPI (включая IgA) |
*Хорея у молодых пациенток Тромбоз |
|
Фосфатидилсерин/протромбиновый комплекс |
*Сильно коррелирует с наличием МА *Артериальный и венозный тромбоз *Тромботическая микроангиопатия (считается вехой для катастрофического АФС |
|
Антифосфатидилсерин (аФС) |
*Заболеваемость беременностью (совместное присутствие с aCL) |
|
Антифосфатидилглицерин (aPG) |
*Проявления ЦНС (совместное присутствие аПТ, аПГ, аАН и аПИ) |
|
Анти-виментин |
*Тяжесть заболевания |
|
Анти-аннексин 5 (аАН) |
*Заболеваемость беременных *Проявления ЦНС (совместное присутствие аПТ, аПГ, аАН и аПИ) |
|
Антифосфатидная кислота |
*IgM обратно связан с венозным тромбозом *Потеря плода, но не тромбоз |
|
Антифосфатидилинозитол (API) |
*Проявления ЦНС (совместное присутствие аПТ, аПГ, аАН и аПИ) *Значительно связан с тромбозом у пациентов с АФС и СКВ |
|
Антифосфатидилэтаноламин (аФЭ) |
*Тяжесть заболевания |
Заключение
Таким образом, нервная система является наиболее уязвимыми при системных, воспалительных и аутоиммунных заболеваниях. Системная красная волчанка и антифосфолипидный синдром — они являются теми нозологиями, при котором наиболее чаще, тяжелее и разнообразно поражается те или иные структуры нервной системы. Воспалительные и цитокиновые механизмы являются важными составляющими поражения нервной системы у пациентов с СКВ. Исследования в этой области все еще продолжаются, и дальнейшие исследования помогут лучше понять эти механизмы и разработать более эффективные методы лечения для пациентов с СКВ и поражением нервной системы.
Широкий спектр поражения нервной системы наблюдается и при антифосфолипидном синдроме которые могут иметь клинически важные нейрокогнитивные последствия.
При наличии анамнеза тромбозов или рецидивирующих неврологических симптомов необходимо обратить особое внимание на возможное наличие АФС.
Ранняя диагностика и специфическое лечение связанных с АФС неврологических проявлений являются ключевыми для предотвращения осложнений и улучшения прогноза пациентов. Дальнейшие исследования в этой области помогут лучше понять патогенез и оптимальные стратегии лечения неврологических проявлений АФС.
Список литературы Системная красная волчанка, антифосфолипидный синдром: фокус на поражения нервной системы
- Мамасаидов А. Т., Юсупов Ф. А. Взаимосвязь показателей В-клеточной активации и клинических проявлений неврологических осложнений при ревматоидном артрите // Наука и новые технологии. 2001. Т. 3. С. 21.
- Мамасаидов А. Т., Юсупов Ф. А., Грошев С. А. Показатели в-клеточной активации при ревматоидном артрите с поражением нервной системы на фоне антифосфолипидного синдрома // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2005. Т. 6. №3. С. 148.
- Рукавишников Г. В., Смирнова А. А., Незнанов Н. Г., Мазуров В. И., Мазо Г. Э. Общие патофизиологические механизмы системной красной волчанки и аффективных расстройств // Вестник Северо-Западного государственного медицинского университета им. ИИ Мечникова. 2021. Т. 13. №2. С. 5-14. https://doi.org/10.17816/mechnikov61262
- Benallegue N., Kebir H., Alvarez J. I. Neuroinflammation: extinguishing a blaze of T cells // Immunological Reviews. 2022. V. 311. №1. С. 151-176. https://doi.org/10.1111/imr.13122
- DiSabato D. J., Quan N., Godbout J. P. Neuroinflammation: the devil is in the details // Journal of neurochemistry. 2016. V. 139. P. 136-153. https://doi.org/10.1111/jnc.13607
- Tran V. T. A., Lee L. P., Cho H. Neuroinflammation in neurodegeneration via microbial infections // Frontiers in Immunology. 2022. V. 13. P. 907804. https://doi.org/10.3389/fimmu.2022.907804
- Heneka M. T., Kummer M. P., Latz E. Innate immune activation in neurodegenerative disease // Nature Reviews Immunology. 2014. V. 14. №7. P. 463-477. https://doi.org/10.1038/nri3705
- Грошев С.А., Юсупов Ф.А. Неврологические проявления антифосфолипидного синдрома // Научно-практическая ревматология. 2004. Т. 42. №2. С. 233.
- Chen X., Hu Y., Cao Z., Liu Q., Cheng Y. Cerebrospinal fluid inflammatory cytokine aberrations in Alzheimer's disease, Parkinson's disease and amyotrophic lateral sclerosis: a systematic review and meta-analysis // Frontiers in immunology. 2018. V. 9. P. 2122. https://doi.org/10.3389/fimmu.2018.02122
- Unterman A., Nolte J. E., Boaz M., Abady M., Shoenfeld Y., Zandman-Goddard G. Neuropsychiatric syndromes in systemic lupus erythematosus: a meta-analysis // Seminars in arthritis and rheumatism. WB Saunders, 2011. V. 41. №1. P. 1-11. https://doi.org/10.1016/j.semarthrit.2010.08.001
- De Amorim L. C. D., Maia F. M., Rodrigues C. E. M. Stroke in systemic lupus erythematosus and antiphospholipid syndrome: risk factors, clinical manifestations, neuroimaging, and treatment // Lupus. 2017. V. 26. №5. P. 529-536. https://doi.org/10.1177/09612033166887
- Schreiber K., Sciascia S., De Groot P. G., Devreese K., Jacobsen S., Ruiz-Irastorza G., Hunt B. J. Antiphospholipid syndrome //Nature reviews Disease primers. 2018. V. 4. №1. P. 1-20. https://doi.org/10.1038/nrdp.2017.103
- Narshi C. B., Giles I. P., Rahman A. The endothelium: an interface between autoimmunity and atherosclerosis in systemic lupus erythematosus? // Lupus. 2011. V. 20. №1. P. 5-13. https://doi.org/10.1177/096120331038242
- Bentham J. et al. Genetic association analyses implicate aberrant regulation of innate and adaptive immunity genes in the pathogenesis of systemic lupus erythematosus // Nature genetics. 2015. V. 47. №12. P. 1457-1464. https://doi.org/10.1038/ng.3434
- Hanly J. G., Fisk J. D., Eastwood B. Brain reactive autoantibodies and cognitive impairment in systemic lupus erythematosus // Lupus. 1994. V. 3. №3. P. 193-199. https://doi.org/10.1177/0961203394003003
- Alexopoulos H., Kampylafka E. I., Fouka P., Tatouli I., Akrivou S., Politis P. K., Dalakas M. C. Anti-aquaporin-4 autoantibodies in systemic lupus erythematosus persist for years and induce astrocytic cytotoxicity but not CNS disease // Journal of neuroimmunology. 2015. V. 289. P. 8-11. https://doi.org/10.1016/j.jneuroim.2015.10.007
- Asgari N., Jarius S., Laustrup H., Skejoe H. P., Lillevang S. T., Weinshenker B. G., Voss A. Aquaporin-4-autoimmunity in patients with systemic lupus erythematosus: a predominantly population-based study // Multiple Sclerosis Journal. 2018. V. 24. №3. P. 331-339. https://doi.org/10.1177/1352458517699
- Johnson R. T., Richardson E. P. The neurological manifestations of systemic lupus erythematosus: a clinical-pathological study of 24 cases and review of the literature // Medicine. 1968. V. 47. №4. P. 337.
- Bortoluzzi A., Scire C. A., Bombardieri S., Caniatti L., Conti F., De Vita S., Govoni M. Development and validation of a new algorithm for attribution of neuropsychiatric events in systemic lupus erythematosus // Rheumatology. 2015. V. 54. №5. P. 891-898. https://doi.org/10.1093/rheumatology/keu384
- Tay S. H., Mak A. Diagnosing and attributing neuropsychiatric events to systemic lupus erythematosus: time to untie the Gordian knot? // Rheumatology. 2017. V. 56. №suppl_1. P. i14-i23. https://doi.org/10.1093/rheumatology/kew338
- Urowitz M. B., Gladman D., Ibanez D., Bae S. C., Sanchez-Guerrero J., Gordon C., Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus // Arthritis care & research. 2010. V. 62. №6. P. 881-887. https://doi.org/10.1002/acr.20122
- Chiu C. C., Huang C. C., Chan W. L., Chung C. M., Huang P. H., Lin S. J., Leu H. B. Increased risk of ischemic stroke in patients with systemic lupus erythematosus: a nationwide population-based study // Internal Medicine. 2012. V. 51. №1. P. 17-21. https://doi.org/10.2169/internalmedicine.51.6154
- Bertsias G. K., Boumpas D. T. Pathogenesis, diagnosis and management of neuropsychiatric SLE manifestations // Nature Reviews Rheumatology. 2010. V. 6. №6. P. 358-367. https://doi.org/10.1038/nrrheum.2010.62
- Mikdashi J., Handwerger B., Langenberg P., Miller M., Kittner S. Baseline disease activity, hyperlipidemia, and hypertension are predictive factors for ischemic stroke and stroke severity in systemic lupus erythematosus // Stroke. 2007. V. 38. №2. P. 281-285. https://doi.org/10.1161/01.STR.0000254476.05620.14
- Юсупов Ф. А., Грошев С. А. Поражение центральной нервной системы при ревматоидном артрите с вторичным антифосфолипидным синдромом // Вестник Санкт-Петербургской государственной медицинской академии им. И. И. Мечникова. 2005. Т. 6. № 4. С. 176.
- Hanly J. G., Urowitz M. B., Su L., Gordon C., Bae S. C., Sanchez-Guerrero J., Farewell V. Seizure disorders in systemic lupus erythematosus results from an international, prospective, inception cohort study // Annals of the rheumatic diseases. 2012. V. 71. №9. P. 1502-1509.
- Appenzeller S., Cendes F., Costallat L. T. L. Epileptic seizures in systemic lupus erythematosus // Neurology. 2004. V. 63. №10. P. 1808-1812. https://doi.org/10.1212/01.wnl.0000144178.32208.4f
- Pittock S. J., Lennon V. A., De Seze J., Vermersch P., Homburger H. A., Wingerchuk D. M., ... & Weinshenker, B. G.. Neuromyelitis optica and non–organ-specific autoimmunity // Archives of neurology. 2008. V. 65. №1. P. 78-83. https://doi.org/10.1001/archneurol.2007.17
- Sellner J., Boggild M., Clanet M., Hintzen R. Q., Illes Z., Montalban X., Hemmer B. EFNS guidelines on diagnosis and management of neuromyelitis optica // European journal of neurology. 2010. V. 17. №8. P. 1019-1032. https://doi.org/10.1111/j.1468-1331.2010.03066.x
- Baizabal-Carvallo J. F., Delgadillo-Márquez G., Estañol B., García-Ramos G. Clinical characteristics and outcomes of the meningitides in systemic lupus erythematosus // European neurology. 2009. V. 61. №3. P. 143-148. https://doi.org/10.1159/000186504
- Reiner P., Galanaud D., Leroux G., Vidailhet M., Haroche J., Huong D. L. T., Costedoat- Chalumeau, N.. Long‐term outcome of 32 patients with chorea and systemic lupus erythematosus or antiphospholipid antibodies // Movement disorders. 2011. V. 26. №13. P. 2422-2427. https://doi.org/10.1002/mds.23863
- Khubchandani R. P., Viswanathan V., Desai J. Unusual neurologic manifestations (I): Parkinsonism in juvenile SLE // Lupus. 2007. V. 16. №8. P. 572-575. https://doi.org/10.1177/09612033070814
- Keiserman B., da Silva L. F. G., Keiserman M. W., von Mühlen C. A., Staub H. L.. Lupoid sclerosis // Rheumatology international. 2010. V. 30. P. 431-434. https://doi.org/10.1007/s00296-009-1175-1
- Hanly J. G., Urowitz M. B., O'Keeffe A. G., Gordon C., Bae S. C., Sanchez-Guerrero J., Farewell V. Headache in systemic lupus erythematosus: results from a prospective, international inception cohort study // Arthritis & Rheumatism. 2013. V. 65. №11. P. 2887-2897. https://doi.org/10.1002/art.38106
- Davey R., Bamford J., Emery P. The ACR classification criteria for headache disorders in SLE fail to classify certain prevalent headache types // Cephalalgia. 2008. V. 28. №3. P. 296-299. https://doi.org/10.1111/j.1468-2982.2007.01510.x
- Appenzeller S., Cendes F., Costallat L. T. L. Acute psychosis in systemic lupus erythematosus // Rheumatology international. 2008. V. 28. P. 237-243. https://doi.org/10.1007/s00296-007-0410-x
- Lennox B. R., Pollak T., Palmer-Cooper E. C., Scoriels L., Harrison P. J., Jones P. B., Vincent A. Serum neuronal cell-surface antibodies in first-episode psychosis–Authors' reply // The Lancet Psychiatry. 2017. V. 4. №3. P. 187-188. https://doi.org/10.1016/S2215-0366(17)30053-6
- Bonfa E., Golombek S. J., Kaufman L. D., Skelly S., Weissbach H., Brot N., Elkon K. B Association between lupus psychosis and antiribosomal P protein antibodies // New England Journal of Medicine. 1987. V. 317. №5. P. 265-271. https://doi.org/10.1056/NEJM198707303170503
- Hanly J. G., Su L., Urowitz M. B., Romero-Diaz J., Gordon C., Bae S. C., Farewell V.Mood disorders in systemic lupus erythematosus: results from an international inception cohort study // Arthritis & rheumatology. 2015. V. 67. №7. P. 1837-1847. https://doi.org/10.1002/art.39111
- Юсупов Ф. А., Юлдашев А. А., Ормонова Г. М., Абдыкадыров М. Ш. Синдром задней обратимой лейкоэнцефалопатии // Практическая медицина. 2022. Т. 20. №2. С. 30-36. https://doi.org/10.32000/2072-1757-2022-2-30-36
- Lim K. L., Abdul-Wahab R., Lowe J., Powell R. J. Muscle biopsy abnormalities in systemic lupus erythematosus: correlation with clinical and laboratory parameters // Annals of the rheumatic diseases. 1994. V. 53. №3. P. 178-182.
- Tsokos G. C., Moutsopoulos H. M., Steinberg A. D. Muscle involvement in systemic lupus erythematosus // Jama. 1981. V. 246. №7. P. 766-768. https://doi.org/10.1001/jama.1981.03320070050025
- Florica B., Aghdassi E., Su J., Gladman D. D., Urowitz M. B., Fortin P. R. Peripheral neuropathy in patients with systemic lupus erythematosus // Seminars in arthritis and rheumatism. WB Saunders, 2011. V. 41. №2. P. 203-211. https://doi.org/10.1016/j.semarthrit.2011.04.001
- Omdal R., Løseth S., Torbergsen T., Koldingsnes W., Husby G., Mellgren S. I. Peripheral neuropathy in systemic lupus erythematosus–a longitudinal study // Acta neurologica scandinavica. 2001. V. 103. №6. P. 386-391. https://doi.org/10.1034/j.1600-0404.2001.103006386.x
- Hellmann D. B., Laing T. J., Petri M., Whiting-O'keefe Q., Parry G. J. Mononeuritis multiplex: the yield of evaluations for occult rheumatic diseases // Medicine. 1988. V. 67. №3. P. 145-153.
- Rivière E., Cohen Aubart F., Maisonobe T., Maurier F., Richez C., Gombert B., Amoura Z. Clinicopathological features of multiple mononeuropathy associated with systemic lupus erythematosus: a multicenter study // Journal of neurology. 2017. V. 264. P. 1218-1226. https://doi.org/10.1007/s00415-017-8519-7
- Hughes R. A. C., Donofrio P., Bril V., Dalakas M. C., Deng C., Hanna K., van Doorn P. A.. Intravenous immune globulin (10% caprylate-chromatography purified) for the treatment of chronic inflammatory demyelinating polyradiculoneuropathy (ICE study): a randomised placebocontrolled trial // The Lancet Neurology. 2008. V. 7. №2. P. 136-144. https://doi.org/10.1016/S1474-4422(07)70329-0
- Toledano P., Orueta R., Rodríguez-Pintó I., Valls-Solé J., Cervera R., Espinosa G.. Peripheral nervous system involvement in systemic lupus erythematosus: prevalence, clinical and immunological characteristics, treatment and outcome of a large cohort from a single centre // Autoimmunity Reviews. 2017. V. 16. №7. P. 750-755. https://doi.org/10.1016/j.autrev.2017.05.011
- Frigui M., Frikha F., Sellemi D., Chouayakh F., Feki J., Bahloul Z. Optic neuropathy as a presenting feature of systemic lupus erythematosus: two case reports and literature review // Lupus. 2011. V. 20. №11. P. 1214-1218. https://doi.org/10.1177/0961203311403344
- Stone J. The bare essentials: functional symptoms in neurology // Practical neurology. 2009. V. 9. №3. P. 179-189. https://doi.org/10.1136/jnnp.2009.177204
- Petri M. Epidemiology of the antiphospholipid antibody syndrome // Journal of autoimmunity. 2000. V. 15. №2. P. 145-151. https://doi.org/10.1006/jaut.2000.0409
- Sène D., Piette J. C., Cacoub P. Antiphospholipid antibodies, antiphospholipid syndrome and infections // Autoimmunity reviews. 2008. V. 7. №4. P. 272-277. https://doi.org/10.1016/j.autrev.2007.10.001
- Ünal S., Varan A., Yalçın B., Büyükpamukçu M., Gürgey A. Evaluation of thrombotic children with malignancy // Annals of hematology. 2005. V. 84. P. 395-399. https://doi.org/10.1007/s00277-005-1004-x
- Farmer-Boatwright M. K., Roubey R. A. S. Venous thrombosis in the antiphospholipid syndrome // Arteriosclerosis, thrombosis, and vascular biology. 2009. V. 29. №3. P. 321-325. https://doi.org/10.1161/ATVBAHA.108.182204
- Empson M. B., Lassere M., Craig J. C., Scott J. R. Prevention of recurrent miscarriage for women with antiphospholipid antibody or lupus anticoagulant // Cochrane database of systematic reviews. 2005. №2.
- Leal Rato M., Bandeira M., Romão V. C., Aguiar de Sousa D. Neurologic manifestations of the antiphospholipid syndrome - an update // Current Neurology and Neuroscience Reports. 2021. V. 21. №8. P. 41. https://doi.org/10.1007/s11910-021-01124-z
- George D., Erkan D. Antiphospholipid syndrome // Progress in cardiovascular diseases. 2009. V. 52. №2. P. 115-125. https://doi.org/10.1016/j.pcad.2009.06.005
- Rodríguez-Pintó I., Moitinho M., Santacreu I., Shoenfeld Y., Erkan D., Espinosa G., CAPS Registry Project Group.. Catastrophic antiphospholipid syndrome (CAPS): descriptive analysis of 500 patients from the International CAPS Registry // Autoimmunity Reviews. 2016. V. 15. №12. P. 1120-1124. https://doi.org/10.1016/j.autrev.2016.09.010
- Otomo K., Atsumi T., Amengual O., Fujieda Y., Kato M., Oku K., Koike T. Efficacy of the antiphospholipid score for the diagnosis of antiphospholipid syndrome and its predictive value for thrombotic events // Arthritis & Rheumatism. 2012. V. 64. №2. P. 504-512. https://doi.org/10.1002/art.33340
- Asif S., Bali A., Dang A. K., Gonzalez D. A., Kumar R. Neurological and neuropsychiatric manifestations of antiphospholipid-antibody syndrome (APS) // Cureus. 2022. V. 14. №6. https://doi.org/10.7759/cureus.26022
- Юсупов Ф. А. Острые нарушения мозгового кровообращения и антифосфолипидный синдром у больных системной красной волчанкой // Журнал неврологии и психиатрии им. C.C. Корсакова. 2003. № 9. С. 170.
- Rodrigues C. E. M., Carvalho J. F., Shoenfeld Y. Neurological manifestations of antiphospholipid syndrome // European Journal of Clinical Investigation. 2010. V. 40. №4. P. 350-359. https://doi.org/10.1111/j.1365-2362.2010.02263.x
- Gris J. C., Brenner B. Antiphospholipid antibodies: neuropsychiatric presentations // Seminars in thrombosis and hemostasis. Thieme Medical Publishers, 2013. P. 935-942. https://doi.org/10.1055/s-0033-1357488
- Hallab A., Naveed S., Altibi A., Abdelkhalek M., Ngo H. T., Le T. P., Huy N. T. Association of psychosis with antiphospholipid antibody syndrome: A systematic review of clinical studies // General Hospital Psychiatry. 2018. V. 50. P. 137-147. https://doi.org/10.1016/j.genhosppsych.2017.11.005
- Bevers E. M., Galli M., Barbui T., Comfurius P., Zwaal R. F. A. Lupus anticoagulant IgG's (LA) are not directed to phospholipids only, but to a complex of lipid-bound human prothrombin // Thrombosis and haemostasis. 1991. V. 66. №12. P. 629-632. https://doi.org/10.1055/s-0038-1646476
- Ferreira S., D'Cruz D. P., Hughes G. R. V. Multiple sclerosis, neuropsychiatric lupus and antiphospholipid syndrome: where do we stand? // Rheumatology. 2005. V. 44. №4. P. 434-442. https://doi.org/10.1093/rheumatology/keh532
- Iyer A., Elsone L., Appleton R., Jacob A. A review of the current literature and a guide to the early diagnosis of autoimmune disorders associated with neuromyelitis optica // Autoimmunity. 2014. V. 47. №3. P. 154-161. https://doi.org/10.3109/08916934.2014.883501
- Sorice M., Longo A., Capozzi A., Garofalo T., Misasi R., Alessandri C., Valesini G. Anti– β2‐glycoprotein I antibodies induce monocyte release of tumor necrosis factor α and tissue factor by signal transduction pathways involving lipid rafts // Arthritis & Rheumatism. 2007. V. 56. №8. P. 2687-2697. https://doi.org/10.1002/art.22802


