Системное воспаление и иммунологическое микроокружение в прогнозе течения солидных опухолей
Автор: Кутукова С.И., Беляк Н.П., Раскин Г.А., Манихас Г.М., Яременко А.И., Иваськова Ю.В., Божор С.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.9, 2019 года.
Бесплатный доступ
Цель исследования. изучить прогностическую значимость показателей системного воспаления периферической крови и относительных показателей: нейтрофильно-лимфоцитарное и тромбоцитарно-лимфоцитарное соотношение, на течение плоскоклеточного рака слизистой оболочки полости рта и аденокарциномы желудка. Материалы и методы. Произведен проспективный анализ больных плоскоклеточным раком слизистой оболочки полости рта и диссеминированной аденокарциномой желудка. Были отобраны пациенты с верифицированным диагнозом, без признаков воспалительных заболеваний в анамнезе, не получающие антибактериальную и иммуномодулирующую терапию. В качестве основных оцениваемых параметров рассматривали общую выживаемость и выживаемость без прогрессирования. Результаты. Критериям отбора соответствовали 32 больных диссеминированной аденокарциномой желудка и 60 больных плоскоклеточным раком слизистой оболочки полости рта. Определена прогностическая ценность относительных показателей: общая выживаемость пациентов с аденокарциномой желудка с низким значением нейтрофильно-лимфоцитарного индекса достоверно выше, чем у остальной когорты пациентов: 16 месяцев против 8 и 7 месяцев (95 % ДИ от 12 до 23 месяцев, р=0,0382)...
Аденокарцинома желудка, плоскоклеточный рак слизистой оболочки полости рта, иммунологическое микроокружение, нейтрофильно-лимфоцитраный и тромбоцитарно-лимфоцитарные индексы
Короткий адрес: https://sciup.org/140243811
IDR: 140243811
Текст научной статьи Системное воспаление и иммунологическое микроокружение в прогнозе течения солидных опухолей
Актуальность вопроса
Злокачественная опухоль является крайне динамической системой, которую целесообразно рассматривать в комплексе со всеми клиническими и морфологическими составляющими, и формирующими ее микроокружение (клетки стромы, клетки системы иммунитета, кровеносные, лимфатические сосуды и экстрацеллюлярный матрикс), и определяющими общую реакцию организма пациента на развивающийся опухолевый процесс [2, 7].
Иммунная система и клетки, инфильтрирующие опухоль, являются объектом активного изучения [1, 4, 12], поскольку им отводится ключевая роль в формировании противоопухолевого иммунитета. Многообразие субпопуляций иммунных клеток, а также основных продуктов их синтеза и путей совместного взаимодействия может объяснять их возможное диаметрально противоположное действие: от активации путей противоопухолевой защиты до потенциирования прогрессирования заболевания.
Кроме того, в литературе встречаются данные, свидетельствующие о том, что хроническое воспаление является риском развития опухоли и ее прогрессирования [3].
Материалы и методы
Основные критерии включения пациентов в исследование:
Основные критерии исключения пациентов из исследования:
-
1. Наличие в анамнезе воспалительных заболеваний (в том числе признаков воспаления в опухоли и окружающих пространствах).
-
2. Поддерживающая антибактериальная и иммуномодулирующая терапия на момент включения в исследование.
Всем пациентам с плоскоклеточным раком слизистой оболочки полости рта проводилось лечение согласно существующим стандартам (I–II стадия — хирургическое лечение; III–IVA стадия — индукционная химиотерапия; IVB стадия — лекарственная терапия 1 линии).
На этапе исходной оценки всем пациентам был проведен стандартный комплекс обследований: физикальный осмотр, клинический и биохимический анализ крови (анализатор «Abbott Diagnostic», США: Cell-Dyn 3700 SL и Architect c8800), электрокардиограмма в 12-ти отведениях, компьютерная томография с целью уточнения распространенности опухолевого процесса. Все пациенты имели удовлетворительный общий статус, определенный по шкале ECOG — 1 балл.
Методика расчета клинических факторов воспаления
С целью выявления прогностической ценности клинических маркеров воспаления нами был произведен расчет следующих соотношений (по результатам клинического анализа крови на этапе исходной оценки):
-
1) нейтрофильно-лимфоцитарный индекс (НЛИ), который рассчитывался как отношение абсолютного числа нейтрофилов к абсолютному числу лимфоцитов в периферической крови,
-
2) тромбоцитарно-лимфоцитарный индекс (ТЛИ), который рассчитывался как отношение абсолютного числа тромбоцитов к абсолютному числу лимфоцитов в периферической крови, 3) моноцитарно-лимфоцитарный индекс (только для группы пациентов с опухолями слизистой оболочки полости рта), который рассчитывался как отношение абсолютного числа
моноцитов к абсолютному числу лимфоцитов в периферической крови.
Методика определения нейтрофильной и эозинофильной инфильтрации опухоли и ее микроокружения, и иммуногистохимического исследования с целью выявления инфильтрации опухоли CD8 Т-лимфоцитами.
Выполнение иммуногистохимического исследования проводилось по стандартному протоколу: срезы с парафиновых блоков наносились на поли-L-лизиновые стекла с последующей инкубацией их при температуре 35-37°С в условиях термостата для их плотного прикрепления. Затем выполнялась депарафинизация материала в ксилоле, отмывание в 96% и 70% этиловых спиртах и дистиллированной воде. После этого проводилась демаскировка антигенов при температуре 96оС в буфере AntigenRetrievalSolution (DAKO), pH-9,0. Впоследствии выполнялись ингибирование эндогенной пероксидазы 3% перекисью водорода и инкубация первых антител (CD8 — DAKO, клон C8/144B, 1:100; p16ink4a — NeoMarkers, клон 16P04, 1:600); выявление процесса связывания антиген-антитело осуществлялось при помощи системы визуализации DakoEnVision и диаминобензидина в качестве хромогена. Окрашивание ядер осуществлялось при помощи гематоксилина Майера.
Оценка результатов исследования осуществлялась с помощью светового микроскопа ОlympusCX41, камера DP72. Подсчет количества нейтрофилов и эозинофилов осуществлялся на препаратах, окрашенных гематоксилином и эозином, CD8-позитивных Т-лимфоцитов — на препаратах, окрашенных иммуногистохимическим способом. Количество клеток подсчитывалось на 1 мм2 (5 полей зрения при увеличении Х400, окуляре WHB10X/20) двумя способами: только в опухолевой ткани и в опухолевой ткани и прилежащей строме, однако опухоль должна была занимать не менее 50% поля зрения. Оценка иммуногистохимического исследования p16ink4a осуществлялась путем подсчета позитивных клеток относительно 2000 злокачественных клеток, и в случае ограниченности материала процент позитивных клеток высчитывался относительно всех опухолевых клеток на срезе.
Основные оцениваемые параметры
Основными конечными точками в данном исследовании были общая выживаемость и безрецидивная выживаемость.
Безрецидивная выживаемость определялась как время от момента наступления ремиссии заболевания на фоне проводимого лечения до времени регистрации рецидива.
Анализ выживаемости проводился с использованием процедуры Каплана-Майера, а сравнение кривых выживаемости — с использованием log-rank теста. Медиана общей выживаемости рассчитывалась с двусторонним 95% доверительным интервалом (ДИ).
Статистическая обработка полученных результатов осуществлялась с помощью программ статистических пакетов STATISTICA, ver. 12.0, MedCalc, ver. 18.11.6, PASS 11, ver. 11.0.7, Microsoft Excel 2010.
Результаты исследования
Группа пациентов с плоскоклеточным раком слизистой оболочки полости рта
Под нашим наблюдением находились 60 пациентов, 37 мужчин и 23 женщины, в возрасте от 42 до 82 лет, медиана возраста составила 59 лет (95% ДИ от 57 до 65 лет). Все пациенты проходили лечение в СПб ГБУЗ «Городской клинический онкологический диспансер» по поводу верифицированного плоскоклеточного рака слизистой оболочки полости рта с 2010 года по 2015 год.
У 26 (43,33 %) больных первичный опухолевый очаг локализовался на слизистой оболочке передней и средней третей языка, у 13 (21,67%) — на слизистой оболочке дна полости рта, у 4 пациента (6,67%) отмечено поражение задней трети или корня языка и альвеолярной части нижней челюсти; слизистая оболочка щеки явилась первичным очагом у 3 (5,00%) пациентов, у 2 пациентов 3,33%) обнаружена опухоль слизистой оболочки ретромолярной области. По 1 пациенту (1,66%) имели первичные поражения слизистой оболочки альвеолярного отростка верхней челюсти, прежней небной дужки, боковой стенки глотки, твёрдого неба, слизистой оболочки крыло-челюстной складки и слизистой верхнечелюстной пазухи.
После проведённого стандартного обследования была определена стадии заболевания, при этом ни одного случая диссеминированного процесса не зарегистрировано. I стадия заболевания установлена у 3 (5,0%) пациентов, II — у 7 (11,8%), III стадия — у 8 (13,2 %) и IV — у 42 (70,0 %) больных (IVA — 37, IVB — 5 пациентов).
Согласно проведённому морфологическому исследованию, 23 (38,33%) пациентов имели высокодифференцированные опухоли, 15 (25,00%) — умереннодифференцированные, и 5 (8,33%) — низ- кодифференцированные; у 17 (28,33%) больных степень дифференцировки опухоли не определена. В 27 (45,0%) образцах из 60 выявлены признаки ороговения, в 16 (26,7%) они отсутствовали, в 2 (3,3%) образцах имелись признаки частичного ороговения, а в остальных 15 (25,0%) ороговение не определено.
Исследование иммунологического микроокружения опухоли
При ИГХ-исследовании у пациентов данной группы получены следующие результаты.
Показатель нейтрофильного звена микроокружения варьировал в пределах от 0 до 112 клеток в кв.мм. (8 стандартных полей зрения): средний показатель составил 50,00 ± 32,88.
Эозинофильный компонент варьировал в пределах от 0 до 10 клеток в мм2. Среднее количество эозинофилов составило 6,67 ± 3,33 клеток.
Частота CD8-положительных клеток колебалась в пределах от 26 до 380 клеток/мм2, средний показатель составил 198,67 ± 102,28.
Группа пациентов с плоскоклеточным раком слизистой оболочки полости рта
Показатель нейтрофильного звена в опухоли и в непосредственном микроокружении варьировал в пределах от 5 до 1050 клеток в мм2 (8 стандартных полей зрения); средний показатель в опухоли составил 101,33 ± 21,77, в микроокружении — 175,72 ± 29,01.
Эозинофильный компонент в опухоли и в непосредственном микроокружении варьировал в пределах от 0 до 872 клеток в мм2 (8 стандартных полей зрения), причем столь высокий уровень эозинофильной инфильтрации был выявлен только у одного пациента из 60; средний показатель в опухоли составил 16,19 ± 10,72, в микроокружении — 37,29 ± 17,79.
Экспрессия CD8 колебалась в пределах от 3 до 1380 кле-ток/мм2; средний показатель в опухоли составил 144,14 ± 21,87, в микроокружении — 451,02 ± 42,90.
Полученные результаты представлены в таблице 1.
Исследование факторов воспаления
Уровень нейтрофилов периферической крови пациентов варьировал в пределах от 1,63 до 13,80 × 109/л, средний показатель составил 5,43 ± 0,52 × 109/л.
Таблица 1. Результаты анализа иммунологического микроокружения опухоли
Уровень тромбоцитов периферической крови пациентов варьировал в пределах от 163,00 до 737,00 × 109/л, средний показатель составил 346,56 ± 23,58 × 109/л.
Уровень лимфоцитов периферической крови пациентов варьировал в пределах от 0,81 до 3,32 × 109/л, средний показатель составил 1,88 ± 0,12 × 109/л.
Расчет относительных индексов продемонстрировал следующие результаты.
Нейтрофильно-лимфоцитарный индекс варьировал в пределах от 0,82 до 15,06, средний его показатель составил 3,42 ± 0,49 × 109/л.
Тромбоцитарно-лимфоцитарный индекс варьировал в пределах от 72,00 до 535,30, средний его показатель составил 208,59 ± 20,44.
Группа пациентов с плоскоклеточным раком слизистой оболочки полости рта
Уровень нейтрофилов периферической крови пациентов варьировал в пределах от 1,75 до 10,51 × 109/л, средний показатель составил 4,53 ± 0,26 × 109/л.×
Уровень тромбоцитов периферической крови пациентов варьировал в пределах от 144,00 до 653,00 × 109/л, средний показатель составил 305,35 ± 14.02 × 109/л.
Уровень моноцитов периферической крови пациентов варьировал в пределах от 0,05 до 1,05 × 109/л, средний показатель составил 0,52 ± 0,03 × 109/л.
Уровень лимфоцитов периферической крови пациентов варьировал в пределах от 0,84 до 3,83 × 109/л, средний показатель составил 2,15 ± 0,09 × 109/л.
Расчет относительных индексов показал следующие результаты.
Нейтрофильно-лимфоцитарный индекс варьировал в пределах от 0,65 до 7,22, средний его показатель составил 2,34 ± 0,18.
Тромбоцитарно-лимфоцитарный индекс варьировал в пределах от 55,03 до 428,10, средний его показатель составил 155,70 ± 10,12.
Попытка выявить корреляционные зависимости между иммунологическим опухолевым окружением (инфильтрация опухоли и микроокружения нейтрофилами, эозинофилам, экспрессия CD8 Т-лимфоцитами) и показателями периферической крови не удалась, что свидетельствует о том, что эти факторы могут являются самостоятельными и независимыми прогностическими маркерами.
Полученные результаты представлены в таблице 2.
Оценка выживаемости
С целью оценки влияния факторов воспаления на выживаемость нами была произведена оценка влияния рассматриваемых параметров на общую и безрецидивную выживаемость пациентов обеих групп.
Достоверной зависимости общей выживаемости от инфильтрации опухоли и ее микроокружения нейтрофилами, эозинофилами и CD8 Т-лимфоцитами в данной когорте пациентов выявлено не было (р>0,05).
Проведен многофакторный анализ с построением модели Кокса. Помимо исследуемых факторов в данную модель были включены демографические характеристики пациентов (пол, возраст), а также такие характеристики опухолевого процесса, как локализация первичной опухоли, стадия процесса и дифференцировка опухоли.
Вероятность влияния экспрессии CD8 на общую выживаемость составила 0,57 (95% CIofExp (b) от 0,96 до 1,03), вероятность влияния нейтрофильного компонента — 0,87 (95% CIofExp (b) от 0,98 до 1,01), а эозинофильного — 0,25 (95% CIofExp (b) от 0,95 до 1,13). Общий уровень значимости модели Кокса составил p=0,65.
Столь низкая значимость исследуемых показателей связана, по всей видимости, с малым объемом выборки, что говорит о необходимости дальнейшего исследования.
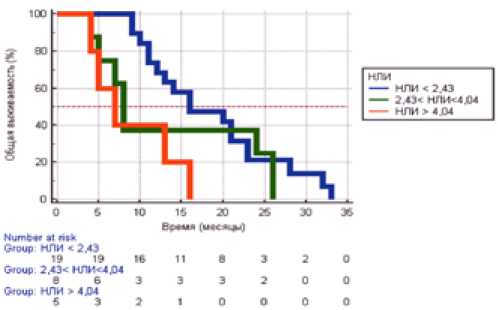
С целью оценки прогностической ценности нейтрофильнолимфоцитарного и тромбоцитарно-лимфоцитарного индексов на общую выживаемость нами были использованы средние значения данных индексов как минимальные пороговые значения (2,43 для НЛИ и 166,91 для ТЛИ); максимальным пороговым значением для НЛИ было выбрано максимальное значение 95% порогового интервала (4,04 для НЛИ).
Общая выживаемость пациентов у пациентов с низким показателем нейтрофильно-лимфоцитарного индекса (<2,43) составила 16 месяцев (95% ДИ от 12 до 23 месяцев), что достоверно (р=0,0382) отличается от выживаемости пациентов в группе умеренного (2,43–4,04) показателя НЛИ, где она составила 8 месяцев (95%ДИ от 5 до 26 месяцев), и группы высокого НЛИ (> 4,04), где она составила 7 месяцев (95%ДИ от 4 до 16 месяцев) (рис. 1).
Таблица 2. Результаты анализа клинических маркеров воспаления
Группа пациентов с плоскоклеточным раком слизистой оболочки полости рта
Нами была оценена общая и безрецидивная выживаемость пациентов с использованием модели Kaplan-Meier: медиана общей выживаемости составила 8 месяцев (95% CI от 7,000 до 12,000); медиана времени до прогрессирования составила 6 месяцев (95% CI от 4,000 до 9,000).
Нами был проведен многофакторный анализ влияния количественных показателей наличия нейтрофилов, эозинофилов и экспрессии CD8 на общую и безрецидивную выживаемость с использованием модели Кокса. Помимо исследуемых факторов в данную модель также были включены демографические характеристики пациентов (пол, возраст), а также такие характеристики опухолевого процесса, как локализация первичной опухоли, стадия процесса, дифференцировка опухоли и степень ороговения.
Достоверных влияний пока не было выявлено, что, вероятнее всего, связано с малым объемом выборки, однако о тенденции к влиянию на общую выживаемость говорить можно, это подтверждает прогностическую ценность этих показателей.
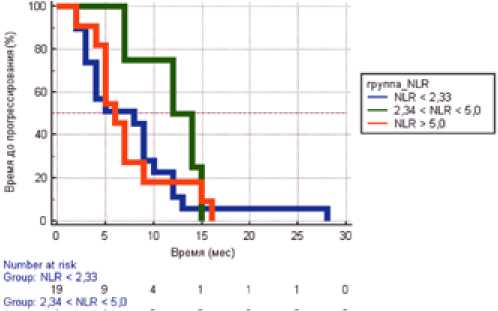
Рисунок 3. Выживаемость без прогрессирования больных плоскоклеточным раком слизистой оболочки полости рта в зависимости от уровня нейтрофильно-лимфоцитарного соотношения.
Вероятность влияния экспрессии CD8 на общую выживаемость составила p=0,08 (95% CIofExp (b) от 0,84 до 1,01), вероятность влияния нейтрофильного компонента — 0,07 (95% CIofExp (b) от 0,91 до 1,01), а эозинофильного — 0,12 (95% CIofExp (b) от 0,98 до 1,00). Общий уровень значимости модели Кокса — p=0,08.
Вероятность влияния на время до прогрессирования оказалась малозначительна: значимость экспрессии CD8 составила p=0,29 (95% CIofExp (b) от 0,96 до 1,00), вероятность влияния нейтрофильного компонента — p=0,72 (95% CIofExp (b) от 0,98 до 1,01), а эозинофильного — p=0,08 (95% CIofExp (b) от 0,84 до 1,06). Общий уровень значимости модели Кокса составил p=0,17.
Для оценки прогностической ценности НЛИ, МЛИ и ТЛИ на общую выживаемость мы использовали пороговые значения данных индексов: как минимальные значения были выбраны 2,33 для НЛИ, 5,28 для МЛИ и 155,70 для ТЛИ); максимальным пороговым значением для НЛИ было выбрано значение 5,0.
Медиана общей выживаемости пациентов с низким показателем нейтрофильно-лимфоцитарного индекса (< 2,43) составила 55 месяцев (95% ДИ от 41 до 58 месяцев), что отличается (р=0,08) от выживаемости пациентов в группе умеренного (2,43–5,0) и высокого (> 5,0) показателя НЛИ, где она достигнута не была, но среднее значение составило 21,8 ± 3,76 (95% ДИ от 14,44 до 29,16), а также от группы высокого уровня НЛИ, где медиана общей выживаемости также еще не достигнута, среднее значение составило 17,72 ± 1,21 (95% ДИ от 15,35 до 20,11).
Медиана времени до прогрессирования пациентов у пациентов с умеренным показателем нейтрофильно-лимфоцитарного индекса (2,43–5,0) составила 12 месяцев (95% ДИ от 7 до 15 месяцев), что отличается (р=0,07) от выживаемости пациентов в группе низкого (< 2,43) и высокого (> 5,0) показателя НЛИ, где она составила 8 месяцев (95%ДИ от 4 до 9 месяцев) и 6 месяцев (95%ДИ от 5 до 9 месяцев), соответственно (рис. 3).
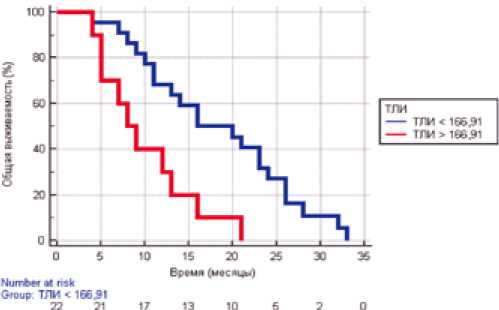
Влияние тромбоцитарно-лимфоцитарного индекса (ТЛИ) на общую выживаемость и время до прогрессирования также демонстрирует связь рассматриваемых показателей с выживаемостью больных плоскоклеточным раком слизистой оболочки полости рта. Медиана общей выживаемости была достигнута только в группе с низким уровнем ТЛИ (<155,70) и составила 55 месяцев, а в группе высокого ТЛИ в среднем общая выживаемость составляет на сегодняшний момент 6 месяцев. Подобные разли- чия, вероятно, связаны с малочисленностью группы пациентов, имеющих исходно низкий уровень ТЛИ.
Медиана времени до прогрессирования у пациентов с низким уровнем соотношения абсолютного числа тромбоцитов к абсолютному числу нейтрофилов (<155,70) составила 7 месяцев (95% ДИ от 5 до 9 месяцев), достоверно отличаясь от таковой у больных с высоким показателем ТЛИ — 2 месяца (95% ДИ от 2 до 5 месяцев) (р=0,0499), что может свидетельствовать о прогностической значимости данного показателя для выявления ранних признаков рецидивирования процесса (рис. 4).
Показатель моноцитарно-лимфоцитарного индекса не показал значимого влияния на показатели общей и безрецидивной выживаемости.
Обсуждение
Кроме того, проведенный нами анализ позволил предположить прогностическую ценность количественного определения элементов иммунологического микроокружения опухолей (особенно плоскоклеточного рака головы и шеи), поскольку показал значимое влияние экспрессии CD8 Т-лимфоцитов, нейтрофилов и эозинофилов на клиническое течение заболевания и степень ответа на проводимую терапию.
Нейтрофильно-лимфоцитарное соотношение может быть достоверным прогностическим маркером выявления раннего рецидива плоскоклеточного рака слизистой оболочки полости рта. Мета-анализ 25 исследований с включением 6847 больных плоскоклеточным раком органов головы и шеи, проведенный L. Yang с соавторами, показал высоко достоверную негативную прогностическую значимость нейтрофильно-лимфоцитарного индекса на общую и безрецидивную выживаемость у пациентов данной когорты, тогда как тромбоцитарно-лимфоцитарный индекс подобной значимостью не обладает [14]. В своей работе W. Yu с соавторами также говорит о том, что высокий показатель нейтрофильно-лимфоцитарного индекса может служить независимым неблагоприятным фактором, ассоциированным с более высоким риском рецидива заболевания у пациентов с опухолями головы и шеи; однако, в этой работе достоверной ассоциации риска рецидивирования и влияния тромбоцитарно-лимфоцитарного индекса на общую выживаемость выявлено не было [15]. Данный факт подтвержден и нашим исследованием.
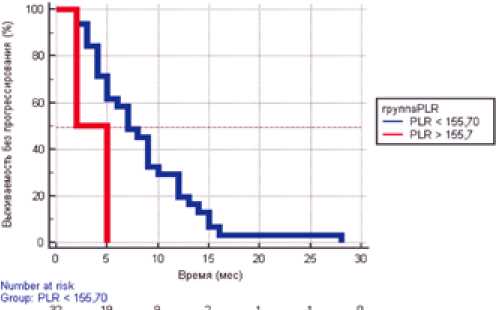
Рисунок 4. Выживаемость без прогрессирования пациентов с плоскоклеточным раком слизистой оболочки полости рта в зависимости от уровня тромбоцитарно-лимфоцитарного соотношения.
Заключение
Список литературы Системное воспаление и иммунологическое микроокружение в прогнозе течения солидных опухолей
- Бережная Н. М. Взаимодействие клеток системы иммунитета с другими компонентами микроокружения//Онкология. 2009 г Т.1, № 2. Стр 86-93.
- Balch C., Riley L., Bae T. Salmeron M. A., Platsoucas C. D., Itoh K.Patterns of human tumor infiltrating lymphocytes in 120 human cancers//Arch. Surg. 1990. Vol.125 (2). P.200-205.
- Berezhnaya N. M. Vzaimodistvie kletok sistemi immuniteta s drugimi componentami microokrugeniya//Oncologia. 2009 Т.1, № 2. Str 86-93
- Coussens LM, Werb Z. Inflammation and cancer. Nature 2002; 420 (6917):860-7
- Galon J., Pages F., Marincola F. M., Angell H. K.et al. Cancer classification using the immunoscore: a worldwide task force. J. Transl Med 10: 205, 2012/
- Gunaldi M, Goksu S, Erdem D, Gunduz S, Okuturlar Y, Tiken E, et al. Prognostic impact of platelet/lymphocyte and neutrophil/lymphocyte ratios in patients with gastric cancer: a multicenter study. Int J ClinExp Med. 2015;8 (4):5937-42.
- Hu B, Yang XR, Xu Y, Sun YF, Sun C, Guo W, et al. Systemic immune-inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma. Clin Cancer Res. 2014;20 (23):6212-22. 10.1158/1078-0432. CCR-14-0442
- DOI: :10.1158/1078-0432.CCR-14-0442
- Mantovani A., Sica A. Tumor immunity: effector response to tumor and role of the microenvironment. Lanset 2008; 371 (9614):771-83.
- Mori M., Shuto K., Kosugi C., Narushima K., Hayashi H., Matsubara H., Koda K. An increase in the neutrophil-tolymphocyte ratio during adjuvant chemotherapy indicates a poor prognosis in patients with stage II or III gastric cancer//BMC Cancer. 2018 Dec 17;18 (1):1261. 10.1186/s12885-018-5171-2
- DOI: :10.1186/s12885-018-5171-2
- Passardi A, Scarpi E, Cavanna L, Dall"Agata M, Tassinari D, Leo S, et al. Inflammatory indexes as predictors of prognosis and bevacizumab efficacy in patients with metastatic colorectal cancer. Oncotarget. 2016;7 (22):33210-9. do i:10.18632/Oncotarget.8901.
- Shimada H, Takiguchi N, Kainuma O, Soda H, Ikeda A, Cho A, et al. High preoperative neutrophil-lymphocyte ratio predicts poor survival in patients with Gastric Cancer. Gastric Cancer. 2010;13 (3):170-6. doi
- DOI: :10.1007/s10120-010-0554-3
- Takenaka Y., Oya R., Kitamiura T., Ashida N., Shimizu K., Takemura K., Yamamoto Y., Uno A. Platelet count and platelet-lymphocyte ratio as prognostic markers for head and neck squamous cell carcinoma: Meta-analysis//Head Neck. 2018 Dec;40 (12):2714-2723. 10.1002/hed.25366
- DOI: :10.1002/hed.25366
- Tupicin N. N. Immunofenotiprakamolochnoizhelezi//Rakmolochnoizhelesi/Pod red. N. E. Kushlinskogo, S. M. Portnogo,K. G. Laktionova. -М.:Izdatelstvo R AMN, 2005. -Str.174-197.
- Wen J., Bedford M., Begum R., Mitchell H., Hodson J., Whiting J., Griffiths E. The value of inflammation based prognostic scores in patients undergoing surgical resection for oesophageal and gastric carcinoma//J Surg Oncol. 2018 Jun;117 (8):1697-1707. 10.1002/jso.25057
- DOI: :10.1002/jso.25057
- Yang L., Huang Y., Zhou L., Dai Y., Hu G. High pretreatment neutrophil-to-lymphocyte ratio as a predictor of poor survival prognosis in headand neck squamous cell carcinoma: A systematic review and meta-analysis//Head Neck. 2018 Dec 30. 10.1002/hed.25583
- DOI: :10.1002/hed.25583
- Yu W., Dou Y., Wang K., Liu Y., Sun J., Gao H., Liu S., Wei F., Yuan D., Song X., Qu X. Preoperative neutrophil lymphocyte ratio but not platelet lymphocyte ratio predicts survival and early relapse in patients with oral, pharyngeal, and lip cancer//Head Neck. 2019 Jan 11. 10.1002/hed.25580
- DOI: :10.1002/hed.25580


