Системные проявления первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития
Автор: Белова С.В., Гладкова Е.В., Зубавленко Р.А., Ульянов В.Ю.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 (50), 2021 года.
Бесплатный доступ
Цель исследования - изучение системных проявлений первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития. При обследовании 42 пациентов без клинической симптоматики, находившихся в группе риска развития остеоартроза коленных суставов, и 12 доноров без патологии опорно-двигательной системы, было установлено, что уже на ранней стадии развития первичного остеоартроза имелись нарушения системного характера, заключающиеся в негативном изменении клеточного звена иммунитета на фоне активации провоспалительных цитокинов, что могло способствовать развитию аутоиммунного ответа с последующей воспалительной реакцией, приводящей к возникновению и прогрессированию деструктивных изменений в соединительнотканных структурах коленных суставов, подтвержденных повышенным содержанием олигомерного матриксного хрящевого белка и хрящевого гликопротеина-39.
Первичный остеоартроз, ранняя стадия, коленные суставы, системные проявления
Короткий адрес: https://sciup.org/143176798
IDR: 143176798 | УДК: 003.8:616-092 | DOI: 10.20340/vmirvz.2021.2.CLIN.5
Текст научной статьи Системные проявления первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития
УДК 003.8:616-092
С позиций современной ревматологии остеоартроз (ОА) объединяет гетерогенную группу заболеваний с различными постоянно меняющимися клиникопатогенетическими фенотипами, приводящими к общим клиническим проявлениям [1, 2]. ОА является результатом взаимодействия биологического и механического факторов, приводящих к дисбалансу между синтетическими и деградационными процессами экстрацеллюлярного матрикса суставного хряща и субхондральной кости [3]. Возникновение и прогрессирование данной патологии могут обусловливать эволюционные, генетические, травматические и метаболические факторы [3], вызывающие молекулярные изменения клеток и состояния экстрацеллюлярного матрикса, приводящие к разволокнению, ульцерации, истончению хрящевого слоя, а также к остеосклерозу с утолщением и уплотнением кортикального слоя субхондральной кости, к образованию субхондральных кист и остеофитозу. Локальные изменения при ОА со временем принимают системный характер. Развитие молекулярной биологии и открытие способности растворимых провос-палительных медиаторов увеличивать синтез матричных металлопротеиназ и коллагеназ хондроцитами позволили выдвинуть предположение об участии иммунной системы в патогенезе ОА и обосновать «воспалительную» теорию возникновения и развития данного заболевания [4].
В научной литературе имеются сведения о важной роли адаптивного и врожденного иммунитета в патогенезе ОА [1], при этом именно последнему уделяется особое внимание в развитии раннего ОА [5]. Клеточные и внеклеточные факторы (TLR фагоцитирующие клетки, хондроциты, компоненты системы комплемента и NK-клетки) врожденного иммунитета принимают активное участие в возникновении воспалительного процесса в суставных тканях. Позднее к развитию воспаления в соединительнотканных структурах присоединяются факторы адаптивного иммунитета в силу того, что в синовиальной среде сустава (синовиальная жидкость и синовиальная оболочка) у пациентов с ОА имеются клетки, принимающие участие в гуморальном и клеточном иммунном ответе, а также благодаря высвобождающимся антигенным детерминантам хрящевого матрикса в результате воздействия факторов риска и активации катаболических процессов, что приводит к хронизации воспалительных процессов [1].
Цель исследования: изучение системных проявлений первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития.
Материалы и методы
В исследовании приняли участие 42 пациента без клинической симптоматики, находящиеся в группе риска развития ОА коленных суставов (возраст, пол, генетические заболевания соединительной ткани), включенные в исследование методом случайной выборки, среди которых было 19 (45,2 %) мужчин и 23 (54,8 %) женщин в возрасте 49,2 ± 4,4 года. Группу контроля составили 12 доноров (5 мужчин и 7 женщин) без патологии опорно-двигательной системы аналогичного возраста. В исследование не включались лица, имевшие сопутствующую соматическую патологию.
Все пациенты были обследованы с помощью клинических, инструментальных и лабораторных методов исследования. Клиническая картина заболевания складывалась из определения клинической симптоматики и состояния системы опорнодвигательного аппарата. Инструментальное обследование включало в себя проведение УЗИ, рентгенографии и МРТ крупных суставов. Проведение оценки иммунологических реакций заключалось в определении количественного и качественного состава клеточных популяций лимфоцитов по их иммунофенотипу (CD3+, CD3+CD8+, CD3+CD4+, CD16+CD56+, CD19+) методом ла- зерной проточной цитофлюориметрии на цитометре BD FACSCantoll (США), а также по уровню неоптерина, низкомолекулярного производного гуанозинтрифосфата и основного продуцента макрофагов, определяемого методом твердофазного иммунофер-ментного анализа на многофункциональном фотометре Epoch (Bio Tek, CША). Аналогичным методом определяли содержание про-воспалительных цитокинов (ТNF-α, IL-1, IL-6, «Вектор Бест», Россия), а также содержание олигомерного матриксного хрящевого белка и хрящевого гликопротеина-39, характеризующие состояние хрящевой ткани. Определение вышеуказанных параметров осуществлялось на фоне проведения таких стандартных биохимических тестов как альбумин, глюкоза, фракции билирубина, трансаминазы, холестерин, мочевина, креатинин, С-реактивный протеин на биохимическом анализаторе «Сапфир-400», Япония.
Весь цифровой материал подвергался статистической обработке с помощью программ Microsoft Excel 2010, Statistica 6.0. с применением непараметрического критерия Манна – Уитни. Результаты были представлены в виде медиан (Ме) с указанием квартильных размахов (нижний (25 %) и верхний (75 %) квартили). Результаты считались достоверно значимыми при р < 0,05.
От обследуемых пациентов было получено добровольное информированное согласие на проведение комплексных медицинских мероприятий, осуществляемых согласно стандартам Хельсинской декларации Всемирной медицинской организации.
Результаты
У обследованных пациентов жалобы, в основном, отсутствовали. Исключение составили 4 пациента, отмечавшие периодически возникающие боли в коленном суставе после физических нагрузок.
По данным инструментальных методов исследования у 24 пациентов была установлена нулевая стадия при отсутствии рентгенологических признаков поражения и у 18 – первая стадия заболевания с имеющимися остеофитами на поверхности сустава в незначительном количестве. При этом отмечалось некоторое утолщение синовиальной оболочки, снижение толщины гиалинового хряща, дегенеративные изменения в медиальном мениске (по данным УЗИ), а также незначительное сужение суставной щели (рентгенографическое исследование) и наличие участков патологически измененных тканей с утратой трехмерной высокоупорядоченной структуры хрящевого матрикса (МРТ-исследование).
У данных пациентов были обнаружены изменения в клеточном звене иммунной системы. Было достоверно снижено содержание Т-лимфоцитов (табл. 1), при этом имелось незначительное снижение Т-хелперов (CD3+CD4+), Т-супрессоров (CD3+CD8+) и В-лимфоцитов (CD19+) (табл. 1). Уровень NK-клеток (CD16+CD56+) имел тенденцию к повышению (табл. 1).
При исследовании активности провос-палительных цитокинов было установлено достоверно (р < 0,05) повышенное содержание IL-1 β , TNF- α и несущественное (р > 0,05) понижение уровня IL-6 в сравнении с группой контроля (рис. 1).
Изучение основного продуцента макрофагов – неоптерина показало несущественное повышение его содержания [8,7 (8,1; 9,2)] ммоль/л по сравнению с показателями контрольной группы [7,6 (6,8; 7,6)] ммоль/л на фоне повышенного содержания С-реактивного протеина [4,7 (4,2; 5,0)] мг/л по сравнению со значениями у доноров [3,1 (2,2; 3,4)] мг/л.
Таблица 1. Показатели клеточного иммунитета
Table 1. Indicators of cellular immunity
|
Показатели |
Контрольная группа (n = 11) |
Пациенты с первичным ОА коленных суставов (n = 24) |
Значение р |
|
Т-лимфоциты CD3+ (абс.) |
1672,5 (1562,1; 1782,3) |
1510,1 (1359,6; 1636,7) |
0,025181* |
|
Т-лимфоциты CD3+ (относит.) |
72,2 (71,5; 72,3) |
71,2 (70,4; 72) |
0,046605* |
|
Т-супрессоры CD3+CD8+ (абс.) |
689,9 (653,8; 714,9) |
675,8 (660,5; 695) |
0,594032 |
|
Т-супрессоры CD3+CD8+ (относит.) |
27,2 (22,5; 28,7) |
23,1 (20,9; 24,8) |
0,00855* |
|
Т-хелперы CD3+ CD4+ (абс.) |
991,3 (945,5; 994) |
982,9 (974; 991,5) |
0,915106 |
|
Т-хелперы CD3+ CD4+ (относит.) |
48,7 (41,5; 49,3) |
46,4 (41,8; 48,8) |
0,455545 |
|
Естественные киллеры CD16+CD56+ (абс.) |
230,5 (210,1; 248,3) |
242,5 (215,4; 260,5) |
0,569672 |
|
Естественные киллеры CD16+CD56+ (относит.) |
13,2 (11,1; 16,1) |
14,5 (11,3; 14,7) |
0,943345 |
|
В-лимфоциты CD19+ (абс.) |
272,1 (237,9; 275,5) |
268,1 (235,9; 292,9) |
0,83117 |
|
В-лимфоциты CD19+ (относит.) |
13,7 (11,7; 14,2) |
12,7 (11; 15,2) |
0,423999 |
Примечание: р – показатель различий исследуемых показателей между донорами и пациентами с первичным ОА коленных суставов на ранней стадии, * – достоверная значимость, n – количество обследуемых.
Кроме того, у данного контингента были достоверно (р < 0,05) повышены метаболиты хрящевой ткани в сыворотке крови: олигомерный матриксный хрящевой белок был повышен у пациентов [852,1 (759,3; 917,8)] нг/л по сравнению с значениями в группе контроля [582,0 (418,5; 629,3)] нг/л; уровень хрящевого гликопротеина-39 у пациентов составил [64,7 (62,2; 71,2)] нг/мл против значений доноров [17,2 (16,6; 17,3)] нг/мл.
Обсуждение
Результаты проведенного нами исследования показали, что у пациентов с первичным ОА коленных суставов без клинической симптоматики уже на ранней стадии его развития имелись нарушения системного характера.
Анализ результатов иммунологического исследования выявил отклонения в состоянии клеточного иммунитета у пациентов с ранним первичным ОА коленных суставов по сравнению со значениями в контрольной группе. Изменения касались как количественного, так и качественного состава субпопуляций лимфоцитов: Т-лимфоциты, В-лимфоциты, NK-клетки, аутентифицированные с помощью цветных моноклональных антител. Анализ значений Т-лимфоцитов, активность которых направлена на распознавание и уничтожение патологических клеток с чужеродным антигеном, свидетельствовал о достоверно значимом снижении их абсолютного и относительного содержания (табл. 1). Отмечалось незначительное снижение Т-хелперов (CD3+CD4+) и Т-супрессоров (CD3+CD8+) (табл. 1). Изменение В-лимфоцитов(CD19+), обеспечивающих гуморальный иммунитет, было аналогичным изменению Т-хелперов (табл. 1). Что касается значений NK-клеток (CD16+CD56+), то их уровень имел тенденцию к повышению (табл. 1). NK-клетки относят к лимфоцитам врожденного иммунитета, способных немедленно, без предварительной иммунизации реагировать на чужеродный агент, а также на собственные деформированные клетки без молекул основного комплекса гистосовместимости I класса (МНС-I) автономно от системы комплемента и антител. К повышению NK-клеток в крови приводит их быстрое реагирование на клеточный стресс, инфекционный и воспалительный агенты, что отмечалось и в нашем исследовании. По литературным источникам у женщин с ОА коленного сустава III стадии, в отличие от наших пациентов с 0-I стадиями, определение содержания NK-клеток в периферической крови также показало тенденцию к их повышению по сравнению со значениями в контрольной группе [6]. В исследовании иностранных авторов было установлено наличие корреляционных взаимосвязей между повышенным уровнем провоспалительных цитокинов и присутствием естественных киллеров с фенотипом CD56brightCD16- в синовиальной жидкости, представляющей собой важную составляющую сустава и отражающую картину происходящих изменений в синовиальной оболочке и хрящевой ткани, при этом быстро реагирующей на негативные изменения в суставной среде. Данное обстоятельство могло способствовать возникновению и прогрессированию хронического воспалительного процесса в структурных компонентах сустава [7].
Цитокины относятся к биологическим медиаторам межклеточных и системных взаимодействий. При соединительнотканной патологии у пациентов с ОА четыре класса (регуляторные, деструктивные, ингибирующие, анаболитические факторы роста) этих биологически активных компонента оказывают разнонаправленное воздействие практически на все структурные элементы сустава, включая синовиальную оболочку, хрящевую и костную ткани. В нашей работе при изучении провоспали-тельных цитокинов была определена повышенная продукция IL-1 β и TNF- α на фоне незначительного понижения уровня IL-6 в сравнении с группой контроля (рис. 1). При определении провоспалительного цитокина
IL-1 β , отвечающего за активацию остеокластов, реструктуризацию коллагеновой сети и деминерализацию костной ткани, был установлен его достоверно повышенный уровень (р < 0,05) в сравнении со значениями в контрольной группе. Определение провоспалительного цитокина TNF- α – основного медиатора воспаления, оказывающего подавляющее действие на синтез клеточных элементов экстрацеллюлярного матрикса и стимулирующего дегенеративные процессы в нем, также показало его достоверное повышение (р < 0,05). Данный цитокин отличает разнообразие иммуномодулирующих и провоспалительных свойств, как считают некоторые авторы, большинство их этих характерных свойств TNF- α могут приобретать фундаментальное значение в иммунопатологических процессах при воспалительных ревматических заболеваниях [8]. Определение содержания провоспалительного цитокина IL-6, основного индуктора синтеза острофазовых белков, показало его незначительное снижение (р > 0,05) в сравнении с группой контроля. В исследовании И.В. Ширинского с соавт. (2015) уровень IL-6 прямо коррелировал с рядом функциональных показателей тяжести заболевания у пациентов с диабет-ассоциированным ОА [9].
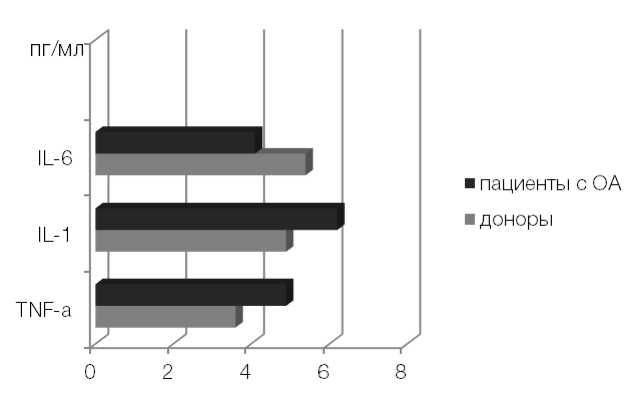
Рис. 1. Содержание провоспалительных цитокинов у доноров и пациентов с первичным ОА коленных суставов на ранней стадии
Fig. 1. Content of pro-inflammatory cytokines in donors and patients with early primary knee OA
Установленные в нашем исследовании изменения экспрессии провоспалительных цитокинов могут способствовать инициации развития дегенеративных явлений в соединительнотканных компонентах сустава в силу того, что они являются биологически активными медиаторами, активирующими выработку протеолитических ферментов хондроцитами, клетками хрящевой ткани. Протеолитические ферменты, индуцируя деструкцию коллагеновых волокон и молекул протеогликанов, приводят к нарушению соединительнотканных структур, что активирует аутоиммунные механизмы и вызывает воспалительную реакцию в суставных тканях.
Помимо изучения компонентов клеточного звена иммунитета и активности цитокинов, в данной работе исследовался основной продуцент макрофагов – неоптерин, производимый гуанозинтрифосфатом. Установленное несущественное повышение содержания неоптерина по сравнению с показателями контрольной группы косвенно указывало на некоторую возрастающую секреторно-синтетическую активность иммунокомпетентных клеток под влиянием на них растворимого цитокина интерферона-гамма (IFN- γ ) и фактора некроза опухоли-альфа (TNF- α ). Кроме того, повышенное содержание неоптерина могло свидетельствовать и о воспалительной составляющей. Данное положение подтверждает и повышенное содержание С-реактивного протеина по сравнению со значениями у доноров, что отмечалось и в другом исследовании у пациентов с ОА, ассоциированным с метаболическим синдромом [10]. Повышенная продукция С-реактивного протеина, относящегося к белкам острой фазы, может быть объяснена тем, что на границе суставного хряща и синовиальной оболочки, в зоне повышенного риска развития деструктивных процессов, синтезируемые клетками синовиальной мембраны некоторые цитокины приводят к повышенному образованию продукции данных острофазовых белков.
В последнее время для оценки состояния хрящевой ткани многими авторами используется определение олигомерного матриксного хрящевого белка, относящегося к внеклеточному белку семейства тромбоспондина-5, выполняющему связывание полимерных коллагеновых волокон в экстрацеллюлярном матриксе соединительной ткани. Имеются данные, указывающие на связь между уровнем этого белка и развитием деструктивных изменений в соединительнотканных структурах суставов [11] . Интерес к представленному белку появился после открытия в его гене мутаций, приводящих к таким аутосомнодоминантным заболеваниям соединительной ткани, как множественная эпифизарная дисплазия I типа и псевдохондроплазия. В нашей работе содержание олигомерного матриксного хрящевого белка у пациентов с первичным ОА коленных суставов на ранней стадии его развития было достоверно (p < 0,05) повышено в сыворотке крови [852,1 (759,3; 917,8)] нг/л по сравнению со значениями в группе контроля [582,0 (418,5; 629,3)] нг/л. Из научных источников известно влияние изменений в структуре олигомерного матриксного хрящевого белка на структурно-функциональное состояние связочного аппарата. Генные мутации в данном белке могут приводить к возникновению гипермобильности суставов, что можно отнести к факторам риска развития раннего ОА [12].
Кроме исследования маркера хрящевой ткани – олигомерного матриксного хрящевого белка, нами был изучен еще один показатель, характеризующий метаболизм хрящевой ткани – хрящевой гликопротеин-39, свойства которого изучены не в полной мере, однако, определенная направленность изменений и характер имеющихся взаимосвязей с развитием ряда патологий дают основание предположить его важную роль в ремоделировании тканевых структур. У обследованных нами пациентов содержание данного гликопротена-39 было отлично от нормы (p < 0,05) и соответствовало [64,7 (62,2; 71,2)] нг/мл против значений доноров [17,2 (16,6; 17,3)] нг/мл. Аналогичные результаты были получены в научном исследовании, в котором у больных ОА с кардиоваскулярной патологией уровень гликопротена-39 также был повышен, кроме того, была установлена взаимосвязь клинических особенностей течения ОА у пациентов с преимущественным поражением коленных суставов и продукта деградации хрящевой ткани сустава – хрящевого гликопротеина-39, свидетельствовавшего о наличии воспалительного процесса и характеризующего тяжесть течения заболевания [3].
Заключение
Резюмируя, можно утверждать, что у пациентов с первичным ОА коленных суставов без клинической симптоматики уже на ранней стадии его развития имелись нарушения системного характера. Исследование иммунологических реакций у данного контингента выявило некоторые изменения в состоянии клеточного звена иммунитета на фоне активации провоспалитель-ных цитокинов. Данное обстоятельство, как правило, способствует развитию аутоиммунного ответа с последующей воспалительной реакцией, о чем свидетельствует повышенное содержание С-реактивного протеина, что в итоге приводит к возникновению и прогрессированию деструктивных изменений в соединительнотканных структурах коленных суставах, подтверждающихся повышенным содержанием олигомерного матриксного хрящевого белка и хрящевого гликопротеина-39 в биологической среде организма.
Список литературы Системные проявления первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития
- Shirinskij V.S., Kazygasheva E.V., Shhirinskij I.V. Vospalenie i immunitet: rol' v patogeneze osteoartrita. Medicinskaya immunologiya. 2019;21(1):39-48. (In Russ).
- Castaneda S., Roman-Blas J.A., Largo R. et al. Osteoarthritis: a progressive disease with changing pheno-types. Rheumatology. 2014;53(6):1-3. https://doi.org/10.1093/rheumatology/ket247.
- Kczoeva A.A. Rol' xryashhevogo glikoproteina-39 u bol'ny'x osteoartrozom kolennogo sustava v sochetanii s ishemicheskoj boleznyu serdcza, arterial'noj gipertenziej i dislipidemiej. Terapiya. 2018;3(21):72-77. (In Russ).
- Kragstrup T.W., Sohn D.H., Lepus C.M. et al. Fibroblast-like synovial cell production of extra domain A fi-bronectin associates with inflammation in osteoarthritis. BMC Rheumatol. 2019;2(3).Art. № 46. https://doi.org/10.1186/s41927-019-0093-4.
- Kandahari A.M., Yang X., Dighe A.S. et al. Recognition of immune response for the early diagnosis and treatment of osteoarthritis. J. Immunol. Res. 2015. Art. ID 192415. https://doi.org/10.1155/2015/192415.
- CHepeleva M.V., CHegurov O.K., Kuznecova E.I. Koncentracii citokinov v perifericheskoj krovi i sinovial'noj zhidkosti pacientov s deformiruyushchim osteoartrozom kolennogo sustava v zavisimosti ot velichiny defekta vnutrennego myshchelka bol'shebercovoj kosti. Genij Ortopedii. 2017;23(4):450-454. (In Russ).
- Jaime P., Garcia-Guerrero N., Estella R. et al. CD56+/CD16- natural killer cells expressing the inflammatory protease granzyme A are enriched in synovial fluid from patients with osteoarthritis. Osteoarthritis cartilage. 2017;25(10):1708-1718. https://doi.org/10.1016/j.joca.2017.06.007.
- Nasonov E.L., Aleksandrova E.N., Novikov A.A. Autoimmunnye revmaticheskie zabolevaniya - problemy im-munopatologii i personificirovannoj terapii. Vestnik RAMN. 2015;70(2): 169-182. https://doi.org/10.15690/vramn.v70i2.1310 (In Russ).
- SHirinskij I.V., Kalinovskaya N.YU., SHirinskij V.S. Kliniko-immunologicheskaya harakteristika diabet-associirovannogo osteoartrita. Medicinskaya immunologiya. 2015;17(1):87-92. https://doi.org/10.15789/1563-0625-2015-1-87-92 (In Russ).
- Vasil'eva L.V., Lahin D.I. Vliyanie metabolicheskogo sindroma na klinicheskuyu kartinu osteoartroza. Medicin-skij vestnik Severnogo Kavkaza. 2017;12(1):8-10. http://doi.org/10.14300/mnnc.2017.12002 (In Russ).
- Belova YU.S. Karyakina E.V. Hryashchevoj protein pri razlichnyh tipah displazii. Russkij medicinskij zhurnal. 2017;25(19):1352-1355. (In Russ).
- Tyurin A.V. Klinicheskie osobennosti i molekulyarno-geneticheskie aspekty osteoartroza u bol'nyh s displaziej soedinitel'noj tkani: avtoref. dis. ... kand. med. nauk. Moscow; 2015. 23 c. (In Russ).


