Скорость трансформации перфузии у животных при круглосуточном экспериментальном световом десинхронозе
Автор: Андреев К.А., Злобина О.В.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 12-1 (28), 2018 года.
Бесплатный доступ
В статье описывается влияние скорости изменения перфузионных показателей и её взаимосвязь с состоянием микрокровотока, микроциркуляторного русла под действием круглосуточного светового десинхроноза. Много внимания уделено корреляции стадийности развития стресс-нарушений со стадийностью десинхроноза непосредственно, характеризующие трансформацию микроциркуляторных колебаний.
Скорость перфузии, микроциркуляция, лазерная допплеровская флоуметрия, десинхроноз
Короткий адрес: https://sciup.org/140280734
IDR: 140280734
Текст научной статьи Скорость трансформации перфузии у животных при круглосуточном экспериментальном световом десинхронозе
Состояние организма человека напрямую связано с колебаниями циркадианных ритмов и, что более важно, механизмы приспособления, обеспечивающие оптимальную жизнедеятельность в пределах этих колебаний, являются единственным барьером между нормой и патологией. Однако, эти механизмы недостаточно прочны, т.к. относительно резкие изменения естественных биоритмов способны вызвать особое патологическое состояние - световой десинхроноз, затрагивающий все без исключения системы органов, и в том числе сердцечно-сосудистую. Постоянное воздействие стрессорных факторов такого рода могут привести к изменениям структуры органов и тканей, и даже к тяжелым заболеваниям, включая онкологические [1]. Актуальность данного эксперимента предопределяется частотой возникновения светового десинхроноза в современных реалиях, а также его негативное влияние на людей в группе риска, к которым относятся работающие по ночам, подвергнутые постоянному излучению искусственного освещения или быстрой смене времени суток, а также люди с депривацией сна, как результата расстройств при депрессивных состояниях [1, 2]. Необходимо упомянуть о том, что в ходе эксперимента установлено, что наиболее пагубное влияние оказывает круглосуточное искусственное освещение (Модель LL).
Сдвиги циркадианных ритмов подчиняются концепции общего адаптационного синдрома и влияют на организм как мощнейшая стрессорная сила, а первичная реакция рассматривается как простой адаптивный механизм, при этом изменения полностью обратимы [1, 3]. Отрицательные последствия такой реакции, вызванные длительным воздействием или большой силой светового раздражителя определяются как патологические и связаны с необратимыми изменениями, которые касаются не только органных и тканевых структур, но и микроциркуляторных и перфузионных показателей, причем изменения достаточно выражены и характеризуются как стадийные [4]. Но главным вопросом остается не столько собственные изменения жизненно важных функций, сколько скорость изменения этих самых функций и показателей. В свете этого основной задачей эксперимента являлось отслеживание скорости изменения микроциркуляторных изменений и её стадийности вследствие воздействия стрессорного фактора. Далее была сформирована цель настоящего эксперимента - оценка скорости изменения перфузионных изменений и/или нарушений у животных в условиях круглосуточного экспериментального светового десинхроноза (LL-десинхроноза).
Материал и методы
Эксперимент проводился на 80 беспородных белых крысах-самцах 180-220 г, по случайному принципу разделённых на 4 группы, равные по количеству особей (20 штук): контрольная и 3 опытные. В ходе всего эксперимента животные имели постоянный доступ и воде и пище. Особи контрольной группы находились в условиях естественного отношения день-ночь, т.е. естественного освещения. Особи опытных групп подвергали 24-часовому воздействию света в течение 1 суток для первой, 10 суток для второй и 21 суток для третьей опытной группы для моделирования круглосуточного десинхроноза. При этом естественное освещение в светлое время суток сочеталось с искусственным в тёмное время суток. Искусственное освещение моделировалось лампой дневного света с освещённостью, равной лампе накаливания мощностью в 60 Вт. Все действия были выполнены в соответствии с Хельсинской декларацией о гуманном отношении к животным, Женевской конвенцией и с одобрения этического комитета ФГБОУ ВО Саратовского ГМУ им. В. И. Разумовского Минздрава России (протокол №4 от 06.12.2016 года). Для введения в наркоз за несколько минут до записи ЛДФ-грамм животным внутримышечно вводили комбинацию Телазола (Zoetis Inc, США) в дозе 0,1 мл/кг и Ксиланита (Нита-Фарм, Россия) в дозе 0,1 мг/кг. Для изучения микроциркуляции методом ЛДФ (Лазерной Допплеровской Флоуметрии) использовали анализатор «ЛАКК-ОП» (производство НПП «Лазма», Россия). Регистрацию ЛДФ-грамм в опытных группах проводили на 1-ый 10-ый и 21 -ый день эксперимента. При записи ЛДФ-грамм световодный зонд фиксировали на коже дистального отдела задней конечности животного. Регистрация проходила периодами по 8 минут трижды, т.е. всего 24 минуты на одну особь, для достижения минимализации больших отклонений в какую-либо сторону [5]. По результатам определяли показатель перфузии М в перфузионных единицах (пф. ед.), ее среднеквадратического отклонения (СКО, пф.ед.), коэффициента вариации (%), а также абсолютные амплитуды эндотелиальных (0,01–0,076 Гц), нейрогенных (0,076–0,2 Гц), миогенных (0,2–0,74 Гц), дыхательных (0,15– 0,4 Гц) и пульсовых (0,8–1,6 Гц) колебаний микроциркуляции с помощью спектрального вейвлет-анализа [4, 6]. Нормированные амплитуды колебаний показателей каждого диапазона вычисляли по формуле: (А/3хСКО)х100. Полученные данные были обработаны с применением возможностей программы «STATISTICA 10» (StatSoft, США). В связи с тем, что полученные данные в большей степени не подчинялись закону нормального распределения, для сравнения показателей использовали непараметрический U-критерий Манна–Уитни. Значимыми считали изменения при p<0,05.
Результаты
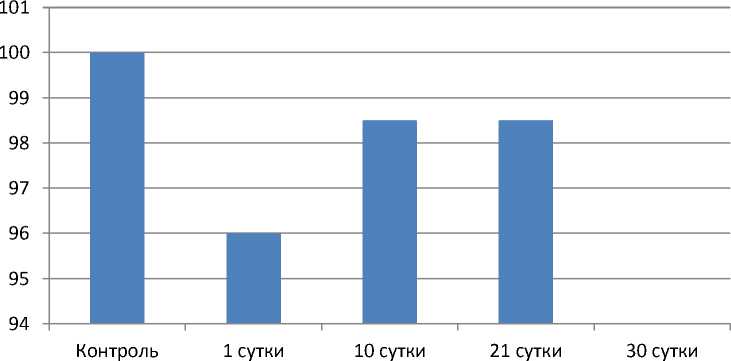
По мере эксперимента показатель перфузии у животных при воздействии светового десинхроноза стабильно снижался. На 1 сутки недостоверно понизился, всего на 4% от контрольной группы, к 10 дню снижался постоянно со скоростью 1,5%/день, к 21 дню тенденция к снижению оставалась, причем показатель падал с такой же скоростью и показатель изменения скорости оказался недостоверным.
Для абсолютных колебаний (таблица 2):
-
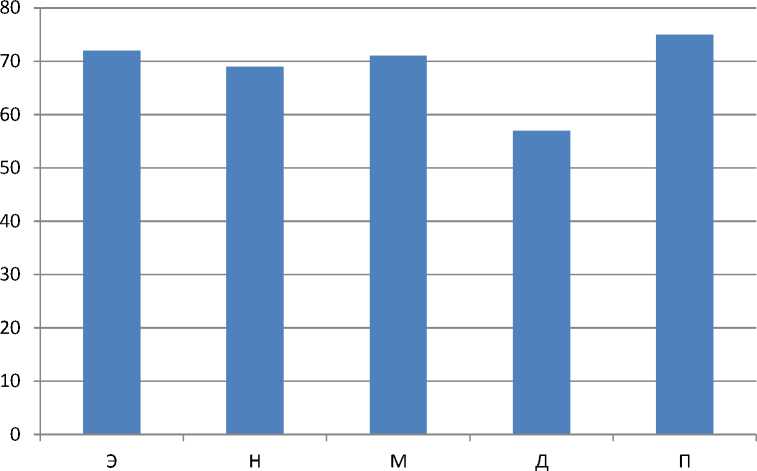
1. На 1 сутки эксперимента наблюдалось резкое, однако недостоверное снижение эндотелиальных колебаний на 28% относительно контрольной группы. К 10 суткам показатель продолжал снижаться, но менее интенсивно, со скоростью 9%/день. К 21 дню эксперимента показатель продолжил стабильно снижаться, но с чуть меньшей скоростью 3%/день от предыдущего значения.
-
2. Показатель нейрогенных колебаний на 1 день эксперимента значительно, однако недостоверно, снизился на 31% относительно группы контроля. К 10 дню эксперимента тенденция к снижению прекратилась и показатель стал чуть выше, средняя скорость изменения при этом составила 1,8%/день. К 21 дню эксперимента показатель снижался, но уже
-
3. На 1 сутки воздействия десинхроноза показатель миогенных колебаний заметно снизился на 29% относительно контрольной группы. На 10 день не было обнаружено значительных изменений в этом показателе, средняя скорость падения перфузии этих колебаний соответственно снизилась до 2,9%/день. На 21 день исследуемый показатель вновь начал снижаться и стал меньше предыдущего, средняя скорость падения при этом составила 1,8%/день.
-
4. Дыхательные колебания изменялись таким образом: на 1 сутки воздействия светового десинхроноза показатель снизился практически на половину (43%), к 10 дню было замечено небольшое увеличение со скоростью 1,3%/день, к 21 же суткам показатель сохранил тенденцию к снижению на небольшую величину, но настолько незначительную, что средняя скорость снижения была равна 1%/день.
-
5. Изменения пульсовых колебаний оказались весьма интересными: на 1 день воздействия десинхроноза показатель снизился на четверть (25%), далее значительных изменений показателя зафиксировано не было, ни на десятые, ни на двадцать первые сутки.
совсем с маленькой скоростью (средняя=0,7%/день), отличие показателей оказалось недостоверно.
Для нормированных колебаний (таблица 3):
Общей закономерностью явилось то, что значения всех 5 исследуемых показателей колебаний к 10 суткам заметно снижались, а к 21 суткам резко возрастали до кратного увеличения (в 2-3 раза в некоторых случаях). В остальном, изменения показателя на 1 день эксперимента распределилось неоднозначно.
-
1. Для эндотелиальных колебаний: на 1 день небольшое увеличение значения на 12% оказалось недостоверным, к 10 дню резкое снижение со скоростью 4,6%/день, до 21 дня воздействия показатель стремился вверх со скоростью 7,2%/день.
-
2. Для нейрогенных колебаний: на 1 день показатель заметно увеличился на 28%, к 10 дню эксперимента сильно снижался со скоростью 6,1%/день, к 21 дню колоссально возрос, при этом изменяясь со скоростью 19,6%/день.
-
3. Для миогенных колебаний: на 1 день незначительное и недостоверное снижение на 5%, к 10 суткам показатель стабильно снижался со скоростью 5,5%/день ниже предыдущего уровня, а к 21 суткам возрос в несколько раз от предыдущего уровня, изменяясь при этом со скоростью 18,5%/день.
-
4. Для дыхательных колебаний: после воздействия светового десинхроноза значение показателя стабильно уменьшалось, на 28% в первые сутки(изменения показателя оказались недостоверными), и к 10 дню тенденция снижения продолжилась (средняя скорость снижения составила 3,1%/день). На двадцать первые сутки показатель возрос в 2 раза, но оставался ниже контрольного показателя, изменялся со скоростью 9,3%/день.
-
5. Для пульсовых колебаний: с начала воздействия десинхроноза показатель недостоверно снизился на 8% и к 10 дню сильно изменился, снижаясь со скоростью 4,5%/день, после этого стал резко увеличиваться и к двадцать первому дню эксперимента был выше предыдущего, увеличивался со скоростью 11,6%/день.
Обсуждение
Полученные и описанные в ходе экспериментальной части результаты в полной мере характеризуют патологическое влияние световой стимуляции на микроциркуляторные колебания. Нарушения выражаются явной стадийностью, коррелирующейся в соответствии с этапами десинхроноза. Так, в стадию начального воздействия световой раздражитель становится стрессорным фактором, ответная реакция организма животных практически не выражена и характеризуется усилением миогенного тонуса, что в совокупности с увеличением пульса вследствие уменьшенной дилатации сосудов может быть опознано как предпосылка к ишемии периферических сосудов [1, 3], однако значительного сдвига перфузии не происходит, это может объяснять то, что скорость трансформации на начальных этапах воздействия самая низкая, в сравнении со следующими стадиями. Уменьшенная дилатация стала итогом одновременного снижения эндотелиальных колебаний с высокоамплитудным пульсовым ритмом(независимо от его стагнации) и может означать начальную степень редукции нутритивного кровотока за счёт констрикции прекапилляров [1, 4]. На 10 день эксперимента нарушения перфузии принимали регуляторный характер. Здесь стоит обратить внимание на нейрогенные и миогенные колебания, имеющие сильную взаимосвязь, особенно на этом этапе. Доминирование и последующая скоростная стойкость этих амплитуд среди остальных активных колебаний говорит о преобладании эрготропной направленности регуляции микрогемоциркуляторно-тканевых систем [6]. В совокупности их воздействие приводит к мышечному перенапряжению сосудов, регулирующих приток крови в нутритивное русло. Этот процесс сопровождается стойкостью колебаний во времени, показатели изменяются со сравнительно высокой скоростью, что и вызывает истощение как гладких мышцы, так и вегетативной нервной системы, следствием чего явилась стойкая ишемия прекапилляров и близрасположенных артериол. Выделялись также дыхательные колебания, указывающие на ухудшение скорости кровотока на уровне венул [1, 7]. На этапе 21 суток эксперимента состояние микроциркуляторного русла характеризовалось структурными нарушениями. Снижение перфузии сохраняется, но с меньшей скоростью, что свидетельствует о переходе стресса в стадию истощения, сопровождающуюся сильным угнетением модуляции сосудов за счёт снижения эндотелиальных, миогенных, пульсовых и дыхательных колебаний и их амплитуд. Резкое увеличение нормированнных амплитуд всех типов колебаний, но эндотелиальных в большей степени, на 21 сутки эксперимента связано с редукцией модуляции кровотока, что ,наиболее вероятно, указывает на развитие спазма мелких артерий. Колоссально возросшая скорость нормированных колебаний, а конкретно миогенного и нейрогенного тонусов, может быть причиной наличия шунтирующего протока[3-4, 6-7].
Световой десинхроноз сопряжен с длительной стрессорной стимуляцией светового раздражителя, которая приводит к возбуждению светочувствительных супрахиазматических ядер гипоталамуса, это сопровождается повышением активности образования гормонов тропного типа в гипофизе и снижению темновой секреции мелатонина в эпифизе. Механизм активирует симпатоадреналовую систему с последующим выбросом гормонов в кровь. Действие катехоламинов и глюкокортикостероидов доказывает угнетение активных и пассивных механизмов регуляции микроциркуляторного русла, уменьшение вазодилатации эндотелия сосудов, что выражается снижением абсолютных колебаний в миогенном, нейрогенном и эндотелиальном диапазонах, увеличением периферического сопротивления, уменьшением числа функционирующих капилляров и прекапилляров[1, 3], а также оскудением микроциркуляторного русла, то есть имеются явления ишемии периферических тканей, воздействие которой усугубляется постоянной, непрерывно изменяющейся скорости перфузионных изменений, постепенно снижающейся к окончательным дням эксперимента.
Выводы
Таким образом, непрерывное воздействие освещения на организм обуславливает значительные нарушения микроциркуляции, проявление и стабильность которых напрямую коррелирует с длительностью стрессорного воздействия. В условиях круглосуточного освещения у животных на 1 день возникала слабая стресс-реакция, неподкреплённая мобилизацией ресурсов организма, из-за того, что изменения перфузии происходили довольно медленно. В течение 10 дней наступает стадия регуляторных нарушений - сильной физиологической стресс-реакции, а скорость изменения колебаний перфузии на этом этапе достигает максимальных значений. На 21 сутки воздействия светового десинхроноза у крыс проявляются довольно значительные и стабильные дефекты микроциркуляции, что указывает на возникновение патологического круглосуточного десинхроноза (LL типа) и перехода стресса в стадию истощения за счет постоянной скорости воздействия. Стадийность развития указанных выше нарушений соответствует стадийности протекания десинхроноза, этот факт доказывает возможность изучения этого процесса в качестве одной из главных причин развития сердечнососудистых заболеваний.
Таблица 1.
Скорость трансформации показателей перфузии у животных при световом десинхронозе модели L/L
|
Группа |
Показатель перфузии, пф, ед. |
Среднеквадратическое отклонение, пф. ед. |
Коэффициент вариации, % |
|
Контроль(n=10) |
11,4 (10,6;11,9) |
0,45 (0,4;0,65) |
4,7 (3,15;6,0) |
|
1-е сутки (n=10) |
11,0 (9,6;11,4) p 1 =0,19 -4%/день |
0,4 (0,3;0,7) Р 1 =0,14 |
3,4 (2,5;5,8) Р 1 =0,2 |
|
10-е сутки (n=10) |
9,65 (8;10,3) Р 1 =0,004* -1,2%/день |
0,75 (0,5;1,1) Р 1 =0,25 |
8,8 (3,9;12,4) Р 1 =0,11 |
|
21-е сутки (n=10) |
8,0 (7,6;10,4) Р 1 =0,0009 Р 2 =0,55 -1,5%/день |
0,3 (0,2;0,6) Р 1 =0,01 Р 2 =0,006 |
3,6 (2,3;5,3) Р 1 =0,1 Р 2 =0,02 |
Примечание: в каждом случае приведены медиана, верхний и нижний квартили; p1, p2 - по сравнению с контролем и 10-ми сутками эксперимента соответственно.
Символом "*" помечены достоверные показатели (p<0,05)
|
Нормированные амплитуды колебаний, отн. ед. |
Контроль (n=10) |
1-е сутки (n=10) |
10-е сутки (n=10) |
21-е сутки (n= 10) |
|
Эндотелиальных |
10,4 (8,7;13,9) |
11,6(7,59;14,06) Р 1 =0,8 +12%/день |
6,21 (3,65;9,17) Р 1 =0,002* -4,6%/день |
11,13(8,35;12,68) Р 1 =0,92; Р 2 =0,02* +7,2%/день |
|
Нейрогенных |
10,18 (9.33;12.25) |
13,06(10,2;14,4) Р 1 =0,2* +28%/день |
5,04(3,39;10,74) Р 1 =0,03* -6,1%/день |
15,9(13,68;19,14) Р 1 =0,03*; p 2 =0,006* +19,6%/день |
|
Миогенных |
9,89 (8,39;12,05) |
9,4 (6,5;11,8) p i =0,5 -5%/день |
4,19 (2,49;9,21) Р 1 =0,009* -5,5%/день |
12,72(9,34;13,79) p1=0,09; p2=0,008* +18,5%/день |
|
Дыхательных |
9,46 (6,46;11,88) |
6,79 (4,02;9,7) Р 1 =0,1 -28%/день |
4,03 (2,07;6,38) Р 1 =0,0009* -3,1%/день |
8,17 (5,31;14,32) Р 1 =0,67; Р 2 =0,02* +9,3%/день |
|
Пульсовых |
6,07 (3,93;7,48) |
5,6 (2,5;8,6) Р 1 =0,8 -8%/день |
3,08 (1,58;4,55) Р 1 =0,007* -4,5%/день |
7,01 (3,66;9,54) Р 1 =0,35*; Р 2 =0,009* +11,6%/день |
Таблица 2.
Скорость трансформации показателей нормированных амплитуд колебаний перфузии у животных при световом десинхронозе
Примечание: см. Таблицу 1.
График 1.
Скорость общей трансформации перфузи
Скорость трансформации перфузии модели L/L
Перфузия
График 2.
Скорость трансформации абсолютных амплитуд колебаний перфузии модели L/L на 1 сутки
■ 1 сутки
График 3.
Скорость трансформации абсолютных амплитуд колебаний перфузии модели L/L на 10 сутки
■ 10 сутки
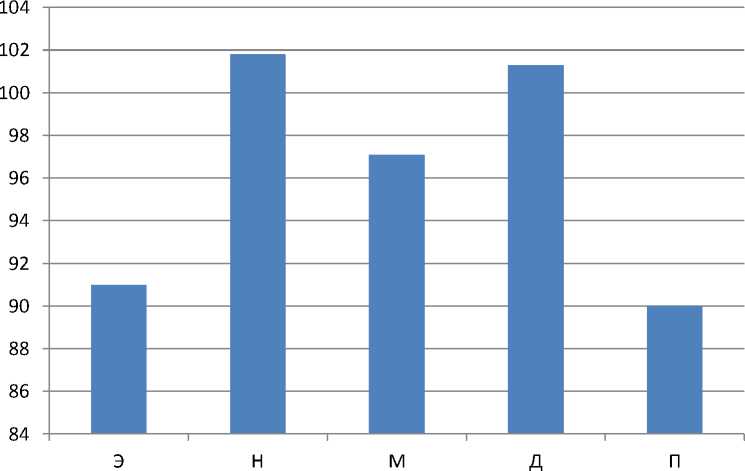
График 4.
Скорость трансформации абсолютных амплитуд колебаний перфузии модели L/L на 21 сутки
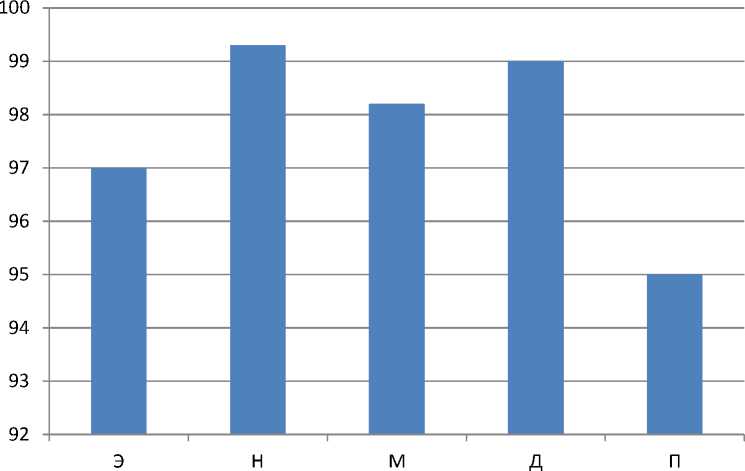
График 5.
Скорость трансформации нормированных амплитуд колебаний перфузии модели L/L на 1 сутки
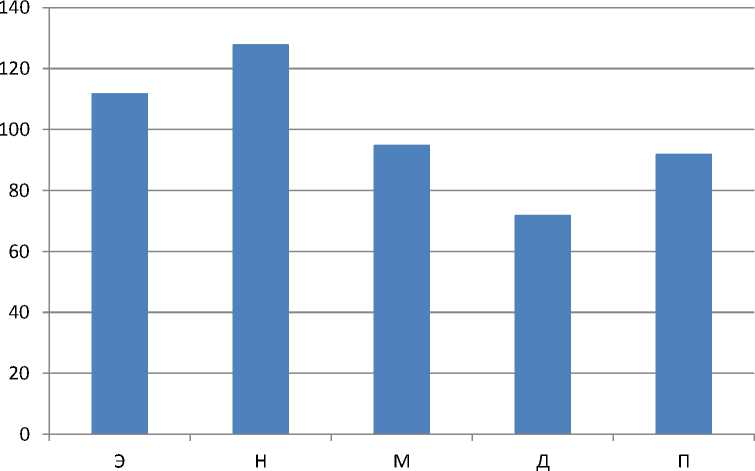
■ 1 сутки
График 6.
Скорость трансформации нормированных амплитуд колебаний перфузии модели L/L на 10 сутки
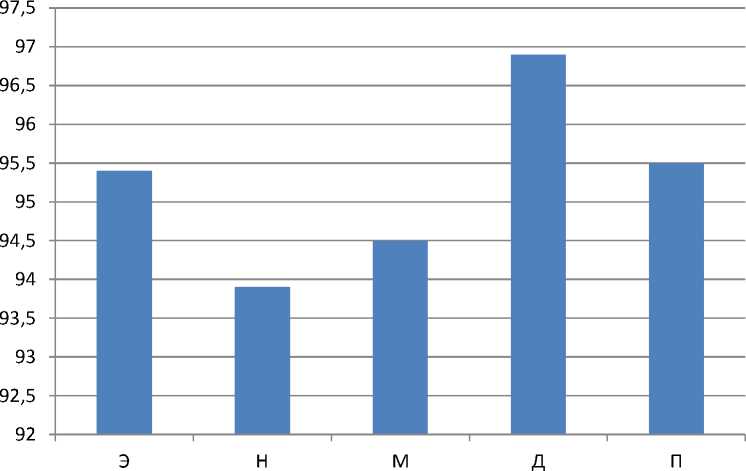
■ 10 сутки
График 7.
Скорость трансформации нормированных амплитуд колебаний перфузии модели L/L на 21 сутки
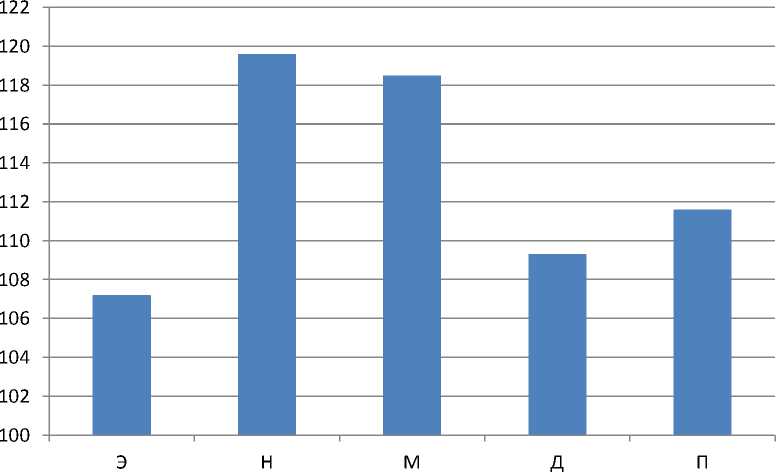
Список литературы Скорость трансформации перфузии у животных при круглосуточном экспериментальном световом десинхронозе
- Терешкина Н.Е., Злобина О.В., Иванов А.Н., Долгов А.А. Влияние продолжительности воздействия непрерывным освещением на обратимость микроциркуляторных нарушений при экспериментальном десинхронозе. Регионарное кровообращение и микроциркуляция. 2018;17(3):129-134.
- Кику П.Ф., Хотимченко М.Ю., Нагирная Л.Н. Проблемы трансмеридиональных перелетов // Экология человека. 2015. №1. С. 15-20.
- Иванов А.Н., Злобина О.В., Журкин К.И., Николашкина А.Д., Бугаева И.О., Федонников А.С., Норкин И.А. Изменения микроциркуляции при экспериментальном световом десинхронозе. Регионарное кровообращение и микроциркуляция. 2017;16(1):43-48.
- Крупаткин А.И. Колебания кровотока - новый диагностический язык в исследовании микроциркуляции // Регионарное кровообращение и микроциркуляция. 2014. Т. 13, №1. С. 83-99
- Лазерная допплеровская флоуметрия (ЛДФ) и оптическая тканевая оксиметрия (ОТО) в оценке состояния и расстройств микроциркуляции крови. Методические рекомендации, 2013.
- Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем. Колебания, информация, нелинейность. Руководство для врачей. М, 2013.- 496с
- Осиков М.В., Огнева О.И., Гизингер О.А., Федосов А.А. Этологический статус и когнитивная функция при экспериментальном десинхронозе в условиях светодиодного освещения // Фундаментальные исследования. 2015. № 1-7. С. 1392-1396.


