Скрининг эффективности и антипролиферативного действия потенциальных ингибиторов DDIT4 на моделях рака молочной железы
Автор: Жидкова Е.М., Григорьева Д.Д., Лылова Е.С., Максимова В.П., Сагитова Г.Р., Хайриева Г.И., Трапезникова Е.С., Кирсанов К.И., Якубовская М.Г., Лесовая Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Цель исследования - скрининг отобранных нами ранее ингибиторов ddit4 по способности подавлять базальную и глюкокортикоид-индуцированную экспрессию данного гена в клетках рака молочной железы (РМЖ), а также оценка антипролиферативных и цитотоксических эффектов исследуемых комбинаций препаратов. Материал и методы. В исследовании использованы клетки РМЖ люминального, HeR2-положительного и тройного негативного подтипов. Методами количественной ПЦР и Вестерн-блоттинга было оценено влияние препаратов (рапамицина, вортманнина, lY-294002, апигенина, ресвератрола, куркумина, cgp-60474 и эметина) на базальный и индуцированный глюкокортикоидами уровень экспрессии гена DDIT4 и его белкового продукта. Результаты. Наиболее эффективными ингибиторами ddit4 оказались рвотное средство эметин, ингибитор протеинкиназы С cgp-60474 и модуляторы сигнального пути pi3K/akt/mtoR рапамицин, вортманнин и lY-294002. В отношении клеточных линий РМЖ были продемонстрированы цитотоксические эффекты и антипролиферативная активность комбинаций глюкокортикоида дексаметазона с противорвотным соединением эметином, ингибитором протеинкиназы С cgp-60474, а также фитонутриентами ресвератролом и куркумином. Заключение. Выявлены новые ингибиторы как базального, так и глюкокортикоид-индуцированного уровня белка и мРНК гена DDIT4 в клеточных моделях РМЖ in vitro . По итогам работы эметин и cgp-60474 являются наиболее перспективными препаратами для дальнейших исследований.
Глюкокортикоиды, глюкокортикоидный рецептор, рак молочной железы, ddit4, комбинированная химиотерапия, экспрессия генов
Короткий адрес: https://sciup.org/140295080
IDR: 140295080 | УДК: 618.19-006.6:615.277:615.065:577.21 | DOI: 10.21294/1814-4861-2022-21-3-50-60
Текст научной статьи Скрининг эффективности и антипролиферативного действия потенциальных ингибиторов DDIT4 на моделях рака молочной железы
Глюкокортикоиды (GC) применяют в клинической практике уже более 50 лет. Цитотоксическое действие GC на клетки иммунной системы обусловливает их применение в лечении опухолей кроветворной системы [1, 2]. При терапии солидных опухолей, в частности рака молочной железы (РМЖ), GС применяют в качестве адъюванта для расширения терапевтического интервала основного цитотоксического препарата и снижения побочных эффектов химиотерапии [1]. Однако при длительном применении GC вызывают развитие серьезных побочных эффектов, в частности асептический остеонекроз, диабет, мышечную атрофию, метаболические осложнения и др. [3]. Кроме того, в зависимости от подтипа РМЖ, GC могут значительно способствовать прогрессированию опухоли [2, 4].
За последнее десятилетие был предложен ряд подходов по расширению терапевтического интервала GC благодаря одновременному снижению их побочных эффектов. Одним из таких подходов является использование GC в комбинации с препаратами, способными подавить экспрессию генов, отвечающих за развитие побочных эффектов GC. В ряде исследований было показано, что при действии GC в тканях, чувствительных к стероид-индуцированной атрофии, наблюдается повышение экспрессии DDIT4 (RTP801/Dig2/ DDIT4), консервативного индуцируемого стрессом ингибитора mTOR [5, 6].
В ряде исследований было установлено, что повышение уровня экспрессии DDIT4 ассоциировано с более быстрым прогрессированием опухоли, что делает его интересным объектом исследований в качестве возможного прогностического маркера при ряде злокачественных новообразований (ЗНО) [7]. При этом роль DDIT4 в прогрессировании и терапии РМЖ изучена недостаточно, а данные опубликованных исследований весьма противоречивы. Показано, что повышение экспрессии DDIT4 после использования отдельных химиопрепаратов кор- релирует со снижением жизнеспособности клеток РМЖ [8]. Более того, при HER2-положительном и тройном негативном (ТН) РМЖ пролиферация опухолевых клеток в условиях гипоксии возможна за счет гиперактивации сигнального пути mTOR при ингибировании DDIT4 [9]. Однако в других исследованиях была показана взаимосвязь повышения экспрессии DDIT4 c неблагоприятным прогнозом при ТН РМЖ [10]. По всей видимости, ингибирование DDIT4 приводит к неодинаковым последствиям при РМЖ различных подтипов.
Данная работа посвящена анализу действия ряда ингибиторов DDIT4 на клетки РМЖ разных подтипов с целью выявления соединений, проявляющих наибольшую эффективность как по подавлению экспрессии данного гена и его белкового продукта, так и по подавлению жизнеспособности опухолевых клеток.
Цель исследования – скрининг отобранных нами ранее ингибиторов DDIT4 по способности подавлять базальную и глюкокортикоид-индуцированную экспрессию данного гена в клетках рака молочной железы (РМЖ), а также оценка антипролиферативных и цитотоксических эффектов исследуемых комбинаций препаратов.
Выбор соединений
На основании биоинформатического скрининга, проведенного в сотрудничестве с лабораториями И.В. Будуновой (Northwestern University, Чикаго, США) и Дж.Т. Дадли (госпиталь Маунт-Синай, Нью-Йорк, США) с использованием аналитической системы «карты взаимодействия» (ConnectivityMap, CMap) из лекарственных препаратов различных классов, одобренных управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), были определены 1 300 потенциальных ингибиторов DDIT4 [11, 12]. Для 5 из них была продемонстрирована успешность применения GC в комбинации с ингибиторами экспрессии DDIT4 с целью снижения их побочного действия при терапии ЗНО кроветворной системы. На моделях лейкозов и лимфом in vitro был показан синергизм противоопухолевого действия при комбинировании с GC для вортман-нина, LY-294002 и AZD-8055. Данные соединения, а также противопротозойное и рвотное средство эметин и ингибитор протеинкиназы С CGP-60474 подавляют базальную и GC-индуцированную экспрессии гена DDIT4 в клеточных линиях CEM и Granta [11, 13].
Сравнив биоинформатические данные о потенциальной активности веществ в отношении клеток РМЖ, а также данные, полученные на линиях опухолей кроветворной системы [11, 13], мы отобрали для дальнейшего исследования in vitro 8 различных по структуре и физико-химическим свойствам соединений: растительные полифенолы куркумин, ресвератрол и апигенин, модуляторы сигнального пути PI3K/Akt/mTOR LY-294002, рапамицин и вортманнин, а также рвотное средство эметин и ингибитор протеинкиназы С CGP-60474.
Соединения группы природных полифенолов (куркумин, ресвератрол и апигенин) обладают разнообразной биологической активностью. Они действуют как акцепторы свободных радикалов и антиоксиданты, проявляя антимутагенное и противовоспалительное действие [14–20]. Изучаемые полифенолы обладают антиканцерогенным эффектом в отношении ЗНО, а также обладают антипролиферативным действием на опухолевые клетки [21–23]. Также показано, что ресвератрол обладает хроматин-модулирующим эффектом и способен активировать интерфероновый сиг-налинг в клетках, культивируемых in vitro [24]. Эметин, изохинолин растительного происхождения, обладает противопротозойным действием, противовирусной активностью, а также противовоспалительным эффектом за счет ингибирования NF-kB [25]. Эметин усиливает чувствительность клеток рака яичника к цисплатину [26], индуцирует апоптоз, снижает пролиферацию и метастатическую активность клеток РМЖ [27]. Ингибитор протеинкиназы С CGP-60474 является двойным ингибитором циклинзависимых киназ cdk1/cdk2 и запускает обратимую остановку клеточного цикла в G1/S фазах [28]. Рапамицин, вортманнин и LY-294002, несмотря на большие структурные различия, имеют схожие биологические функции и входят в группу ингибиторов Akt/PI3K/mTOR. Было показано, что mTOR регулирует протеасом-ную деградацию DDIT4 и что ингибиторы mTOR и PI3K снижают период полужизни белка DDIT4 в кератиноцитах in vitro и в эпидермисе мышей in vivo [11].
Материал и методы
Клеточные линии аденокарциномы человека культивировали в стандартной среде DMEM (для MCF-7 и MDA-MB-231) или RPMI 1640 (для HCC-1954), содержащей 10 % эмбриональную сыворотку телят, 2 mM L-глутамин, пенициллин (50 ед/мл) и стрептомицин (50 ед/мл) (все – «ПанЭко», Россия) при 37 °С в атмосфере 5 % СО2.
В культуральную среду вносили потенциальные ингибиторы в концентрации 0,1 мкМ (апигенин, ресвератрол, куркумин), 10 нМ (рапамицин, вор-тманнин, LY-294002), 1 нМ (CGP-60474, эметин) или дексаметазон (100 нМ) и инкубировали 24 ч. В экспериментах по исследованию совместного действия препаратов и GC обработку дексаметазоном проводили после 4 ч инкубации с ингибиторами. Оптимальная схема обработки клеток была отработана нами ранее: с помощью МТТ-теста были подобраны минимальные нетоксичные концентрации веществ (IC80-90), в пилотном эксперименте с наиболее активным соединением рапамицином оптимальным временем предобработки клеток
Таблица 1/table 1
Последовательности праймеров для qpcr qpcr primers
Ген/Gene
Последовательность праймеров 5’-3'/Primer sequences 5’-3'
RPLP0
Прямой праймер/Forward primer ccttctcctttgggctggtcatcca
Обратный праймер/Reverse primer cagacactggcaacattgcggacac
DDIT4
tagcctttgggaccgcttctcgt
caggtaagccgtgtcttcctccg
РМЖ для регистрации ингибирования DDIT4 являлся 4-часовой интервал [29].
Антипролиферативное действие веществ определяли методом прямого подсчета клеток. Клетки рассаживали в 24-луночные планшеты (по 1 мл, 25 000 кл/мл) и обрабатывали, как описано выше. Подсчет клеток проводили на автоматическом счетчике клеток (BioRad, США) с исключением трипановым синим через 24 ч и 120 ч после внесения первой дозы препаратов.
Вестерн-блоттинг. Клетки рассаживали по 1 мл, 1 млн кл/мл и обрабатывали, как описано выше. Клетки промывали PBS. Лизис клеток проводили в буфере RIPA с добавлением ингибитора протеиназ (Sigma-Aldrich). Лизат отделяли центрифугированием. Белки разделяли методом вертикального электрофореза в 10 % полиакриламидном геле в Tris-глициновом буфере с 1 % SDS. Перенос на поливинилиденфторидную мембрану (поры 0,22 мкм) осуществляли мокрым способом. Для предотвращения неспецифической сорбции мембраны инкубировали в растворе 5 % обезжиренного молока в PBS, затем проводили гибридизацию с первичными антителами к DDIT4 (2516S, Cell Signaling Technology). Для нормализации получаемых данных проводили гибридизацию с антителами к глицеральдегид-3-фосфатдегидрогеназе (GAPDH) (ab181602, Abcam). Далее проводили гибридизацию с вторичными антителами (ab97051, Abcam). Белки проявляли при помощи набора Clarity™ Western ECL Substrate (BioRad, США). Количественный анализ проводился с использованием денситометрии на приборе ImageQuant TL (General Electric, США).
Количественная ПЦР (qPCR). Тотальную РНК выделяли фенол-хлороформной экстракцией. Для удаления загрязнения геномной ДНК и исключения контаминаций при ПЦР проводили обработку полученных образцов РНК ДНКаза I (RQ1 RNase-Free DNase, Promega). Для получения кДНК проводили реакцию обратной транскрипции с использованием коммерческого набора («Синтол», Россия) по протоколу производителя. В реакцию Q-PCR брали 50 нг кДНК и по 500 нМ обратного и прямого праймеров (табл. 1). Амплификацию проводили в следующем режиме: 95 °С, 10 мин (95 °С, 15 с; 72 °С, 30 с, 60 °С, 30 с) – 45 циклов. Количество ПЦР-продуктов оценивали по флуоресценции красителя EVA GREEN («Синтол», Россия) и нормализовали относительно ПЦР-продукта гена рибосомного белка RPLP0. Относительное изменение экспрессии мРНК вычисляли методом ΔΔCt, где ΔΔCt определяли путем вычитания среднего значения ΔCt (цикл регистрации максимальной интенсивности флуоресценции) контроля из ΔCt для экспериментальных образцов.
Все эксперименты выполнены в 3–5 повторах. Средние значения и среднеквадратичные отклонения рассчитывали с помощью пакета программ SPSS Statistics. Для определения статистической значимости выявленных различий использовали непараметрический критерий Манна–Уитни.
Результаты
Индукция DDIT4 дексаметазоном в клетках РМЖ различных молекулярных подтипов
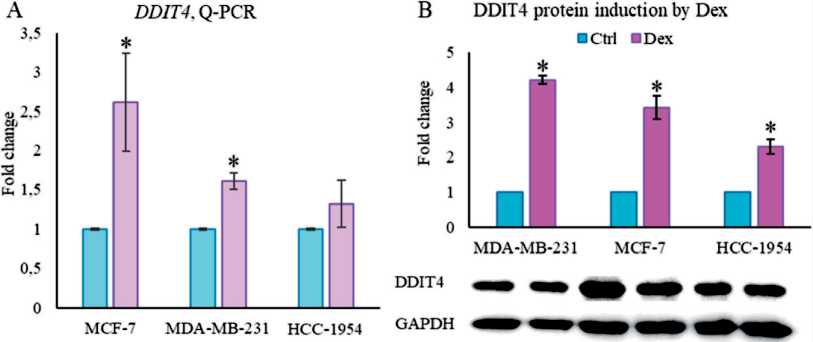
Первым этапом данной работы являлось определение оптимальных условий обработки клеток РМЖ потенциальными ингибиторами экспрессии DDIT4. Основным параметром, принимаемым во внимание, была интенсивность индукции экспрессии гена DDIT4 и его белкового продукта после обработки GC в используемых клеточных линиях. С помощью количественной ПЦР и Вестерн-блоттинга было показано, что дексаметазон (Dex) за 24 ч вызывал повышение экспрессии мРНК гена DDIT4 и его белкового продукта в линиях РМЖ (рис. 1). Наиболее сильную индукцию гена наблюдали в линии люминального РМЖ MCF-7, что согласуется с полученными ранее данными о высокой чувствительности данной линии к действию GC [30]. В клетках линии НСС-1954 индукция экспрессии гена DDIT4 была наименьшей, в то же время содержание белка после инкубации с Dex увеличилось в 2,2 раза.
Оценка влияния исследуемых соединений на базальную и GC-индуцированную экспрессию DDIT4
Подавление базальной экспрессии гена DDIT4 на всех линиях РМЖ было показано для вортман-нина (рис. 2). Эметин и рапамицин эффективно подавляли экспрессию гена в линиях люминального и ТН РМЖ, не вызывая при этом статистически значимой индукции в клетках HER2-положительного подтипа. Ни один из рассматриваемых ингибиторов не индуцировал экспрессию гена DDIT4 в клетках РМЖ. Подавление GC-индуцированной
□ Chi DDex
Chi Dex Ctrl Dex
MDA-MB-231 MCF7
Ctrl Dex
HCC-1954
Рис. 1. GC-индуцированная экспрессия белка и гена DDIT4 в клетках РМЖ. Клетки культивировали в течение 24 ч в присутствии дексаметазона (100 нМ): А. Уровень экспрессии гена DDIT4 определяли методом количественной ПЦР, сопряженной с обратной транскрипцией. Количество ПЦР-продуктов нормализовали по количеству ПЦР-продукта гена RPLP0; B. Уровень экспрессии белка DDIT4 определяли методом иммуноблоттинга с использованием специфических антител. Результаты денситометрическо-го анализа нормированы на экспрессию белка GAPDH. Данные представлены как M±SD (n=3–5).
Примечание: * – отличия от отрицательного контроля статистически значимы (p<0,05)
Fig. 1. Dex-induced DDIT4 expression on mRNA and protein level in breast cancer cells. Cells were cultivated for 24 h with Dex or solvent. А. qPCR of DDIT4 expression after Dex threatment results were normalized to the housekeeping gene RPLP0 . B. Western blot analysis of DDIT4 expression after Dex threatment. GAPDH served as loading control. Data are presented as M±SD (n=3–5).
Note: * – a statistically significant difference from the control (p<0.05)
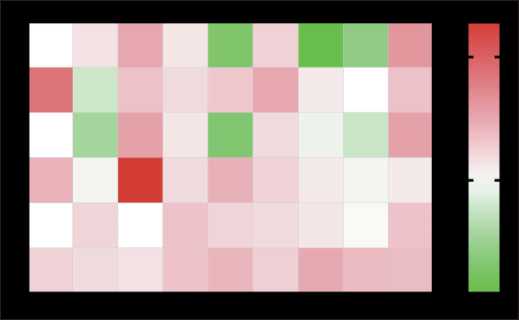
Рис. 2. Экспрессия гена DDIT4 в клетках РМЖ при обработке ингибиторами DDIT4 и их комбинациями с GC. Клетки культивировали в течение 4 ч в присутствии растворителя или исследуемого ингибитора DDIT4 , затем добавляли GC в концентрации 100 нМ или растворитель и инкубировали в течение 24 ч. Уровень экспрессии DDIT4 определяли методом количественной ПЦР, сопряженной с обратной транскрипцией.
Количество ПЦР-продуктов оценивали и нормализовали по количеству ПЦР-продукта гена RPLP0 . Данные представлены в виде тепловой карты распределения значений Log2 экспрессии гена. Для каждого соединения было получено 3–5 биологических повторов
Fig. 2. Effects of DDIT4 inhibitors, GCs and their combined treatment on DDIT4 expression in breast cancer cells. Cells were pretreated with solvent or DDIT4 inhibitors for 4 h, then were treated for 24 h with Dex or solvent. qPCR results were normalized to the housekeeping gene RPLP0. Data are presented as heat map of log2FoldChange экспрессии гена DDIT4 было показано для ингибиторов PI3K/Akt/mTOR LY-294002 и вортманнина. Растительные полифенолы ресвератрол, апигенин и куркумин и рвотное средство эметин также обладали способностью ингибировать экспрессию DDIT4, индуцированную дексаметазоном.
Наиболее ярко выраженный эффект ингибирования базальной экспрессии белка DDIT4 был показан для ингибитора протеинкиназы С CGP-60474: 3,42-кратное увеличение экспрессии DDIT4 после инкубации клеток MCF-7 с дексаметазоном и снижение уровня белка и мРНК в 0,7 раза после инкубации клеток с CGP-60474 (рис. 3). Для клеточной линии MDA-MB-231 наблюдали аналогичные эффекты (рис. 3).
Антипролиферативные эффекты исследуемых веществ
Были оценены эффекты изучаемых соединений на пролиферативную активность модельных линий клеток как индивидуально, так и в сочетании с дексаметазоном. Число жизнеспособных клеток подсчитывали через 24 ч и через 120 ч после обработки. Ингибитор протеинкиназы CGP-60474 и рвотное средство эметин продемонстрировали наиболее высокую способность подавлять рост и жизнеспособность клеток РМЖ. Так, при обработке эметином в течение 24 ч число жизнеспособных клеток линии MCF-7 и MDA-MB-231 составило 50–60 %, при обработке в течение 5 сут этот показатель падал на 15–20 % (рис. 4). Обработка клеток комбинацией эметина с дексаметазоном
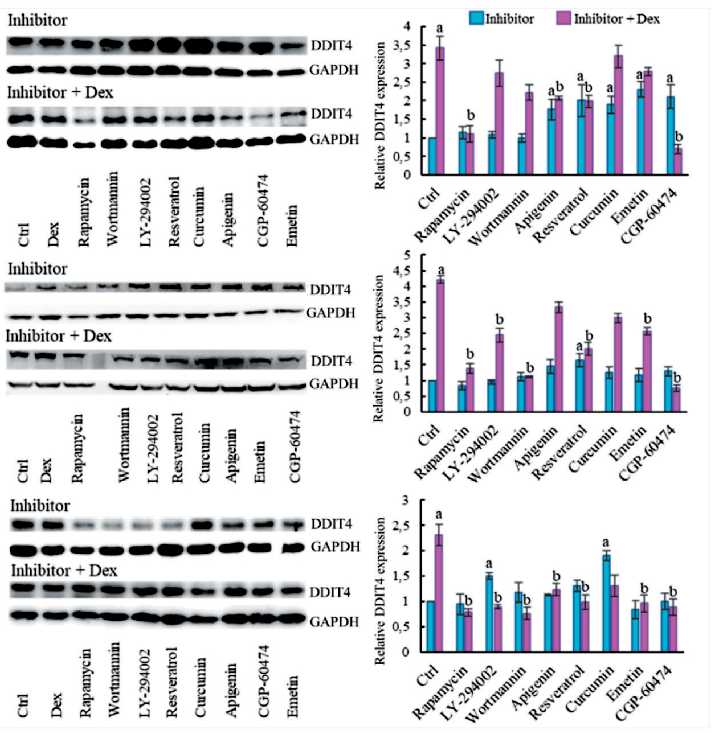
Рис. 3. Экспрессия белка DDIT4 в клетках РМЖ при обработке ингибиторами DDIT4. Клетки культивировали в течение 4 ч в присутствии растворителя или исследуемого ингибитора DDIT4, затем добавляли GC в концентрации 100 нМ или растворитель и инкубировали в течение 24 ч. Уровень экспрессии DDIT4 определяли методом иммуноблоттинга с использованием специфических антител. Относительное изменение количества белка оценивали денситометрически и нормализовали по экспрессии белка GAPDH. Данные представлены как M±SD (n=3).
Примечание: a – отличия от контроля статистически значимы;
b – отличия от образцов клеток, обработанных Dex, статистически значимы (p<0,05)
Fig. 3. Effects of DDIT4 inhibitors, GCs and their combined treatment on DDIT4 protein expression in breast cancer cells. Cells were pretreated with in the presence of solvent or DDIT4 inhibitor for 4 h, then were treated for another 24 h with Dex or solvent. GAPDH served as loading control. Data are presented as M±SD (n=3).
Note: a – statistically significant difference from the control (Ctrl);
b – statistically significant difference from the samples treated with Dex (p<0.05)
частично приводила к кооперации цитотоксических эффектов при 120-часовой инкубации линии MDA-MB-231. Цитотоксические эффекты CGP-60474 были менее выражены, однако для данного соединения в комбинации с GC наблюдали более четкую кооперацию в подавлении жизнеспособности клеток РМЖ (рис. 4). Более слабый цитотоксический эффект был продемонстрирован для препаратов класса ингибиторов PI3K/Akt/mTOR рапамицина, вортманнина и LY-294002, а также фитоалексина ресвератрола, причем преимущественно на 120 ч инкубации с данными соединениями индивидуально и в комбинации с дексаметазоном. Цитотоксический эффект остальных анализируемых потенциальных ингибиторов DDIT4 был менее выражен. В связи с этим эметин и CGP-60474
являются наиболее перспективными препаратами для дальнейших исследований.
Обсуждение
Стандартная химио- и радиотерапия РМЖ вызывает большое количество токсических побочных эффектов, для купирования которых разработаны отдельные схемы применения препаратов. GC являются частым компонентом таких схем; более того, собственный антипролиферативный эффект GC на клетки РМЖ может усиливать действие основного цитостатика [31, 32]. Однако следует принимать во внимание тот факт, что среди побочных эффектов применения GC в терапии ЗНО могут наблюдаться развитие резистентности [33, 34], остеопороза и мышечной дистрофии, усиление
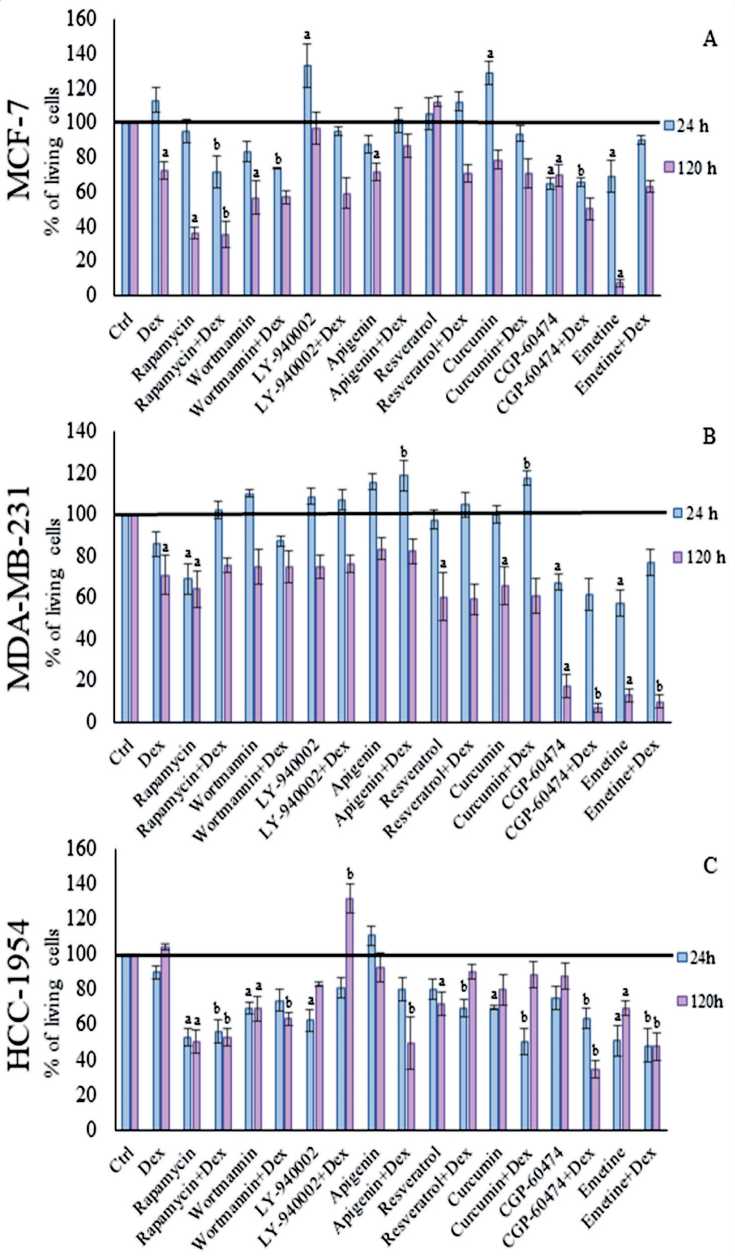
Рис. 4. Антипролиферативный эффект исследуемых ингибиторов DDIT4 индивидуально и в комбинации с дексаметазоном на клетки РМЖ:
A – число живых клеток линии MCF-7 после инкубации с исследуемыми веществами и их комбинациями; B – число живых клеток линии MDA-MB-231 после инкубации с исследуемыми веществами и их комбинациями; C – число живых клеток линии HCC-1954 после инкубации с исследуемыми веществами и их комбинациями. Клетки культивировали в присутствии растворителя, дексаметазона, исследуемых ингибиторов, а также их комбинаций.
Подсчет клеток проводили через 24 ч и 120 ч. Количество живых клеток в экспериментальных образцах приведено в процентах от контроля, обработанного растворителем. Данные представлены как M±SD (n=5). Примечание: a – отличия от контроля статистически значимы;
b – отличия от образцов клеток, обработанных Dex, статистически значимы (p<0,05)
Fig. 4. Antiproliferative effect of DDIT4 inhibitors individually and in combination with Dex on breast cancer cells. A – data for MCF-7 cells, B – data for MDA-MB-231, C – data for HCC-1954 line. Cells were treated with the solvent, Dex, inhibitors and their combination. Cells were counted 24 h and 120 h after the treatment. Data are presented as M±SD (n=5).
Note: a – statistically significant difference from the control (Ctrl);
b – statistically significant difference from the samples treated with Dex (p<0.05)
метастазирования [35] и пр. Введение в протокол противоопухолевой терапии дополнительных соединений для ингибирования экспрессии GR-зависимых генов/белков, опосредующих развитие побочных эффектов, рассматривается как один из наиболее рациональных подходов для совершенствования GC-терапии. При этом перепрофилирование зарегистрированных и уже используемых в клинической практике препаратов с описанными свойствами является перспективной альтернативой долгосрочной и дорогостоящей разработке новых фармакологических препаратов [12]. Более того, многие препараты растительного происхождения (флавоноиды, алкалоиды, фенолы, танины, гликозиды, лактоны и пр.) могут служить «мягкими» вспомогательными средствами при химиотерапии или при купировании ее побочных эффектов. Биоинформатический скрининг на основе принципа перепрофилирования препаратов оказался продуктивным подходом к подбору соединений, способных подавлять побочные эффекты GC.
В ходе работы нами были продемонстрированы цитотоксические эффекты эметина и CGP-60474 на клетки РМЖ различных подтипов, что согласовывалось с литературными данными [27]. Наблюдаемая нами антипролиферативная активность ресвератрола и куркумина на клетках РМЖ также была описана в литературе [23]. Цитотоксический эффект комбинаций данных соединений с GC дексаметазоном был описан нами впервые. Также впервые было показано, что данные соединения ингибируют как базальный, так и GC-индуцированный уровень белка и мРНК DDIT4 в клеточных моделях РМЖ.
Таким образом, в данном исследовании выявлен ряд ингибиторов DDIT4, способных in vitro подавлять экспрессию данного гена в клетках РМЖ люминального и ТН подтипов. Наиболее эффективными ингибиторами DDIT4 были рвотное средство эметин, ингибитор протеинкиназы С CGP-60474 и модуляторы сигнального пути PI3K/Akt/mTOR рапамицин, вортманнин и LY-294002. Также определенную активность в данном направлении проявили природные полифенолы растительного происхождения: апигенин, куркумин и ресвератрол. Способность исследуемых соединений подавлять жизнеспособность клеток РМЖ была менее выражена, чем в отношении клеток лейкозов и лимфом [11, 13]. Однако наблюдаемое подавление пролиферации после инкубации с ин- гибиторами DDIT4 свидетельствует о перспективности исследования данных соединений в качестве адъювантных препаратов в комбинированной химиотерапии с использованием GC.
Список литературы Скрининг эффективности и антипролиферативного действия потенциальных ингибиторов DDIT4 на моделях рака молочной железы
- Vandewalle J., Luypaert A., DeBosscherK., Libert C. Therapeutic Mechanisms of Glucocorticoids. Trends Endocrinol Metab. 2018; 29(1): 42-54. doi: 10.1016/j.tem.2017.10.010.
- Kadmiel M., Cidlowski J.A. Glucocorticoid receptor signaling in health and disease. Trends Pharmacol Sci. 2013; 34(9): 518-30. doi: 10.1016/j.tips.2013.07.003.
- Oray M., Abu Samra K., Ebrahimiadib N., Meese H., Foster C.S. Long-term side effects of glucocorticoids. Expert Opin Drug Saf. 2016; 15(4): 457-65. doi: 10.1517/14740338.2016.1140743.
- NoureddineLM, Tredan O., HusseinN, BadranB, LeRomancer M., Poulard C. Glucocorticoid Receptor: A Multifaceted Actor in Breast Cancer. Int J Mol Sci. 2021; 22(9): 4446. doi: 10.3390/ijms22094446.
- Baida G., Bhalla P., Kirsanov K., Lesovaya E., Yakubovskaya M., Yuen K., Guo S., Lavker R.M., Readhead B., Dudley J.T., Budunova I. REDD1 functions at the crossroads between the therapeutic and adverse effects of topical glucocorticoids. EMBO Mol Med. 2015; 7(1): 42-58. doi: 10.15252/emmm.201404601.
- Wang H., Kubica N., Ellisen L.W., Jefferson L.S., Kimball S.R. Dex-amethasone represses signaling through the mammalian target of rapamycin in muscle cells by enhancing expression of REDD1. J Biol Chem. 2006; 281(51): 39128-34. doi: 10.1074/jbc.M610023200.
- Pinto J.A., Rolfo C., Raez L.E, Prado A., Araujo J.M., Bravo L., Fajardo W., Morante Z.D., AguilarA., Neciosup S.P., MasL.A., BretelD., Balko J.M., Gomez H.L. In silico evaluation of DNA Damage Inducible Transcript 4 gene (DDIT4) as prognostic biomarker in several malignancies. Sci Rep. 2017; 7(1): 1526. doi: 10.1038/s41598-017-01207-3.
- Savukaityte A., Gudoityte G., Bartnykaite A., Ugenskiene R., Juozaityte E. siRNA Knockdown of REDD1 Facilitates Aspirin-Mediated Dephosphorylation of mTORC1 Target 4E-BP1 in MDA-MB-468 Human Breast Cancer Cell Line. Cancer Manag Res. 2021; 13: 1123-33. doi: 10.2147/CMAR.S264414.
- Horak P., Crawford A.R., Vadysirisack D.D., Nash Z.M., DeYoungM.P., SgroiD., EllisenL.W. Negative feedback control of HIF-1 through REDD1-regulated ROS suppresses tumorigenesis. Proc Natl Acad Sci USA. 2010; 107(10): 4675-80. doi: 10.1073/pnas.0907705107.
- Koo J.S., Jung W. Alteration of REDD1-mediated mammalian target of rapamycin pathway and hypoxia-inducible factor-1a regulation in human breast cancer. Pathobiology. 2010; 77(6): 289-300. doi: 10.1159/000320936.
- Lesovaya E., Agarwal S., Readhead B., Vinokour E., Baida G., Bhalla P., Kirsanov K., Yakubovskaya M., Platanias L.C, Dudley J.T., Budunova I. Rapamycin Modulates Glucocorticoid Receptor Function, Blocks Atrophogene REDD1, and Protects Skin from Steroid Atrophy. J Invest Dermatol. 2018; 138(9): 1935-44. doi: 10.1016/j.jid.2018.02.045.
- Савинкова А.В., Жидкова Е.М., Тилова Л.Р., Лаврова М.Д., ЛыловаЕ.С., Кузин К.А., ПортянниковаА.Ю., МаксимоваВ.П., Холодова А.В., Власова О.А., Фетисов Т.И., Кирсанов К.И., Белицкий Г.А., ЯкубовскаяМ.Г., Лесовая Е.А. Варианты и перспективы перепрофилирования лекарственных препаратов для использования в терапии онкологических заболеваний. Сибирский онкологический журнал. 2018; 17(3): 77-87. [Savinkova A.V., Zhidkova E.M., Tilova L.R., Lavrova M.D., Lylova E.S., Kuzin K.A., Portyannikova A.Yu., Maximova V.P., Kholodo-va A.V., Vlasova O.A., Fetisov T.I., Kirsanov K.I., Belitskiy G.A., Yakubovskaya M.G., Lesovaya E.A. Variants and perspectives of drug repurposing for cancer treatment. Siberian Journal of Oncology. 2018; 17(3): 77-87. (in Russian)]. doi: 10.21294/1814-4861-2018-17-3-77-87.
- Лылова Е.С., Савинкова А.В., Жидкова Е.М., Кирсанов К.И., Якубовская М.Г., Будунова И.В., Лесовая Е.А. Ингибирование экспрессии гена REDD1 для снижения побочных эффектов глюкокортикоидов. Сибирский онкологический журнал. 2020; 19(6): 73-81. [Lylova E.S., Savinkova A.V., Zhidkova E.M., Kirsanov K.I., Yakubovskaya M.G., Budunova I.V., Lesovaya E.A. Inhibition of REDD1 expression for the reduction of glucocorticoid-induced side effects. Siberian Journal of Oncology. 2020; 19(6): 73-81. (in Russian)]. doi: 10.21294/1814-4861-2020-19-6-73-81.
- Hostetler G.L., Ralston R.A., Schwartz S.J. Flavones: Food Sources, Bioavailability, Metabolism, and Bioactivity. Adv Nutr. 2017; 8(3): 423-35. doi: 10.3945/an.116.012948.
- Montenegro-Landivar M.F., Tapia-Quiros P., Vecino X., Reig M., Valderrama C., Granados M., Cortina J.L., Saurina J. Polyphenols and their potential role to fight viral diseases: An overview. Sci Total Environ. 2021; 801: 149719. doi: 10.1016/j.scitotenv.2021.149719.
- Yu C., Yang B., Najafi M. Targeting of cancer cell death mechanisms by curcumin: Implications to cancer therapy. Basic Clin Pharmacol Toxicol. 2021; 129(6): 397-415. doi: 10.1111/bcpt.13648.
- Fu X., LiM., Tang C., Huang Z., NajafiM. Targeting of cancer cell death mechanisms by resveratrol: a review. Apoptosis. 2021; 26(11-12): 561-73. doi: 10.1007/s10495-021-01689-7.
- HazafaA., IqbalM.O., Javaid U., TareenM.B.K., AmnaD., Ram-zan A., Piracha S., Naeem M. Inhibitory effect of polyphenols (phenolic acids, lignans, and stilbenes) on cancer by regulating signal transduction pathways: a review. Clin Transl Oncol. 2022; 24(3): 432-45. doi: 10.1007/ s12094-021-02709-3.
- Nozhat Z., Heydarzadeh S., Memariani Z., Ahmadi A. Chemopro-tective and chemosensitizing effects of apigenin on cancer therapy. Cancer Cell Int. 2021; 21(1): 574. doi: 10.1186/s12935-021-02282-3.
- Javed Z., Sadia H., Iqbal M.J., Shamas S., MalikK., Ahmed R., Raza S., Butnariu M., Cruz-Martins N., Sharifi-Rad J. Apigenin role as cell-signaling pathways modulator: implications in cancer prevention and treatment. Cancer Cell Int. 2021; 21(1): 189. doi: 10.1186/s12935-021-01888-x.
- Shukla S., Gupta S. Apigenin: a promising molecule for cancer prevention. Pharm Res. 2010; 27(6): 962-78. doi: 10.1007/s11095-010-0089-7.
- Aggarwal B.B., Bhardwaj A., Aggarwal R.S., Seeram N.P., Shishodia S., Takada Y. Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res. 2004; 24(5A): 2783-840.
- Arena A., Romeo M.A., Benedetti R., Masuelli L., Bei R., Gilardini Montani M.S., Cirone M. New Insights into Curcumin- and Resveratrol-Mediated Anti-Cancer Effects. Pharmaceuticals (Basel). 2021; 14(11): 1068. doi: 10.3390/ph14111068.
- Власова О.А., Борунова А.А., Сафина А., Сметанина И.В., Лесовая Е.А., Белицкий Г.А., Заботина Т.Н., Гурова К., Кирсанов К.И., Якубовская М.Г. Активация сигнального пути интерферона-альфа ресвератролом, генистеином и кверцетином. Сибирский онкологический журнал. 2019; 18(1): 50-5. [Vlasova O.A., BorunovaA.A., SafinaA., Smetanina I.V., Lesovaya E.A., Belitsky G.A., Zabotina T.N., Gurova K., KirsanovK.I., YakubovskayaM.G. Activation of interferon-a signaling by resveratrol, genistein and quercetin. Siberian Journal of Oncology. 2019; 18(1): 50-5. (in Russian)]. doi: 10.21294/1814-4861-2019-18-1-50-55.
- 25.MillerS.C., HuangR., Sakamuru S., ShuklaSJ., Attene-Ramos M.S., Shinn P., Van Leer D., Leister W., Austin C.P., Xia M. Identification of known drugs that act as inhibitors of NF-kappaB signaling and their mechanism of action. Biochem Pharmacol. 2010; 79(9): 1272-80. doi: 10.1016/j.bcp.2009.12.021.
- Sun Q., Yogosawa S., Iizumi Y., Sakai T., Sowa Y. The alkaloid emetine sensitizes ovarian carcinoma cells to cisplatin through down-regulation of bcl-xL. Int J Oncol. 2015; 46(1): 389-94. doi: 10.3892/ ijo.2014.2703.
- Sun Q., Fu Q, Li S., Li J., Liu S., Wang Z., Su Z., Song J., Lu D. Emetine exhibits anticancer activity in breast cancer cells as an antagonist of Wnt/p-catenin signaling. Oncol Rep. 2019; 42(5): 1735-44. doi: 10.3892/or.2019.7290.
- Meyuhas O. Ribosomal Protein S6 Phosphorylation: Four Decades of Research. Int Rev Cell Mol Biol. 2015; 320: 41-73. doi: 10.1016/ bs.ircmb.2015.07.006.
- Григорьева Д.Д., Жидкова Е.М., Лылова Е.С., Демина Д.В., Кирсанов К.И., Белицкий Г.А., Якубовская М.Г., Лесовая Е.А. Ингиби-рование глюкокортикоидиндуцированной экспрессии REDD1 рапами-цином в клетках рака молочной железы. Успехи молекулярной онкологии. 2022; 9(1): 42-7. [Grigorieva D.D., Zhidkova E.M., Lylova E.S., Demina D.V., Kirsanov K.I., Belitsky G.A., Yakubovskaya M.G., Leso-vaya E.A. Inhibition of glucocorticoid-induced expression of REDD1 by rapamycin in breast cancer cells. Advances in Molecular Oncology. 2022; 9(1): 42-7. (in Russian)].
- Жидкова Е.М., Кузин К.А., Тилова Л.Р., Савинкова А.В., Борисова О.И., Лаврова М.Д., Максимова В.П., Кирсанов К.И., Якубовская М.Г., Лесовая Е.А. Сравнительный анализ биологических эффектов селективного агониста глюкокортикоидного рецептора cpda на клеточные линии рака молочной железы различных молекулярных подтипов. Сибирский онкологический журнал. 2017; 16(6): 41-46. [Zhidkova E.M., Kuzin K.A., Tilova L.R., Savinkova A.V., Borisova O.I., Lavrova M.D., Maximova V.P., Kirsanov K.I., Yakubovskaya M.G., Les-ovaya E.A. Comparative analysis of biological effects of selective activator of the glucocorticoid receptor cpda on different subtypes of breast cancer cell lines. Siberian Journal of Oncology. 2017; 16(6): 41-46. (in Russian)]. doi: 10.21294/1814-4861-2017-16-6-41-46.
- Kach J., Conzen S.D., SzmulewitzR.Z. Targeting the glucocorticoid receptor in breast and prostate cancers. Sci Transl Med. 2015; 7(305). doi: 10.1126/scitranslmed.aac7531.
- Vilasco M., Communal L., Mourra N., Courtin A., Forgez P., Gompel A. Glucocorticoid receptor and breast cancer. Breast Cancer Res Treat. 2011; 130(1): 1-10. doi: 10.1007/s10549-011-1689-6.
- Zhang C., Wenger T., Mattern J., Ilea S., Frey C., Gutwein P., Altevogt P., Bodenmuller W., Gassler N., Schnabel P.A., Dienemann H., Marme A., Hohenfellner M., Haferkamp A., Pfitzenmaier J., Grone H.J., Kolb A., Buchler P., Buchler M., Friess H., Rittgen W., Edler L., Debatin K.M., Krammer P.H., Rutz H.P., Herr I. Clinical and mechanistic aspects of glucocorticoid-induced chemotherapy resistance in the majority of solid tumors. Cancer Biol Ther. 2007; 6(2): 278-87. doi: 10.4161/ cbt.6.2.3652.
- Mikosz C.A., Brickley D.R., Sharkey M.S., Moran T. W., Conzen S.D. Glucocorticoid receptor-mediated protection from apoptosis is associated with induction of the serine/threonine survival kinase gene, sgk-1. J Biol Chem. 2001; 276(20): 16649-54. doi: 10.1074/jbc.M010842200.
- Obradovic M.M.S., Hamelin B., Manevski N., Couto J.P., Sethi A., Coissieux M.M., MUnst S., Okamoto R., Kohler H., Schmidt A., Bentires-Alj M. Glucocorticoids promote breast cancer metastasis. Nature. 2019; 567(7749): 540-4. doi: 10.1038/s41586-019-1019-4.


