Сложное хирургическое лечение гигантской забрюшинной липосаркомы: клинический случай
Автор: Жигулев А.Н., Баландина И.А., Шляков Д.Д., Довбыш А.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинические случаи
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Забрюшинная липосаркома — редкое злокачественное новообразование с высокой частотой рецидивов. Гигантская забрюшинная липосаркома представляет значительные трудности для врачей-онкологов из-за своей инвазивной природы и сдавливания жизненно важных органов. Ранняя диагностика и полное удаление опухоли во время операции является ключевым фактором успеха в лечении этого заболевания. Этот случай демонстрирует сложность лечения 65-летней женщины с опухолью размером 31 × 26 × 17 см и весом 5,9 кг, подчеркивает важность точности и сложности оперативного вмешательства, а также возможность использования 3D-моделирования новообразования для проведения расчета объема опухоли, объема интраоперационной кровопотери, планирования хода операции и прогнозирования осложнений.
Клинический случай, липосаркома, забрюшинное пространство, онкология, 3D-моделирование
Короткий адрес: https://sciup.org/140313478
IDR: 140313478 | DOI: 10.18027/2224-5057-2025-059
Текст научной статьи Сложное хирургическое лечение гигантской забрюшинной липосаркомы: клинический случай
Саркомы мягких тканей — очень редкие опухоли. На их долю приходится менее 1 % всех злокачественных опухолей у взрослых [1], а частота их возникновения в Европе оценивается в 4–5 случаев на 100 000 человек в год [2]. Около 10 –15 % сарком мягких тканей у взрослых локализуются забрюшинно. Существует множество гистологических подтипов сарком мягких тканей, и липосаркома является наиболее распространённым вариантом, составляя 20 % от всех сарком мягких тканей [2]. Она имеет мезодер- мальное происхождение и развивается из жировой ткани. Липосаркома чаще всего возникает в конечностях (52 %) и забрюшинно (19 %). Другие области поражения встречаются реже и локализуются в мягких тканях конечностей и туловища, в меньшей степени — в плевральной полости, пищеводе, средостении и других органах. Согласно классификации ВОЗ 2020 года, выделяют четыре типа липосаркомы: атипичная липоматозная опухоль / высокодифференцированная липосаркома, дедифференци- рованная липосаркома, миксоидная (круглоклеточная) липосаркома и плеоморфный тип [3]. Анатомическое распределение подтипов липосаркомы зависит от гистологического типа. В то время как хорошо дифференцированные и дедифференцированные подтипы чаще встречаются забрюшинно, плеоморфные и миксоидные подтипы чаще поражают конечности. Дедифференцированная липо-саркома — это высокозлокачественная саркома, которая ведёт себя более агрессивно по сравнению с хорошо дифференцированной липосаркомой и склонна к локальным рецидивам и метастазированию. Характерным признаком дедифференцированной липосаркомы при визуализации является образование с сосуществующими жировыми и нежировыми тканями, часто с очаговым узловым нелипоматозным компонентом размером более 1 см. Могут наблюдаться кальцинаты, которые являются признаком неблагоприятного прогноза [4].
Забрюшинная липосаркома обычно протекает бессимптомно до тех пор, пока опухоль не достигнет таких размеров, что начнёт сдавливать окружающие органы. Из-за своей редкости и отсутствия явных клинических симптомов она часто диагностируется несвоевременно. Размеры и вес липосарком варьируют: опухоли весом более 20 кг называются «гигантскими липосаркомами» и встречаются крайне редко [5]. Прогноз при забрюшинной липосаркоме неблагоприятный по сравнению с другими подтипами забрюшинных сарком. Возможным радикальным методом лечения больных с забрюшинной липосаркомой является хирургический [6]. Это часто бывает затруднительно, особенно при дифференцированных подтипах, поскольку границы опухоли бывают необъективны, и, как риск, частота локального рецидива будет выше, что требует резекции прилегающих органов. Применение неоадъювантной или адъювантной химиотерапии и/или лучевой терапии вызывает споры из-за низкой чувствительности этих опухолей [7,8]. Иные методы лечения в настоящее время используются с паллиативной целью. В соответствии с клиническими рекомендациями лекарственное противоопухолевое лечения применяется с паллиативной направленностью или при диагностике метастатических форм. Множество работ было посвящено использованию различных вариантов лучевой терапии (различное фракционирование, дистанционные методы и брахитерапия, одновременное химио-лучевое лечение, сроки проведения (предоперационно, интраоперационно или послеоперационно), применение альтернативных видов излучений — электронов, протонов или ионов углерода) при лечении ретроперитонеальных сарком, но ни один метод не вошел в «золотой стандарт» [6].
Из-за большого пространства в брюшной полости первичная опухоль может достигать очень больших размеров, не вызывая никаких симптомов. По литературным данным, средний диаметр опухоли на момент постановки диагноза составляет 20 –25 см [9]. Из-за вышеупомянутых параметров у пациентов с первичной липосаркомой забрюшинного пространства симптомы проявляются на более поздних стадиях заболевания, в основном, из-за давления на соседние органы и, реже, из-за инвазии в органы. В ходе многочисленных исследований (ретроспективных, проспективных) было тщательно изучено несколько прогностических факторов, не зависящих от гистологического типа опухоли, для определения риска локального или отдаленного рецидива и общей выживаемости. Эти прогностические факторы разнообразны и, в основном, включают в себя степень злокачественности опухоли, ее гистологический вариант, возраст пациента, статус респектабельности и размер опухоли. Первичный рецидив обычно развивается в течение 0,5–2 лет после хирургической резекции, при этом частота рецидивов достигает 60 % при наблюдении в течение 5 лет. Более крупные опухоли не рецидивировали после хирургической резекции R0,в то время как опухоли меньшего размера возвращались уже через 3 месяца после резекции. Факторами риска рецидива опухоли в исследованиях были подтип опухоли (миксоидный или смешанный) и факт резекции смежных органов.
Мы сообщаем о гигантской дедифференцированной забрюшинной липосаркоме диаметром 31 × 26 × 17 см и весом 5,95 кг. Опухоль, сдавливающая окружающие анатомические структуры, была успешно удалена с сохранением окружающих органов.
Пациентка 65 лет жаловалась на периодический дискомфорт в животе и прогрессирующее вздутие живота в течение последних двух лет. За последние шесть месяцев отмечает снижение веса тела. В декабре 2024 года самостоятельно обнаружила опухоль в животе, в медицинском центре выполнено ультразвуковое исследование брюшной полости, выявлена опухоль. В рамках первичной диагностики проведена позитронно-эмиссионная томография: в брюшной полости и забрюшинном пространстве слева с распространением в малый таз определялось объемное образование больших размеров, неоднородной структуры (с включениями жировой ткани), с неравномерной фиксацией РФП 201 × 138 × 213 мм, SUV (lbm) max = 3.67, компримировавшее прилежащие анатомические структуры. Выполнена core-биопсия, верифицирована дедиф-ференцированная липосаркома.
КТ-сканирование с контрастированием за 3 дня до операции выявило,что в центральных и левых отделах брюшной полости есть опухоль размерами 243 × 183 × 244 мм, структура неоднородная — кистозно- солидная с жировыми включениями (рис. 1 и 2). Петли тонкой кишки оттеснены вправо, левая половина поперечной и нисходящая часть ободочной кишки компримированы между новообразованием и передней брюшной стенкой, желудок и поджелудочная железа оттеснены вправо, селезенка — поддиафрагмально. Левая почка деформирована новообразованием, смещена кзади и медиально. Сосудистая ножка почки компримирована, почечная артерия прослеживается, почечная вена четко не дифференцируется. Кортико-медуллярная дифференциация почки сохранена, в прилежащей к опухоли паренхиме почки определяются участки гипоперфузии (компрессионные изменения).
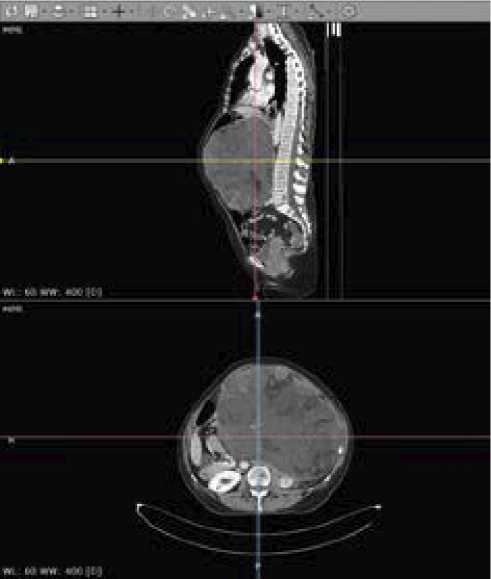
Рисунок 1. КТ-сканы до операции
Figure 1. CT scans before surgery
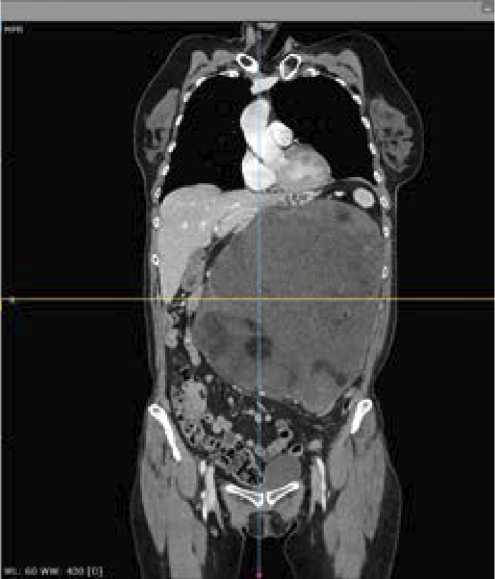
Рисунок 2. КТ-сканы до операции
Figure 2. CT scans before surgery
При ангионефросцинтиграфии получено изображение обеих почек в динамике. Изображение левой почки бобовидной формы с нечеткими контурами размером 6,9 × 4,2 см, накопление РФП в проекции левой почки значительно снижено, распределение его диффузно неравномерное. Накопление РФП в проекции правой почки достаточное, распределение его диффузно неравномерное. Перфузия почек асимметрична за счет значительного снижения перфузии слева.Левая ренограмма обструктивного типа (накопление нуклида в проекции левой почки на протяжении всего исследования преобладает над его выведением). Показатели фильтрационно-экскреторной функции правой почки замедлены (ренограмма паренхиматозного типа).
Консилиумом врачей (онкологическим) было принято решение о необходимости хирургического вмешательства.
В период предоперационной подготовки проведен анализ интраоперационных и послеоперационных рисков. Риск инфекционных и тромбоэмболических осложнений был учтен и стратифицирован. Отдельно проведена оценка интраоперационной кровопотери, так как она могла привести к физиологическим сдвигам в составе крови, коагулопатии, снижению эффективности антибиотиков и необходимости переливания компонентов крови. Кроме того, выявление и устранение источников кровотечения увеличивает продолжительность операции. В целях оценки интраоперационной кровопотери, связанной с кровонаполнением самой опухоли и изменением объема циркулирующей крови пациентки, после удаления опухоли выполнено 3D-моделирование новообразования и проведен расчет объема опухоли, а также сравнение с данными компьютерной томографии.
В предоперационном периоде у пациентки установлена гипохромная анемия смешанного генеза, легкой степени. Уровень эритроцитов составлял 3,8 × 10 12 , гемоглобин — 105 г / л.
Моделирование и визуализация объектов неправильной геометрической формы на основе данных компьютерной томографии, а также измерение их площади и объема осуществляется на основе стандартных геометрических формул с использованием программы для ЭВМ «Интерактивный графический универсальный программный комплекс измерения анатомических структур» [10].
Построение трёхмерной модели на основе набора двумерных контуров реализуется посредством обработки исходных данных, унификации геометрического представления, генерации поверхности и последующей дополнительной обработки (рис. 3 и 4). Исходная информация извлекается из XML-файла,содержащего набор координатных точек, формирующих замкнутый контур каждого среза, а также параметры, определяющие пространственное положение среза: порядковый номер, физическую толщину и межсрезовое расстояние. Для обеспечения корректной пространственной организации данные упорядочиваются по порядковому номеру среза и координате Z, рассчитанной на основании межсрезового интервала.
С целью обеспечения геометрической согласованности между срезами выполняется приведение контуров к уни- фицированному виду. Так как количество точек и их распределение по периметру могут различаться, применяется линейная интерполяция с последующей нормализацией длины контура в диапазоне [0;1] и формированием равномерно распределённого набора точек фиксированной мощности. Такой подход обеспечивает идентичность структурных характеристик смежных срезов и корректность формирования межслойных поверхностей.
Генерация трёхмерной оболочки осуществляется путём последовательного соединения пар унифицированных контуров граней, формирующих боковую поверхность объекта. Процесс построения выполняется циклически по каждой паре точек, что позволяет получить непрерывный и топологически корректный каркас модели. Верхнее и нижнее основания формируются посредством триангуляции Делоне контуров крайних срезов, что обеспечивает замкнутость геометрической оболочки.
Вычисление объёма объекта основано на интегрировании площадей поперечных сечений по оси Z. Площадь каждого сечения определяется с использованием алгоритма построения выпуклой оболочки, после чего объём между слоями вычисляется как произведение среднего значения площадей двух соседних сечений на межсре-зовое расстояние. Суммирование полученных величин по всем парам слоёв позволяет определить полный объём в кубических миллиметрах и сантиметрах.
Финальный этап заключается в визуализации и экспорте полученной модели. Для этого используется библиотека PyVista, обеспечивающая сглаживание поверхности, настройку освещения и генерацию интерактивного HTML-файла, позволяющего исследовать модель в трёхмерном пространстве с возможностью вращения, масштабирования и отображения координатной сетки без необходимости установки специализированного программного обеспечения.
Вместе с этим проведено сравнение расчета объема опухоли по данным ее линейных размеров по компьютерной томографии и стандартных геометрических формул и расчета программы для ЭВМ «Интерактивный графический универсальный программный комплекс измерения анатомических структур». Для стандартного расчета объема опухоли за основу взята формула объем эллипсоида, как максимально похожего на нее по форме.
аз* ■и | V - "^i^jj'^i
Учитывая данные компьютерной томографии, размеры опухоли были равны 243 × 183 × 244 мм. При расчете по представленной формуле объем опухоли составил 5681 см 3 . При этом фактические размеры опухоли по данным прижизненного патологоанатомического исследования составили 31× 26 × 17, при расчете объем опухоли составил 7174 см 3 . Объем опухоли, рассчитанный программой ЭВМ, составил 7061 см 3 . При установлении объема
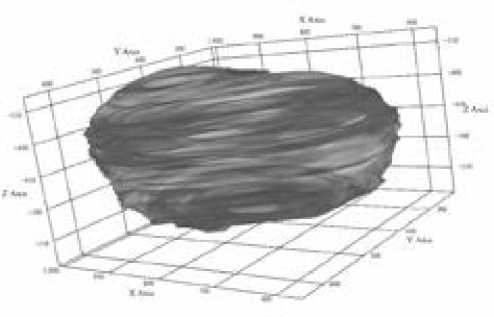
Рисунок 3. Дооперационное 3D-моделирование
Figure 3. Preoperative 3D modeling

Рисунок 4. Дооперационное 3D -моделирование
Figure 4. Preoperative 3D modeling опухоли при патологическом исследовании за эталон, то отклонение данных компьютерной томографии составило 20,8%, программы ЭВМ — 1,5%. В ряде исследований получены результаты расчета объема крови в опухоли, проницаемости сосудов и прочих параметров методами магнитно-резонансной томографии.
Во время операции было установлено, что новообразование возникло из забрюшинной жировой ткани и сдавливало окружающие органы, но ни один из них не был поражён. Это может происходить из-за того, что забрюшинная локализация — это глубокая, расширяемая область без большого количества костных границ. Таким образом, забрюшинное расположение опухоли может способствовать росту липосаркомы без сдавливания жизненно важных органов. Если появляются такие клинические симптомы, как дискомфорт в животе, потеря веса и уплотнение в брюшной полости, это означает, что забрюшинная липосаркома достигла очень больших размеров и может сдавливать окружающие органы или проникать в них.
В ходе оперативного вмешательства полностью удалена забрюшинная опухоль без одновременной резекции окружающих органов. Размер этой забрюшинной липосар-комы составлял 31 × 26 см, а вес — 5952 гр. (рис. 5 и 6). Полное удаление опухоли во время операции является ключевым фактором в лечении этого заболевания. В противном случае возможен рецидив, и единственным способом лечения считается повторная операция. Следует отметить, что проведение операции было сопряжено с большими
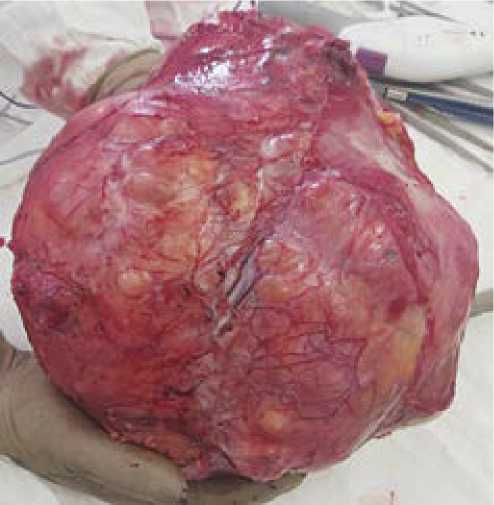
Рисунок 5. Опухоль, макропрепарат, разрез, × 1
Figure 5. Tumor, macro-preparation, section, * 1
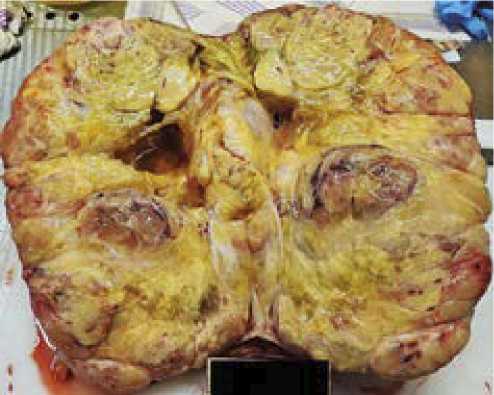
Рисунок 6. Опухоль, макропрепарат, разрез, × 1
Figure 6. Tumor, macropreparation, section, * 1
трудностями, а риск остаточной опухоли повышает риск рецидива. В данном случае левый мочеточник был сдавлен и смещён вправо,распластан по капсуле опухоли на всем протяжении. Предоперационная попытка катетеризации левого мочеточника не увенчалась успехом. Поэтому во время операции были тщательно и аккуратно идентифицированы крупные кровеносные сосуды и опухолевая ткань, в частности подвздошные и кишечные кровеносные сосуды, а также был визуализирован мочеточник на всем протяжении, поскольку гигантские опухоли нарушают нормальное анатомическое расположение органов. Интраоперационная кровопотеря составила 200 мл. После удаления опухоли проведена оценка гематологических показателей: уровень эритроцитов составлял 2,65 × 10 12 , гемоглобина — 69 г/л. Проведена трансфузия эритроцитарной взвеси объемом 283 мл. Послеоперационное течение было без осложнений, и пациентка была выписана на 8-й день после операции, оценка гематологических показателей: уровень эритроцитов составлял 4,0 × 10 12 , гемоглобина — 110 г / л.
Прижизненное патологоанатомическое исследование операционного материала показало, что опухолевый узел образован полиморфными липоцитами, разделенными полями мелких округлых клеток с нечеткими контурами, мутной цитоплазмой, овальными светлыми ядрами, фигурами митозов, в части полей зрения участки миксоматоза стромы и некрозы (рис. 7). Дополнительное исследование произведено на иммуностейнерах Link (DAKO), Ventana
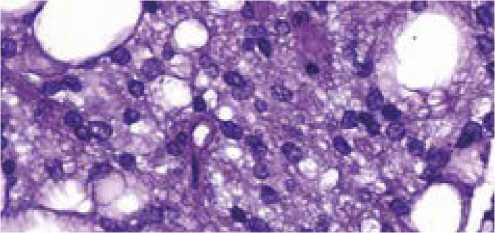
Рисунок 7. Опухоль в окраске гематоксилин-эозин, × 1000
Figure 7. Tumor stained with hematoxylin and eosin, * 1000
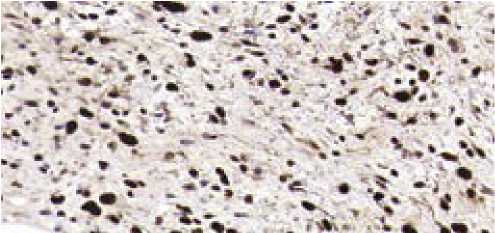
Рисунок 8. ИГХ опухоли с антителом к MDM2, × 1000
Figure 8. Immunohistochemical study of the tumor with an antibody to MDM2, * 1000
BenchMark Ultra, к клеткам опухоли vimentin+, S10 0+, MDM2+, NSE–, –, DES–, CD34–, CD31–, ki67+ до 40%. Верифицирована забрюшинная дедифференцированная липосар-кома. Гиперэкспрессия MDM2 (рис. 8) является характерной чертой дифференцированной и дедифференцированной липосаркомы, при этих саркомах гиперэкспрессия и амплификация MDM2 широко используются для подтверждения диагноза или дифференциации заболевания с другими саркомами, имеющими схожее морфологическое строение.
Принцип хирургического вмешательства заключается в удалении опухоли, ее капсулы и всех компрометированных органов. Успешная полная резекция забрюшинной липосар-комы может повысить пятилетнюю выживаемость с 16,7% до 58% [11]. Однако полное удаление представляет собой сложную задачу, особенно при дедифференцированном подтипе, поскольку границы опухоли трудно различимы. Для достижения макроскопического излечения иногда требуется комбинированная резекция; чаще всего удаляют почку, затем — толстую кишку. Локальный рецидив остается основной причиной смертности при забрюшинной липосаркоме. У пациентов, которым было проведено удаление рецидивирующей опухоли, выживаемость была выше, чем у пациентов, которым резекция не проводилась. Таким образом, золотым стандартом лечения остается удаление рецидива.
ЗАКЛЮЧЕНИЕ
Гигантская забрюшинная липосаркома — чрезвычайно редкая опухоль с высокой частотой рецидивов, которая зависит от некоторых факторов, таких как гистологический тип и степень злокачественности, а также полнота удаления опухоли. В данном случае мы провели радикальную операцию без одновременной резекции окружающих органов, выполнено исследование отдельных краев резекции, и опухолевого роста не выявлено. Кроме того, мы продолжим внимательно наблюдать за пациенткой на предмет рецидива. Проведенное оперативное вмешательство не сопровождалось обширной кровопотерей, при этом в послеоперационном периоде после удаления опухоли установлены показания для проведения гемотрансфузии. В ходе выполнения такого хирургического вмешательства увеличивается суммарный объем интраоперационной кровопотери в комплексе с опухолью, что влечет за собой увеличение объема гемотрансфузии и гематологических осложнений. Предоперационный расчет объема опухоли, объема крови в опухоли и прогноз интраоперационной кровопотери является предметом дальнейшего исследования.


