Случай клинической манифестации неклассифицируемой кардиомиопатии в период новой коронавирусной пандемии
Автор: Барсуков А. В., Борисова Е. В., Козлов П. С., Рудь С. Д., Ясеновец М. В., Ахметшин И. М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 4 т.37, 2022 года.
Бесплатный доступ
Изолированный некомпактный миокард левого желудочка (НКМЛЖ) - редкий вариант неклассифицируемой кардиомиопатии (КМП). Основу клинической картины некомпактной КМП составляют сердечная недостаточность (СН), аритмии, тромбоэмболии. Острые кардиальные и экстракардиальные заболевания могут выступить в качестве триггера манифестации НКМЛЖ. В статье приведен пример диагностики НКМЛЖ у взрослого пациента после перенесенного острого миокардита на фоне вакцинации против новой коронавирусной инфекции COVID-19. Дана характеристика проводимой терапии, отражена динамика течения заболевания на протяжении 5 мес. наблюдения.
Некомпактный миокард левого желудочка, некомпактная кардиомиопатия, новая коронавирусная инфекция, вакцинация, миокардит, сердечная недостаточность, аритмия, диагностика, лечение
Короткий адрес: https://sciup.org/149141448
IDR: 149141448 | УДК: 616.98:578.834.1-036.21 | DOI: 10.29001/2073-8552-2022-37-4-166-173
Текст научной статьи Случай клинической манифестации неклассифицируемой кардиомиопатии в период новой коронавирусной пандемии
Как известно, некомпактный миокард левого желудочка (НКМЛЖ) характеризуется изменениями его стенки с формированием наружного плотного (компактного) и внутреннего некомпактного слоя, состоящего из выступающих в просвет полости ЛЖ трабекул и глубоких межтрабекулярных впадин. Некомпактный миокард представляет собой редкий вариант кардиомиопатии (КМП), которая по предложению Американской ассоциации сердца (АНА, 2006) помещена в группу генетических КМП [1], а экспертами Европейского общества кардиологов (ESC, 2008) определена как семейная/генетическая неклассифициру-емая КМП [2]. В соответствии с нозологической классификацией КМП MOGE (S) (2013), учитывающей морфофункциональный фенотип (М), поражение органов (О), паттерн генетического наследования (G), этиологическую характеристику (Е) (включающую генетический дефект или основное заболевание/субстрат) и функциональный статус пациента (S) [3], НКМЛЖ (LVNC) рекомендуется описывать как MLVNC-D (с дилатацией/дисфункцией ЛЖ), MLVNC-H (с гипертрофией ЛЖ) или MLVNC (так называемая чистая некомпактная КМП).
Распространенность НКМЛЖ, по различным оценкам, составляет 0,014–0,7% среди всех пациентов, направленных на эхокардиографию, достигая 3–4% среди лиц с симптомной сердечной недостаточностью (СН). НКМ-ЛЖ чаще встречается среди мужчин, при этом средний возраст дебютной манифестации заболевания находится в диапазоне от 40 до 50 лет. В 18–50% случаев прослеживается наследственный характер данной патологии сердца. Наряду с генетическими дефектами, лежащими в основе интракардиальной некомпактности, описаны другие (приобретенные) механизмы ее развития. Так, состояния и заболевания, протекающие с повышением пред- и постнагрузки на ЛЖ (например, беременность, соревновательный спорт с высокими физическими нагрузками, хроническая почечная недостаточность, серповидно-клеточная анемия, различные пороки сердца, дилатация полостей сердца), могут сопровождаться избыточной трабекулярностью миокарда ЛЖ, требующей дифференциальной диагностики с истинной некомпактной КМП [4].
Некомпактный миокард может существовать не только в качестве изолированной аномалии ЛЖ, но и может быть ассоциированным с другими заболеваниями, в частности, аритмогенной дисплазией правого желудочка (ПЖ), гипертрофической, рестриктивной или дилатационной КМП, врожденными пороками клапанного аппарата (аномалия Эбштейна, двустворчатый аортальный клапан) или синдромами, вовлекающими несколько систем органов [5]. Триггеры манифестации некомпактной КМП у взрослых пациентов мало изучены, однако есть свидетельства выявления этой патологии на фоне различных острых (миокардит, тиреотоксикоз и др.) и хронических (нейромышечных, лицевых, кожных, эндокринных) болезней, кар-диотоксической химиотерапии онкозаболеваний [6].
Результатом некомпактности миокарда зачастую служит формирование фенотипа дилатационной КМП, поэтому СН считается наиболее стереотипным проявлением НКМЛЖ. Также достаточно часто регистрируются аритмии: фибрилляция предсердий (ФП) (18% пациентов), пароксизмальная желудочковая тахикардия/фибрилляция желудочков (6%), атриовентрикулярная блокада высокой степени, требующая имплантации постоянного электрокардиостимулятора (5%), и другие клинически менее значимые нарушения ритма и проводимости у абсолютного большинства пациентов [7]. Тромбы в полости ЛЖ наблюдаются у 9–25% больных с некомпактным миокардом. Частота эмболий в большой круг кровообращения среди лиц с выявленным тромбозом ЛЖ составляет 21–38%. Согласно имеющимся данным, более трети случаев некомпактной КМП протекают без СН, аритмий, дилатации камер сердца, изменения толщины стенок, нарушений систолической и диастолической функций ЛЖ. Отмечено, что асимптомные пациенты с НКМЛЖ характеризуются лучшим прогнозом в аспекте внезапной аритмической смерти по сравнению с субъектами, демонстрирующими симптомы СН [8].
До настоящего времени не разработано золотого стандарта в алгоритме доказательства наличия некомпактной КМП. Среди многочисленных диагностических критериев, предложенных для верификации НКМЛЖ, наиболее применяемыми в реальной клинической практике остаются ультразвуковые критерии T. Chin и соавт. (1990) [9], R. Jenni и соавт. (2001) [10], а также магнитно-резонансные (МР) критерии S.E. Petersen и соавт. (2005) [11], M. Grothoff и соавт. (2012) [12].
Прогноз пациентов с изолированным НКМЛЖ определяется развитием осложнений, в частности, желудочковых аритмий высоких градаций, СН, тромбоэмболий. ФП, дилатация полости и снижение насосной функции ЛЖ, митральная регургитация II–III степени, соотношение некомпактного и компактного миокарда > 2 в конце систолы ассоциированы с ухудшением долговременной выживаемости наблюдаемых пациентов [13].
Конкретные рекомендации по лечению больных некомпактной КМП пока не разработаны. Терапевтические возможности продолжают базироваться на современных подходах к лечению СН. Показаниями к назначению пероральных антикоагулянтов при НКМЛЖ считаются ФП и наличие подтвержденного тромба в полости ЛЖ. Применение антикоагулянтной терапии у лиц с некомпактной КМП без ФП и интракардиального тромбоза представляется спорным, поскольку нет убедительных доказательств пользы, как, впрочем, и вреда такого подхода. Недостаточно данных об использовании имплантируемых кардиовертеров-дефибрилляторов (ИКД) при данной патологии. Вместе с тем сообщалось об адекватности клинически обоснованного применения ИКД у 42% лиц с НКМЛЖ [14]. По данным другого небольшого исследования, комбинация ИКД и бивентрикулярной кардиостимуляции способствовала улучшению функционального класса СН у пациентов с НКМЛЖ с исходно выраженным снижением фракции выброса (ФВ) ЛЖ и признаками его диссинхронии [15]. Это исследование показало пользу девайсной терапии не только у пациентов с низкой сократительной способностью ЛЖ, но и у определенной части (38%) пациентов с нормальной ФВ ЛЖ [15]. Ниже приводим описание клинического случая, посвященного диагностике и лечению некомпактной КМП у мужчины 46 лет, манифестировавшей в период пандемии новой коронавирусной инфекции.
Клиническое наблюдение
В декабре 2020 г. пациент, исходно считавший себя здоровым, стал отмечать одышку при интенсивных физических нагрузках. В этот период за медицинской помощью не обращался, одышка возобновлялась только при высокой физической активности. На протяжении последующих 6 мес. самочувствие пациента оставалось хорошим, симптомы заболевания не прогрессировали. 02.06.2021 г. получил первую дозу комбинированной векторной вакцины для профилактики коронавирусной инфекции COVID-19, а 23.06.2021 г. – вторую. В течение последующей недели после инъекции первой дозы вакцины усилилась одышка, снизилась толерантность к физической нагрузке, возникло чувство тяжести в левой половине грудной клетки, перебои в работе сердца, появились отеки на стопах и голенях. В связи с прогрессированием вышеуказанных симптомов 30.06.2021 г. пациент был осмотрен кардиологом, тогда же на электрокардиограмме (ЭКГ) выявлена синусовая тахикардия и полная блокада левой ножки пучка Гиса (ЛНПГ), по данным эхокардиографии (выполненной с низким качеством визуализации), отмечены: преобладание дилатации левых камер сердца (индекс объема левого предсердия 61 мл/м², индекс объема правого предсердия 38 мл/м², индекс конечно-диастолического объема ЛЖ 76,5 мл/м², передне-задний размер ПЖ 28 мм), выраженная диффузная гипокинезия миокарда ЛЖ с резким снижением глобальной сократимости (ФВ ЛЖ биплановым методом Симпсона 24%), незначительное снижение сократительной способности ПЖ (TAPSE 14), относительная недостаточность митрального и трикуспидального клапанов 2-й степени, легкая аортальная регургитация, диастолическая дисфункция ЛЖ 3-й степени (Ve/Va 3,4; E/e’ 19; скорость трикуспидальной регургитации 3,25 м/с), с формированием высокой легочной гипертензии (62 мм рт. ст.). Сложилось клиническое впечатление о СН на фоне предположительно ишемической болезни сердца (ИБС), была инициирована терапия в составе сартана, бета-блокатора и петлевого диуретика. Это привело к некоторому улучшению самочувствия в виде уменьшения одышки и периферических отеков.
21–23.07.2021 г. пациент был обследован в условиях клиники госпитальной терапии Военно-медицинской академии им. С.М. Кирова и АО «КардиоКлиника». Физикальный статус: состояние удовлетворительное, индекс массы тела 35 кг/м², визуально определялась отечность стоп и голеней, пульс 82 в 1 мин, аритмичный, артериальное давление (АД) 134/82 мм рт. ст., частота дыхания 16 в 1 мин, сатурация кислорода – 97%, признаки расширения перкуторных границ сердца, ослабление 1-го тона над верхушкой, акцент 2-го тона над легочной артерией, систолический шум митральной и трикуспидальной регургитации. Тест с 6-минутной ходьбой 290 м. Лабораторные показатели: мозговой натрийуретический пептид (BNP) 1120 пг/мл, тропонин Т 0,05 нг/мл, гемоглобин 165 г/л, тромбоциты 201 × 109 /л, креатинин 95 мкмоль/л, калий 4,51 ммоль/л, глюкоза 5,5 ммоль/л, общий белок 72 г/л, АЛТ 51 Ед/л, тиреотропный гормон 2,1 млЕд/л, Д-димер 230 мкг/мл. На ЭКГ – синусовый ритм, частота сердечных сокращений (ЧСС) 70 в 1 мин, признаки увеличения левого предсердия, полная блокада ЛНПГ (QRS 130 мс). Холтеровский мониторинг ЭКГ подтвердил наличие транзиторной полной блокады ЛНПГ, частой полиморфной желудочковой экстрасистолии. На рисунке 1 визуализируется транзиторная полная блокада ЛНПГ (сверху), парная полиморфная желудочковая экстрасистолия (снизу).
С целью исключения ИБС была выполнена компьютерная томографическая коронарная ангиография, выявлена солитарная плотная атеросклеротическая бляшка проксимального отдела передней межжелудочковой артерии, стенозирующая ее просвет на 20%. По данным эхокардиографии, было констатировано наличие неком-пактности ЛЖ (индекс R. Jenni = 2,3; индекс Chin 0,47) на фоне низкой сократительной его способности (ФВ 21%), умеренной дилатации всех полостей сердца. На рисунке 2 стрелками указано на гипертрабекулярность и глубокие лакуны нижней стенки (фрагмент А), верхушечного отдела межжелудочковой перегородки и губчатый миокард боковой стенки ЛЖ (фрагмент Б).
С целью подтверждения диагностической концепции была проведена магнитно-резонансная томография (МРТ) сердца с гадолиний-содержащим препаратом. Данные МРТ: все камеры сердца расширены; систолическая функция ЛЖ значительно снижена (ФВ 20%); признаков отека миокарда на Т2-взвешенных изображениях не выявлено; при оценке изображений отсроченного контрастирования во всех отделах ЛЖ определены множественные очаги фиброзных изменений по неишемическому типу, преимущественно интрамиокардиально и незначительно – в трабекулах некомпактного слоя миокарда; выявлена повышенная трабекулярность во всех апикальных сегментах и сегментах средних отделов (S7, S9–S17) ЛЖ; соотношение некомпактного и компактного миокарда ЛЖ в апикальных и средних отделах составило 20–17 мм/6–9 мм; сократительная способность ПЖ снижена (ФВ 31%); отмечена повышенная трабекулярность апикальных отделов ПЖ; тромбов в просвете желудочков не обнаружено.
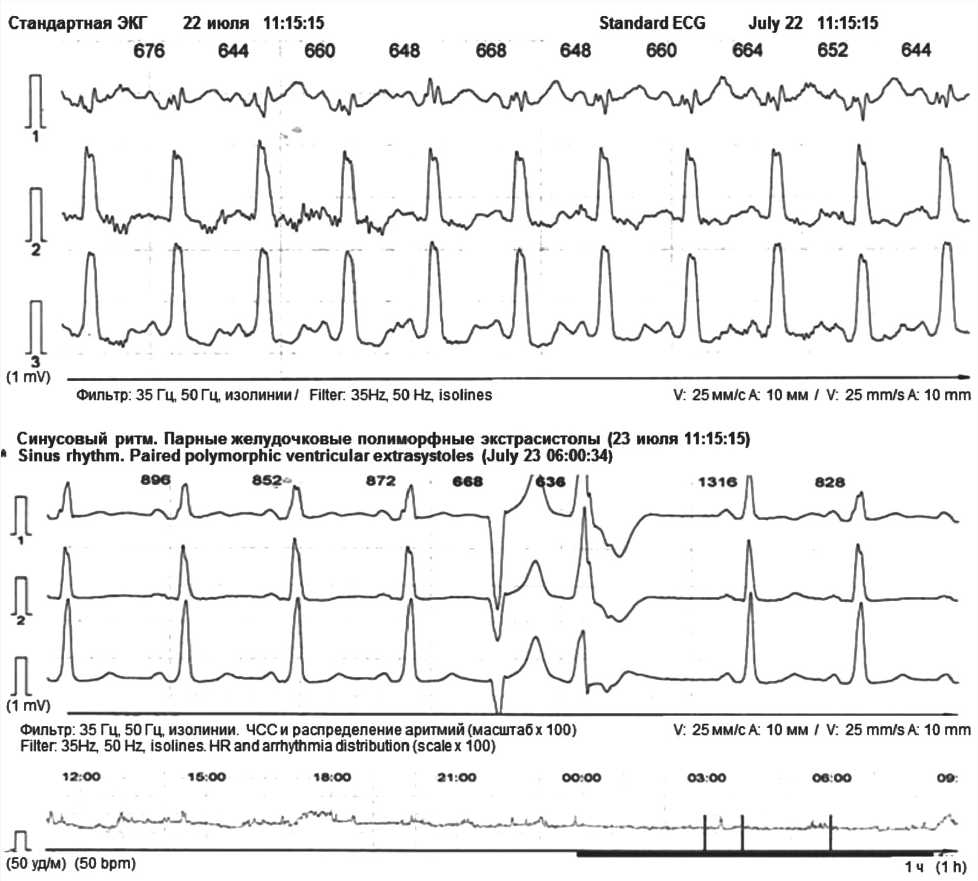
Рис. 1. Фрагменты суточного мониторинга ЭКГ по Холтеру (21–22.07.2021 г.)
Fig. 1. Fragments of 24-hour Holter ECG monitoring (July 21–22, 2021)
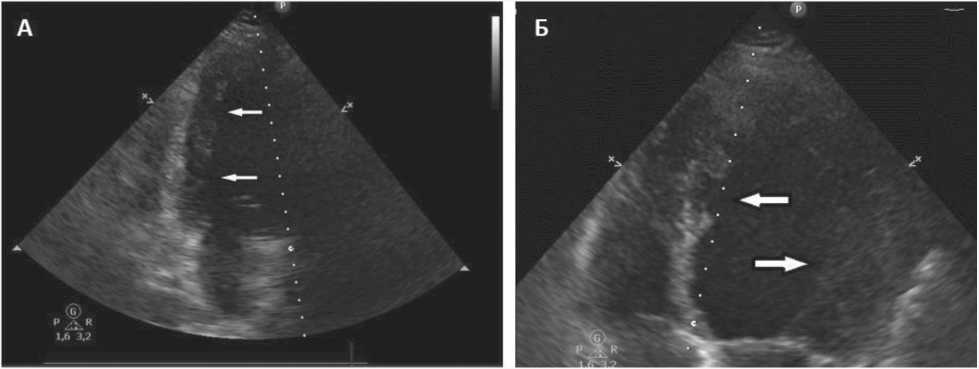
Рис. 2. Ультразвуковая картина некомпактного миокарда левого желудочка (21.07.2021 г.) Fig 2. Ultrasound picture of left ventricular noncompaction (July 21, 2021)
На рисунке 3 в двухкамерной (фрагмент А), четырехкамерной позициях по длинной оси (фрагмент Б), в сечении по короткой оси (фрагмент В) отражена гипер- трабекулярность миокарда ЛЖ (указано стрелками). Отношение некомпактного к компактному миокарду составило 3,75 (фрагмент В).
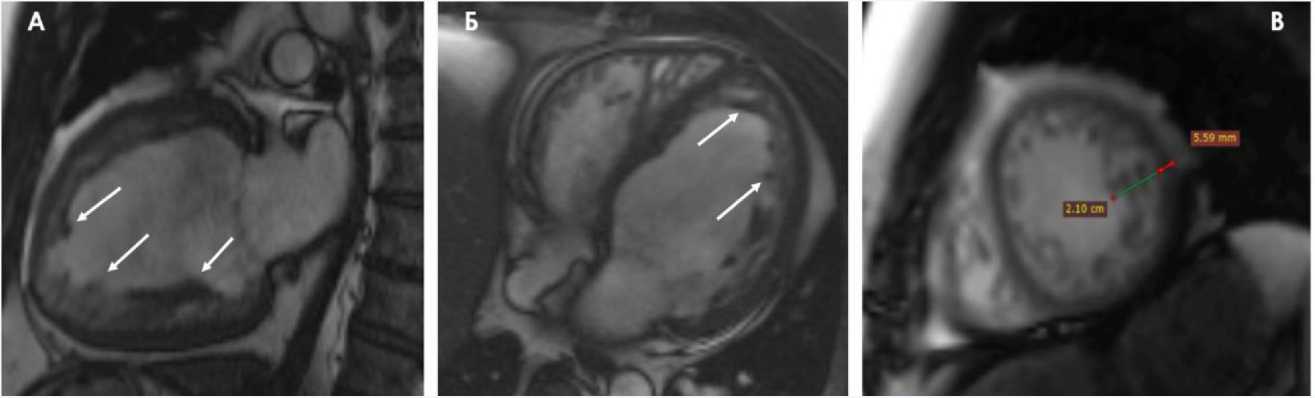
Рис. 3. Данные МРТ в двухкамерной позиции (А), четырехкамерной позиции по длинной оси (Б), в сечении по короткой оси (В). Бесконтрастное изображение подвижного миокарда (SSFP) в режиме «белой крови» в фазу диастолы (22.07.2021 г.)
Fig. 3. Magnetic resonance imaging data in a two-chamber position (A), a four-chamber position along the long axis (B), and in a section along the short axis (C). Non-contrast imaging of the mobile myocardium (SSFP) in the “white blood” mode in the diastole phase (July 22, 2021)
На рисунке 4 (фрагменты А–В) представлены изображения по короткой оси на уровне апикальных, средних и базальных отделов. Визуализируются множественные участки фиброза миокарда ЛЖ по неишемическому типу во всех отделах и в области трабекул губчатого миокарда (указано стрелками).
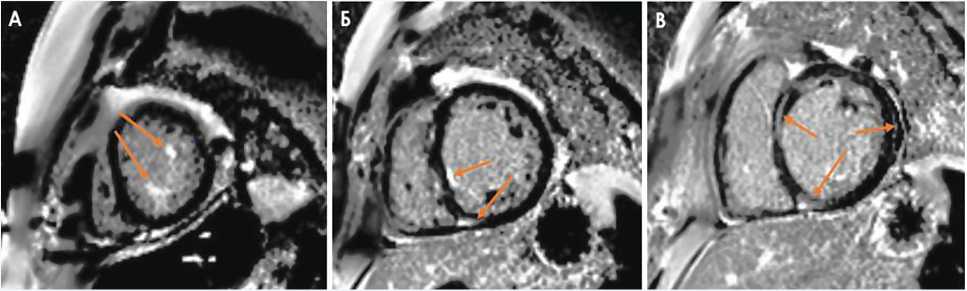
Рис. 4. Изображение позднего контрастирования миокарда на уровне апикальных (А), средних (Б) и базальных (В) отделов левого желудочка после внутривенного введения гадолиний-содержащего контрастного вещества (22.07.2021 г.)
Fig. 4. Images of late myocardial contrast enhancement at the levels of the apical (A), middle (B) and basal (C) sections of the left ventricle after intravenous administration of a gadolinium-containing contrast agent (July 22, 2021)
С учетом МР-признаков интрамиокардиального фиброза по истечении 5–6 нед. после яркой манифестации застойной СН, хронологически совпавшей с периодом вакцинации против новой коронавирусной инфекции, было предположено, что пациент «на ногах» перенес острый иммунный (?) миокардит на фоне НКМЛЖ с формированием поствоспалительного кардиосклероза. Таким образом, на основании клинико-анамнестических и лабораторно-инструментальных данных в период 21–23.07.2021 г. была оптимизирована диагностическая концепция: неклассифицируемая (некомпактная) кардиомиопатия; реконвалесценция после острого иммунного миокардита; транзиторная полная блокада ЛПНГ; частая полиморфная желудочковая экстрасистолия; СН III функционального класса.
Фармакотерапия заболевания была модифицирована в пользу комбинации: валсартан/сакубитрил 50 мг 2 раза в день, карведилол 12,5 мг 2 раза в день, эплеренон 50 мг 1 раз в день, эмпаглифлозин 10 мг 1 раз в день. Пациенту были даны рекомендации по соблюдению ограничительного режима физической активности, диеты, титрации доз препаратов под контролем кардиолога. В последующем пациент регулярно принимал назначенную нами стартовую терапию, однако по личным мотивам проигнорировал рекомендации по титрации доз названных препаратов.
Контрольный визит пациента в АО «КардиоКлиника» состоялся в декабре 2021 г. При осмотре был отмечен явный регресс признаков СН (исчезли одышка при низкой и умеренной физической активности, отеки нижних конечностей, увеличилась толерантность к физической нагрузке (тест с 6-минутной ходьбой 810 м), уровень BNP снизился до 123 пг/мл). В ходе тредмил-теста пациент достиг субмаксимальной ЧСС, освоив 8,5 METs. Данные стандартной ЭКГ (24.12.2021 г.); синусовый ритм с ЧСС 61 в 1 мин, отсутствие признаков полной блокады ЛНПГ (QRS 111 мс). По данным суточного мониторинга ЭКГ (19.12.2021 г.) также не выявлено эпизодов наруше- ний внутрижелудочковой проводимости, регрессировала практически до полного исчезновения желудочковая эктопическая активность.
При выполнении эхокардиографии было зарегистрировано явное улучшение систолической функции ЛЖ и ПЖ. На фоне уменьшения объема ЛЖ (индекс конечно-диастолического объема ЛЖ 68,9 мл/м²) был отмечен рост ФВ ЛЖ до 62% по Симпсону и до 55% в 3D-режиме, уменьшение митральной и трикуспидальной регургитации до 1-й степени, значительное улучшение диастолической функции ЛЖ. Субклиническая дисфункция ЛЖ проявлялась визуально отмечаемой легкой диффузной гипокинезией миокарда ЛЖ и снижением показателя глобальной продольной деформации ЛЖ в 2Д и 3Д (GLS 16%). Гипертрабекулярность по критериям T. Chin и R. Jenni была отмечена лишь в 2 верхушечных сегментах. Как следует из рисунка 5, в четырехкамерной позиции при апикальном сечении определяются трабекулы протяженностью до 22 мм (фрагмент А); на изображении из парастернального доступа по короткой оси в конечно-диастолическом кадре определяется двуслойная структура миокарда с компактным слоем до 7–8 мм и некомпактным (трабекулярном) слоем до 15 мм, максимально выраженным в области одного переднелатерального сегмента (фрагмент Б).
Вместе с тем на срединном уровне двуслойная структура миокарда оказалась не вполне очевидной. Так, расчет соотношения губчатого и плотного слоев на основе индекса R. Jenni (<2,0) в конечно-систолическом кадре не отражает, а на основе индекса T. Chin (<0,5) в конечно-диастолическом кадре, напротив, подтверждает наличие некомпактности миокарда ЛЖ. На рисунке 6 приведены изображения из парастернального доступа по короткой оси в конечно-диастолическом (фрагмент А) и конечно-систолическом (фрагмент Б) кадрах, которые указывают на несовпадение критериев некомпактности миокарда (не валидный для диагноза индекс R. Jenni = 1, валидный для диагноза индекс Т. Chin = 0,28). Известно, что у некоторых отдельно взятых пациентов из общей выборки лиц с НКМЛЖ эти критерии могут не совпадать [7], поэтому комплексный подход к оценке количественных критериев некомпактности представляется важным.
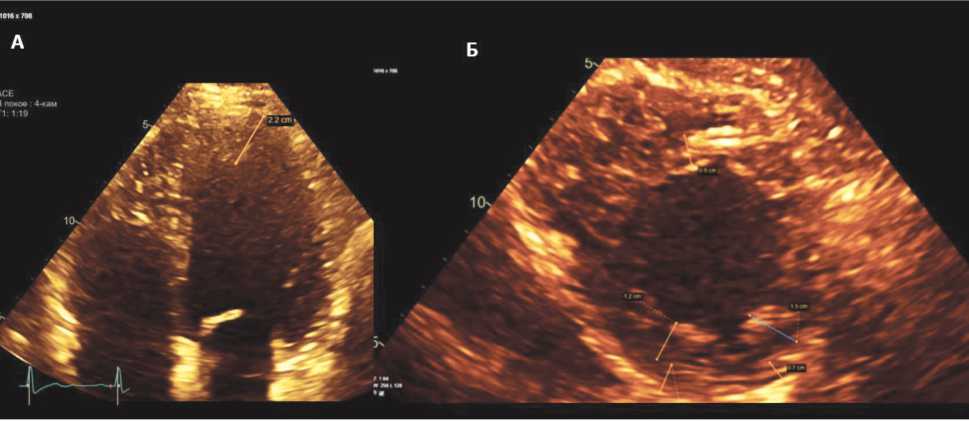
Рис. 5. Данные эхокардиографии при апикальном сечении (А) и из парастернального доступа по короткой оси (Б) на фоне регресса клинических проявлений сердечной недостаточности (24.12.2021 г.)
Fig. 5. Echocardiography data in the apical section (A) and from the parasternal approach along the short axis (B) against the background of regression of the clinical manifestations of heart failure (December 24, 2021)
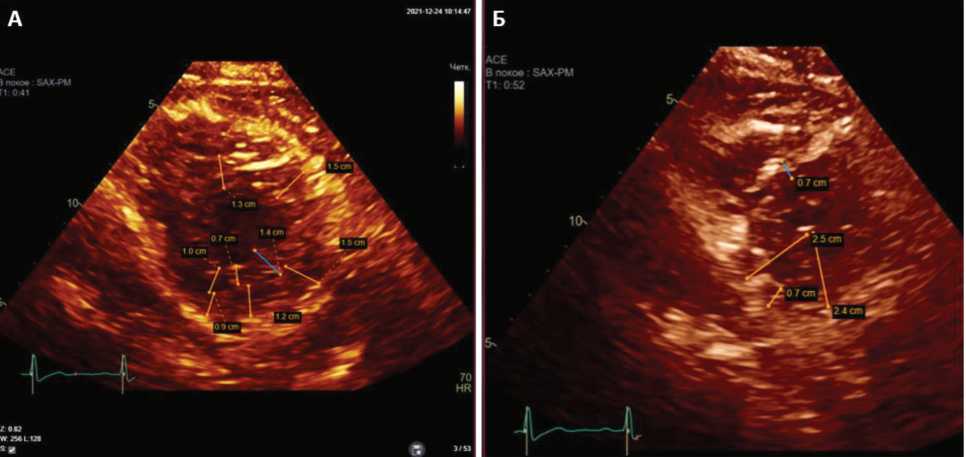
Рис. 6. Данные эхокардиографии из парастернального доступа по короткой оси в конечно-диастолическом (А) и конечно-систолическом (Б) кадрах на фоне регресса клинических проявлений сердечной недостаточности (24.12.2021 г.)
Fig. 6. Echocardiography data from parasternal short-axis access in end-diastolic (A) and end-systolic frames (B) against the background of regression of clinical manifestations of heart failure (December 24, 2021)
Таким образом, полученные данные позволили объективизировать регресс клинических проявлений СН, признаков некомпактности и электрической нестабильности миокарда у пациента 46 лет, на фоне современной патогенетической терапии.
Обсуждение
Литературные данные свидетельствуют о наиболее частой манифестации некомпактной кардиомиопатии у взрослых мужчин в возрастном диапазоне 40–50 лет. В приведенном клиническом случае постепенный дебют проявлений СН, обусловленной этой аномалией миокарда, соответствовал 45 годам. Фульминантное прогрессирование СН в сочетании с нарушениями сердечного рит- ма и проводимости возникло на фоне малосимптомного течения заболевания. Нельзя исключить взаимосвязь клинической декомпенсации с профилактической вакцинацией против новой коронавирусной инфекции.
К текущему моменту стали доступны немногочисленные описания острого миокардита после введения вакцины против новой коронавирусной инфекции. Анализ имеющихся данных, опубликованных в журнале Американской медицинской ассоциации (JAMA), показал, что частота ассоциированных с вакцинацией против COVID-19 миокардитов составляет 1,0 на 100 000 [95% ДИ: 0,61–1,54]. При этом из 20 пациентов с поствакци-национным миокардитом 11 (55%) были привиты вакциной mRNA-1273 (Moderna), а 9 (45%) – BNT162b2 (Pfizer/
BioNTech). Доля мужчин составила 75%, медиана возраста – 36 лет (межквартильный размах 26–48); медиана срока развития миокардита – 3,5 дня после вакцинации (межквартильный размах – 3,0–10,8). У 20% лиц симптомы миокардита появились после первого этапа вакцинации, у 80% – после второго. У 65% пациентов проявления миокардита разрешились с медианой в 23,5 дня (межквартильный размах – 4,8–41,3) после начала симптомов, а у остальных 35% за этот период отмечалось улучшение состояния [16].
Одна из патогенетических гипотез о механизме развития поствакцинального миокардита допускает аутоиммунный феномен [17]. Предполагается, что в роли триггера выступает так называемая молекулярная мимикрия, при которой вирусный антиген имеет сходство с белками миокарда. При аутореактивной сенсибилизации цитокины и лимфоциты мигрируют в интерстициальное пространство миокарда, вызывая воспалительную реакцию [18]. В соответствии с другой гипотезой возникновение миокардита после второй дозы вакцины обусловлено отсроченной реакцией гиперчувствительности (аналогичной таковой при сывороточной болезни). Еще одна гипотеза состоит в том, что после иммунизации медленно развивается эозинофильный миокардит [19].
В описанном нами случае симптомы декомпенсации СН появились приблизительно через 5–7 дней после введения первого компонента отечественной двухвекторной вакцины против COVID-19. В прогностическом аспекте наличие хронического кардиального заболевания у пациента с поствакцинационным миокардитом, безусловно, представляется неблагоприятным фактором, увеличивающим сроки регресса вновь появившихся (либо усилившихся) симптомов поражения сердца. Суждение о перенесенном остром миокардите на фоне вакцинации против COVID-19 высказано нами ретроспективно на основе клинико-анамнестического анализа всей ситуации, а также данных инструментальных исследований (прежде всего, МРТ сердца). Более веские доказательства воспаления сердечной мышцы могли бы быть получены в острой фазе патологического процесса при выполнении МРТ сердца и прижизненной биопсии миокарда.
Ретроспективно о перенесенном миокардите можно судить по наличию МР-признаков позднего накопления гадолиния. Вместе с тем у пациентов с некомпактной КМП имеются определенные трудности в интерпретации подобных МР-изменений, поскольку показано, что не только трабекулы, но и плотный слой миокарда могут отсроченно накапливать этот контраст. Позднее накопление гадолиния в субэндокардиальном, интрамиокарди-альном и субэпикардиальном отделах миокарда считается признаком миокардиального фиброза, наблюдаемого при различных врожденных и приобретенных КМП [20].
По имеющимся единичным данным, латентное течение НКМЛЖ может трансформироваться в манифестное при развитии у такого пациента миокардита, обусловленного вирусной, в частности, новой коронавирусной инфекцией [6]. Логично предположить, что развитие миокардита может обнажить проблему латентно существующей некомпактной КМП. По мере разрешения воспалительного процесса в миокарде наблюдается и регресс его некомпактности. Вопрос о дальнейшем хроническом течении НКМЛЖ в данном случае остается открытым. Очевидно, пациенту показаны меры, направленные на профилактику дальнейшего ремоделирования и прогрессирования хронической СН с применением поддерживающих доз патогенетически значимых препаратов.
Заключение
Приведенный клинический случай отражает роль острого поствакцинального миокардита как триггера манифестации исходно малосимптомной некомпактной кардиомиопатии. Применение современных неинвазивных диагностических кардиовизуализирующих методик с последующим комплексным фармакотерапевтическим подходом обеспечило достоверное улучшение течения заболевания с уменьшением признаков некомпактности миокарда ЛЖ. Проблема своевременной диагностики и оказания специализированной и высокотехнологичной помощи пациентам с некомпактным миокардом продолжает оставаться актуальной, мало освещенной в рекомендательных документах и не вполне понятой для практикующих врачей.
Список литературы Случай клинической манифестации неклассифицируемой кардиомиопатии в период новой коронавирусной пандемии
- Maron B.J., Towbin J.A., Thiene G., Antzelevitch C., Corrado D., Arnett D. et al. Contemporary definitions and classification of the cardiomyopathies. Circulation 2006;113(14):1807-1816. DOI: 10.1161/CIRCULATIO-NAHA.106.174287.
- Elliott P., Andersson B., Arbustini E., Bilinska Z., Cecchi F., Charron P. et al. Classification of the cardiomyopathies: a position statement from the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J. 2008;29(2):270-276. DOI: 10.1093/ eurheartj/ehm342.
- Arbustini E., Narula N., Dec G.W., Reddy K.S., Greenberg B., Kush-waha S. et al. The MOGE(S) classification for a phenotype-geno-type nomenclature of cardiomyopathy: endorsed by the World Heart Federation. J. Am. Coll. Cardiol. 2013;62(22):2046-2072. DOI: 10.1016/j.jacc.2013.08.1644.
- Gati S., Papadakis M., Van Niekerk N., Reed M., Yeghen T., Sharma S. Increased left ventricular trabeculation in individuals with sickle cell anaemia: Physiology or pathology? Int. J. Cardiol. 2013;168(2):1658-1560. DOI: 10.1016/j.ijcard.2013.03.039.
- Stahli B.E., Gebhard C., Biaggi P., Klaassen S., Valsangiacomo Buec-hel E. et al. Left ventricular non-compaction: prevalence in congenital heart disease. Int. J. Cardiol. 2013;167(6):2477-2481. DOI: 10.1016/j. ijcard.2012.05.095.
- Bonnet M., Craighero F., Harbaoui B. Acute myocarditis with ventricular noncompaction in a COVID-19 patient. JACC Heart Fail. 2020;8(7):599-600. DOI: 10.1016/jjchf.2020.05.004.
- Gerecke B.J., Engberding R. Noncompaction cardiomyopathy -history and current knowledge for clinical practice. J. Clin. Med. 2021;10(11):2457. DOI: 10.3390/jcm10112457.
- Murphy R.T., Thaman R., Blanes J.G., Ward D., Sevdalis E., Papra E. et al. Natural history and familial characteristics of isolated left ventricular noncompaction. Eur. Heart J. 2005;26(2):187-192. DOI: 10.1093/ eurheartj/ehi025.
- Chin T.K., Perloff J.K., Williams R.G., Jue K., Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation. 1990;82(2):507-513. DOI: 10.1161/01.cir.82.2.507.
- Jenni R., Oechslin E., Schneider J., Attenhofer Jost C., Kaufmann P.A. Echocardiographic and pathoanatomical characteristics of isolated left ventricular noncompaction: a step towards classification as a distinct cardiomyopathy. Heart. 2001;86(6):666-671. DOI: 10.1136/heart.86.6.666.
- Petersen S.E., Selvanayagam J.B., Wiesmann F., Robson M.D., Francis J.M., Anderson R.H. et al. Left ventricular noncompaction: insights from cardiovascular magnetic resonance imaging. J. Am. Coll. Cardiol. 2005;46(1):101-105. DOI: 10.1016/j.jacc.2005.03.045.
- Grothoff M., Pachowsky M., Hoffmann J., Posch M., Klaassen S., Lehmkuhl L. et al. Value of cardiovascular MR in diagnosing left ventricular noncompaction cardiomyopathy and in discriminating between other cardiomyopathies. Eur. Radiol. 2012;22(12):2699-2709. DOI: 10.1007/ s00330-012-2554-7.
- Engberding R., Stoellberger C., Fehske W., Gietzelt M., Haux R., Gerecke B.J. Predictors of adverse cardiac events in noncompaction cardiomyopathy: Data from the german noncompaction registrY (ALKK). J. Am. Coll. Cardiol 2014;63(12_S):A1274. DOI: 10.1016/S0735-1097(14)61274-2.
- Kobza R., Jenni R., Erne P., Oechslin E., Duru F. Implantable cardioverter-defibrillators in patients with left ventricular noncompaction. Pacing. Clin. Electrophysiol. 2008;31(4):461-467. DOI: 10.1111/j.1540-8159.2008.01015.x.
- Kobza R., Steffel J., Erne P., Schoenenberger A.W., Hurlimann D., Luscher T.F. et al. Implantable cardioverter-defibrillator and cardiac resynchronization therapy in patients with left ventricular non-compaction. Heart Rhythm. 2010;7(11):1545-1549. DOI: 10.1016/j. hrthm.2010.05.025.
- Diaz G.A., Parsons G.T., Gering S.K., Meier A.R., Hutchinson I.V., Ro-bicsek A. Myocarditis and pericarditis after vaccination for COVID-19. JAMA. 2021;326(12):1210-1212. DOI: 10.1001/jama.2021.13443.
- D'Angelo T., Cattafi A., Carerj M.L., Booz C., Ascenti G., Cicero G. et al. Myocarditis after SARS-CoV-2 vaccination: A vaccine-induced reaction? Can. J. Cardiol. 2021 ;37(10):1665-1667. DOI: 10.1016/j. cjca.2021.05.010.
- Nagano N., Yano T., Fujita Y., Muranaka A., Kokubu N., Miura T. Hemodynamic collapse after influenza vaccination: A vaccine-induced fulminant myocarditis? Can. J. Cardiol. 2020;36(9):1554.e5-1554.e7. DOI: 10.1016/j.cjca.2020.05.005.
- Yamamoto H., Hashimoto T., Ohta-Ogo K., Ishibashi-Ueda H., Imana-ka-Yoshida K., Hiroe M. et al. A case of biopsy-proven eosinophilic myocarditis related to tetanus toxoid immunization. Cardiovasc. Pathol. 2018;37:54-57. DOI: 10.1016/j.carpath.2018.10003.
- Vullaganti S., Levine J., Raiker N., Syed A.A., Collins J.D., Carr J.C. et al. Fibrosis in hypertrophic cardiomyopathy patients with and without sarcomere gene mutations. Heart Lung Circ. 2021;30(10):1496-1501. DOI: 10.1016/j.hlc.2021.04.008.


