Собственный опыт применения эрибулина в условиях реальной клинической практики г. Москвы и Московской области
Автор: Марфутов В.В., Филоненко Д.В., Белоногов А.В., Андреяшкина И.И., Бяхов А.В., Крамская Л.В., Карандеева Т.В., Мехтиев В.Н., Оскирко Д.А., Суслова И.Р., Скорина М.О., Романчук О.В., Самышина М.А., Шикина В.Е., Козлов Д.В., Хрупало О.В., Тювинова Е.В., Шерстнев В.М., Чернов И.С., Колоколов Д.Д., Коноплева Е.И.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.8, 2018 года.
Бесплатный доступ
Введение. Эрибулин - ингибитор динамики микротрубочек нетаксанового ряда, зарегистрирован в России для пациентов с местнораспространенным или метастатическим раком молочной железы (мРМЖ), получившим ранее не менее одного режима химиотерапии по поводу распространенного заболевания; предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания, за исключением тех пациентов, которым не могли назначаться данные препараты. В настоящей работе представлен собственный опыт применения эрибулина в условиях реальной клинической практики г. Москвы и Московской области. Пациенты и методы. Проведен ретроспективный анализ опыта применения эрибулина в г. Москве и Московской области у 202 пациентов с мРМЖ с января 2016 по февраль 2017 г. для оценки эффективности и безопасности препарата. Все больные получили предшествующую терапию с использованием антрациклинов и таксанов по поводу местнораспространенного и / или метастатического рака...
Эрибулин, метастатический рак молочной железы, опыт применения, безопасность, эффективность, реальная клиническая практика
Короткий адрес: https://sciup.org/140243784
IDR: 140243784 | DOI: 10.18027/2224-5057-2018-8-2-21-30
Текст научной статьи Собственный опыт применения эрибулина в условиях реальной клинической практики г. Москвы и Московской области
Введение ваний у женщин на протяжении десятилетий [1]. Основной причиной высокой смертности от рака молочной железы Рак молочной железы занимает первое место в струк- является выявление болезни на поздних стадиях, что тре-туре заболеваемости среди злокачественных новообразо- бует системного подхода в лечении. Хирургический этап в составе комплексной терапии диссеминированного рака молочной железы, как правило, сводится к санирующим операциям при распаде опухоли. Лучевая терапия применяется с паллиативной целью в случаях развития болевого синдрома на фоне метастазов в кости. Химиотерапия остается ведущим методом лечения диссеминированной болезни и направлена на улучшение качества жизни и увеличение ее продолжительности.
Не существует стандартных подходов к проведению 2-й и последующих линий химиотерапии метастатического рака молочной железы [2]. Основной задачей для онколога является индивидуальное планирование программы поэтапной химио-гормонотерапии, таргетного лечения с учетом фенотипа опухоли, а также особенностей метастазирования для обеспечения максимально возможной длительности контроля над болезнью и приемлемой переносимости.
Интерес представляет препарат эрибулин, являющийся ингибитором динамики микротрубочек нетаксано-вого ряда, синтетически полученный алкалоид галихон-дрин Б (halichondrin B), изолированный из морской губки Halichondria okadai. Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредо-ванный антимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M (стадии клеточного цикла GAP 2/митоза) и нарушению формирования митотических веретен, что в итоге приводит к апоптотической гибели клетки в результате длительной блокировки митоза [3–6]. Эрибулин также воздействует на микроокружение опухоли и ее фенотип с помощью механизмов, не связанных с его антимитотическим эффектом. Эти дополнительные эффекты изучены в экспериментальных работах и включают ремоделирование сосудистого русла опухоли, при котором улучшается перфузия ее центральной части, снижается гипоксия; при этом наблюдается фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимальной трансформации [7, 8].
В исследовании EMBRACE эрибулин продемонстрировал достоверное увеличение медианы общей выживаемости (ОВ) у больных, получивших минимум две линии лечения, по сравнению с терапией по выбору врача (вино-релбин, капецитабин, гемцитабин и др.): 13,2 мес. против 10,5 мес. (p=0,014) [9]. В исследовании 301 при сравнении с капецитабином преимущество эрибулина в ОВ в 1,4 мес. не достигло статистической значимости (р=0,056) [10].
При проведении объединенного анализа двух крупных рандомизированных исследований (EMBRACE и 301) были исключены пациенты, получившие в рамках исследования 1-ю линию химиотерапии по поводу распространенного заболевания. В группу эрибулина были включены 946 пациентов, в группу контроля (терапия по выбору врача из EMBRACE и капецитабин из 301 исследования) – 698 пациентов. Эрибулин достоверно увеличивал медиану общей выживаемости (ОВ) пациентов с мРМЖ по сравнению с группой контроля: 15 мес. против 12,6 мес., p=0,002. Наибольшее преимущество по показателю общей выживаемости было продемонстрировано в подгруппах с HER2-отрицательным мРМЖ (15,1 мес. против 12,0 мес., p<0,001) и с тройным отрицательным мРМЖ (12,4 мес. против 8,1 мес., p=0,005) [11].
Более раннее назначение эрибулина по сравнению с другими вариантами терапии обеспечивает максимальное увеличение общей выживаемости больных мРМЖ. В исследовании EMBRACE, в рамках которого эрибулин сравнивался с монотерапией по выбору врача, было показано, что у пациенток, ранее получивших не более трех схем химиотерапии, включая неоадъювантные режимы, медиана ОВ в группе эрибулина достигла 13,3 мес., в то время как в более интенсивно предлеченной подгруппе (>3 схем химиотерапии в анамнезе) этот показатель составил 11,7 мес. [12].
Опубликованный в 2018 г. подгрупповой анализ в рамках исследования 301 продемонстрировал преимущество эрибулина по сравнению с капецитабином во 2-й линии терапии HER2-отрицательного мРМЖ [13]. Из 1102 пациентов, включенных в исследование 301, в данный поданализ попали 392 (36%) пациента с HER2-отрицательным мРМЖ, получавших терапию во 2-й линии. Медиана ВБП, по данным исследователей, не различалась между группами эрибулина и капецитабина (4,2 мес. по сравнению с 4,0 мес. соответственно; ОР 0,86; 95% ДИ 0,69–1,08; р=0,192). ЧОО также была сопоставима (9,7% в группе эрибулина по сравнению с 8,7% в группе капецитабина; р=0,86). При этом в подгруппе пациентов с HER2-отри-цательным мРМЖ, получавших препараты сравнения во 2-й линии терапии, было продемонстрировано преимущество эрибулина по показателю ОВ в сравнении с ка-пецитабином (16,1 мес. по сравнению с 13,5 мес. соответственно; ОР 0,77; 95% ДИ 0,62–0,97; р=0,026) [13].
Особого внимания заслуживает профиль переносимости и безопасности эрибулина. Нейтропения и периферическая полинейропатия являются наиболее частыми нежелательными явлениями при терапии эрибулином (по данным инструкции по применению, все степени нейтропении и полинейропатии регистрируются в 53,6 и 35,9% случаев соответственно) [14].
Частота развития нейтропении 3–4 степеней тяжести при применении эрибулина составляет 46%, при этом данное нежелательное явление является обратимым и некумулятивным [14]. Среднее время до восстановления после тяжелой нейтропении составляет 8 дней. Только в 1% случаев выраженная нейтропения приводила к отмене терапии эрибулином [14].
Частота развития периферической полинейропатии 3–4 степеней тяжести при применении эрибулина составляет 7,4%. Медиана времени до развития периферической нейропатии 2-й степени тяжести составляет 13 недель (что эквивалентно четырем циклам терапии эрибули-на) [14]. В клинических исследованиях продемонстрировано, что у пациентов, имевших нейропатию в анамнезе, отсутствовал риск развития новых или ухудшения уже имеющихся симптомов при лечении эрибулином по сравнению с пациентами, не имевшими данных нарушений до назначения препарата [14].
Кроме рандомизированных исследований, большую ценность для клиницистов представляют наблюдательные программы, помогающие оценить воспроизводимость результатов, ранее полученных в рамках крупных клинических исследований, в рутинной клинической практике. Данные об эффективности и переносимости эрибу-лина в рутинной клинической практике были получены в разных странах, в том числе и в России [15–18].
Важно отметить, что в реальной клинической практике хорошая переносимость эрибулина была под- тверждена в рамках исследования у больных разных возрастных групп, включая пожилых пациентов. По данным исследования с включением 476 пациенток с мРМЖ (из них 48 старше 70 лет), эффективность препарата не зависела от возраста больных: показатели ВБП и ОВ были сопоставимы в сравниваемых группах [19].
На основании полученных данных был сделан вывод, что эрибулин является эффективным препаратом для лечения мРМЖ с управляемым профилем токсичности, доказавшим эти результаты в крупных рандомизированных исследованиях, что также подтверждают данные из реальной клинической практики. С учетом всего вышеперечисленного большой интерес представляет получение и анализ собственного опыта использования эрибулина. В данной работе представлен опыт применения препарата эрибулин в условиях реальной клинической практики г. Москвы и Московской области.
Пациенты и методы
Проведен ретроспективной анализ эффективности и безопасности применения эрибулина в восьми лечебных учреждениях г. Москвы и Московской области в условиях рутинной клинической практики. Анализ данных охватывает период с января 2016 по февраль 2018 г. В анализ включены 202 пациента с морфологически верифицирован-
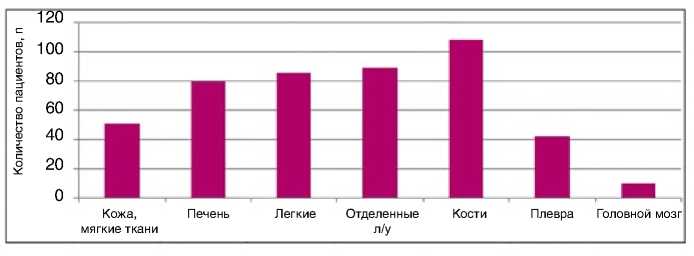
Рисунок 1. Локализация метастазов РМЖ у пациенток, получивших терапию эрибу-лином (n=202)
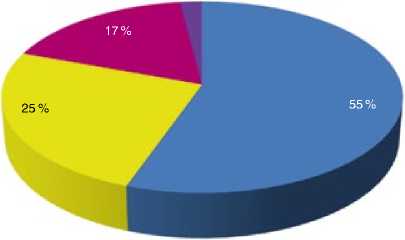
■ Люминальный
Тройной негативный
■ HER2-положительный
■ Нет данных
Рисунок 2. Распределение больных по подтипам мРМЖ (n=202)
ным мРМЖ, которые получили лечение эрибулином. Все больные имели гистологическую верификацию диагноза, удовлетворительную функцию печени, почек и костного мозга, статус по шкале ECOG от 0 до 3. Все пациенты получили предшествующую терапию с использованием антра-циклинов и таксанов по поводу местнораспространенного и/или метастатического рака. Биологический подтип опухоли определялся по данным иммуногистохимического исследования.
Больным проводилась терапия эрибулином в дозе 1,4 мг/м2 внутривенно 2–5 мин. в 1-й и 8-й дни 21-дневного курса. В случае развития клинически значимой токсичности принималось решение о редукции дозы эрибу-лина до 1,1 мг/м2 и далее до 0,7 мг/м2 согласно инструкции по применению препарата. Терапия эрибулином проводилась до прогрессирования заболевания, развития неприемлемой токсичности или отказа пациентки от продолжения лечения. По показаниям проводилась сопроводительная терапия (включая колониестимулирующие факторы, эритропоэтины и т. д.). Стоит отметить, что большая часть пациенток получала терапию в условиях дневного стационара.
Средний возраст пациенток составил 58 лет (28–81). Объективный статус по шкале ECOG 0–1 имели 100 из 123 (81,3%) проанализированных пациенток, ECOG 2–3 – 23 из 123 (18,7%). Среднее число пораженных зон составило 2, в диапазоне от 1 до 5. У 75 (37,1%) пациенток
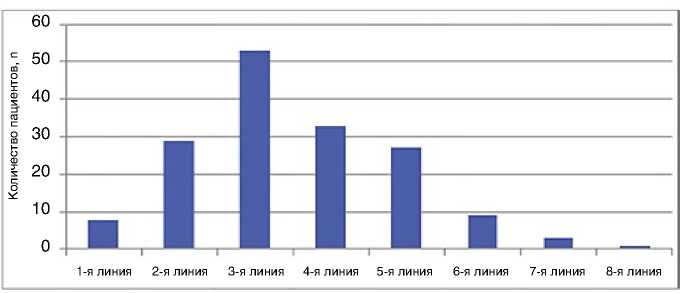
Рисунок 3. Линии химиотерапии назначения эрибулина у пациенток с HER2 (-) мРМЖ (n=163, 81%)
Под полной регрессией (ПР) подразумевалось полное исчезновение всех проявлений болезни; под частичной регрессией (ЧР) – уменьшение очагов (в наибольшем измерении) более чем на 30%; под стабилизацией заболевания (СЗ) – уменьшение очагов менее чем на 30% либо рост очагов не более чем на 20%; под прогрессированием заболевания (ПЗ) – рост очагов более чем на 20% либо появление новых очагов.
Частота объективного ответа
Таблица 1. Эффективность терапии эрибулином при HER2 (-) мРМЖ (n=153)
|
Параметр |
Значение |
|
Полная регрессия |
3 (2 %) |
|
Частичная регрессия, n (%) |
24 (15,7 %) |
|
Стабилизация заболевания, n (%) |
89 (58,2 %) |
|
Стабилизация заболевания > 6 мес., n (%) |
28 (18,3 %) |
|
Прогрессирование заболевания, n (%) |
37 (24,1 %) |
|
Медиана ВБП, мес., (95% ДИ) |
4,76 (2,97–6,87) |
на начало терапии определялось более двух метастатических очагов. Висцеральные метастазы отмечались у 130 (64,4%) больных. Локализация метастазов была различной, включая метастазы в головной мозг в 10% случаев. Распределение метастазов по органам указано на рис. 1.
Ранее пациентки получали химиотерапию как в адъювантном режиме, так и по поводу метастатического заболевания. Медиана числа предшествующих линий химиотерапии по поводу метастатического заболевания составила 2 (диапазон 0–7). Антрациклины и таксаны получили 129 из 141 пациентов (94,3%), только антрациклины – 2 пациента из 141 (1,5%), только таксаны – 6 из 141 пациентов (4,2%), капецитабин в анамнезе был у 92 из 141 пациентов (65%).
Распределение больных (n=202) по подтипам мРМЖ указано на рис. 2.
Большинство пациенток, 112 (55%), имели люминальный фенотип опухоли, 51 (25%) пациентка – тройной негативный (ТН) фенотип, 35 (17%) – HER2-положительный. У 4 (2%) больных рецепторный статус был неизвестен.
Статистический анализ
Целью данного ретроспективного анализа являлась оценка эффективности и безопасности применения эри-булина в условиях реальной клинической практики лечебных учреждений г. Москвы и Московской области. Для оценки эффективности использовались следующие критерии: 1) частота объективного ответа (ЧОО); 2) контроль роста опухоли (КРО); 3) выживаемость без прогрессирования (ВБП). Отдаленные результаты лечения, такие как одногодичная, трех-, пятилетняя выживаемость, общая выживаемость (ОВ), в нашем анализе не оценивались.
Для оценки противоопухолевого ответа применялись различные методы диагностики, рутинно используемые в клинической практике, такие как ультразвуковое исследование (УЗИ), маммография, компьютерная томография (КТ), магнитно-резонансная томография (МРТ).
(ЧОО) – сумма полных и частичных регрессий. Частота клинической эффективности (ЧКЭ) – сумма полных и частичных регрессий и стабилизации заболевания более 6 мес. Контроль роста опухоли (КРО) – сумма полных, частичных регрессий, а также стабилизации заболевания вне зависимости от длительности. Выживаемость без прогрессирования измерялась от даты начала терапии до прогрессирования или смерти больного и рассчитывалась по методу Каплан – Майера. Оценка безопасности лечения осуществлялась согласно критериям NCI-CTC.
Результаты. Эффективность
В самой многочисленной группе с HER2-отрицатель-ным мРМЖ (81%, n=163) пациентки получали эрибулин, начиная с 1-й и заканчивая 8-й линией терапии мРМЖ. Большинство из них (52%) получили эрибулин в 3-й линии (рис. 3). Медиана числа курсов эрибулина составила 4, также выявлялись пациентки с длительным контролем над заболеванием, получившие 17 курсов.
Эффективность терапии эрибулином при HER2-отри-цательном мРМЖ оценена у 153 больных. Полная регрессия отмечена у 3 (2%); частичная регрессия – у 24 (15,7%); стабилизация заболевания достигнута у 89 (58,2%) пациенток, из них более 6 мес. она отмечалась у 28 (18,3%). Прогрессирование заболевания было отмечено у 37 (24,1%) пациенток. Медиана ВБП составила 4,76 мес. (95% ДИ 2,97–6,87), частота объективного ответа – 17,7%, контроль роста опухоли – 75,9% (табл. 1).
Проанализирована эффективность эрибулина в зависимости от линии химиотерапии. У больных, получавших препарат на более ранних этапах лечения, объективный ответ регистрировался в два раза чаще по сравнению с пациентами, получавшими препарат в поздних линиях (рис. 4).
При проведении анализа эффективности эрибулина в зависимости от фенотипа HER2-отрицательного мРМЖ среди пациенток с люминальным фенотипом опухоли (n=106) у двух больных (2%) зарегистрирована полная
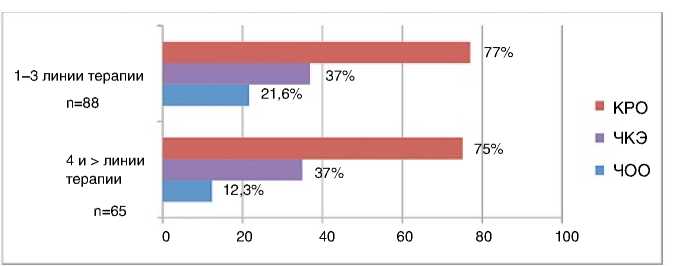
Рисунок 4. Эффективность эрибулина при мРМЖ при HER2 (-) мРМЖ (n=153) в зависимости от линии терапии
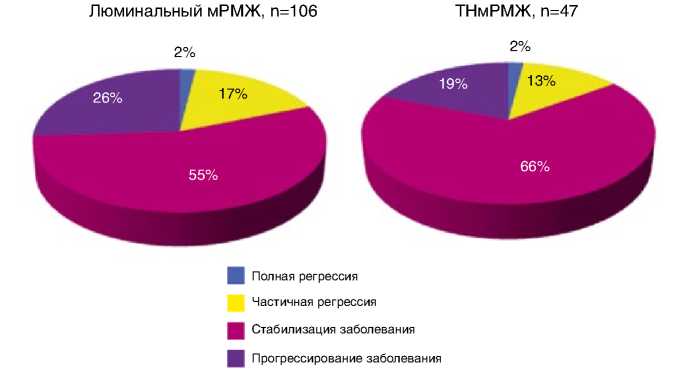
Рисунок 5. Частота ответов на терапию эрибулином в зависимости от подтипа HER2 (-) (n=153)
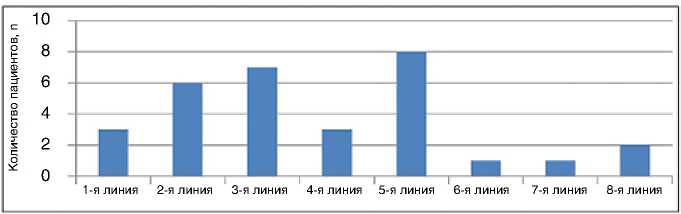
Рисунок 6. Линии химиотерапии эрибулином у пациенток с HER2-положительным мРМЖ (n=35)
регрессия опухоли, у 18 пациенток (17%) отмечены частичные ремиссии, у 58 (55%) – стабилизация, у 28 (26%) – прогрессирование заболевания.
Среди пациенток с тройным негативным фенотипом опухоли (n=47) у одной (2%) наблюдалась полная регрессия опухоли, у шести (13%) отмечена частичная регрессия, у 31 (66%) – стабилизация и у 9 (19%) – прогрессирование заболевания (рис. 5).
Следует отметить, что при сравнении медианы ВБП больных люминальным HER2-отрицательным и тройным отрицательным мРМЖ статистически достоверной разницы не достигнуто: 4,84 мес. (95% ДИ 2,8–6,98) и 4,64 мес. (95% ДИ 3,14–6,6) соответственно, р=0,072.
Среди пациенток с HER2-положи-тельным мРМЖ (n=35) количество проведенных курсов эрибулина варьировало от 2 до 27, медиана составила 5. При этом монотерапия эри-булином проводилась у 13 больных (37,2%), в комбинации с трастузумабом препарат получили 22 пациентки (62,8%). Больным HER2-положи-тельным мРМЖ эрибулин назначали в 1–8 линиях терапии, большинству (23%) – в 5-й линии (рис. 6).
Эффективность терапии эрибу-лином при HER2-положительном мРМЖ оценивалась у 35 больных. Полных регрессий не выявлено. Частичная регрессия достигнута у двух (5,7%), стабилизация заболевания – у 16 (45,7%) пациенток, из них длительная стабилизация (более 6 мес.) отмечалась у 8 (22,8%) больных. Прогрессирование заболевания было отмечено у 17 (48,6%) пациенток. Медиана ВБП составила 3,98 мес. (95% ДИ 2,23–6,0), частота объективного ответа – 15,7%, контроль роста опухоли – 51,4% (табл. 2).
Также был проведен анализ эффективности эрибулина у больных HER2-положительным мРМЖ (n=35) в зависимости от наличия или отсутствия в терапии трастузумаба. Отмечено значимое преимущество ВБП при назначении эрибулина в комби-
Таблица 2. Распределение пациенток по эффективности лечения эрибулином при HER2 (+) мРМЖ (n=35)
|
Параметр |
Значение |
|
Полная регрессия |
– |
|
Частичная регрессия, n (%) |
24 (15,7 %) |
|
Стабилизация заболевания, n (%) |
16 (45,7 %) |
|
Стабилизация заболевания > 6 мес., n (%) |
8 (22,8 %) |
|
Прогрессирование заболевания, n (%) |
17 (48,6 %) |
|
Медиана ВБП, мес. (95% ДИ) |
3,98 (2,23–6,0) |
Монотерапия эрибулином Эрибулин + трастузумаб
ВБП (Каплан-Мейер)
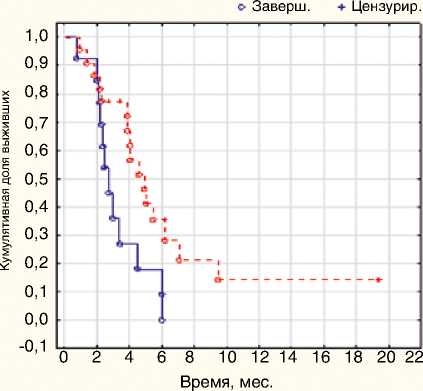
нации с трастузумабом в сравнении с монотерапией эри-булином: 4,64 мес. (95% ДИ 2,94–6,6) и 2,58 мес. (95% ДИ 2,15–3,6) соответственно, р=0,021 (рис. 7).
С целью определения клинических предикторов эффективности терапии эрибулином проведено сравнение ВБП в зависимости от возраста: у больных до 50 лет и старше 50 лет достоверной разницы не выявлено (медиана ВБП 4,81 мес. (95% ДИ 3,27–6,51) и 4,65 мес. (95% ДИ 1,94–7,1) соответственно, p=0,19. Также не выявлено разницы в сравнении ВБП при терапии эрибулином в зависимости от локализации метастазов, поражения висцеральных органов. Дальнейший поиск возможных клинических предикторов эффективности эрибулина будет возможен при включении в анализ большего количества пациентов.
Безопасность
Эрибулин имел управляемый профиль безопасности. Наиболее клинически значимыми видами токсичности (3–4 степень) были нейтропения, лейкопения, полинейропатия. Нейтропения 3–4 степеней наблюдалась у 21 (10,4%) пациента, лейкопения 3–4 степеней – у 10 (4,6%), полинейропатия 3–4 степеней – у 7 (3,5%). Из 202 больных терапия отменена по причине нежелательных явлений только у трех (1,5%).
Таким образом, проведенный ретроспективный анализ данных, которые были получены из рутинной клинической практики, подтвердил эффективность эрибулина при лечении пациентов с различными биологическими подтипами мРМЖ: в качестве монотерапии – в случае HER2-отрицательного и тройного отрицательно фенотипа, в комбинации с трастузумабом – при HER2-поло-жительном мРМЖ. Помимо увеличения ОВ, важными факторами эффективности проводимого лечения
Рисунок 7. Эффективность эрибулина при HER2 (+) мРМЖ в зависимости от наличия трастузумаба (n=35)
данным цитостатиком являются удовлетворительная переносимость препарата, удобство применения (короткая в/в инфузия), возможность двухступенчатой редукции дозы, что позволяет увеличить приверженность пациентов к терапии и максимально использовать потенциальный химиотерапевтический эффект эрибулина.
Полученные и описанные выше результаты способствуют дальнейшему изучению эрибулина при мРМЖ в рутинной клинической практике, в том числе поиску возможных клинических предикторов эффективности эрибулина.
Данная публикация подготовлена при финансовой поддержке компании «Эйсай». Авторы несут полную ответственность за содержание публикации и редакционные решения.
Александр В. Белоногов, к. м. н., зав. дневным стационаром № 1 ГБУЗ «Московская городская онкологическая больница № 62» Департамента здравоохранения города Москвы
Ирина И. Андреяшкина, д. м. н., зам. главного внештатного специалиста – онколога ДЗМ, ведущий научный сотрудник, ГБУЗ «Московский клинический научно-практический центр имени А. С. Логинова Департамента здравоохранения города Москвы»
Антон В. Бяхов, врач-онколог, ГБУЗ «Московский клинический научно-практический центр имени А. С. Логинова Департамента здравоохранения города Москвы»
Людмила В. Крамская, врач-онколог, зав. 2-м онкологическим отделением, Онкологический диспансер, ГБУЗ «Городская клиническая больница имени Д. Д. Плетнёва Департамента здравоохранения города Москвы»
Татьяна В. Карандеева, врач-онколог, онкологический диспансер, ГБУЗ «Городская клиническая больница имени Д. Д. Плетнёва Департамента здравоохранения города Москвы»
Вадим Н. Мехтиев, врач-онколог, зав. онкологическим диспансером, ГБУЗ «Городская клиническая больница имени Д. Д. Плетнёва Департамента здравоохранения города Москвы»
Денис А. Оскирко, врач-онколог, зам. зав. диспансером по медицинской части, онкологический диспансер, «Городская клиническая больница имени Д. Д. Плетнёва Департамента здравоохранения города Москвы»
Ирина Р. Суслова, зав. отделением дневной стационар, ГБУЗ «Онкологический диспансер № 4 Департамента здравоохранения города Москвы»
Маргарита О. Скорина, врач-онколог, ГБУЗ «Онкологический диспансер № 4 Департамента здравоохранения города Москвы»
Ольга В. Романчук, врач-онколог, ГБУЗ «Онкологический диспансер № 4 Департамента здравоохранения города Москвы»
Елена А. Самышина, к. м. н., окружной специалист, ГБУЗ «Онкологический диспансер № 4 Департамента здравоохранения города Москвы»
Валентина Е. Шикина, зав. отделением дневной стационар, ГБУЗ «Московский областной онкологический диспансер»
Дмитрий В. Козлов, зав. отделением онкологии, ГБУЗ «Диагностический клинический центр № 1 Департамента здравоохранения города Москвы», Филиал № 5
Ольга В. Хрупало, окружной специалист, ГБУЗ «Диагностический клинический центр № 1 Департамента здравоохранения города Москвы», Филиал № 3
Елена В. Тювинова, врач-онколог, ГБУЗ «Городская поликлиника № 201 Департамента здравоохранения города Москвы»
Виктор М. Шерстнев, к. м. н., зав. отделением химиотерапии, ГБУЗ «Онкологический диспансер № 5 Департамента здравоохранения города Москвы»
Игорь С. Чернов, к. м. н., врач-онколог, ГБУЗ «Онкологический диспансер № 5 Департамента здравоохранения города Москвы»
Джеймс Дж. Колоколов, врач-онколог, ГБУЗ «Городская поликлиника № 195 Департамента здравоохранения города Москвы»
Елена И. Коноплева, врач, факультет фундаментальной медицины, Московский Государственный Университет им. М.В. Ломоносова
Список литературы Собственный опыт применения эрибулина в условиях реальной клинической практики г. Москвы и Московской области
- Злокачественные новообразования в России в 2016 году (Заболеваемость и Смертность)/Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. Москва, 2018. 250 c.
- Zlokachestvennye novoobrazovaniya v Rossii v 2016 godu (Zabolevaemost’ i Smertnost’). Eds. A. D. Kaprin, V. V. Starinskii, G. V. Petrova. Moscow, 2018. 250 p. (In Russ.)
- Стенина М. Б., Жукова Л. Г., Королева И. А., Пароконная А. А., Семиглазова Т. Ю., Тюляндин С. А. и др. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли. 2016. № 4, Спецвыпуск 2. С. 97-122.
- Stenina M. B., Zhukova L. G., Koroleva I. A., Parokonnaya A. A., Semiglazova T. Y. et al. Practical recommendations for advanced breast cancer treatment. Malignance tumors. 2016. No. 4, Speсial Issue 2. P. 97-122 (In Russ.)
- Kuznetsov G., Towle M. J., Cheng H. et al. Induction of morphological and biochemical apoptosis following prolonged mitotic blockage by halichondrin B macrocyclic ketone analog E7389. Cancer Res. 2004. Vol. 64. P. 5760-5766.
- Jordan M. A., Kamath K., Manna T. et al. The primary antimitotic mechanism of action of the synthetic halichondrin E7389 is suppression of microtubule growth. Mol. Cancer Ther. 2005. Vol. 4. P. 1086-1095. 5
- Okouneva T., Azarenko O., Wilson L. et al. Inhibition of centromere dynamics by eribulin (E7389) during mitotic metaphase. Mol. Cancer Ther. 2008. Vol. 7. P. 2003-2011.
- Smith J. A., Wilson L., Azarenko O. et al. Eribulin binds at microtubule ends to a single site on tubulin to suppress dynamic instability. Biochemistry. 2010. Vol. 49. P. 1331-1337.
- Funahashi Y., Okamoto K., Adachi Y. et al. Eribulin mesylate reduces tumor microenvironment abnormality by vascular remodeling in preclinical human breast cancer models. Cancer Sci. 2014. Vol. 105. No. 10. P. 1334-1342.
- Ueda S., Saeki T., Takeuchi H. et al. In vivo imaging of eribulin-induced reoxygenation in advanced breast cancer patients: a comparison to. Br. J. Cancer. 2016.
- Cortes J., O’Shaughnessy J., Loesch D. et al. Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a Phase 3 open-label randomised study. Lancet. 2011. Vol. 377 (9769). P. 914-923.
- Kaufman P. A., Awada A., Twelves C. et al. Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane. J. Clin. Oncol. 2015. Vol. 33. P. 594-601.
- Pivot X., Marme F., Koenigsberg R., Guo M., Berrak E., Wolfer A. Pooled analyses of eribulin in metastatic breast cancer patients with at least one prior chemotherapy. Annals of Oncology. 2016. Vol. 27. P. 1525-31.
- Blum J. L., Twelves C. J., Dutcus C. et al. Impact of the number of prior chemotherapy regimens on overall survival (OS) among subjects with locally recurrent or MBC treated with eribulin mesylate: results from the Phase III EMBRACE study. Presented at the 33rd Annual San Antonio Breast Cancer Symposium (SABCS), December 8-12, 2010, San Antonio, TX, USA. Cancer Res. Vol. 70, Issue 24 Supplement. P. P6-13-01.
- Pivot X., Seock Ah Im, Guo M., Marm F. Subgroup analysis of patients with HER2negative metastatic breast cancer in the secondline setting from a phase 3, openlabel, randomized study of eribulin mesilate versus capecitabine. Breast Cancer. 2018. Vol. 25 (3). P. 370-374. 10.1007/s12282-017-0826-4
- DOI: :10.1007/s12282-017-0826-4
- Инструкция по медицинскому применению препарата Халавен (РУ ЛП-001782 от 24.07.2012 с изменением от 17.10.2017).
- Instructions for the medical use of Halaven (Rev. 17.10.2017) (In Russ.)
- Fabi A., Moscetti L., Ciccarese M. et al. Eribulin in heavily pretreated metastatic breast cancer patients and clinical/biological feature correlations: impact on the practice. Future Oncology. 2015. Vol. 11 (3). P. 431-438.
- Манзюк Л. В., Коваленко Е. И., Артамонова Е. В. Эрибулин в лечении метастатического рака молочной железы//Вопросы онкологии. 2015. № 2. С. 195-198.
- Manzyuk L. V., Kovalenko E. I., Artamonova E. V. Eribulin v lechenii metastaticheskogo raka molochnoi zhelezy. Voprosy onkologii. 2015. No. 2. P. 195-198 (In Russ.)
- Болотина Л. В., Манзюк Л. В., Горбунова В. А., Коваленко Е. И. и др. Результаты первого ретроспективного данных по применению эрибулина у пациентов с метастатическим раком молочной железы в условиях реальной клинической практики в России//Современная Онкология. 2016. № 18 (3). С. 27-32.
- Bolotina L. V., Manzyuk L. V., Gorbunova V. A., Kovalenko E. I. et al. Rezul’taty pervogo retrospektivnogo dannykh po primeneniyu eribulina u patsientov s metastaticheskim rakom molochnoi zhelezy v usloviyakh real’noi klinicheskoi praktiki v Rossii. Sovremennaya Onkologiya. 2016. No. 18 (3). P. 27-32 (In Russ.)
- Манзюк Л. В., Коваленко Е. И., Горбунова В. А., Болотина Л. В. и др. Эффективность и безопасность эрибулина при различных подтипах рака молочной железы: данные из реальной клинической практики в России//Злокачественные опухоли. 2017. Том 7. № 3. С. 44-54.
- Manzyuk L. V., Kovalenko E. I., Gorbunova V. A., Bolotina L. V. et al. Effektivnost’ i bezopasnost’ eribulina pri razlichnykh podtipakh raka molochnoi zhelezy: dannye iz real’noi klinicheskoi praktiki v Rossii. Zlokachestvennye opukholi. 2017. Vol. 7. No. 3. P. 44-54 (In Russ.)
- Muss H., Cortes J., Vahdat L. T. et al. Eribulin monotherapy in patients aged 70 years and older with metastatic breast cancer. Oncologist. 2014. Vol. 19. P. 318-327.


