Собственный опыт применения поликапролактона при производстве скаффолда мениска коленного сустава
Автор: Кудрачев Т.Р., Лычагин А.В., Липина М.М., Калинский Е.Б., Елизаров М.П., Гончарук Ю.Р., Аксенова Н.А., Ларионов Д.И., Шкердина М.И.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 1 (51), 2023 года.
Бесплатный доступ
Разрывы мениска влияют на распределение нагрузки в суставе и без реконструкции целостности структуры менисковой ткани прогрессия остеоартроза будет только нарастать. На сегодняшний день при помощи регенеративной медицины возможно сконструировать персонализированный скаффолд мениска, который должен решить данную проблему. Однако выбор метода производства и материала каркаса остается большим вопросом для исследователей. В качестве материала для формирования каркаса исследователи все чаще рассматривают поликапролактон в связи с его биосовместимостью и хорошими механическими функциями.Цель данной работы: Оценка возможности использования поликапролактонового филамента для создания скаффолда мениска коленного сустава при помощи 3Д печати.Материалы и методы: Экспериментальная работа, включающая печать сконструированного в компьютерной программе скаффолда мениска с помощью поликапролактонового филамента (молекулярной массой = 50кДа) на FDM 3Д принтере Flashforge Guider 2s. Оценка и характеристика материала проводилась посредством визуализации скаффолда на оптическом микроскопе Olympus SZ51, измерения температуры деструкции при помощи синхронного термического анализатора STA 6000 и исследование химической структуры ИК-Фурье-спектроскопии многократного нарушенного полного внутреннего отражения (МНПВО) на приборе Spectrum Two (“Perkin-Elmer”, США).Результаты: Температура экструдера 3Д принтера изменяет физико-химические свойства поликапролактона, что ограничивает возможность контроля величины пор и балок скаффолда. Характеристики конечного продукта не позволяют производить его последующую модификацию. Выводы: для дальнейшего производства скаффолдов мениска на основе поликапролактона необходимо использовать 3Д принтер, температуру экструдера которого возможно настроить на более низкие параметры.
Тканевая инженерия, скаффолды менисков, аддитивные технологии, поликапролактон, 3д печать
Короткий адрес: https://sciup.org/142238934
IDR: 142238934 | УДК: 617.3 | DOI: 10.17238/2226-2016-2023-1-18-24
Текст научной статьи Собственный опыт применения поликапролактона при производстве скаффолда мениска коленного сустава
Разрыв мениска является одной из наиболее распространённых травм коленного сустава.
Несмотря на имеющееся разнообразие методик восстановления целостности менисков, ни одна из них не может в полной мере воссоздать структуру последнего. Регенеративные способности тканей мениска ограничены, что связано с его строением и относительно скудным кровоснабжением. [1]
Экстрацеллюлярный матрикс мениска преимущественно состоит из коллагеновых волокон и обладает механическими свойствами для противостояния сжимающей, растягивающей и сдвигающей силе. Пучки волокон коллагена первого типа расположены на периферии и идут по окружности до места крепления к плато большеберцовой кости. [2] Радиальные волокна находятся перпендикулярно основному ходу волокон. Разрушение целостности менискового полукольца приводит к потере механической функции и стремительно ведет к развитию остеоартроза. [3]
Благодаря достижениям в области регенеративной медицины, в настоящее время стало возможно создавать скаффолды (каркасы) мениска для замещения резецированной ткани. В коммерческом использовании представлены две модели:
коллагеновый скаффолд мениска CMI и синтетический полиуретановый скаффолд мениска Actifit. Исследователи демонстрируют ряд недостатков при использовании данных каркасов в клинической практике. При двухлетнем наблюдении данных МРТ отмечено заполнение места конструктов новой менисковой тканью и изменение изначальной формы скаффолда. При этом размеры новообразованной ткани были уменьшены относительно размеров изначальных скаффолдов. [4]
Существует мнение, что скаффолд должен максимально точно повторять исходную ткань с точки зрения структуры и функции, чтобы воспринять нагрузку и сделать возможным образование неоменисковой ткани после деградации конструкта. [5]
На данный момент для создания скаффолдов возможно использование следующих биологических материалов: кол-лаген[6], хитозан[7], фиброин шелка [8].
Несмотря на их высокую биосовместимость и биодеградируемость, материалы не лишены недостатков, в частности такие каркасы не способны переносить ротационные и компрессионные нагрузки. [9]
Помимо биоматериалов было исследовано несколько биодеградируемых синтетических веществ: поликапролактон (PCL) [10], полиуретан [11], полимолочная кислота[12] и полимолочно-ко-гликолевая кислота (PLGA)[13]. Скаффолды из синтетических материалов обладают хорошей механической прочностью. В последних исследованиях все большее внимание приковано к поликапролактону и его использованию в качестве основы для скаффолда мениска.
Биоматериалы на основе поликапролактона на протяжении долгого времени применяют в медицине из-за биосовместимости, механических свойств и более длительного периода деградации. Способность материала к использованию в различных типах производства позволяет создавать рассасывающиеся шовные материалы, системы доставки лекарственных средств и каркасы в тканевой инженерии для различных органов и тканей. [14]
За последнее время отмечается тенденция к использованию поликапролактона в составе комбинированного скаффолда мениска.[15][16] Чистый материал PCL является гидрофобным и на его поверхности происходит скудная адгезия клеток. Поэтому присутствует необходимость в модификации скаффолда для создания более привычной для клеточных культур среды с целью интеграции и пролиферации. [17]
Наиболее подходящими для формирования скаффолда мениска из поликапролактона являются электросшивание и аддитивные технологии. К аддитивным технологиям относят 3Д биопечать и FDM печать (моделирование методом послойного наплавления). [18] Печать с помощью 3Д принтера привлекательна тем, что исследователь может контролировать диаметр пор и балок скаффолда в отличии от электроспайнинга. [19]
В данной статье приведен опыт применения поликапролактона в качестве печати скаффолда мениска на FDM 3Д принтере, а также освещены проблемы, с которыми столкнулись во время исследования.
-
2. Материалы и методы
В качестве материала для 3Д печати скаффолда был использован поликапролактоновый филамент с молекулярной массой 50 кДа, диаметр волокна которого был равен 1.75 мм. Печать осуществлялась на принтере Flashforge Guider 2s с применением сопла диаметром 0,2 мм. Температура в экструдере была равна 180 градусам. Время печати варьировалось от 1 до 1,5 минут на каждую модель. Всего было напечатано 15 поликапролактоновых скаффолдов. При этом параметры скорости печати меняли с целью получения более точной детализации балок конструкта. Визуальную оценку поликапролактона проводили при помощи оптического микроскопа Olympus SZ51.
Модель скаффолда мениска (рис. 1) сконструирована при помощи компьютерной программы согласно размерам нативного мениска кролика (диаметр окружности мениска равен 10 мм, высота внешней стороны мениска – 1 мм). Данный размер был выбран с целью дальнейшей трансплантации на резецированную часть мениска кролика.
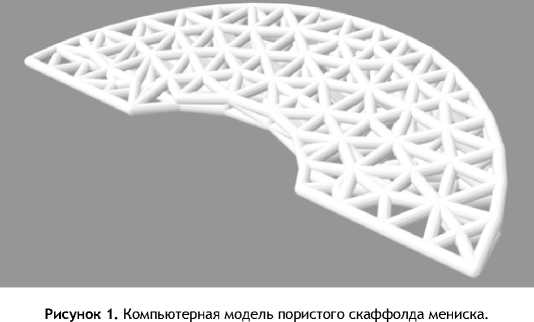
Опираясь на ранние исследования, было принято решение сделать поры диаметром 300 мкм, а толщину балок размером 0,4 мм. Данные параметры позволят клеткам мигрировать сквозь поры, а механическое воздействие на скаффолд со стороны костей не разрушит каркас до момента его полной деградации. [19]
Для определения изменений в структуре поликапролактона было проведено три эксперимента:
Исследование особенностей надмолекулярной структуры исходного филамента и скаффолда на его основе было проведено методами дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА).
Для определения температуры деструкции в двух экспериментах был использован поликапролактон с помощью синхронного термического анализатора STA 6000 (PerkinElmer, США) (Рис. 2). Использовали два образца скаффолда и два образца исходного филамента. Образцы, ~15 mg, разлагались в среде азота при скорости газового потока 20 мл/мин и линейной скорости нагрева 10 °C/мин. Относительная ошибка температурного и термического эффекта составляла ±1.5 °C и ±2%, соответственно.

Рисунок 2. Синхронный термический анализатор STA 6000 (PerkinElmer, США)
Дизайн первого эксперимента:
На ДСК анализаторе исследовали образцы поликапролактонового филамента и поликапролактонового скаффолда. В ходе первого эксперимента осуществлялось нагревание образцов до 500 ° С. Далее происходило сравнение образцов исходного филамента и группы образца распечатанного скаффолда.
Дизайн второго эксперимента:
В ДСК анализаторе производился нагрев полимера до 200 ° С и выдерживание образца при этой температуре на протяжении 10 минут. После чего последовало охлаждение материала до 30 ° С на протяжении 5 минут. Затем поликапролактон подвергли повторному нагреву от 30 ° С до 500 ° С.
Исследование химической структуры филамента и скаффолда на его основе проводили методом ИК-Фурье-спектроскопии многократного нарушенного полного внутреннего отражения (МНПВО) на приборе Spectrum Two (“Perkin-Elmer”, США), оснащенном высокопроизводительным детектором LiTaO3, стандартной оптической системой с окнами из KBr для сбора данных в спектральном диапазоне 3800–350 см–1 с разрешением 0.5см–1.
Дизайн третьего эксперимента:
Сравнение показателей на проведенной ИК-Фурье-спектроскопии группы образца поликапролактонового филамента и распечатанного скаффолда мениска.
Результаты и обсуждения
По опыту зарубежных коллег использование поликапролактона в качестве материала для печати скаффолда мениска на FDM 3Д принтере позволяло производить хорошо детализированные скаффолды мениска. В отличии от других методов производства возможно было контролировать параметры диаметра пор и балок конструкции. [19]
При печати первого десятка моделей менисков в нашем исследовании было отмечено несколько проблем. Визуально конструкт отличался от компьютерной модели. Отмечены многочисленные слипшиеся элементы конструкции. При повторных печатях точность конструкции немного улучшилась, однако толщину пор по-прежнему было сложно контролировать, также присутствовали дефекты балок. При микроскопии одной из моделей скаффолда можно увидеть дефекты печати: невозможно определить толщину балок и их детализацию, поры заполнены материалом. (Рис.3)

Рисунок 3. Модель поликапролактонового скаффолда под увеличением микроскопа.
-
3.1. Термические характеристики поликапролактона
В поиске возможных причин неудач во время печати скаф-фолда необходимо было протестировать поликапролактон на предмет возможного раннего разрушения химических связей внутри полимера на этапе плавления филамента в экструдере 3Д принтера.
В ходе первого эксперимента были получены следующие результаты. Во-первых, температура, при которой образец поликапролактона начинает терять свою массу (происходит деструкция) равна примерно 368 °С. Во-вторых, термостабильность (температура начала деструкции) филамента отличается от термостабильности скаффолда. Распечатанный скаффолд более термостабилен. Данный факт доказывает, что образцы имеют структурные различия (Рис. 4).
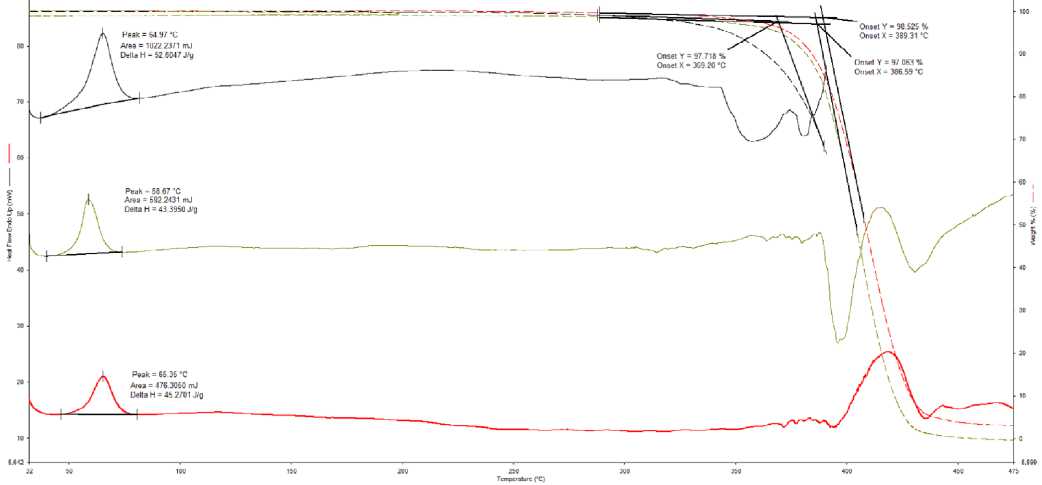
Рисунок 4. Графическое изображение двух экспериментов.
Верхние графики кривых показывают температуры горения отображают температуру деструкции:
График черного цвета - исходного филамента (ТГ=369°С);
График зеленого цвета - температура деструкции исходного филамента прошедший термическую обработку (ТГ=386°С); График красного цвета - температуру деструкции скаффолда (ТГ=389°С). Нижние графики показывают температуру плавления материала (кривые ДСК).
-
1) График черного цвета отображает кривую ДСК исходного филамента
-
2) График зеленого цвета отображает кривую ДСК исходного филамента при повторном плавлении.
-
3) График красного цвета отображает кривую ДСК распечатанного на 3Д принтере скаффолда.
-
3.2. Химические характеристики поликапролактона.
После первого эксперимента невозможно однозначно узнать истинную причину изменений свойств скаффолда. Помимо температурного воздействия экструдера имеется риск контаминации поликапролактонового филамента остаточными материалами, которые ранее проходили через экструдер.
Для выявления причины различия термостабильности был взят еще один образец поликапролактонового филамента и проведен следующий эксперимент.
По итогу второго эксперимента определено, что описанное выше температурное воздействие действительно приводит к повышению термостойкости полимера. Характеристики нагретого в аппарате филамента практически совпадают с характеристиками скаффолда.
Таким образом, можно полагать, что при температурах 180 ° С (в экструдере 3D принтера) и 200 ° С (в ДСК анализаторе) начинается процесс термоокислительной деструкции и образование первичных радикалов, которые взаимодействуют между собой и формируют более термоустойчивую полимерную структуру.
Для исследования химической структуры филамента и скаффолда был проведен эксперимент методом ИК-Фурье-спектроскопии многократного нарушенного полного внутреннего отражения (МНПВО).
На рисунке 5 представлены ИК-спектры исходного филамента (кривая красного цвета) и скаффолда (кривая черного цвета). Видно, что все характеристические полосы поликапролактона сохранились. В частности, полоса, соответствующая колебаниям карбонильной группы С=О (1723 см-1), полосы, соответствующие колебаниям групп С-Н, СОО, СОС, ОН, С-О (1365-733 см-1).[20]
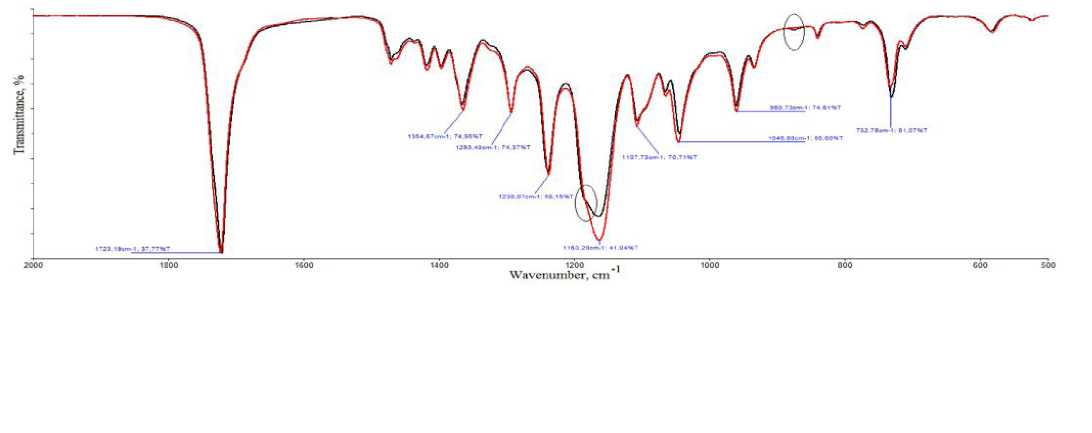
Рисунок 5.
1)Кривая красного цвета - ИК-спектры исходного филамента
2)Кривая черного цвета - ИК-спектры скаффолда
В то же самое время в результате печати на принтере в полимере произошли изменения химической структуры, а именно: уменьшилась интенсивность полосы 1163 см-1 с одновременным появлением плеча при 1187 см-1 и появлением полосы при 876 см-1. Полосы 1163 см-1 и 1187 см-1 соответствуют колебаниям групп СОО в сложноэфирных группировках, полоса 876
см-1 – колебаниям групп RСН=СН. Можно полагать, что при нагреве полимерного филамента в принтере начинается процесс его термоокислительной деструкции. При этом, по-видимому, у атомов углерода, находящихся в непосредственной близости к сложноэфирным группировкам начинают формироваться двойные связи.
Выводы:
Опираясь на результаты проведенных нами экспериментов, следует полагать, что дефект печати связан с повышенной температурой экструдера 3Д принтера, которая привела к уменьшению вязкости поликапролактона.
Таким образом, мы пришли к выводу, что поликапролактоновый филамент требует особых температурных условий для детализированной печати скаффолдов мениска. В дальнейшем планируется апробация других моделей FDM 3Д принтеров с подходящим по условиям набором сопел и тщательная настройка параметров перед каждой печатью.
Помимо выбора принтера с возможностью печати скаф-фолда на низких температурах необходимо рассмотреть использование сопел меньшего диаметра. После печати конечной модели последует его дальнейшее испытание на механическое воздействие.
Дальнейшая модификация каркаса будет происходить физическим и химическим способом.[21] Эксперименты с клеточными культурами для определения цитотоксичности, пролиферации и адгезии клеток будут следующим этапом наших доклинических испытаний
Список литературы Собственный опыт применения поликапролактона при производстве скаффолда мениска коленного сустава
- Gee S. M. , Posner M. Meniscus Anatomy and Basic Science, Sports Med. Arthrosc. Rev., 2021; 29(3):18, doi: 10.1097/JSA.0000000000000327.
- Twomey-Kozak J., Jayasuriya C. Meniscus repair and regeneration: A systematic review from a basic and translational science perspective, Clin. Sports Med., 2020; 39(1):125–163, doi: 10.1016/j.csm.2019.08.003.
- Feeley B. T., Lau B. C. Biomechanics and Clinical Outcomes of Partial Meniscectomy, J. Am. Acad. Orthop. Surg. 2018; 26(24):853–863. doi: 10.5435/JAAOS-D-17-00256.
- Houck D. A., Kraeutler M. J., Belk J. W., McCarty E. C., Bravman J. T. Similar clinical outcomes following collagen or polyurethane meniscal scaffold implantation: a systematic review, Knee Surg. Sports Traumatol. Arthrosc. Off. J. ESSKA. 2018; 26(8):2259–2269. doi: 10.1007/s00167-018-4838-1.
- Lombardo M. D. M., Mangiavini L., Peretti G. M. Biomaterials and Meniscal Lesions: Current Concepts and Future Perspective, Pharmaceutics 2021; 13(11):1886. doi: 10.3390/pharmaceutics13111886.
- Buma P., van Tienen T., Veth R. The collagen meniscus implant, Expert Rev. Med. Devices. 2007;4(4):507–516. doi: 10.1586/17434440.4.4.507.
- Moradi L., Vasei M., Dehghan M. M., Majidi M., Farzad Mohajeri S., Bonakdar S., Regeneration of meniscus tissue using adipose mesenchymal stem cells-chondrocytes co-culture on a hybrid scaffold: In vivo study, Biomaterials. 2017; 126:18–30. doi: 10.1016/j.biomaterials. 2017.02.022.
- Bandyopadhyay A., Mandal B. B. A three-dimensional printed silkbased biomimetic tri-layered meniscus for potential patient-specific implantation, Biofabrication. 2019:12(1): 015003. doi: 10.1088/1758-5090/ab40fa.
- Peng Y., Lu M., Zhou Z., Wang C., Liu E., Zhang Y., Liu T., Zuo J. Natural biopolymer scaffold for meniscus tissue engineering, Front. Bioeng. Biotechnol. 2022; 10:1003484. doi: 10.3389/fbioe.2022.1003484.
- Li H., Li P., Yang Z., Gao C., Fu L., Liao Z., Zhao T., Cao F., Chen W., Peng Y., Yuan Z., Sui X., Liu S., Guo Q. Meniscal Regenerative Scaffolds Based on Biopolymers and Polymers: Recent Status and Applications, Front. Cell Dev. Biol. 2021;9:661802. doi: 10.3389/fcell.2021.661802.
- De Coninck T., Huysse W., Willemot L., Verdonk R., Verstraete K., Verdonk P., Two-Year Follow-up Study on Clinical and Radiological Outcomes of Polyurethane Meniscal Scaffolds, Am. J. Sports Med. 2013; 41(1):64–72. doi: 10.1177/0363546512463344.
- Gu Y., Zhu W., Hao Y., Lu L., Chen Y., Wang Y. Repair of meniscal defect using an induced myoblast-loaded polyglycolic acid mesh in a canine model, Exp. Ther. Med. 2012;3(2):293–298. doi: 10.3892/etm.2011.403.
- Bahcecioglu G., Hasirci N., Hasirci V. Cell behavior on the alginate-coated PLLA/PLGA scaffolds, Int. J. Biol. Macromol. 2019; 124: 444–450. doi: 10.1016/j.ijbiomac.2018.11.169.
- Kumari A., Yadav S. K., Yadav S.C. Biodegradable polymeric nanoparticles based drug delivery systems. Colloids Surf. B Biointerfaces, 2010; 75(1):1–18. doi: 10.1016/j.colsurfb.2009.09.001.
- Gopinathan J., Mano S., Pillai E.V.M.M., Rai S.S.K.D., Rajendran S., Bhattacharyya A. Biomolecule incorporated poly-ε-caprolactone nanofibrous scaffolds for enhanced human meniscal cell attachment and proliferation, RSC Adv. 2015; 5(90):73552–73561. doi: 10.1039/C5RA14315B.
- Bahcecioglu G., Hasirci N., Bilgen B., Hasirci V. A 3D printed PCL/ hydrogel construct with zone-specific biochemical composition mimicking that of the meniscus, Biofabrication. 2019;11(2):025002. doi: 10.1088/1758-5090/aaf707.
- Xu F. J., Wang Z. H., Yang W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules, Biomaterials. 2010; 31(12):3139–3147. doi: 10.1016/j.biomaterials.2010.01.032.
- Rozykulyyeva L., Widiyanti P., Utomo D. N., Astuti S. D. Poly (ε-caprolactone) - Based biomaterials for meniscus tissue engineering, Jember, Indonesia. 2023; 040005. doi: 10.1063/5.0111407.
- Zhang Z.-Z, Jiang D., Ding J. X., Wang S. J., Zhang L., Zhang J. Y., Qi Y. S., Chen X. S., Yu J. K. Role of scaffold mean pore size in meniscus regeneration, Acta Biomater. 2016; 43:314–326. doi: 10.1016/j.actbio.2016.07.050.
- Abdelrazek E. M., Hezma A. M., El-khodary A., и Elzayat A. M. Spectroscopic studies and thermal properties of PCL/PMMA biopolymer blend, Egypt. J. Basic Appl. Sci. 2016;3(1):10–15. doi: 10.1016/j.ejbas.2015.06.001.
- Veronesi F., Di Matteo B., Vitale N.D., Filardo G., Visani A., Kon E., Fini M. Biosynthetic scaffolds for partial meniscal loss: A systematic review from animal models to clinical practice, Bioact. Mater. 2021; 6(11):3782–3800. doi: 10.1016/j.bioactmat.2021.03.033.


