Сочетание острого инфаркта миокарда и синдрома Такоцубо
Автор: Вышлов Е. В., Усов В. Ю., Керчева М. А., Демьянов С. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Больная С., 79 лет, поступила в отделение неотложной кардиологии НИИ кардиологии Томского НИМЦ после эпизода потери сознания и зафиксированной пробежки полиморфной желудочковой тахикардии. При поступлении - подъем сегмента ST в отведениях I, aVL, V1-V5 до 6 мм, депрессия сегмента ST до 1 мм III, aVF. На экстренной инвазивной коронарной ангиографии - выраженное замедление коронарного кровотока без стенозирующего атеросклероза. Диагноз острого инфаркта миокарда (ОИМ) был поставлен на основании: 1. Закономерной динамики электрокардиографии (ЭКГ) в виде снижения сегмента ST и формирования глубоких отрицательных Т в грудных отведениях. 2. Преходящего повышения креатинфосфокиназы (КФК) до 439 Ед/л, КФК-МВ до 52 Ед/л и тропонина I до 5,8 нг/мл. 3. Включения парамагнетика в миокард субэндокардиально в области передней стенки с переходом на перегородку. Диагноз синдрома Такоцубо (СТ) был поставлен на основании быстрого и полного восстановления сократительной способности и геометрии левого желудочка (ЛЖ): на 2-е сут заболевания фракция выброса (ФВ) ЛЖ по данным ультразвукового исследования (УЗИ) сердца составила 21%, дискинез верхушки, акинез передней и переднебоковой стенок ЛЖ, а уже на 7-е сут заболевания зон гипокинеза не обнаружено. В статье обсуждаются данные литературы по частоте сочетания этих заболеваний и возможные патогенетические механизмы такого сочетания.
Инфаркт миокарда, синдром такоцуб
Короткий адрес: https://sciup.org/149142842
IDR: 149142842 | УДК: 616.127-005.8-036.11:616.124.2-008.6 | DOI: 10.29001/2073-8552-2023-38-2-275-280
Текст научной статьи Сочетание острого инфаркта миокарда и синдрома Такоцубо
Как правило, при болевом синдроме в грудной клетке необходимо дифференцировать несколько заболеваний. В частности регулярно возникает необходимость дифференцировать острый инфаркт миокарда (ОИМ) и синдром Такоцубо (СТ). Могут ли эти заболевания сочетаться? В данном клиническом случае, вероятно, произошло такое сочетание.
Больная С., 79 лет, 24 ноября 2019 г. поступила в отделение неотложной кардиологии НИИ кардиологии Томского НИМЦ после эпизода потери сознания. На догоспитальном этапе была зарегистрирована пробежка полиморфной желудочковой тахикардии с частотой 200 уд/мин, синусовый ритм был восстановлен после в/в введения 600 мг кордарона. Эпизод потери сознания развился на фоне относительно благополучного состояния. Ангинозные боли отрицает, в течение последнего года отмечает одышку, которая возникает при ходьбе на расстояние более 100 м; гипертоническая болезнь в течение 20 лет, гипотензивную терапию регулярно не принимает, «рабочие» цифры артериального давления (АД) – 130–140/80–90 мм рт. ст. За несколько дней до приступа отмечает явления острого респираторного вирусного заболевания – преходящие субфебрильная температура и сухой кашель. Из сопутствующих заболеваний у пациентки имеется хроническая железодефицитная анемия легкой степени и сахарный диабет 2-го типа без потребности в инсулинотерапии.
На момент поступления в стационар пациентка – в сознании, активно жалоб не предъявляет. Объективно на момент поступления в стационар: пациентка нормостенического телосложения, кожные покровы нормальной окраски и влажности. Дыхание жесткое, хрипы не выслушиваются, число дыханий 15 в 1 мин. Левая граница относительной тупости сердца на 2 см кнару- жи от левой среднеключичной линии. Тоны сердца приглушены, соотношение тонов сохранено, на верхушке выслушивается мягкий систолический шум. Ритм правильный, 89 ударов в 1 мин, АД 137/92 мм рт. ст., пульс на лучевых артериях удовлетворительного качества. Живот мягкий, безболезненный, печень не увеличена. На электрокардиограмме (ЭКГ) при поступлении: ритм синусовый, частота сердечных сокращений (ЧСС) 90 уд/мин, электрическая ось сердца отклонена влево, подъем сегмента ST в отведениях I, aVL, V1, V4, V5 с максимумом в V2-3 до 6 мм, депрессия сегмента ST до 1 мм III, aVF (рис. 1).
Предварительный диагноз – ишемическая болезнь сердца (ИБС): острый первичный передний инфаркт миокарда с подъемом сегмента ST от 24.11.2019 г. Проведена экстренная инвазивная коронароангиография, по результатам которой выявлено выраженное замедление коронарного кровотока без стенозирующего атеросклероза. Наличие ОИМ было подтверждено преходящим повышением сывороточных уровней кардиоспецифических маркеров: креатинфосфокиназа-МВ (КФК-МВ) до 52 Ед/л и тропонина I до 5,8 нг/мл, что является основным критерием диагностики ОИМ согласно 4-му универсальному определению этого диагноза [1].
На 2-е сут от начала госпитализации фракция выброса (ФВ) левого желудочка (ЛЖ) по данным УЗИ сердца составила 21%, обнаружен дискинез верхушки, акинез передней и переднебоковой стенок ЛЖ. По данным магнитно-резонансной томографии (МРТ) сердца с парамагнитным контрастным усилением, выполненной на 4-е сут от начала госпитализации: ФВ ЛЖ 45%; в Т2-взвешенном режиме отмечается диффузное усиление изображения в области передней стенки и перегородки – в бассейне передней нисходящей ветви левой коронарной артерии, так что здесь следует предполагать массивный отек.
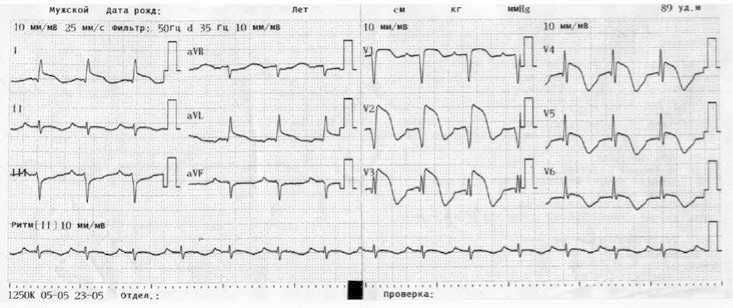
Рис. 1. ЭКГ при поступлении 24.11.2019 г.
Fig. 1. ECG at admission 24.11.2019
Здесь же – диффузное усиление изображения в раннюю фазу контрастирования в Т1-взвешенном режиме с подавлением сигнала от жира, что характерно для острой или ранней подострой стадии ишемического повреждения. Кроме этого, в отсроченную фазу контрастирования в области передней стенки с переходом на перегородку, нетрансмурально, субэндокардиально определяется усиление включения парамагнетика в миокард, что также характерно для ишемического повреждения. Также обнаружено относительное истончение передней стенки ЛЖ до 6–7 мм (рис. 2 слева).
Таким образом, в целом определена картина нарушения коронарного кровоснабжения в бассейне передней нисходящей артерии с повреждением, субэндокарди-ально, с индексом трансмуральности до 50 %, в области передней стенки, в суммарном объеме до 10% массы ЛЖ. При УЗИ сердца на 7-й день заболевания выявлена незначительная дилатация левого предсердия, размеры остальных камер сердца нормальные, умеренная гипер- трофия стенок ЛЖ (межжелудочковая перегородка – 16 мм, задняя стенка ЛЖ – 12,5 мм), нарушений локальной сократимости не установлено, ФВ ЛЖ – 60%, систолическое давление в правом желудочке – 30 мм рт. ст. Динамика ЭКГ через 2 нед. от начала заболевания заключалась в формировании отрицательного зубца Т в отведениях I, II, aVL и V1–V6, комплекс QRS – без динамики (рис. 3). Больной была проведена стандартная терапия ОИМ в сочетании с насыщающей дозой кордарона.
Пациентка выписана из стационара через 2 нед. от начала заболевания в удовлетворительном состоянии с рекомендацией дальнейшего приема двойной антитром-боцитарной терапии, ингибитора АПФ, β-блокатора, статина, сорбифера и кордарона.
Через 1,5 мес. от начала заболевания – 10.01.2020 г. – больная жалоб не предъявляет, состояние удовлетворительное; выполнили контрольное МРТ сердца, на котором обнаружено полное восстановление геометрии ЛЖ и толщины его стенок (рис. 2 справа).
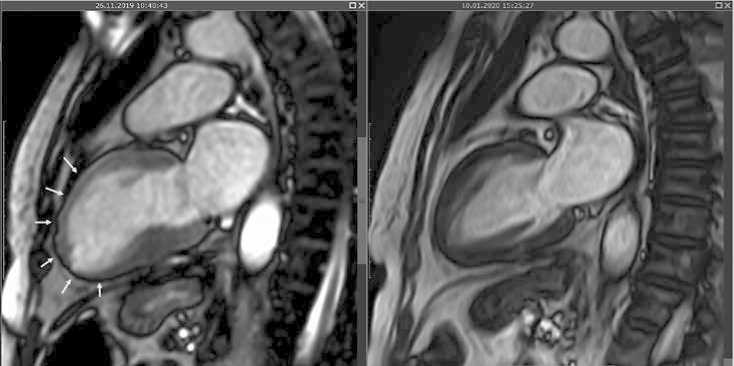
Рис. 2. Магнитно-резонансная томография диастолических кадров в кино-режиме. Слева: на исходном МРТ от 26.11.2019 г. хорошо видно истончение передней стенки левого желудочка (отмечено стрелками) в сочетании с относительным утолщением базальной стенки. Справа: на исследовании от 10.01.2020 г. это истончение полностью регрессировало
Fig. 2. Magnetic resonance imaging (MRI) of diastolic frames by movie mode. Left: the baseline MRI from 26.11.2019; the thinning of the anterior wall of the left ventricle is clearly visible (marked with arrows) in combination with a relative thickening of the basal wall. Right: the study from 10.01.2020, this thinning has completely regressed
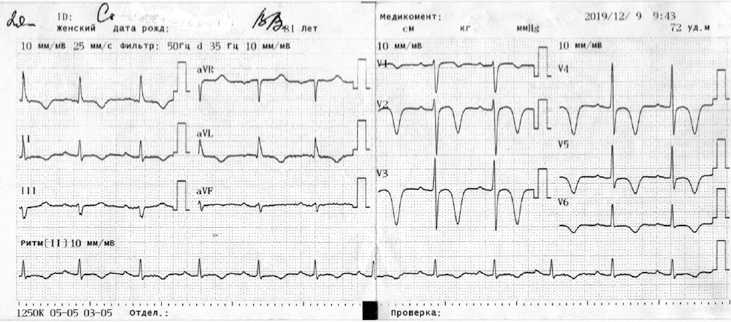
Рис. 3. Электрокардиограмма перед выпиской 09.12.2019 г.
Fig.3 ECG at discharge 09.12.2019
Обсуждение
Учитывая тот факт, что заболевание началось через несколько дней после острой респираторной вирусной инфекции, обсуждался диагноз острого миокардита, но он не нашел своего подтверждения при МРТ сердца. Кроме этого, для острого миокардита не характерно такое быстрое восстановление сократительной функции ЛЖ. На основании преходящего повышения уровня кардиомаркеров, формирования отрицательных зубцов Т по переднебоковой стенке ЛЖ, нарушения сократимости миокарда при поступлении и данных МРТ сердца был поставлен диагноз ОИМ. Но при этом заболевании такое выраженное нарушение сократимости ЛЖ на 2-й день заболевания и изменения на ЭКГ при поступлении, как правило, бывают обусловлены окклюзией передней нисходящей артерии, а в данном случае не было ни стенозирующего атеросклероза, ни тромбоза артерии. Кроме того, для ОИМ также не характерна такая динамика сократительной функции ЛЖ: дискинез верхушки, акинез передней и переднебоковой стенок с ФВ ЛЖ 21% на 2-е сут заболевания и полное отсутствие нарушений локальной сократимости ЛЖ с ФВ ЛЖ 60% на 7-е сут заболевания. Такая быстрая динамика описана только при СТ, являясь основным диагностическим критерием этого заболевания. Согласно регистрам, этот синдром наиболее часто развивается у женщин в период менопаузы, что соответствует нашей больной. Отсутствие явного стресса не исключает этого заболевания: около 30% его развивается при отсутствии в анамнезе стресс-фактора [2].
Но и рассматривать этот случай только в рамках СТ затруднительно: для него не характерно такое значительное повышение кардиомаркеров, а также на МРТ обнаружен участок ишемического повреждения миокарда в виде субэндокардиального включения парамагнетика в области передней стенки миокарда и перегородки. Морфологический субстрат для инфаркта миокарда тоже есть: это замедленный коронарный кровоток, что можно рассматривать как микрососудистую ИБС.
Возможно ли сочетание этих заболеваний? Согласно международному регистру СТ, среди пациентов с этим заболеванием у 21% в качестве сопутствующего заболе- вания имеется ИБС [2]. То есть сочетание СТ и морфологического субстрата для развития инфаркта миокарда встречается довольно часто.
Кроме этого, в последние годы в англоязычной литературе уже описано несколько десятков случаев сочетания ОИМ и СТ [3–7]. Взаимоотношения между ОИМ и СТ можно классифицировать на 3 группы [8]:
-
1. ОИМ как соматический стресс является причиной развития СТ [3].
-
2. СТ является причиной развития ОИМ: описан случай развития ОИМ в результате коронарной эмболии на фоне СТ [9].
-
3. Когда эти взаимоотношения, что первично, что вторично, остаются неясными как дилемма курицы и яйца [10]. В представленном случае клиническое проявление заболевания началось с желудочковой тахикардии. Что было первопричиной – ишемия миокарда или СТ, остается невыясненным.
Сложность дифференциальной диагностики между ОИМ и СТ частично обусловлена тем, что УЗИ-картина оглушенного миокарда после эпизода ишемии и при СТ принципиально не различается [11]. Поэтому, вероятно, когда имеет место их сочетание, часто остается только диагноз ОИМ [12]. При этом одним из критериев СТ является следующее: «Транзиторные патологические движения миокарда обычно не соответствуют зоне кровоснабжения одной коронарной артерии» [13]. То есть если при ОИМ происходит преходящее нарушение локальной сократимости вне области кровоснабжения известной ин-фаркт-связанной коронарной артерии, надо подозревать сопутствующий СТ. Но при верифицированном ОИМ на эти «тонкости» уже часто не обращают внимания.
В современных клинических рекомендациях по СТ как Общества кардиологов [14], так и Общества по лучевой диагностике [15] представлен алгоритм дифференциальной диагностики между ОИМ, СТ и острым миокардитом. Согласно этому алгоритму, при подъеме сегмента ST пациенты сразу направляются на инвазивную коронарную ангиографию, что и было выполнено у нашей больной. В дальнейшем можно использовать все методы лучевой диагностики миокарда, но основными являются УЗИ сердца и МРТ. Но эти алгоритмы существуют именно для дифференциальной диагностики заболеваний. Возможность од- новременного/сочетанного развития ОИМ и СТ, тем более в одной области миокарда, в этих рекомендациях не обсуждается. Поэтому можно предполагать, что сочетание ОИМ и СТ в реальной клинической практике встречается значительно чаще, чем формулируется такой диагноз.
С одной стороны, все эти больные ничего «не теряют», так как все равно получают терапию ОИМ, которая «перекрывает» потребности при СТ (ингибиторы АПФ и ß-блокаторы). Но с другой стороны, более полный диагноз позволяет лучше понимать клиническую картину в таких случаях. В частности можно предполагать, что наиболее тяжелые случаи ОИМ (с развитием кардиогенного шока) в ряде случаев могут быть обусловлены именно таким сочетанием.
Еще одной находкой в этом клиническом случае является значительное истончение стенки миокарда в области верхушки и передней стенки ЛЖ в острый период заболевания с последующим восстановлением этой толщины. В литературе мы не нашли аналогичных описаний. Что происходит со структурой миокарда при такой быстрой динамике? Этот вопрос остается открытым. Согласно современным критериям, диагноз СТ верифицируется динамикой УЗИ сердца (нарушение локальной сократимости исходно с последующим ее восстановлением) без упоминания толщины стенок. Более широкое внедрение в клиническую практику МРТ позволит получать дополнительную информацию об этом заболевании и, возможно, расширит его диагностические критерии.
Список литературы Сочетание острого инфаркта миокарда и синдрома Такоцубо
- Thygesen K., Alpert J.S., Jaffe A.S., ESC Scientific Document Group et al. Fourth universal definition of myocardial infarction. EHJ. 2018;40(3):237-269. https://doi.org/10.1093/eurheartj/ehy462.
- Templin C., Ghadri J.R., Diekmann J., Napp L.C., Bataiosu D.R., Jaguszewski M. et al. Clinical features and outcomes of takotsubo (stress) cardiomyopathy. N. Engl. J. Med. 2015;373(10):929-938. https://doi.org/10.1056/NEJMoa1406761.
- Redfors B., Råmunddal T., Shao Y., Omerovic E. Takotsubo triggered by acute myocardial infarction: a common but overlooked syndrome? Journal of geriatric cardiology. 2014;11(2):171-173. https://doi.org/10.3969/j.issn.1671-5411.2014.02.001.
- Hurtado Rendon I.S., Alcivar D., Rodriguez-Escudero J.P., Silver K. Acute myocardial infarction and stress cardiomyopathy are not mutually exclusive. Am. J. Med. 2018;131(2):202-205. https://doi.org/10.1016/j.amjmed.2017.07.039.
- Y.-Hassan S. Takotsubo syndrome triggered by acute coronary syndrome in a cohort of 20 patients: an often missed diagnosis. Int. J. Cardiol. Res. 2015;02(2):28-33. https://doi.org/10.19070/2470-4563-150007.
- Gurlek C., van Es J., van der Burgh P.H., Galjee M.A., van Birgelen C. Full pattern of transient apical ballooning of the left ventricle triggered by minor myocardial infarction. Neth. Heart J. 2007;15(9):310-311. https://doi.org/10.1007/BF03086006.
- Messas N., Blondet C., Jesel L., Hess S., Girardey M., Imperiale A. et al. Diagnostic relevance of optical coherence tomography imaging in aborted acute myocardial infarction with a “Takotsubo component”. Int. J. Cardiol. 2015;195:123-125. https://doi.org/10.1016/j.ijcard.2015.05.133.
- Y.-Hassan S. Myocardial Infarction in Patients with Takotsubo Syndrome: Trigger and Consequence. The American Journal of Medicine. 2018;131(5):e217. https://doi.org/10.1016/j.amjmed.2017.09.030.
- Angulo-Llanos R., Sanz-Ruiz R., Solis J., Fernández-Avilés F. Acute myocardial infarction: an uncommon complication of takotsubo cardiomyopathy. Catheter Cardiovasc. Interv. 2013;82(6):909-913. https://doi.org/10.1002/ccd.24846.
- Y.-Hassan S., Themudo R., Maret E. Spontaneous coronary artery dissection and takotsubo syndrome: The chicken or the egg causality dilemma. Catheter Cardiovasc. Interv. 2017;89(7):1215-1218. https://doi.org/10.1002/ccd.26956.
- Y.-Hassan S., Jernberg T. Bromocriptine-induced coronary spasm caused acute coronary syndrome, which triggered its own clinical twin - Takotsubo syndrome. Cardiology. 2011;119(1):1-6. https://doi.org/10.1159/000329349.
- Y.-Hassan S. Why do you not call the condition Takotsubo syndrome triggered by acute coronary ischemia? Echocardiography. 2017;34:1552-1553. https://doi.org/10.1111/echo.13703.
- Lyon A.R., Bossone E., Schneider B., Sechtem U., Citro R., Underwood S.R. et al. Current state of knowledge on Takotsubo syndrome: a Position Statement from the Taskforce on Takotsubo Syndrome of the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2016;18(1):8-27. https://doi.org/10.1002/ejhf.424.
- Ghadri J.R., Wittstein I.S., Prasad A., Sharkey S., Dote K., Akashi Y.J. et al. International expert consensus document on Takotsubo Syndrome (Part II): Diagnostic workup, outcome, and management. Eur. Heart J. 2018;39(22):2047-2062. https://doi.org/10.1093/eurheartj/ehy077.
- Citro R., Okura H., Ghadri J.R., Izumi C., Meimoun P., Izumo M. et al. EACVI scientific documents committee, multimodality imaging in Takotsubo Syndrome: a joint consensus document of the European Association of Cardiovascular Imaging (EACVI) and the Japanese Society of Echocardiography (JSE). Eur. Heart J. Cardiovasc. Imaging. 2020;21(11):1184-1207. https://doi.org/10.1093/ehjci/jeaa149.


