Сочетанная лучевая терапия рака предстательной железы с использованием брахитерапии источником высокой мощности дозы: сравнительная характеристика двух режимов
Автор: Канаев Сергей Васильевич, Новиков Сергей Николаевич, Гафтон Георгий Иванович, Новиков Роман Владимирович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Цель исследования - проанализировать результаты лечения больных раком предстательной железы (РПЖ) посредством сочетанной лучевой терапии (СЛТ) с использованием в качестве метода подведения дополнительной дозы облучения (boost) брахитерапии источником высокой мощности дозы (БТ-ВМД) (198Ir) в виде двух фракций по 10 Гр или одной фракции в 15 Гр. материал и методы. С июля 2012-го по июнь 2017 г в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России СЛТ проведена 98 больным РПЖ. Дистанционный этап лечения (IMRT) был стандартным и подразумевал подведение 46-50 Гр (разовая очаговая доза) 2 Гр к предстательной железе, семенным пузырькам и зонам регионарного лимфооттока (RTOG, 2009). Использовались два режима подведения boost к предстательной железе и семенным пузырькам: две фракции БТ-ВМД по 10 Гр - 81 (82,7 %) пациент (I группа) или одна фракция в 15 Гр - 17 (17,3 %) больных (II группа). Критериями включения являлись: высокий или крайне высокий риск рецидива по NCCN (2010), отсутствие данных за отдаленные метастазы (сM0), отсутствие выраженных нарушений со стороны мочевыводящих путей (объем остаточной мочи менее 50 мл, IPSS менее 17 баллов, максимальная скорость мочеиспускания >10 мл/сек). Оценка лучевых осложнений (токсичности) осуществлялась в соответствии с общепринятыми критериями RTOG/EORTC (1995) и с учетом терминологических рекомендаций CTCAE v4.0 (2009). Результаты. Медиана наблюдения в группах СЛТ составила: I группа - 39,2 [30,7; 48,7] (20,3-69,8) мес, II группа -37,0 [30,9; 47,9] (23,7-50,7) мес (р=0,8). Трехлетняя выживаемость без биохимического рецидива в исследуемых группах независимо от схемы подведения boost составила 77,1 % (I группа - 75,9 %, II группа - 77,8 %) (p=0,7). Трехлетняя безрецидивная выживаемость у пациентов высокого и крайне высокого риска независимо от схемы СЛТ составила 88,6 и 70,8 % соответственно (р=0,04). Ранние и поздние лучевые осложнения со стороны органов мочеполовой системы и желудочно-кишечного тракта IV-V степени не зарегистрированы. Значимая ранняя мочеполовая лучевая токсичность (Р-МПЛТ) и ранняя прямокишечно-интестинальная лучевая токсичность (Р-ПИЛТ) (III степени) зарегистрированы в I группе в 13,5 и 12,3 %, во II - в 17,6 и 5,9 % случаев соответственно. Наиболее значимым вариантом поздних нарушений явилось формирование стриктуры уретры (один пациент I группы) и постлучевого стеноза прямой кишки (один пациент II группы). Оценка уровня эректильной функции (ЭФ) в обеих группах продемонстрировала существенное снижение показателей удовлетворенности качеством половой жизни, что, вероятно, может быть объяснено не только лучевым повреждением структур, отвечающих за гемодинамику полового члена, но и кастрационным синдромом вследствие длительной гормональной депривации у подавляющего числа больных групп СЛТ. Выводы. Проведение СЛТ на основе БТ-ВМД сопровождается приемлемым уровнем осложнений со стороны мочеполовой системы и прямой кишки, представляя собой высокоэффективный метод радикального лечения больных РПЖ групп высокого и крайне высокого риска рецидива.
Рак предстательной железы, сочетанная лучевая терапия, брахитерапия, брахитерапия источником высокой мощности дозы, радиотерапия, лучевая токсичность, осложнения
Короткий адрес: https://sciup.org/140254320
IDR: 140254320 | УДК: 616.65-006.6-08:615.849.1 | DOI: 10.21294/1814-4861-2020-19-1-40-49
Текст научной статьи Сочетанная лучевая терапия рака предстательной железы с использованием брахитерапии источником высокой мощности дозы: сравнительная характеристика двух режимов
В последние десятилетия роль лучевой терапии в лечении больных РПЖ различных групп риска существенно возросла (EAU guidelines 2017, 2018). Реализация возможности подведения тумороцидных доз к облучаемым структурам с высоким градиентом падения лучевой нагрузки на критические органы за счет развития современных методик позволила сделать этот вид лечения относительно безопасным. К числу таких технических решений в полной мере можно отнести модулированную по интенсивности лучевую терапию (IMRT), в том числе в режиме модуляции по объему (RapidArc) и брахитерапию источниками высокой мощности дозы.
Оказание помощи больным РПЖ высокого и крайне высокого риска рецидива связано с рядом сложностей. Длительное время в качестве основной лечебной опции у этой категории пациентов рассматривалась радикальная простатэктомия.
Значительная степень распространенности заболевания и высокая агрессивность его течения требуют особых подходов в хирургической технике: выполнения расширенной (суперрасширенной) лимфаденэктомии, широкого иссечения тканей на этапе апикальной диссекции и обработки шейки мочевого пузыря, кроме того существуют технические сложности при сохранении сосудистонервных пучков. Это ведет к серьезному снижению качества жизни пациентов за счет повышенного риска осложнений, к наиболее значимым из которых относятся: недержание мочи, стриктуры зоны везико-уретрального анастомоза, внутритазовые лимфокисты, лимфостаз нижних конечностей и тяжелые формы эректильной дисфункции. Высокий риск послеоперационного прогрессирования РПЖ обусловливает необходимость частого назначения адъювантной или спасительной лучевой терапии, ведущей к лучевой токсичности.
Альтернативным путем лечения неблагоприятных форм РПЖ является СЛТ, подразумевающая сочетание нескольких видов лучевого воздействия совместно с длительной (2–3 года) гормональной депривацией. Облучение предстательной железы и путей регионарного тазового лимфооттока может осуществляться двумя путями. В первом случае выполняется профилактическое или элективное облучение области малого таза до СОД 46–50 Гр. Такой вариант подразумевает воздействие на возможные субклинические микроочаги, когда данные лучевых методов диагностики указывают на отсутствие вовлеченности в процесс регионарных лимфатических узлов (РЛУ). В случае их поражения подведение стандартной СОД в 50 Гр недостаточно для достижения полного локального контроля над опухолью. Это особенно важно при низкой степени дифференцировки аденокарциномы, характеризующейся большей величиной гипоксической фракции и, как следствие, высокой радиорезистентностью. У данных пациентов использование методов прецизионной лучевой терапии дает возможность подводить на увеличенные РЛУ дополнительную дозу, достигающую 70 Гр и выше.
Важнейший вопрос технологии СЛТ – выбор методики подведения дополнительной лучевой нагрузки на область локализации первичного очага (boost), то есть предстательной железы и семенных пузырьков. На современном этапе развития лучевой терапии идея локальной эскалации дозы практически может быть осуществлена тремя путями: с помощью стереотаксический лучевой терапии, брахитерапии источником низкой мощности дозы и БТ-ВМД. Радиобиологические особенности РПЖ и возможности БТ-ВМД с точки зрения оптимизации режимов подведения и пространственного распределения дозы позволяют рассматривать БТ-ВМД в качестве важного компонента СЛТ.
Цель исследования – оценить результаты лечения больных раком РПЖ групп высокого и крайне высокого риска рецидива с помощью СЛТ, когда в качестве метода дополнительного облучения предстательной железы используется БТ-ВМД в виде 2 фракций по 10 Гр или 1 фракции в 15 Гр.
Материал и методы
С июля 2012-го по июнь 2017 г. в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России СЛТ проведена 98 больным РПЖ. В зависимости от схемы подведения брахитерапевтического boost пациенты были разделены на группы: две фракции БТ-ВМД по 10 Гр – 81 (82,7 %) пациент (I группа) и одна фракция в 15 Гр – 17 (17,3 %) больных (II группа).
Критериями включения являлись: высокий или крайне высокий риск рецидива, отсутствие данных за отдаленные метастазы, отсутствие выраженных нарушений со стороны мочевыводящих путей:
объем остаточной мочи менее 50 мл, IPSS менее 17 баллов, максимальная скорость мочеиспускания Qmax≥10 мл/сек. Оценка функции нижних мочевыводящих путей и желудочно-кишечного тракта проводилась с помощью урофлоуметрии, заполнения дневников мочеиспускания и дефекации, а также опросника IPSS. Оценка эректильной функции осуществлялась при помощи международного индекса эректильной функции (МИЭФ-5).
Распределение больных в соответствии с риском рецидива (NCCN, 2010) [1] в обеих группах было одинаковым: пациенты с высоким и крайне высоким риском рецидива РПЖ в I и II группах составили 40,7 %, 59,3 % и 35,3 %, 64,7 % соответственно (р=0,6). Признаки поражения РЛУ (увеличение при КТ или МРТ) имели место у 32 (32,7%) из 98 пациентов: в I группе – 28 (34,6%), во II группе – 4 (23,5%) больных.
Наиболее частым вариантом гормональной депривации был прием агонистов гонадотропин-рилизинг гормона (I группа – 40,7 %, II группа – 23,5 %) и монотерапия антиандрогенами (II группа – 23,5 %). У 15 (18,5 %) и 4 (23,5 %) больных I и II групп гормональная терапия на момент начала лучевого лечения не проводилась. Общая рекомендованная продолжительность гормональной терапии составляла в среднем 2 года.
Дистанционный этап лечения (конформная дистанционная лучевая терапия) подразумевал подведение 46–50 Гр (разовая очаговая доза 2 Гр) к предстательной железе, семенным пузырькам и зонам регионарного лимфооттока (RTOG, 2009) [2]. Для проведения конформной ДЛТ использовался линейный ускоритель «Novalis Tx» Varian (США) с энергией тормозного рентгеновского излучения 18 МэВ. Пациентам, у которых имелись данные за поражение РЛУ, на увеличенные узлы подводилась дополнительная доза по схеме: три фракции по 4 Гр, что в пересчете на эквивалентную дозу при α/β – 1,5 Гр суммарно составляло 68,9 Гр. Через три недели после ДЛТ осуществлялась БТ-ВМД на аппарате Microselectron (192Ir). Детальное описание методики БТ-ВМД было представлено нами ранее [3, 4], что соответствовало стандартному протоколу GEC-ESTRO [5]. У всех пациентов за одну госпитализацию выполнялся 1 сеанс ВДБТ по схеме – 1 фракция за 1 имплантацию.
Биохимический рецидив после проведенного лечения определяли в соответствии с рекомендациями согласительной конференции RTOG-ASTRO: повышение сывороточного уровня ПСА более 2 нг/мл относительно наименьшего полученного значения ПСА после завершения лечения [6].
Оценка лучевых осложнений (токсичности) после ЛТ осуществлялась в соответствии с общепринятыми критериями RTOG/EORTC (1995) и с учетом терминологических рекомендаций CTCAE v4.0. (2009) [7, 8]. Выделяли раннюю (2–6 мес) и позднюю (12 мес и более) мочеполовую лучевую токсичность (Р-МПЛТ и П-МПЛТ) и раннюю прямокишечно-интестинальную лучевую токсичность (Р-ПИЛТ и П-МПИЛТ).
Результаты
Ранние лучевые осложнения СЛТ. Заполнение дневника мочеиспускания выявило достоверную отрицательную динамику по всем его показателям в обеих группах по сравнению с исходными показателями (р<0,001). В табл. 1 представлены медианы основных показателей функции мочеполовой системы через 2 мес после СЛТ.
Выявлен достаточно высокий процент недержания мочи у пациентов в ранний период после СЛТ: I группа – 20 (24,6 %), II группа – 2 (11,8 %) человека. Во всех случаях инконтиненция носила ургентный характер и, как правило, была представлена легкой степенью нарушений.
Отсутствие эректильной функции или выраженная дисфункция суммарно составили в I группе 71,6 %, во II – 70,5 % наблюдений. Столь существенное снижение уровня эрекции по сравнению с исходным, вероятно, обусловлено двумя основными причинами: длительной гормональной терапией и лучевым повреждением сосудистых структур.
У 11 (13,5 %) и 3 (10,0 %) пациентов I и II групп была выявлена Р-МПЛТ III степени (табл. 2). Во всех случаях отнесение к этой категории осложнений было обусловлено наличием видимой примеси крови в моче при мочеиспускании и выраженным болевым синдромом. При двух фракциях по 10 Гр отмечаются более выраженные ранние лучевые реакции II–III степени по сравнению с одной фракцией в 15 Гр. Вместе с тем различия имеют незначимый характер.
Длительная диарея наблюдалась в 19,8 и 23,5 % случаев соответственно. Болевой синдром в области прямой кишки вне акта дефекации имел место у 19 (23,5 %) больных I группы: незначительная боль (не требующая назначения анальгетиков) – у 12 (14,8 %) и выраженная (требующая назначения ненаркотических анальгетиков) – у 7 (8,6 %) на- блюдаемых. Во II группе болезненные ощущения вне акта дефекации отмечены у 3 (17,6 %) пациентов, у двух (11,8 %) из которых боль носила незначительный характер. Примесь крови в стуле отмечалась в 33,3 % (I группа) и 29,4 % (II группа) случаев. Наличие выраженной примеси крови при дефекации, которая определялась по устойчивому характеру, наблюдавшейся при каждом акте, наряду с обильным выделением слизи служило основанием к включению этих пациентов в группу Р-ПИЛТ III степени (табл. 2).
Поздние лучевые осложнения СЛТ. Не было отмечено ни одного случая тяжелых осложнений IV–V степени как со стороны нижних мочевыводящих путей, так и со стороны желудочно-кишечного тракта (табл. 3, 4). Среди 83 пациентов с периодом наблюдения не менее 1 года отмечен 1 (1,2 %) случай формирования стриктуры уретры (П-МПЛТ III степени) из группы, в которой локальная эскалация дозы осуществлялась посредством двух фракций БТ-ВМД по 10 Гр. Больному была выполнена трансуретральная резекция простаты с удовлетворительными результатами.
С течением времени частота лучевых осложнений уменьшается. Межгрупповое сравнение частоты и выраженности П-МПЛТ при различных схемах подведения boost демонстрирует отсутствие различий по данному показателю в группах в течение всего периода изучения – 12 мес (р=0,54); 24 мес (р=0,17); 36 мес (р=0,22).
Наиболее часто в первый год после окончания СЛТ регистрировались изменения, которые можно отнести к П-ПИЛТ I степени: в I группе – 52,2 %, во II – 56,2 %. Выраженная (≥III степени) П-ПИЛТ выявлена у 1 пациента II группы, у которого на втором году после облучения сформировалось рубцовое сужение прямой кишки, диагностированное при ректороманоскопии. Значимых различий по показателю П-ПИЛТ в периоды наблюдений через 12, 24 и 36 мес в сравниваемых группах не выявлено (р=0,33, р=0,08, р=0,81 соответственно).
Отмечены значимые изменения статуса ЭФ в зависимости от времени, прошедшего с момента
Таблица 1/Тable 1
Характеристика исследуемых групп через 3 мес после СЛТ РПЖ
Characteristics of the studied groups 3 months after radiotherapy in patients with prostate cancer
|
Параметр/Parameter |
I группа/Group I |
II группа/Group II |
р |
|
Число мочеиспусканий / Urinary frequency |
10,0 [9,0; 12,0] (6,0–15,0) |
9,0 [8,0; 11,0] (7,0–12,0) |
0,06 |
|
IPSS, балл/Point |
16,0 [12,0;19,0] (8,0–30,0) |
14,0 [10,0; 17,0] (7,0–21,0) |
0,09 |
|
Qmax, мл/сек/ml/sec |
12,8 [10,0; 15,0] (7,0–30,0) |
12,0 [11,0; 16,0] (6,5–23,0) |
0,7 |
|
ООМ, см3 |
30,0 [20,0; 40,0] (0,0–75,0) |
30,0 [20,0; 35,0] (0,0–65,0) |
0,6 |
|
МИЭФ-5, балл / IIEF-5, point |
5,0 [2,0; 11,0] (1,0–20,0) |
4,0 [1,0; 11,0] (1,0–17,0) |
0,5 |
Таблица 2/table 2
|
Токсичность/ Toxicity |
Р-МПЛТ/ Early urinary radiation-induced toxicity |
Р-ПИЛТ/ Early rectal intestinal radiation toxicity |
||
|
I группа/ Group I |
II группа/ Group II |
I группа/ Group I |
II группа/ Group II |
|
|
Отсутствует / No evidence |
4 (4,9 %) |
19 (23,5 %) |
5 (29,4 %) |
|
|
I степени / Grade I |
43 (53,1 %) |
9 (52,9 %) |
36 (44,4 %) |
8 (47,1 %) |
|
II степени / Grade II |
23 (28,5 %) |
5 (29,5 %) |
16 (19,8 %) |
3 (17,6 %) |
|
III степени / Grade III |
11 (13,5 %) |
3 (17,6 %) |
10 (12,3 %) |
1 (5,9 %) |
|
IV степени / Grade IV |
||||
|
Всего / Total |
81 (100 %) |
17 (100 %) |
81 (100 %) |
17 (100 %) |
|
Таблица 3/table 3 Поздняя лучевая токсичность со стороны нижних мочевых путей после СЛТ late radiation-induced urinary toxicity |
||||||
|
12 мес/12 months |
24 мес/24 months |
36 мес/36 months |
||||
|
П-МПЛТ/Late urinary |
||||||
|
radiation-induced toxicity |
I группа/ |
II группа/ |
I группа/ |
II группа/ |
I группа/ |
II группа/ |
|
Group I |
Group II |
Group I |
Group II |
Group I |
Group II |
|
|
Отсутствует / No evidence |
14 (20,9 %) |
6 (37,5 %) |
15 (31,2 %) |
4 (44,5 %) |
8 (34,8 %) |
2 (50,0 %) |
|
I степени / Grade I |
35 (52,2 %) |
7 (43,7 %) |
26 (54,2 %) |
2 (22,2 %) |
10 (43,5 %) |
|
|
II степени / Grade II |
17 (25,4 %) |
3 (18,3 %) |
7 (14,6 %) |
3 (33,3 %) |
5 (21,7 %) |
2 (50,0 %) |
|
III степени / Grade III |
1 (1,5 %) |
|||||
|
Всего / Total |
67 (100 %) |
16 (100 %) |
48 (100 %) |
9 (100 %) |
23 (100 %) |
4 (100 %) |
Таблица 4/table 4
Ранняя лучевая токсичность после СЛТ early radiation-induced urinary toxicity
Поздняя прямокишечно-интестинальная лучевая токсичность после СЛТ late radiation-induced rectal intestinal toxicity
Эффективность СЛТ РПЖ. За время исследования в группе из 98 человек летальных исходов не было, то есть трехлетняя общая выживаемость составила 100,0 %. Трехлетняя выживаемость без биохимической прогрессии в группах независимо от схемы СЛТ – 77,1 % (I группа – 75,9 %, II группа – 77,8 %) (рис. 1а). Трехлетняя безрецидивная выживаемость у пациентов высокого и крайне высокого риска – 88,6 и 70,8 % соответственно (рис. 1б).
Биохимический рецидив установлен у 20 (20,4 %) из 98 пациентов. Из этого числа 3 (15,0 %) больных принадлежали к группе высокого, 17 (85 %) – крайне высокого риска рецидива. Обследование позволило выявить причину роста ПСА у 15 из 20 пациентов (2 – из группы высокого риска, 13 – из группы крайне высокого
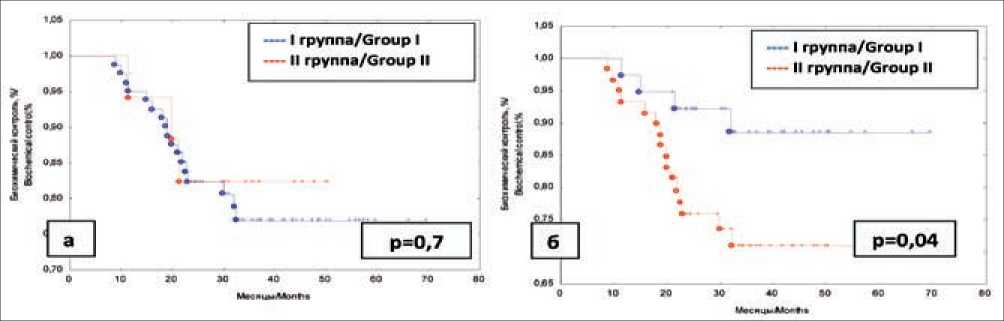
Рис. 1. Безрецидивная выживаемость (биохимический контроль) после СЛТ: А – в зависимости от схемы СЛТ; Б – в зависимости от группы риска по NCCN (2010) Fig. 1. Disease-free survival (biochemical control) after radiotherapy.
А – radiotherapy regimen; Б – risk groups defined by the NCCN guidelines (2010)
риска). Для клинической диагностики рецидива использовалась ПЭТ/КТ (11С-холин, 68Ga-ПМСА) и данные биопсии простаты. При оценке клинического рецидива различали прогрессию в области ПЖ, РЛУ, отдаленных лимфоузлов и костные метастазы.
Местный рецидив в области ПЖ за весь период наблюдения отмечен у 4 (26,7 %) из 15 пациентов с биохимическим рецидивом. Все эти больные принадлежали к группе крайне высокого риска и получали boost на предстательную железу в виде двух фракций БТ-ВМД по 10 Гр (I группа).
Признаки поражения РЛУ, по данным ПЭТ/КТ, как возможная причина биохимической прогрессии определены у 6 (40,0 %) (все I группа) из 15 больных, которые принадлежали к группе крайне высокого риска. Из 6 больных с рецидивом в РЛУ двое входили в группу, состоящую из 57 человек, которые на момент проведения СЛТ имели категорию сN0, а 4 (15,4 %) из 26 пациентов с признаками инвазии в РЛУ (сN1) (р=0,07).
Вовлечение в процесс отдаленных ЛУ выявлено у 8 (53,3 %) из 15 пациентов (7 – из группы крайне высокого риска, 1 – из группы высокого риска рецидива). Во всех случаях рецидив определен в зоне парааортальных ЛУ, которые на момент начала лечения были признаны интактными. Костные метастазы обнаружены у 6 из 15 больных с диагностированным рецидивом РПЖ (2 – из группы высокого риска, 4 – из группы крайне высокого риска рецидива).
Обсуждение
Выбор СЛТ в качестве компонента комбинированного лечения больных РПЖ основывается на определении риска поражения РЛУ. В радиотерапии наибольшее распространение получили методы оценки риска поражения тазовых лимфатических узлов, предложенные M. Роасh et al. [9] и A. Briganti et al. [10]. В настоящее время считается стандартным облучение внутритазовых путей лимфооттока с профилактической СОД в 46–50 Гр при
Таблица 5/table 5
Статус эректильной функции после СЛТ the erectile function status after radiotherapy
|
12 мес/12 months |
24 мес/24 months |
36 мес/36 months |
||||
|
МИЭФ-5, балл/ IIEF-5, point |
I группа/ |
II группа/ |
I группа/ |
II группа/ |
I группа/ |
II группа/ |
|
Group I |
Group II |
Group I |
Group II |
Group I |
Group II |
|
|
ЭД отсутствует / No evidence of erectile dysfunction (ED) |
1 (2,0 %) |
|||||
|
Легкая ЭД / Mild ED |
7 (10,4 %) |
3 (6,3 %) |
2 (8,7 %) |
|||
|
Умеренная ЭД / Moderate ED |
9 (13,4 %) |
5 (31,3 %) |
3 (6,3 %) |
3 (33,3 %) |
2 (8,7 %) |
1 (25,0 %) |
|
Выраженная ЭД / Severe ED |
19 (28,4 %) |
3 (18,7 %) |
17 (35,4 %) |
1 (11,1 %) |
11 (47,8 %) |
|
|
Отсутствие ЭФ / No evidence of ED |
32 (47,8 %) |
8 (50,0 %) |
24 (50,0 %) |
5 (55,6 %) |
8 (34,8 %) |
3 (75,0 %) |
|
Всего/Total |
67 (100 %) |
16 (100 %) |
48 (100 %) |
9 (100 %) |
23 (100 %) |
4 (100 %) |
отсутствии клинических данных, свидетельствующих о вовлеченности их в опухолевый процесс и рассчитанном риске, превышающем 15 %.
Вместе с тем необходимо отметить, что, по данным трех многоцентровых рандомизированных проспективных исследований, облучение тазовых лимфатических узлов в дополнение к лучевой терапии на предстательную железу не приводит к достоверному повышению показателей общей и безрецидивной выживаемости [11–13]. Тем не менее многие авторы рассматривают лучевую терапию на область тазовых лимфатических узлов в качестве неотъемлемого компонента лучевого лечения у пациентов группы высокого риска [14]. Проводимое проспективное рандомизированное исследование RTOG 0924, вероятно, позволит окончательно ответить на этот вопрос.
Принцип локальной эскалации дозы на область предстательной железы технически может быть реализован посредством различных видов лучевой терапии: стереотаксической, низкомощностной брахитерапии и БТ-ВМД. Учитывая преимущества внутритканевой лучевой терапии источником высокой мощности дозы, наиболее адекватным и распространенным является сочетание ДЛТ и высокомощностной брахитерапии [14]. Длительное время брахитерапевтический boost в виде двух фракций по 10 Гр считался стандартным. Однако в последнее время он уступает схеме, в которой подведение дополнительной лучевой нагрузки на железу осуществляется посредством единственной фракции в 15 Гр [15, 16]. В данный момент проводятся исследования RTOG 0924 и RTOG 1115 для обоснования возможности применения единственной фракции БТ-ВМД в качестве стандартной методики [17].
G. Morton et al. [17] проанализировали результаты 22 исследований, посвященных СЛТ РПЖ (около 5 000 пациентов со средней продолжительностью наблюдения не менее 10 лет). Во всех случаях в качестве boost применялась БТ-ВМД. Средние показатели выживаемости без признаков биохимического рецидива составили 95, 91 и 82 % в группах низкого, промежуточного и высокого риска соответственно. Выраженная поздняя лучевая токсичность (III степени) со стороны прямой кишки отмечена в 0–3 % и мочеполовой системы – в 1–14 % случаев. Схожая эффективность СЛТ на основе БТ-ВМД приставлена в работе B. De Bari et al. [18], авторы показали отсутствие роста ПСА после окончания лечения отмечено у 90–100, 69–97 и 63–97 % для групп низкого, промежуточного и высокого риска соответственно.
СЛТ обеспечивает превосходный контроль над опухолевым процессом по сравнению с альтернативными методами, даже при условии достижения в них значительного повышения дозы. Сравнительный анализ результатов СЛТ и дистанционной лучевой терапии с эскалацией дозы до 86,4 Гр представлен D. Spratt et al. [19]. В исследование вошло 870 больных группы промежуточного риска, которым проводилась модулированная по интенсивности ДЛТ в СОД 86,4 Гр и СЛТ в виде модулированной по интенсивности ДЛТ в СОД 50,4 Гр и последующей брахитерапии. Средний период наблюдения составил 5,3 года. Оба показателя выживаемости – отсутствие биохимической прогрессии и появление отдаленных метастазов – были значительно выше в группе СЛТ – 92 против 81 % и 97 против 93 % соответственно.
A.L. Liss et al. [20] сообщили о преимуществах СЛТ в группе пациентов, имеющих паттерн суммы Gleason 5 как один из наиболее значимых неблагоприятных факторов прогноза. Было установлено, что 5-летняя выживаемость без признаков биохимической прогрессии, безметастатическая, канцер-специфическая и общая выживаемость составили 89, 89, 93 и 88 % по сравнению с 65, 67, 78 и 67% при стандартной ДЛТ соответственно.
В работе специалистов группы Американского общества брахитерапевтов (2017) осуществлен сравнительный анализ эффективности СЛТ по сравнению с ДЛТ и РПЭ на результатах исследований, опубликованных с 2005 по 2016 г. [14]. Сроки наблюдения больных находились в интервале от 8 до 16 лет. В случае СЛТ, где локальная эскалация дозы осуществляется посредством БТ-ВМД на фоне длительной гормональной депривации, показатель биохимического контроля находился в интервале от 54 до 84 %. Отсутствие биохимического рецидива после лечения с помощью ДЛТ (+гормональная терапия) или радикальной простатэктомии наблюдалось значительно реже – 37–69 и 27–68 % соответственно. A. Kishan et al. [21] выполнили ретроспективное изучение исходов лечения 487 пациентов с РПЖ с суммой Gleason 9–10: 230 больных – ДЛТ, 87 – СЛТ и 170 – РПЭ. Медиана длительности наблюдения составила 4,6 года. Наиболее часто спасительное лечение требовалось после радикальной простатэктомии – в 49 % (местное) и 30,1 % (системное), после ДЛТ – 0,9 и 19,7 %, СЛТ – 1,2 и 16,1 % соответственно (p<0,001). Показатели 5 и 10-летней выживаемости без появления отдаленных метастазов были существенно выше при СЛТ (94,6 и 89,8 %), в то время как после ДЛТ и простатэктомии эти показатели составили 78,7 и 66,7 % (p=0,0005) против 79,1 и 61,5 % (p<0,001) соответственно.
На данный момент опубликованы результаты трех проспективных исследований III фазы, посвященных сравнению СЛТ и ДЛТ РПЖ [22–24]. Во всех исследованиях продемонстрировано превосходство СЛТ над ДЛТ. В самом большом исследовании ASCENDE-RT 398 пациентов (276 группы высокого риска) были рандомизированы в две группы: первые получали ДЛТ в СОД 78 Гр, вторые – СЛТ (46 Гр на область малого таза + НДБТ (125I) в качестве boost) [24]. Все пациенты принимали гормональную терапию длительностью один год. Оценивалась выживаемость без биохимической прогрессии по двум критериям рецидива – хирургическому (ПСА>0,2 нг/мл) и радиотерапевтическому (минимальное значение ПСА после лечения + 2 нг/мл). В соответствии с хирургическим критерием биохимического рецидива после девяти лет наблюдения преимущество СЛТ составило 51 % (82,2 против 31,5 %; p<0,0001). У 276 пациентов группы высокого риска при той же длительности наблюдения разница в показателях выживаемости на основе радиотерапевтического критерия составила 20 % в пользу СЛТ: 78 против 58 % (p=0,05).
R. Marshall et al. [25] представили результаты использования брахитерапии при лечении 2 495 больных РПЖ. У 943 человек брахитерапия сочеталась с ДЛТ на область малого таза. Согласно полученным данным, 56 % наблюдаемых отмечали острую МПЛТ с повышением средних значений IPSS на 1,9 пункта в течение первых 12 мес. Однако 10 % пациентов более 1 года предъявляли жалобы на выраженные расстройства мочеиспу- скания. После завершения модулированной по интенсивности ДЛТ (СОД на простату 86,4 Гр) и СЛТ (низко- и высокомощностная брахитерапия) 7-летняя поздняя токсичность со стороны прямой кишки II степени составила 4,6 и 4,1 % (p=0,89), III степени – 0,4 и 1,4 % (p=0,36) соответственно [19]. Частота поздних лучевых осложнений III степени со стороны мочевыводящих путей после ДЛТ и СЛТ составила 3,1 и 1,4 % (p=0,74). Сохранность эректильной функции в наблюдаемых группах была схожей – 57,8 и 55 % соответственно.
Список литературы Сочетанная лучевая терапия рака предстательной железы с использованием брахитерапии источником высокой мощности дозы: сравнительная характеристика двух режимов
- Mohler J., Bahnson R.R., Boston B., Busby J.E., D'Amico A., Eastham J.A., Enke C.A., George D., Horwitz E.M., Huben R.P., Kantoff P., Kawachi M., Kuettel M., Lange P.H., Macvicar G., Plimack E.R., Pow-Sang J.M., Roach M. 3rd, Rohren E., Roth B.J., Shrieve D.C., Smith M.R., Srinivas S., Twardowski P., Walsh P.C. NCCN clinical practice guidelines in oncology: prostate cancer. J Natl Compr Canc Netw. 2010 Feb; 8(2): 162-200. DOI: 10.6004/jnccn.2010.0012
- Новиков С.Н., Канаев С.В., Новиков Р.В., Ильин Н.Д., Готовчикова М.Ю. Высокодозная брахитерапия рака предстательной железы в режиме реального времени с использованием источника 192-Ir (особенности дозиметрического планирования). Вопросы онкологии 2015; 61(1): 130-6.
- Новиков С.Н., Канаев С.В., Новиков Р.В., Ильин Н.Д., Готовчикова М.Ю, Гиршович М.М. Клинический опыт использования брахитерапии источниками высокой мощности дозы для монотерапии больных раком предстательной железы. Вопросы онкологии 2018; 64(3): 366-73.
- Lawton C.A., Michalski J., El-Naqa I., Buyyounouski M.K., Lee W.R., Menard C., OMeara E., Rosenthal S.A., Ritter M., Seider M. RTOG GU Radiation oncology specialists reach consensus on pelvic lymph node volumes for high-risk prostate cancer. Int J Radiat Oncol Biol Phys. 2009 Jun; 74 (2): 383-7. DOI: 10.1016/j.ijrobp.2008.08.002
- Hoskin P.J., Colombo A., Henry A., Niehoff P., Paulsen Hellebust T., Siebert F.A., Kovacs G. GEC/ESTRO recommendations on high dose rate afterloading brachytherapy for localised prostate cancer: an update. Radiother Oncol. 2013 Jun; 107 (3): 325-32. 10.1016/j. radonc.2013.05.002. DOI: 10.1016/j.radonc.2013.05.002


