Сочетанное поражение плевральных листков при COVID-19 (клинические наблюдения)
Автор: Салимов Дмитрий Шамильевич, Воробьев Александр Александрович, Веденин Юрий Игоревич, Глушков Илья Викторович, Крайнюков Павел Евгеньевич
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (74), 2022 года.
Бесплатный доступ
Дистресс-синдром является пусковым механизмом к развитию внутриплевральных осложнений, приводящих к более тяжелому течению заболевания, а порой и летальному исходу при COVID-19-ассоциированных пневмониях. Проанализированы два случая спонтанного пневмомедиастинума, спонтанного пневмоперикардита, спонтанного пневмоторакса и подкожной эмфиземы. Ведущую роль в развитии плевральных осложнений играет тяжелое диффузное альвеолярное повреждение на фоне новой коронавирусной пневмонии.
Covid-19, спонтанный пневмомедиастинум, спонтанный пневмоперикардит, спонтанный пневмоторакс, подкожная эмфизема
Короткий адрес: https://sciup.org/142235241
IDR: 142235241 | УДК: 617-089.844
Текст научной статьи Сочетанное поражение плевральных листков при COVID-19 (клинические наблюдения)
Пациенты с тяжелой формой COVID-19-ассоциированной пневмонией составляют основную массу больных отделений реанимации и интенсивной терапии (ОРИТ) ковидных госпиталей в период пандемии. У 40 % пациентов, госпита- лизированных в ОРИТ, развивается острый респираторный дистресс-синдром (ОРДС), который является одним из ключевых патогенетических факторов, определяющих тяжесть течения заболевания [1, 2]. ОРДС является пусковым меха- низмом к развитию внутриплевральных осложнений, приводящих к более тяжелому течению заболевания, а порой их летальному исходу при COVID-19 ассоциированных пневмониях [3, 4].
ЦЕЛЬ РАБОТЫ
Представить опыт лечения пациентов с осложнениями COVID-19-ассоциированных пневмоний, приведшим к развитию спонтанного пнев-момедиастинума (СПМ), спонтанного пневмоперикардита (СПП), спонтанного пневмоторакса (СП) и подкожной эмфиземы (ПЭ) без применения интубационной вентиляции легких.
Клинический пример 1
Пациентка С. (67 лет) госпитализирована в стационар на 10-е сутки заболевания с жалобами на сильный кашель, нарастающую одышку, головную боль, общую слабость, повышение температуры до 38,5 °С. При поступлении получен положительный результат ПЦР-теста на COVID-19. При рентгенографии органов грудной клетки (РОГК) обнаружена правосторонняя пневмония. Больная госпитализирована в инфекционное отделение.
Глюкокортикоидная, антикоагуляционная, противовирусная, симптоматическая терапия проводилась на всем протяжении лечения. Начата оксигенотерапия через носовые канюли с потоком 12–15 л/мин, в том числе в прон-позиции. На 3-и сутки госпитализации больная отметила нарастание одышки.
При выполнении компьютерной томографии органов грудной клетки (КТ ОГК) на фоне двухсторонних изменений по типу «матового стекла», ретикулярных изменений определялись многочисленные скопления воздуха в переднем средостении, обширные участки подкожной эмфиземы мягких тканей шеи (преимущественно справа), малый правосторонний пневмоторакс (рис. 1).
Больная переведена в ОРИТ, консультирована торакальным хирургом. Принято решение о консервативном лечении с динамическим наблюдением. На контрольной КТ ОГК через 2 суток увеличения объема свободного воздуха в плевральной полости не обнаружено, нарастания СПМ и подкожной эмфиземы не выявлено. Больная продолжила лечение в условиях ОРИТ. Клинически и по данным КТ, подкожная эмфизема регрессировала на 15-е сутки. Явления спонтанного пневмомедиастинума по дан- ным КТ ОГК сохранялись вплоть до выписки больной на 43 день.
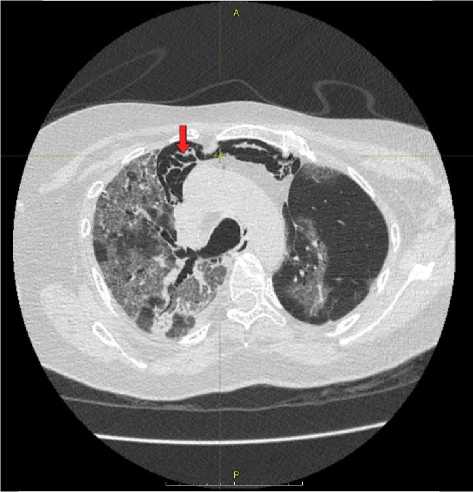
Рис. 1. КТ ОГК пациентки С., 67 лет
Клинический пример 2
Пациент Р. (49 лет) поступил в стационар на 4-е сутки после появления признаков ОРВИ. Из анамнеза: сахарный диабет II типа на протяжении 18 лет (ИМТ = 35,4 кг/м2).
На момент поступления основные жалобы предъявлял на тяжелый кашель. ПЦР-тест на COVID-19 положительный. КТ ОГК при поступлении: объем изменения легочной паренхимы правого легкого – около 6 %, левого легкого – около 5 %.
Проводилась противовирусная, антибактериальная, глюкокортикоидная, антикоагуляционная терапия, оксигенотерапия через назальные канюли с потоком 12–15 л/мин с момента поступления.
Через 4 дня на фоне нарастания дыхательной недостаточности и объема поражения паренхимы легкого больной переведен в ОРИТ. Начата неинвазивная вентиляция легких через маску в режиме СРАР с положительным давлением конца вдоха от 6 до 9 см. вод. ст.
На 2-е сутки нахождения в ОРИТ при выполнении КТ ОГК верифицированы двусторонней пневмоторакс (серая стрелка) и массивная двусторонняя подкожная эмфизема (белая стрелка), пневмомедиастинум, пневмоперитоне-ум (черная стрелка), двусторонняя полисегмен-тарная пневмония COVID-19 (КТ-1) (рис. 2 и 3).
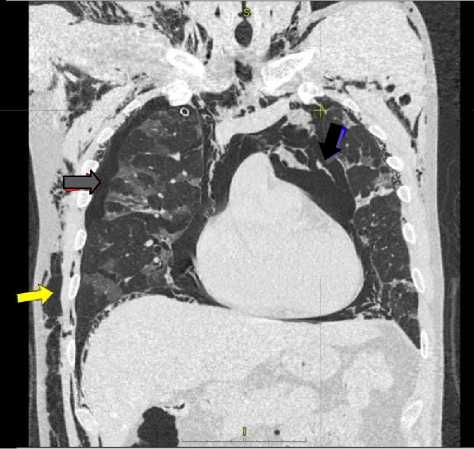
Рис 2. КТ ОГК пациента Р., 49 лет
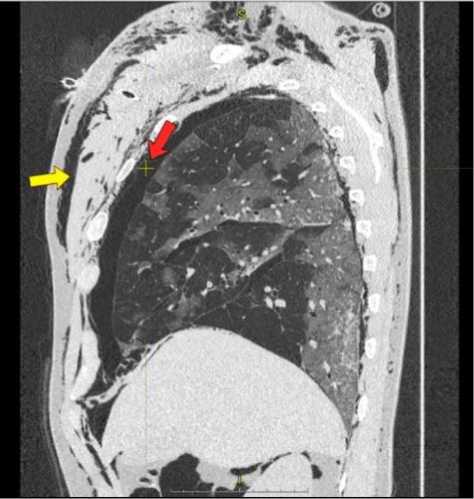
Рис. 3. КТ ОГК Пациент Р., 49 лет
Больной осмотрен торакальным хирургом. Выполнен торакоцентез, дренирование обеих плевральных полостей, применена система активной аспирации. При контрольной РОГК отмечается расправление легких. Появлению пневмомедиастинума и подкожной эмфиземы не предшествовали какие-либо инвазивные манипуляции. Больной получал пищу через рот, назогастральный зонд не устанавливался, рвоты не было. В связи с продолжающимся ухудшением респираторного статуса на 4-е сутки нахождения в ОРИТ больной был переведен на искусственную вентиляцию легких. После чего отмечено значительное прогрессирование подкожной эмфиземы. На 6-е сутки больному была проведена экстракорпоральная мембранная оксигенация, которая в течение следующего месяца проводилась больному неоднократно. Несмотря на проводимое лечение, состояние пациента ухудшалось, нарастала дыхательная, сердечно-сосудистая, полиорганная недостаточность. На 28-е сутки от начала заболевания наступил летальный исход.
ЗАКЛЮЧЕНИЕ
Развитие спонтанного пневмомедиастину-ма, спонтанного пневмоперикардита, спонтанного пневмоторакса и подкожной эмфиземы чаще всего связаны с травмой грудной клетки, перфорацией пищевода, кардиоторакальными оперативными вмешательствами или искусственной вентиляцией легких [5].
Во время вспышки тяжелого острого респираторного синдрома (ТОРС) в 2002–2003 гг. в исследовании, проведенном в Гонконге, сообщалось о заболеваемости СПМ у инфицированных пациентов в 11,6 % случаев [6].
Согласно доступным литературным данным, частота возникновения спонтанного пневмоме-диастинума и спонтанного пневмоперикардита у пациентов с пневмонией, вызванной COVID-19, неизвестна. Считается, что патофизиология спонтанного пневмомедиастинума у пациентов с атипичной пневмонией связана с диффузным альвеолярным повреждением, которое приводит к сбросу воздуха в легочный интерстиций, вызывая пневмомедиастинум [6]. Эта концепция подтверждается патологоанатомическими исследованиями легких при ТОРС, выявляющими обширные признаки острого экссудативного альвеолярного и сосудистого повреждения [7]. Как и вирус SARS, новый вирус SARS-CoV-2 вызывает ОРДС у значительного процента инфицированных пациентов, но механизмы альвеолярного повреждения все еще изучаются.
Однако новые отчеты из Италии и США о вскрытии пациентов с COVID-19 показали, что диффузные альвеолярные повреждения, по-видимому, также являются преобладающим патологическим паттерном легочного повреждения у пациентов с COVID-19 [8, 9]. Иногда накопление давления в средостении приводит к выходу воздуха в плевральную полость (пневмоторакс) или через слабости париетального перикарда (пневмоперикард). Воздух также может поступать в мягкие ткани грудной клетки и в мягкие ткани шеи, вызывая шейно-лицевую подкожную эмфизему [5]. НИВЛ – относительно новая форма вентиляции легких, используемая при лечении ОРДС. НИВЛ обычно обеспечивает более низкое положительное давление конца выдоха, чем ИВЛ, и часть этого давления уходит при открывании рта [10]. Отдельного внимания заслуживает изучение влияния стероидов на развитие внутриплевральных осложнений. Предполагается, что использование стероидов при лечении ОРДС способствует развитию спонтанного пневмомедиастинума за счет ослабления интерстициальной ткани легких, вызывая альвеолярную утечку воздуха [11, 12]. У пациентов, представленных в клинических наблюдениях, основной жалобой был сильный кашель. Приступы кашля, оказывающие давление на уже поврежденные и ослабленные альвеолы из-за пневмонии, вызванной COVID-19, могли напрямую способствовать развитию пневмомедиасти-нума у двух наших пациентов.
Спонтанный пневмомедиастинум, спонтанный пневмоперикардит, спонтанный пневмоторакс и подкожная эмфизема являются осложнением ОРДС COVID-19 ассоциированных пневмоний. Подобные осложнения не всегда являются вентилятор-ассоциированными, возникающими вследствие баротравмы, а могут развиваться на фоне самостоятельного дыхания. В патогенезе развития осложнений ведущую роль играет тяжелое диффузное альвеолярное повреждение на фоне вирусной пневмонии, что делает возможным повреждение легких при сильном кашле и интенсивном спонтанном дыхании.
6050-48.1.11
2020;153(6):725–733. https:// doi.оrg /10.1093/ajcp/ aqaa062
rheumatology/40.4.476
Список литературы Сочетанное поражение плевральных листков при COVID-19 (клинические наблюдения)
- COVID-19-Associated critical illness-report of the first 300 patients admitted to intensive care units at a New York City Medical Center / S. Chand, S. Ka-poor, D. Orsi [et al.] // J. Intens. Care Med. 2020. Vol. 35, nо. 10. P. 963‒970. https://doi.оrg/10.1177/ 0885066620946692.
- Immunogenetic Predictors of Severe COVID-19 / A. Malkova, D. Kudlay, I. Kudryavtsev [et al.] // Vac-cines. 2021. Nо. 9. Р. 211. https://doi.org/10.3390/ vaccines9030211.
- COVID-19-associated nephritis: early warning for disease severity and complications? / O. Gross, O. Moerer, M. Weber [et al.] // Lancet. 2020. Nо. 395(10236). Р. e87–88. https://doi.org/10.1016/ S0140-6736(20)31041-2
- Cardiovascular complications in patients with COVID-19: consequences of viral toxicities and host immune response / H., Zhu J. W. Rhee, P. Cheng [et al.] // Curr Cardiol Rep. 2020. Nо. 22(5). Р. 32. https://doi.org/10.1007/s11886-020-01292-3
- Pneumomediastinum and pneumopericardium in an 11-year-old rugby player: a case report / V. Vanzo, S. Bugin, D. Snijders [et al.] // J Athl Train. 2013. Nо. 48(2). Р. 277–281. https://doi.org/10.4085/1062-6050-48.1.11
- Spontaneous pneumomediastinum in patients with severe acute respiratory syndrome / C. M. Chu, Y. Y. Leung, J. Y. Hui [et al.] // Eur Respir J. 2004. Nо. 23(6). Р. 802–804. https://doi.org/10.1183/ 09031936.04.00096404
- Gu J., Korteweg C. Pathology and pathogenesis of severe acute respiratory syndrome // Am J Pathol. 2007. Nо. 170(4). Р. 1136–1147. https://doi.org/10.2353/ajpath.2007.061088.
- COVID-19 autopsies, Oklahoma, USA / L. M. Barton, E. J. Duval, E. Stroberg [et al.] // Am J Clin Pathol. 2020. Nо. 153(6). Р. 725–733. https:// doi.оrg/10.1093/ajcp/aqaa062
- Pulmonary post-mortem findings in a large series of COVID-19 cases from northern Italy / L. Carsana, A. Sonzogni, A. Nasr [et al.] // The Lancet Infectious Diseases. 2020. Nо. 20(10). Р. 1135–114. https://doi.оrg/10.1016/S1473-3099(20)30434-5
- Recognizing barotrauma as an unexpected compli-cation of high flow nasal cannula / Z. Chauhan, U. Deonarine, A. R. Esteves [et al.] // Chest. 2019. Nо. 156(4). Р. 1875A–1876A. https://doi.org/ 10.1186/s13019-020-01308-7
- Korkmaz C., Ozkan R., Akay M., Hakan T. Pneu-momediastinum and subcutaneous emphysema as-sociated with dermatomyositis. Rheumatology (Ox-ford). 2001. Nо. 40(4). Р. 476–478. https://doi.org/ 10.1093/rheumatology/40.4.476
- Sachdeva R., Sachdeva S. Coughing leading to spontaneous pneumomediastinum and subcutane-ous emphysema in a young male // Med J DY Patil Univ. 2015. Nо. 8. Р. 344–346.


