Сочетанный метод фотодинамической терапии и электрохимического лизиса
Бесплатный доступ
В результате экспериментальных исследований было показано, что использование сочетанного воздействия электрохимического лизиса (ЭХЛ) в оптимальном для интактных тканей режиме и фотодинамической терапии (ФДТ) способствует более полному уничтожению опухоли. В эксперименте оптимальным сочетанием параметров проведения самостоятельного ЭХЛ является горизонтальное положение электродов, сила тока 30 мА, время воздействия 15 мин. При данных условиях достигается 75% полной регрессии опухолей. Сочетание электрохимической и фотодинамической терапии усиливает эффективность лечения по сравнению с самостоятельным применением обоих методов, позволяя получить до 97% полной регрессии опухолей.
Фотодинамическая терапия, электрохимический лизис, саркома м-1, лазер, фотосенсибилизатор, "фотолон", полная регрессия опухоли, крысы, сочетанный метод лечения, экспериментальное исследование
Короткий адрес: https://sciup.org/170170154
IDR: 170170154
Текст научной статьи Сочетанный метод фотодинамической терапии и электрохимического лизиса
Одной из задач современной медицины является поиск способов повышения эффективности лечения злокачественных новообразований для максимального поражения опухоли при минимальном повреждении здоровых тканей. В последние годы проявляется повышенный интерес к экспериментально-клиническому изучению и совершенствованию фотодинамической терапии (ФДТ) злокачественных опухолей [7, 10, 11, 12, 13].
В эксперименте определены оптимальные дозы препарата, светового и лучевого воздействий, их последовательность и разработаны методы сочетанного применения ФДТ и электрохимического лизиса (ЭХЛ) экспериментальных злокачественных опухолей. Нами была разработана методика ФДТ экспериментальной опухоли саркомы М-1 и проанализированы фотодинамические эффекты при различных параметрах проведения ФДТ [14].
Были изучены патоморфологические изменения опухоли саркомы М-1 при проведении фотодинамической терапии с использованием фотосенсибилизатора «Фотолон», установлена прямая корреляция между противоопухолевыми эффектами и плотностью подведенной световой энергии, определены клеточные и тканевые мишени, механизмы противоопухолевого действия ФДТ с «Фотолоном»; изучено влияние системной ФДТ на количество циркулирующих опухолевых клеток, сывороточных факторов оксидативного стресса [4-6, 16, 17].
Данные экспериментальных исследований служат основой для внедрения новых методик
ФДТ различных новообразований кожи и слизистых.
Однако ограничением применения существующего метода ФДТ является относительно небольшая глубина проникновения лазерного излучения. Поэтому актуальным является сочетание ФДТ с другими известными методами лечения опухолей (лучевая терапия, химиотерапия, хирургия и др.) [14]. Одним из таких, но ещё мало изученных, методов является электрохимиче-
Михайловская А.А. * – зав. лаб., к.б.н., Каплан М.А. – зав. отд., д.м.н., профессор. ФГБУ МРНЦ Минздрава России.
ский лизис. Он относится к области минимально инвазивных технологий. Опухолевая ткань является более восприимчивой к электрохимическим воздействиям, чем здоровая [2].
ЭХЛ представляет собой разрушение биологических тканей под воздействием постоянного электрического тока.
С химико-физической точки зрения, мы можем рассматривать организм как совокупность биологически закрытых электрических контуров, наиболее распространёнными из которых являются замкнутые сосудистые контуры, представляющие собой in vivo питательные каналы всех тканей, включая раковые. Артерии и вены в составе замкнутых контуров имеют в 200 раз более высокое изолирующее свойство стенок по сравнению с проводящей плазмой крови. В силу этого артерии и вены формируют проводящие «кабели», которые также электрически связаны по капиллярам с интерстициальной жидкостью, настолько же электропроводной, как и плазма крови. ЭХЛ новообразований включает в себя также воздействие продуктов электрохимических реакций и транспортировок, которые происходят при взаимодействии электрических и магнитных полей с электрохимической системой [1].
Принцип электрохимического лизиса основывается на возникновении асептического некроза (1 этап) и отсроченного химического воздействия на опухоль продуктами электролиза в виде щелочи, кислоты и соединений платины (2 этап). Источником соединений платины служат сами электроды, вводимые в опухолевую ткань. Гидролиз (разложение воды) приводит к образованию кислотности у анода (положительно заряженный электрод) (H+), рН=2 и щелочности у катода (отрицательно заряженный электрод) (ОН-), рН=12. Эти соединения разрушают ткань вокруг электродов, вызывая коагуляционный (H+) и колликвационный (ОН-) некроз. В кислотном некрозе также участвует Cl 2 . Он составляет малую часть, поскольку относительно большие молекулы Cl 2 , не неся избытка заряда, не могут конкурировать с разрушительным эффектом ионов H+ [3, 15, 18].
Часто полагают, что за все эффекты ЭХЛ ответственны исключительно ионы H+ и ОН- и другие продукты реакций взаимодействия электрод-электролит. Однако ситуация значительно сложнее из-за множества механизмов, связанных с системами, которые приводят к структурным и функциональным эффектам в рамках концепции отдалённого воздействия электромагнитного поля. Поэтому зона окончательного повреждения ткани при ЭХЛ превышает суммарную зону первичного некроза.
Отдалённые эффекты электромагнитного поля в биологических тканях связаны с блокированием микрососудистого русла. Причём в поле катода капилляры блокируются в результате электроосмотического переноса жидкости, а в поле анода – из-за микротромбозов.
При ЭХЛ поле анода привлекает белые клетки крови, которые, как известно, заряжены электроотрицательно. Накопление лейкоцитов in vivo в тканевом поле анода с высокой вероятностью указывает на то, что индуцированная полем активация иммунологической системы вызывается ЭХЛ [18].
В литературе данные по лечению злокачественных новообразований методом электрохимического лизиса являются неполными, основанными в большинстве случаев на клиническом применении данного метода. Поэтому экспериментальная оценка как самостоятельного применения ЭХЛ, так и его сочетания с фотодинамической терапией представляется на сегодняшний день достаточно актуальной.
Методы исследования
Работа выполнена на самках беспородных крыс. В качестве экспериментальной опухоли использовался штамм – саркома М-1. Для проведения ЭХЛ использовали низковольтный трёхканальный аппарат ECU-300 немецкой фирмы Soring GmbH Medizintechnik (рис. 1).
Рис. 1. Аппарат для электрохимического лизиса ECU-300.
Монополярные платиновые электроды вводили горизонтально в основание новообразования. Длина активной части электрода соответствовала протяжённости очага по ходу введения электрода. Здоровая ткань была защищена от активной части с помощью изоляционной канюли. Электроды не соприкасались, их вводили на расстоянии 1 см друг от друга. Для исследований с использованием фотодинамического воздействия применяли препарат хлоринового ряда «Фотолон». В каждом отдельном эксперименте «Фотолон» разводили непосредственно перед применением. Введение осуществляли двумя способами: внутрибрюшинно и внутрь опухоли. Облучение проводили на полупроводниковом лазерном аппарате «Аткус-2».
Сочетанную терапию проводили следующим образом.
В первой серии опытов сначала проводили ЭХЛ, через 1 сутки внутрибрюшинно вводили фотосенсибилизатор (ФС) и через 1 час после введения ФС проводили ФДТ.
Во второй серии внутрибрюшинно вводили ФС, через 1 час проводили электрохимический лизис, а затем сразу после ЭХЛ – фотодинамическую терапию.
В третьей серии делали ЭХЛ, после чего сразу вводили фотосенсибилизатор внутрь опухоли и через 10 мин после введения ФС проводили ФДТ.
В качестве контроля использовали 2 группы животных:
-
• интактные крысы-опухоленосители;
-
• животные, пролеченные ФДТ с «Фотолоном».
Для подтверждения результатов использовали метод морфологического исследования.
Результаты изучения эффективности электрохимического лизиса
Представленные на рис. 2 и 3 данные демонстрируют, что проведение электрохимического лечения при параметрах 10-30 мА, 10 и 15 мин дает торможение роста опухолей в опытных группах по сравнению с контрольной группой. При этом показатели полной регрессии опухолей возрастают при увеличении силы тока и времени воздействия. Однако коэффициенты абсолютного прироста у крыс с продолженным ростом опухолей в разных группах статистически не отличались друг от друга.
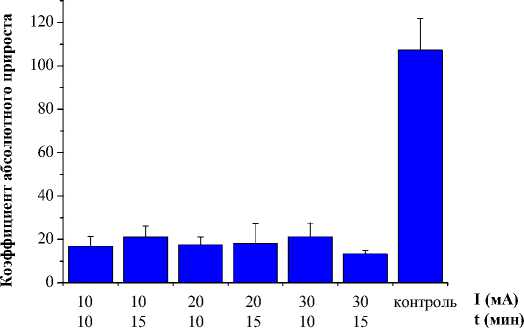
Рис. 2. Показатели коэффициента абсолютного прироста опухолей (M±m) при электрохимическом лизисе в зависимости от параметров на 21 сутки наблюдения.

83»/о
I=10 мА, t=10 мин
I=10 мА, t=15 мин
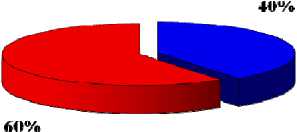

I=20 мА, t=15 мин

I=30 мА, t=15 мин продолженный рост
I=30 мА, t=10 мин полная регрессия
Рис. 3. Показатели полной регрессии опухолей (%) при ЭХЛ в зависимости от параметров на 21 сутки наблюдения.
Результаты исследования эффективности сочетанной терапии опухолей
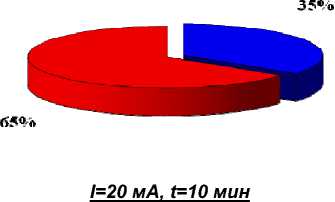
3%
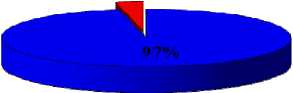
внутрибрюшинное введение ФС, через 1 час ЭХЛ, затем сразу ФДТ
36%
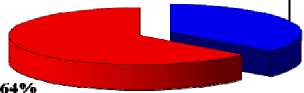
ЭХЛ, затем внутриопухолевое введение ФС и ФДТ
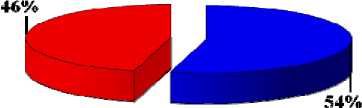
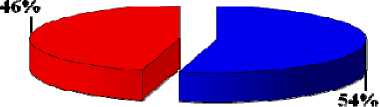
ЭХЛ, через 1 сутки внутрибрюшинное введение ФС, через 1 час после введения – ФДТ
^™ полная регрессия самостоятельная ФДТ
I I продолженный рост
Рис. 4. Показатели полной регрессии опухолей при сочетанной терапии (%) на 21 сутки наблюдения.
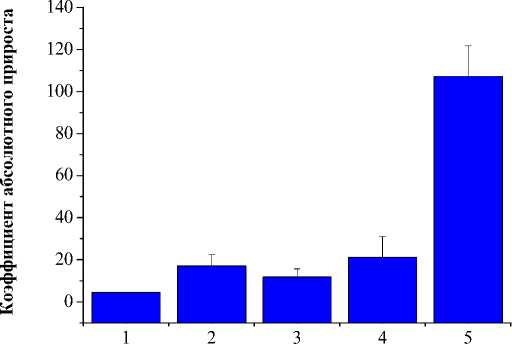
Рис. 5. Показатели коэффициента абсолютного прироста опухолей (M±m) при сочетанной терапии в зависимости от параметров на 21 сутки наблюдения.
1 – внутрибрюшинное введение ФС, через 1 час ЭХЛ, затем сразу ФДТ; 2 – ЭХЛ, затем внутриопухолевое введение ФС и ФДТ; 3 – ЭХЛ, через 1 сутки внутрибрюшинное введение ФС, через 1 час после введения препарата ФДТ; 4 – самостоятельная ФДТ; 5 – контроль.
Учитывая результаты ранее проведённого спектрометрического исследования и данных литературы, в работе использовали следующие варианты проведения сочетанной терапии:
-
1. внутрибрюшинное введение ФС, через 1 час проведение ЭХЛ, а затем сразу же проведение фотодинамической терапии;
-
2. проведение ЭХЛ, затем внутриопухолевое введение ФС и фотодинамическая терапия;
-
3. проведение процедуры ЭХЛ, через 1 сутки – внутрибрюшинное введение ФС с последующей ФДТ через 1 час после введения препарата.
Во всех группах были одинаковые условия. Результаты данных опытов представлены на рис. 4 и 5.
Таким образом, в результате проведённых исследований было определено, что использование сочетанного воздействия ЭХЛ в оптимальном для интактных тканей режиме и ФДТ способствует более полному и стойкому уничтожению опухоли. В эксперименте оптимальным сочетанием параметров проведения самостоятельного ЭХЛ является горизонтальное положение электродов, сила тока 30 мА, время воздействия 15 мин. При данных условиях достигается 75% полной регрессии опухолей. Сочетание электрохимической и фотодинамической терапии усиливает эффективность лечения по сравнению с самостоятельным применением обоих методов, позволяя получить до 97% полной регрессии опухолей. Оптимальной схемой сочетанной терапии является: внутрибрюшинное введение фотосенсибилизатора «Фотолон» в дозе 2,5 мг/кг, проведение электрохимического лизиса через 60 мин (горизонтальное положение электродов, сила тока 20 мА, время воздействия 10 мин) и последующее облучение лазером с плотностью энергии 300 Дж/см2 [8, 9].
Список литературы Сочетанный метод фотодинамической терапии и электрохимического лизиса
- Алибегов Р.А., Борсуков А.В., Алексеев В.А., Ефимкин А.С., Варчук О.Д., Шеметов В.В., Сергеев О.А., Запольский Э.М., Евдокимов А.Н. Комбинированные вмешательства при метастатическом поражении печени//Вестник Смоленской медицинской академии. 2003. № 1. С. 3-5.
- Борсуков А.В., Бельков А.И., Лемешко Р.А. Малоинвазивные технологии под УЗ-контролем в лечении злокачественных поражений печени//Рос. журнал гастроэнтерологии, гепатологии, колопроктологии. 2003. № 1. С. 29.
- Борсуков А.В., Варчук О.Д., Алибегов Р.А. Возможности электрохимического лизиса в паллиативном лечении метастазов в печени//Гастроэнтерология Санкт-Петербурга. 2002. № 2-3. С. 31.
- Каплан М.А., Капинус В.Н., Попучиев В.В., Романко Ю.С., Ярославцева-Исаева Е.В., Спиченкова И.С., Шубина А.М., Боргуль О.В., Горанская Е.В. Фотодинамическая терапия: результаты и перспективы//Радиация и риск. 2013. Т. 22, № 3. С. 115-123.
- Каплан М.А., Никитина Р.Г., Романко Ю.С., Бозаджиев Л.Л., Малыгина А.И., Дрожжина В.В. Фотодинамическая терапия саркомы М-1 у экспериментальных животных//Лазерная медицина. 1998. Т. 2, № 2-3. С. 38-42.
- Каплан М.А., Пономарев Г.В., Баум Р.Ф., Романко Ю.С., Мардынская В.П., Малыгина А.И. Изучение специфической фотодинамической активности фотодитазина при фотодинамической терапии саркомы М-1 у крыс//Российский биотерапевтический журнал. 2003. Т. 2, № 4. С. 23-30.
- Каплан М.А., Романко Ю.С. Фотодинамическая терапия//Физиотерапия, бальнеология и реабилитация. 2004. № 1. С. 43-48.
- Михайловская А.А., Каплан М.А., Бродский Р.А., Бандурко Л.Н. Сочетанное воздействие электрохимического лизиса и фотодинамической терапии//Бюллетень экспериментальной биологии и медицины. 2009. № 1. С. 95-98.
- Михайловская А.А., Каплан М.А., Бродский Р.А., Бандурко Л.Н. Оценка противоопухолевой эффективности электрохимического лизиса на модели саркомы М-1 (экспериментальное исследование)//Бюллетень экспериментальной биологии и медицины. 2009. № 1. С. 99-101.
- Романко Ю.С. Фотодинамическая терапия базальноклеточного рака кожи (экспериментально-клиническое исследование): дис. … д-ра мед. наук. Обнинск: ГУ «Медицинский радиологический научный центр РАМН», 2005. 204 с.
- Романко Ю.С., Коренев С.В., Попучиев В.В., Вайсбейн И.З., Сухова Т.Е. Основы фотодинамической терапии. Калининград, 2010. 136 с.
- Цыб А.Ф., Каплан М. А., Романко Ю.С., Попучиев В.В. Фотодинамическая терапия. М.: МИА, 2009. 195 с.
- Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. Клинические аспекты фотодинамической терапии. Калуга: Издательство научной литературы Н.Ф. Бочкаревой, 2009. 204 с.
- Allman R., Cowburn P., Mason M. Effect of photodynamic therapy in combination with ionizing radiation on human squamous ceel carcinoma cell lines of the head and neck//Br. J. Cancer. 2000. V. 83. P. 655-661.
- Robertson G.S., Wemyss-Holden S.A., Dennison A.R., Hall M., Baxter P., Maddern G.J. Experimental study of electrolysis-induced hepatic necrosis//Surgery. 1998. N 85. P. 1212-1216.
- Romanko Yu.S., Tsyb A.F., Kaplan M.A., Popuchiev V.V. Effect of photodynamic therapy with photodithazine on morphofunctional parameters of M-1 sarcoma//Bulletin of Experimental Biology and Medicine. 2004. V. 138, N 6. P. 584-589.
- Romanko Yu.S., Tsyb A.F., Kaplan M.A., Popuchiev V.V. Relationship between antitumor efficiency of photodynamic therapy with photoditasine and photoenergy density//Bulletin of Experimental Biology and Medicine. 2005. V. 139, N 4. P. 460-464.
- Von Euler H., Soderstedt A., Thorne A. et al. Cellular toxiti induced by different pH levels on the R3230AC rat mammary tumor cell line. An in vitro model for investigation of the tumour destructive properties of electrochemical treatment of tumours//Bioelectrochemistry. 2002. V 58, N 2. P. 163-170.


