Содержание АМГФ в менструальной крови женщин с гиперпластическими процессами эндометрия, ассоциированных с неудачной попыткой ЭКО
Автор: Гилевич-Родкина Ирина Вадимовна, Прибытков Дмитрий Леонидович
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 (39), 2019 года.
Бесплатный доступ
В работе рассматриваются результаты исследования содержания АМГФ в менструальной крови женщин с развившимся в течение года после проведенного протокола ЭКО гиперпластического процесса эндометрия.
Гиперплазия эндометрия, амгф, протокол эко
Короткий адрес: https://sciup.org/143172219
IDR: 143172219 | УДК: 618.177-089.888.11,
Текст научной статьи Содержание АМГФ в менструальной крови женщин с гиперпластическими процессами эндометрия, ассоциированных с неудачной попыткой ЭКО
По данным литературы число женщин с хронической ановуляцией, обращающихся за ВРТ составляет около 36–40 % от всего числа бесплодных женщин и не имеет тенденции к снижению [1]. Отметим, что гормональные нарушения, сопровождающие ановуляцию, прямо влияют на состояние эндометрия, изменяя его рецепторный аппарат и процессы нормальной трансформации в течение менструального цикла [2].
При ановуляции основным нарушением является гипопрогестеронемия, которая отражается, в свою очередь, на продукции эндометриальных белков, продуцирующихся в лютеиновую фазу нормального цикла и служащих маркерами полноценности секреторных преобразований эндометрия, необходимых для успешного зачатия и вынашивания беременности [3].
В частности, у женщин с гипопрогестеронемией существенно меняется продукция аль-фа-2-микроглобулина фертильности (АМГФ).
Изменения этого белка на протяжении менструального цикла отражают функциональную активность маточных желез и децидуализации эндометрия [3].
АМГФ является димерным гликопротеином, который синтезируется исключительно в секреторной фазе менструального цикла. В постовуляторном периоде его тканевая концентрация возрастает с 0,2 мг до 24 мг на один грамм общего белка с 4–5 постовуляторного дня до 12–14 дня после овуляции. Исследованиями in vitro доказано, что АМГФ синтезируется исключительно эпителием желез эндометрия, стромальные клетки в этом синтезе не участвуют. Еще в 1990 г. Fay T.N. и соавт. методом иммунопероксидазного окрашивания после культивирования клеток эндометрия было установлено, что экспрессия АМГФ имеет четкую временную регуляцию [4]. Так, в глубоких базальных железах АМГФ выявлялся только в первые 5 дней менструального цикла, далее, в пролиферативной фазе цикла – белок в тканях отсутствовал и (как было указано выше) начинал экспрессироваться только с 4–5 дня после овуляции. На 10 день после овуляции уже все железы эндометрия показывали присутствие АМГФ.
Таким образом, АМГФ начинает синтезироваться в ткани эндометрия в предмплантаци-онный период и пик его содержания приходится на так называемое «окно имплантации» (с 6-го по 10-й день после пика секреции ЛГ, или 20–24 день идеального менструального цикла) сохраняясь до первых дней следующего менструального цикла. В фазу пролиферации секреция АМГФ временно прекращается [5].
Было установлено, что АМГФ усиленно синтезируется и в первом триместре беременности, особенно в железах decidua spongiosa и decidua compacta. По мере увеличения срока гестации и формирования плаценты количество АМГФ постепенно уменьшается [6].
В 1991 году Посисеевой Л.В. было установлено, что АМГФ можно использовать для дифференцировки овуляторных и ановуляторных циклов. Так, при нормальной функции яичников концентрация АМГФ в менструальной крови составляет 16–64 мкг/мл, в то время, как при ановуляторном менструальном цикле менее 2 мкг/мл (предел чувствительности метода иммунодиффузии) [7].
В связи с изложенным нами было исследовано содержание АМГФ в менструальной крови 179 женщин с неудачными попытками ЭКО, у которых в течение первого года после проведения протокола сформировался гиперпластичсекий процесс эндометрия. Группой сравнения служили 119 пациенток с гиперпластическими процессами эндометрия аналогичной возрастной группы, у которых не было анамнестических указаний на нарушение фертильности. Исследования проводились нами с 2015 по 2019 гг на базе государственного бюджетного учреждения здравоохранения «Самарский областной медицинский центр Династия».
Критериями включения в основную группу являлись: возраст женщин от 25 до 35 лет, первичное бесплодие, неудачный протокол ЭКО, наличие гиперпластического процесса эндометрия в течение первого года после проведения протокола.
Критериями исключения из группы считали : возраст женщин моложе 25 и старше 35 лет, бесплодие, ассоциированное с эндометриозом, нарушения состояния эндометрия, развившиеся более чем через год после проведения протокола ЭКО.
Группу сравнения составили женщины в возрасте от 25 до 35 лет с гиперпластическими состояниями эндометрия без нарушения фертильности.
Рассматривая содержание АМГФ женщин выделенных групп, как показатель функциональной активности эндометрия, следует отметить, что мы забирали менструальную кровь на анализ через 6 месяцев после проведения выскабливания полости матки и завершения гормональной коррекции эндометрия, которая назначалась для профилактики рецидива гиперпластического процесса после получения гистологического заключения. Менструальная кровь забиралась в течение трех последовательных менструальных циклов, высчитывался средний результат, на основании которого проводилась оценка качества функции эндометрия (табл. 1).
Результаты исследования АМГФ в течение 3 месяцев после завершения терапии гиперпластического процесса в обеих группах свидетельствовали о том, что у женщин с сохраненной репродуктивной функцией, независимо от формы гиперпластического процесса, содержание АМГФ в менструальной крови было достоверно выше, чем у женщин, после проведенного ЭКО. В то же время внутри каждой из групп, независимо от формы гиперплазии, различий в содержании АМГФ не было. Это позволило сделать вывод, что содержание АМГФ в менструальной крови не зависит от формы гиперплазии, а ассоциируется с репродуктивным потенциалом женщины (рис. 1).
Таблица 1
Результаты содержания АМГФ женщин в менструальной крови женщин сравниваемых групп (M ± m)
|
Гистологическое заключение |
Основная группа (n = 179) |
Группа сравнения (n = 119) |
р 1-2 |
||
|
Абс. число |
АМГФ (мкг/мл) |
Абс. число |
АМГФ (мкг/мл) |
||
|
Железистая гиперплазия эндометрия функционального типа пролиферативный вариант |
11 |
11,9 ± 0,3 |
49 |
26,7 ± 0,4 |
< 0,001 |
|
Полип эндометрия железистый |
52 |
10,9 ± 0,4 |
38 |
26,8 ± 0,3 |
< 0,001 |
|
Полип эндометрия железисто-фиброзный и преобладанием фиброзного компонента |
6 |
11,8 ± 0,3 |
4 |
27,4 ± 0,4 |
> 0,05 |
|
Эндометрий фазы пролиферации с признаками хронического эндометрита и очаговой гиперплазией |
36 |
11,4 ± 0,4 |
25 |
26,9 ± 0,5 |
< 0,001 |
|
Сложная железисто-кистозная гиперплазия эндометрия |
74 |
10,8 ± 0,3 |
3 |
27,2 ± 0,2 |
< 0,001 |
Примечание: р 1-2 – показатель достоверности различия показателей в сравниваемых группах.
Среднее содержание АМГФ (мкг/мл)
■ Осн овна и группа (п=179) ■ Группа сравнения (п=119)
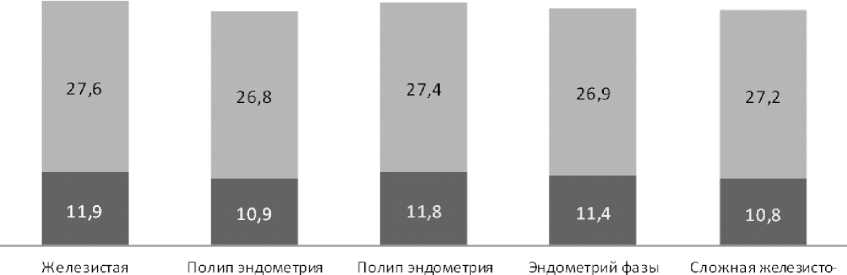
железистый желез исто-фиброзный и преобладанием фиброзного компонента пролиферации с признаками хронического эндометрита и очаговой гиперплазией кистозная гиперплазия эндометрия гиперплазия эндометрия функционал ьноготипа пролиферативный ва риант
Рис. 1. Среднее содержание АМГФ в менструальной крови женщин сравниваемых групп после проведенной терапии гиперпластического процесса
Отметим, что для детализации процессов, происходящих в эндометрии женщин после перенесенного выскабливания полости матки по поводу той или иной гистологической формы гиперпластического процесса и понимания механизмов влияния нарушений гормонального фона на продукцию АМГФ, нами было проведено исследование качества менструального цикла у женщин сравниваемых групп.
Оценивалось наличие овуляции и полноценность лютеиновой фазы менструального цикла стандартными диагностическими тестами (использовались тесты на овуляцию, УЗ иссле- дование толщины и структуры эндометрия в секреторную фазу цикла, наличие «желтого тела» в яичниках, измерение базальной температуры) (табл. 2).
Таблица 2
Результаты содержания АМГФ женщин в менструальной крови женщин сравниваемых групп в зависимости от полноценности менструального цикла (M ± m)
|
Характер менструального цикла |
Основная группа (n = 179) |
Группа сравнения (n = 119) |
р 1-2 |
||
|
Абс. число |
АМГФ (мкг/мл) |
Абс. число |
АМГФ (мкг/мл) |
||
|
Овуляторный менструальный цикл с полноценной фазой секреции |
29 |
32,8 ± 3,6 |
109 |
26,2 ± 3,7 |
> 0,05 |
|
Ановуляторный менструальный цикл |
98 |
1,3 ± 0,2 |
2 |
0,7 ± 0,3 |
> 0,05 |
|
Недостаточность лютеиновой фазы цикла (НЛФ) |
52 |
10,5 ± 1,4 |
8 |
7,9 ± 1,5 |
> 0,05 |
Примечание: р 1-2 – показатель достоверности различия показателей в сравниваемых группах.
В процессе обследования женщин обеих групп было установлено, что в основной группе НЛФ была определена у 52 (29,1 ± 3,4 %) женщин, АМГФ в этой подгруппе женщин составил в среднем 10,5 ± 1,4 мкг/мл. В группе сравнения таких женщин было 8 (6,7 ± 2,3 %), т.е. достоверно меньшее число (р < 0,001), в то время, как содержание АМГФ в этой подгруппе не различалось и составило 7,9 ± 1,5 мкг/мл (р > 0,05).
В основной группе женщин ановуляторные циклы после проведенной терапии гиперплазии эндометрия были установлены у 98 (54,7 ± 3,7 %) пациенток, в группе сравнения таких женщин было только две (1,7 ± 1,2 %), (р < 0,001). Что касается АМГФ, то средние значения у них не имели достоверных различий и составили 1,3 ± 0,2мкг/мл и 0,7 ± 0,3мкг/мо, соответственно (р > 0,05).
Остальные пациентки основной группы – 29 (16,2 ± 2,8 %) и подавляющее большинство женщин группы сравнения – 109 (91,6 ± 2,6 %), (р < 0,001), имели сохраненный овуляторный менструальный цикл, содержание АМГФ в этой подгруппе составило 32,8 ± 3,6 мкг/мл и 26,2 ± 3,7 мкг/мл, соответственно (р > 0,05).
Таким образом, анализ проведенных сопоставлений содержания АМГФ в менструальной крови свидетельствовал о том, что на его секрецию оказывает влияние не только и не столько морфологическая структура эндометрия, сколько яичниковые гормональные влияния, в частности наличие овуляции. В связи с изложенным, вопросы, касающиеся восстановления функции и структуры эндометрия после агрессивного гормонального влияния на организм в процессе стимуляции суперовуляции в протоколах ЭКО, требуют особого внимания, а меры профилактики развития гиперпластических процессов эндометрия нуждаются в коррекции и дальнейшей разработке.
Список литературы Содержание АМГФ в менструальной крови женщин с гиперпластическими процессами эндометрия, ассоциированных с неудачной попыткой ЭКО
- Балтер Р.Б., Целкович Л.С., Иванова Т.В. Клинические особенности женщин с хронической ановуляцией в зависимости от метаболических нарушений // Научные исследования и разработки в эпоху глобализации: сборник статей международной научно-практической конференции. - Самара, 2016. - С. 106-109.
- Бурлеев В.А. и др. Функциональная активность эндометрия влияет на результаты ЭКО и перенос эмбрионов: молекулярные механизмы регуляции фертильности // Проблемы репродукции. - 2010. - № 2. - С. 41-52.
- Bastu, E. Role of Mucin 1 and Glycodelin A in recurrent implantation failure / E. Bastu, M.F. Mutlu, C. Yasa, O. Dural, A. Nehir Aytan, C. Celik // Fertil. Steril. - 2015. - T. 103 (4). - P. 1059-1064.
- Fay, T.N. De novo synthesis of placental protein 14 (PP14) and not placental protein 12 (PP12) by monolayer cultures of glandular epithelium of gestational endometrium / T.N. Fay, S. Lindenberg, B. Teisner, L.G. Westergaard // J Clin Endocrinol Metab. - 1990. - N 70. - P. 1-4.
- Ольховская М.А. Биомаркеры «имплантационного окна» (обзор литературы) // Проблемы репродукции. -2007. - № 1. - С. 72-77.
- Ибрагимова А.Р. Оценка содержания факторов роста и альфа-2-микроглобулина фертильности в диагностике и лечении эндометриоидной болезни: автореф. дис.. канд. мед. наук / Самарский государственный медицинский университет. - Самара, 2015.
- Посисеева Л.В. «Новые» плацентарные белки в оценке нормальной и нарушенной репродукции человека: дис.. д-ра мед. Наук / Л.В. Посисеева. - Иваново, 1991. - 326 с.


