Содержание антоцианов в плодах линий баклажана селекции ВНИИССОК в условиях малообъемной гидропоники
Автор: Мамедов М.И., Пышная О.Н., Шмыкова Н.А., Верба В.М.
Журнал: Овощи России @vegetables
Рубрика: Проблемы качества овощной продукции. Овощи - здоровье нации
Статья в выпуске: 3 (5), 2009 года.
Бесплатный доступ
Окраска плодов баклажана является одним из важных признаков. В их кожуре идентифицированы несколько антоцианов. Установлено, что в плодах образцов баклажана из Японии основным антоцианом является дельфинидин 3-(р-кумароилрутинозид)-5-глюкозид (насунин), в образцах баклажана из других регионов - дельфинидин-3-рутинозид (тулипа-нин). В плодах линий баклажана селекции ВНИИССОК в условиях малообъемной гидропоники количество антоцианов составляет 0,021-0,217г/кг плодов в зависимости от образца.
Короткий адрес: https://sciup.org/14024803
IDR: 14024803 | УДК: 581.19:635.646:631.589.2
Текст научной статьи Содержание антоцианов в плодах линий баклажана селекции ВНИИССОК в условиях малообъемной гидропоники
Потребление овощей с высоким содержанием антиоксидантов и других биологически активных веществ, благоприятно воздействующих на здоровье человека, снижает риск заболеваний сердечно-сосудистой системы, раком, дегенеративными болезнями, а также замедляет старение организма. Фенольные соединения являются одной из групп химических соединений, присутствующих в овощах, и имеющих большое значение для здоровья человека. В последние годы большое внимание уделяется физиологическим функциям полифенолов (Frankel et al., 1993). Фенольные соединения обладают высокой антиоксидантной и противоопухолевой активностью и являются высокоактивной ловушкой свободных радикалов (Sawa et al., 1998). Антоцианы содержатся во многих зерновых, плодовых и овощных культурах с краснофиолетовой окраской кожуры, они также обнаружены в вине. Среди овощных культур перец (Capsicum ssp.) и баклажан (Solanum melongena L.) являются важными источниками фенольных соединений (Cao et al., 1996), и селекция этих культур на высокое их содержание может способствовать созданию новых сортов с улучшенными питательными и лечебными качествами овощной продукции.
Баклажан является экономически важной овощной культурой во всем мире. Валовой сбор баклажана в 2007 году, по данным Международной Организации Продовольствия (FAO, 2007), составил 32,2 млн. тонн, что на 10 млн. тонн больше по сравнению с 1998 годом. Увеличились также до 1,882 млн.га посевные площади. Самыми крупными производителями баклажана в мире являются: Китай (18,026 млн. т), Индия (8,450 млн. т), Египет (1,0 млн. т), Турция (0,864 млн. т), Индонезия (0,391 млн. т), Япония (0,372 млн. т). Широкое распространение баклажана в странах Азии и Африки связано, прежде всего, с высокими питательными и лечебными свойствами этой культуры.
Баклажан в России распространен очень мало, и даже статистические данные отсутствуют. Это, по нашему мнению, связано с экономической непривлекательностью из-за низкой урожайности в различных регионах, отсутствием целенаправленных селекционных программ по созданию специализированных сортов и гибридов в зависимости от потребности рынка, и особенно по биохимическим параметрам. Следует отметить, что китайцы практически никогда не чистят баклажан, хотя его кожура слегка горчит, что в очередной раз подтверждает: польза в китайской кухне всегда доминирует над вкусом, который при желании можно скорректировать с помощью специй.
Антоцианы – наиболее важные пигменты растительного происхождения, относящиеся к классу фенольных соединений группы флавоноидов, которые широко присутствуют в различных растениях: плоды (Garcia-Viguera et al., 1998; Matsumoto et al., 2001; Ichiyanagi et al., 2004а; Ichiyanagi et al. 2004б), овощи (Yoshida et al.,1990; Terahara et al., 1999; Ichikawa et al.,
2001; Otsuki et al., 2002). В литературе указывается на разные физиологические функции антоцианов: антиоксидантное действие (Ichiyanagi et al., 2003; Kahkonen et al., 2003; Serraino et al., 2003; Ichiyanagi et al., 2004в, Ichiyanagi et al., 2004г), антимутагенное (Yoshimoto et al., 2001), противораковый эффект (Hou, 2003; Katsube et al., 2003), повышение остроты зрения (Bastide et al., 1968; Matsumoto et al., 2003). Антиоксидантная активность флавоноидов, включая антоцианы, предотвращает перекисное окисление низкоплотных липопротеинов (de Whalley et al., 1990; Miura et al., 1995) и снижает риск возникновения атеросклероза, который провоцирует заболевания сердечнососудистой системы.
Изучение адсорбционной способности и метаболизма антоцианов, проведенное на экспериментальных животных и людях, подтвердило их значимость для здоровья (Wu et al., 2002; Felgines et al., 2003, Ichiyanagi et al., 2004д; Ichiyanagi et al., 2004е; Ichiyanagi et al., 2005а; Ichiyanagi et al., 2005б). В результате исследований установлена адсорбирующая способность антоциановых глюкозидов в плазме крови, поэтому антоцианы являются основным компонентом продуктов функционального питания, как и другие флавоноиды
1. Активность захвата радикалов супероксид-аниона (О 2 -) экстрактами различных овощей (по Noda et al., 2000
|
СОД эквивалент единица/ мг сухого вещества |
|
|
Насунин (кристалл) |
143 ± 8 |
|
Баклажан |
17,9 ± 1,3 |
|
Перец сладкий, красные плоды |
14,2 ± 0,6 |
|
Перец сладкий, зеленые плоды |
10,5 ± 1,8 |
|
Перец сладкий, желтые плоды |
9,0 ± 1,6 |
|
Капуста |
8,8 ± 0,3 |
|
Брокколи |
8,6 ± 1,0 |
|
Цветная капуста, зеленая форма |
8,5 ± 1,0 |
|
Шпинат |
7,0 ± 0,8 |
|
Цветная капуста |
5,6 ± 0,5 |
|
Тыква |
4,4 ± 0,9 |
|
Лук |
4,0± 0,6 |
|
Картофель |
3,6 ± 0,5 |
|
Томат |
3,6 ± 0,5 |
|
Огурец |
2,7 ± 0,8 |
|
Морковь |
2,3 ± 1,0 |
|
Салат |
1,8 ± 0,5 |
– кверцетин и катехин. Обычно антоцианы присутствуют в виде глюкозидов и дополнительных ацилированных заменителей. Различные формы ацилированных антоцианов обнаружены в цветках (Kondo et al., 1989; Hosokawa et al., 1995а, б) и в некоторых съедобных растениях (Yoshida et al., 1990; Terahara et al., 1999; Otsuki et al., 2002). Они относительно стабильны по сравнению с не ацилированными антоцианами, которые быстро разлагаются в естественных условиях (Terahara et al., 1990; Mazza et al., 1990). Одной из причин стабильности таких соединений является их внутримолекулярная структура (Mazza et al., 1990), в связи с чем они оказывают более эффективное воздействие на организм человека. Terahara et al. (1999) выделил ацилированные антоцианы из клубней фиолетового сладкого картофеля и сообщил об их уникальной функции – подавлении активности α-гликозида, что может быть полезным в предупреждении диабета (Matsui et al., 2001а, б). Об in vitro антиоксидантной активности антоцианов, выделенных из клубней фиолетового сладкого картофеля, сообщил Kano et al. (2005).
Антиоксидантная активность изучена у 16 основных овощных культур с помощью ЭПР-спектрометрии (Noda et

al., 1997; 1999). Экстракт сухого порошка баклажана, полученного при помощи лиофильной сушки, показал наибольшую активность улавливания свободных радикалов среди изученных овощных культур (табл.1), при этом кожура плодов баклажана показала более высокую активность по сравнению с мякотью (Kaneyuki et al., 1999).
Насунин – основной компонент пигментов антоцианов баклажана, впервые был выделен из кожуры плодов в 1933 году Kuroda и Wada, и его структура была определена как дельфинидин-3-дигликозид ацилированный с р-кума-ровой кислотой (Kuroda, Wada, 1933,1935). Окончательно он идентифицирован как дельфинидин-3-(р-ку-мароилрутинозид)-5-гликозид Sakamura et al. (1963).
Noda et al. (1998) определили эффект захвата насунином О2- и ОН-, и установили, что насунин захватывает О2- вырабатываемой гипоксантин-ксантин-оксидазной системой с активностью 143±8 СОД-эквивалент единицы/мг.
Накоплены многочисленные факты, показывающие антиоксидантную активность насунина. Предупреждающий эффект ряда антоцианов, таких как на-сунин, мальвин (мальвинидин-3,5-гли-козид из дикого винограда) и руброб-рассицин (цианидин-3-дигликозид-5-моногликозид из красного турнепса),

был оценен посредством определения их способности подавления окисления свободных радикалов, индуцированных системой: линолевая кислота – липоксигеназа, а также эффекта ингибирования самоокисления линолевой кислоты. Самый высокий антиоксидантный эффект среди изученных антоцианов обнаружен у насунина (Igarashi et al., 1993). Kayamori и Igarashi (1994) наблюдали на крысах, кормя их пищей обогащенной холестерином, что насунин снижает в сыворотке крови уровень общего холестерина и увеличивает уровень холестерина липопротеинов высокой плотности (ЛПВП), т.е. снижает атерогенный индекс. Kimura et al. (1999) сообщают, что насунин не только снижает атерогенный индекс, но и подавляет реактивное вещество тиобарбитуровой кислоты (TBARS) – индекса окислительного стресса, в печени крысы обогащенной гербицидом паракват.
Yoshiki et al. (1995) наблюдали хемилюминесценцию антоцианов в присутствии альдегида уксусной кислоты и трет-бутил гидроперекиси, т.е. интенсивность хемилюминесценции антоцианов была согласно: насунин > руброб-рассицин > дельфинидин > мальвин = цианидин > мальвидин, указывающая, что гликозидирование в положении С-3 и С-5 антоцианов усиливает хемилюми- несценцию. Результат предполагает, что величина антиоксидантной активности антоциана связана с числом гидроксильных групп вокруг 4' позиции В-кольца, т.е. зависит от общего числа -ОН на 3', 4' и 5' позициях В-кольца. В другом случае высокий антиоксидантный эффект насунина связан с р-ку-мароиловой группой (Igarashi, 1998). Доказано, что антиоксидантная активность мальвидина 3-О-(6-О-р-кума-роил-гликозид)-5-гликозид была выше, чем каждая несвязанная р-кума-роиловая производная (Tamura, Yanagami, 1994).
Ингибирующий эффект насунина перекиси водорода (Н2О2), индуцирующей окисление свободными радикалами липидов в гомогенате мозга крыс, исследован Kaneyuki et al. (1999). Кормление с добавлением Н2О2 увеличивает уровень (один из маркеров окислительного процесса) малональ-дегида плюс 4-гидроксиалькинала, как индекса окисления свободных радикалов липидов, в гомогенате мозга после 60 минут инкубации. Совместная инкубация с насунином снижает Н2О2 – способствующей окислению липидов свободными радикалами в дозозависимом методе при концентрации от 1 до 10 μМ.
Сообщается, что основной антоциан в плодах баклажана является дельфинидин 3(р-кумароилрутинозид)-5-гли-козид (насунин) и дельфинидин-3-ру-тинозид (тулипанин) (Sakamura et al., 1963; Watanabe et al., 1966; Matsuzoe et al., 1999). Более того, установлено, что содержание дельфинидин-3-рутино-зид-5-глюкозида насунина в сортах не Японского происхождения незначительно, и основным антоцианом у них является дельфинидин 3-рутинозид – тулипанин (Tateyama, Igarashi, 2006). Насунин имеет самую сильную антиоксидантную активность среди антоцианов (Igarashi et al., 1993) и является акцептором радикалов супероксид-анио-на (Noda et al., 1998; Noda et al., 2000).
Состав антоцианов был изучен в сортах баклажана (Matsuzoe et al., 1999; Tateyama et al., 2006) и у близкородственных видов из различных стран. Возможно, как отмечают Azuma et al. (2008), в этих образцах баклажана, содержатся другие антоцианы, кроме насунина и тулипанина, с более высокой антиоксидантной активностью, чем у насунина. В исследовании были включены 123 образца рода
Solanum, из которых 110 образцов баклажана и 13 образцов, относящихся к близкородственным видам: Solanum aculeatissimum, Solanum gilo, Solanum integrifolium, Solanum laciania-tum, Solanum mammosum, Solanum nigrum, Solanum nodiflorum, Solanum torvum. Среди изученных 123 образцов антоцианы были обнаружены у 105 (101 образец баклажана и 4 родственных вида), у которых окраска кожуры плода красновато-фиолетовая, фиолетовая, темно-фиолетовая и коричневая. У образцов с зеленой и белой окраской кожуры плодов антоцианы не обнаружены. Все обнаруженные антоцианы были классифицированы и распределены на 4 группы. Кривые графиков хроматограммы были однородными, т.е. каждая кривая соответствовала одному основному антоциану. Среди этих графиков группа 1 и группа 2 соответствуют кривым антоцианов у образцов японского сортоти-па, и не японского сортотипа соответственно, а кривые 3 и 4 соответствовали новым антоцианам.
В плодах гибрида между образцами группы 1 и группы 3 выделен новый антоциан – дельфинидин 3-кафейолрути-нозид-5-гликозид (дельфинидин 3RGcaf5G). Интересно, отмечают авторы (Azuma et al., 2008), у этого антоциана антиоксидантная активность выше, чем у насунина и петунидина. Дельфинидин 3RGcaf5G в своей структуре имеет кофейоловую группу, вместо р-кумароиловой группы, которую имеет насунин. В предыдущих исследованиях (Rice-Evance et al., 1996; Chen, Ho, 1997; Moon, Terao, 1998) сообщается, что взаимоотношения структура – антиоксидантная активность фенольных кислот имеет важное значение при наличии как минимум двух гидроксил групп, особенно катехиновой группы (о-дигидроксил группа) на фенольном кольце для их эффективности взаимодействия со свободными радикалами.
Активность захвата свободных радикалов у дельфинидин 3RGcaf5G выше, чем у других антоцианов, но содержание его в плодах значительно меньше, чем насунина, что ограничивает потенциальную возможность этого антоциана в защите здоровья.
Последними исследованиями Ichiyanagi et al. (2005) показано, что на-сунин в своей структуре имеет цис- и транс- изомеры фрагментов р-кума-ровой кислоты.

Окраска плодов баклажана в зависимости от содержания антоцианов

Материал и методика исследований
Цель наших исследований: определение количественного и качественного состава фенольных соединений – антоцианов в кожуре плодов баклажана, и на основе этих данных определение задач селекции по повышению содержания фенольных соединений. Исследования проведены на 6 линиях
2. Содержание антоцианов в плодах линий баклажана селекции ВНИИССОК (анализ 10 июня 2009 года)
|
Название образца |
Масса плода, г |
Масса кожуры, г |
Содержание антоциана в кожуре, % |
Масса антоциана в 1кг плода, г |
|
105 Л-Бак |
403 |
37,6 |
0,1061 |
0,099 |
|
106 Л-Черный дракон |
305 |
35,8 |
0,1850 |
0,217 |
|
108 Л-Бриллиант |
240 |
32,0 |
0,0979 |
0,131 |
|
109 Л-Солярис |
212 |
40,0 |
0,0859 |
0,162 |
|
126 Л-Багратион |
455 |
45,2 |
0,1104 |
0,110 |
(анализ 23 июня 2009 года)
|
105 Л-Бак |
329 |
31,2 |
0,1371 |
0,130 |
|
106 Л-Черный дракон |
212 |
26,2 |
0,1025 |
0,127 |
|
108 Л-Бриллиант |
266 |
34,2 |
0,1002 |
0,129 |
|
109 Л-Солярис |
254 |
36,0 |
0,0499 |
0,071 |
|
126 Л-Багратион |
228 |
28,2 |
0,1446 |
0,179 |
|
100 Л-Беглец |
176 |
21,4 |
0,0174 |
0,021 |
баклажана селекции ВНИИССОК: Л-Бак, Л-Черный дракон, Л-Бриллиант, Л-Солярис, Л-Багратион и Л-Беглец. Растения баклажана выращивали в условиях малообъемной гидропоники. Плоды собирали с одного яруса растений в фазе технической спелости. Для анализа использовали линии, визуально различающиеся по интенсивности фиолетовой окраски кожуры.
Метод определения антоцианов в экстрактах, использованный в исследованиях, основан на обращенно-фазной высокоэффективной жидкостной хроматографии (HPLC) продуктов экстракции образцов 1% раствором соляной кислоты в этаноле. Условия ВЭЖХ были оптимизированы.
Подготовка проб:
В пробирки с завинчивающимися крышками взвесили по 5 г образца. Приготовили смесь соляной кислоты (концентрированной) и 96% этанола: 50 мл содержат 0,5 мл концентрированной соляной кислоты и 49,5 мл 96% этанола. К навескам добавили по 50 мл экстрагирующей смеси и настаивали в темноте при комнатной температуре в течение 7 суток. Центрифугировали раствор и полностью прозрачный супернатант анализировали разработанным методом.
Условия ВЭЖХ анализа:
Аликвоту супернатанта и внешнего стандарта 1 мкл анализировали методом обращенно-фазной ВЭЖХ на колонке Gemini C18 4.6*150mm (5um) производства Phenomenex (США). Был использован хроматограф Agilent1100, состоящий из четырехканального градиентного насоса с дегазатором, авто-самплера, термостата и диодно-матричного детектора. Сбор и обработка хроматограмм осуществлялась с помощью программы «ChemStation B.03.01». Использовалось градиентное элюирование с подвижной фазой
Response Response
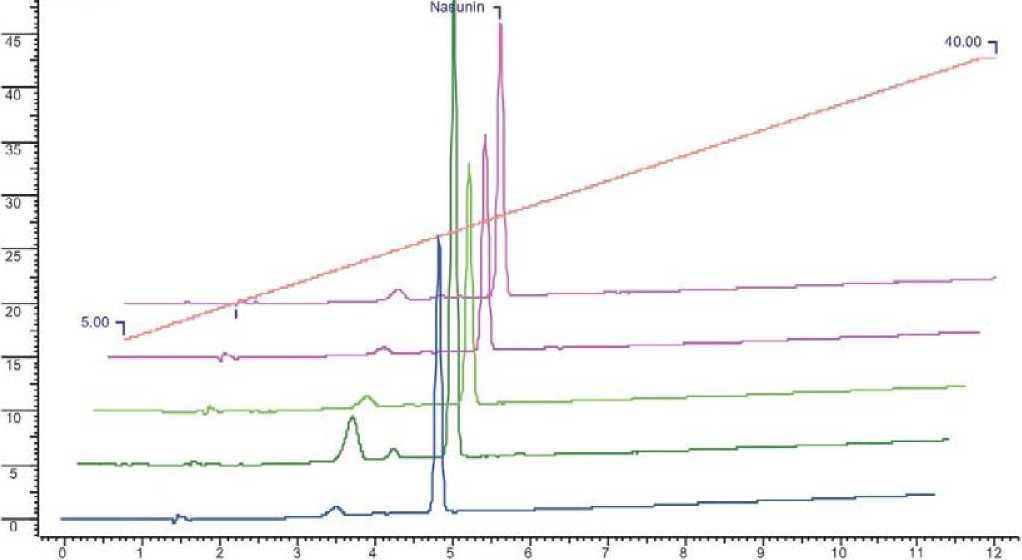
Рис. 1. Хроматограмма антоцианов в кожуре плодов линий баклажана при 520 нм: анализ 10.06.09 снизу верх – Л-Бак, Л-Черный дракон, Л-Бриллиант, Л-Солярис, Л-Багратион.
Retention Timo (min)
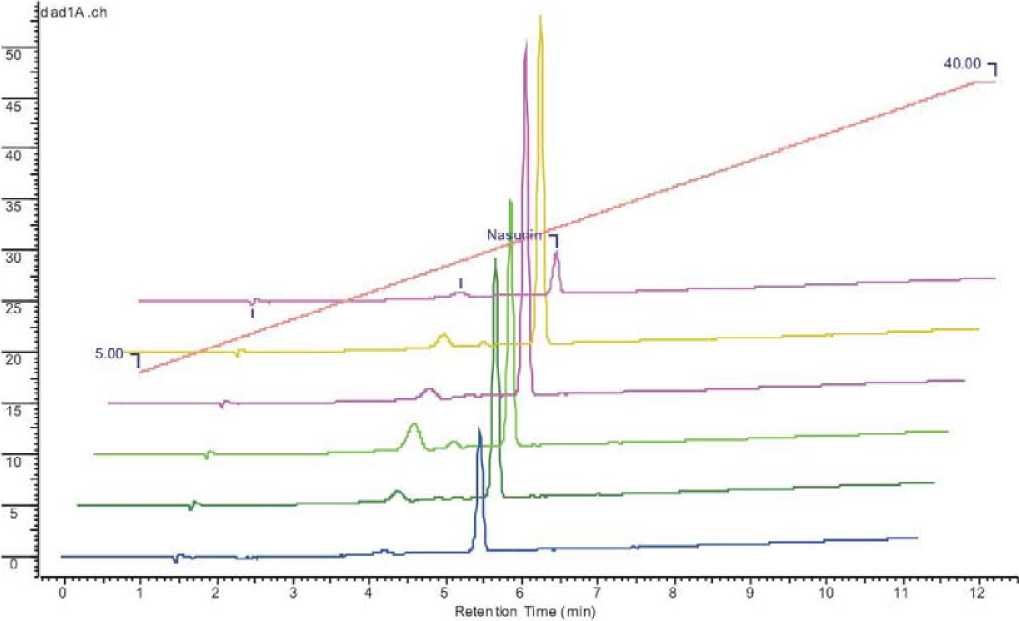
Рис.2. Хроматограмма антоцианов в кожуре плодов линий баклажана при 520 нм: анализ 23.06.09
Снизу верх: Л-Солярис, Л-Бриллиант, Л-Черный дракон, Л-Багратион, Л-Бак, Л-Беглец
А (0,15% раствор трифторуксусной кислоты в воде) и подвижной фазой В (0,15% раствор трифторуксусной кислоты в ацетонитриле) по программе 5-40%В за 11 мин при скорости потока 1,5 мл/мин, температуре 25°С и с УФ-детекцией при 290 нм (для флаваноно-лов), 360 нм (для флавонолов) и 520 нм (для антоцианов) и УФ-спектральными данными от 230 до 800 нм. Время анализа 13 мин.
Условная концентрация рассчитана на основе анализа 1 мкл раствора в этаноле стандартов дельфинидина (Sigma) и цианидина (Sigma) с концентрацией 0,2 г/л при 520 нм.
Анализ сделан на основе методики ГУ НИИ питания РАМН для определения качественного и количественного состава антоциановых пигментов с помощью ВЭЖХ. В качестве стандарта для разделения смеси использовали экстракт из ягод черники.
Расчет содержания антоцианов в образце осуществляется по формуле:
__A_r_e__a*_V_ экстракта _ % 10*k*V инжект*mобр где C% – содержание антоциана в образце; Area – площадь пика анто- циана; V экстракта =50 мл – общий объем экстракта; k =1210950 г-1 – коэффициент пересчета, найденный по анализам внешних стандартов дельфинидина и цианидина; V инжект =1 мкл – объем пробы, введенной в инжектор; mобр =5 г – масса экстрагируемого образца.
Расчет содержания антоцианов в образце осуществляется по формуле:
Количество антоцианов в 1 кг плода = 1000 х содержание антоцианов в кожуре х масса кожуры/100 х масса плода.
Результаты исследований
В результате проведенных исследований установлено, что содержание антоцианов в кожуре плодов баклажана является сортовым признаком, но значительно варьирует в зависимости от интенсивности освещения и от стадии развития и спелости плода (табл.2, рис.1, 2).
В среднем наибольшее количество антоцианов накапливается в плодах Л-Черный дракон – 0,217 г/кг плодов. Но этот показатель варьирует в пределах 0,217-0,127 г/кг плодов в зависимости от сроков сбора. Если у ли- нии Л-Черный дракон содержание антоцианов снижается от первого анализа ко второму, то у линии Л-Ба-гратион, наоборот увеличивается – от 0,110 г до 0,179 г/кг плодов. Содержание антоцианов стабильно в плодах линии Л-Бриллиант – 0,131 г при первом анализе и 0,129 г – во втором. Результаты наших исследований согласовываются с результатами исследований Noda et al. (2000), где авторы отмечают, что содержание антоциана насунина в плодах баклажана сорта Chouja-nasu составляет 0,15 г/кг плодов. Наименьшее количество антоцианов отмечено в плодах линии Л-Беглец, что подтверждается бледно-фиолетовой окраской.
Таким образом, в результате проведенных исследований определено количество антоцианов в плодах линий баклажана селекции ВНИИССОК, которое определяет как товарное, так диетическое и лечебное качество плодов. Это позволит вести селекционную работу на высокое содержание фенольных соединений – антоцианов.
Список литературы Содержание антоцианов в плодах линий баклажана селекции ВНИИССОК в условиях малообъемной гидропоники
- Azuma K., Ohyama A., Ippoushi K., Ichiyanagi T., Takeuchi A., Saito T., Fukuoka H. Structure and antioxidant activity of anthocyanins in many accessions of eggplant and its related species.//J. Agric. Food Chem. -2008.-56.-p. 10154-10159.
- Bomser J., Madhavi D., Singletary K., Smith M.A.L. In vitro anticancer activity of fruit extracts from Vaccinium species.//Planta Med.-1996.-41.-p. 212-216.
- Cao G., Sofic E., Prior R.L. Antioxidant capacity of tea and common vegetables.//J. Agr. Food Chem.-1996.-44.-p. 3426-3431.
- Chen J.H., Ho C.T. Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds.//J. Agric. Food Chem.-1997.-45.-p. 2374-2378.
- de Whalley C.V., Rankin S.M., Hoult J.R., Jessup W., Leake D. Flavonoids inhibit the oxidative modification of low density lipoproteins bt macropharges.//Biochem. Pharmacol.-1990.-39.-p. 1743-1750.
- FAO Statistical Yearbook./2007.
- Felgines C., Talavera S., Gothier M.P., Texier O., Scakbert A., Lamaison J.I., Remesy C. Strawberry anthocyanins are recovered in urine as glucuoro-and sulfoconjugates in humans.//J. Nutr.-2003.133.-p. 1296-1301.
- Frankel E.N., Kanner J., German J.B., Parks E., Kibsella J.E. Inhibition of oxidation of human low density lipoproteins by phenolic substances in red wine.//Lancet. 341.-P-454-457.
- Garcia-Viguera C., Zafrilla P., Tomas-Barveran A. The use of acetone as extraction solvent for anthocyanins from strawberry fruit.//Phytochem. Anal.-1998.-9.-p. 274-277.
- Hosokawa K., Fukunaga Y., Fukushi E., Kawabata J. Seven acylated anthocyanins in the blue flowers of Hyacinthus orientalis.//Phytochemistry.-1995(a),.-38.-p. 1293-1298.
- Hosokawa K., Fukunaga Y., Fukushi E., Kawabata J. Acylated anthocyanins from red Hyacinthus orientalis.//Phytochemistry.-1995(6).-39.-p. 1437-1441.
- Hou D.X. Potential mechanisms of cancer chemoprevention by anthocyanins.//Curr. Mol. Med.-2003.-3.-p.149-159.
- Ichikawa H., Ichiyanagi T., Xu B., Yoshii Y., Nakajima M., Konishi T. Antioxidant activity of anthocyanin extract from purple black rice.//J. Med. Food.-2001.-4.-p. 211-218.
- Ichiyanagi T., Hatano Y., Matsugo S., Konishi T. Comparison of anthocyanin reactivity towards hydroxyl radical, superoxide anion ang singlet oxygen.//ITE Lett.-2003.-4.-p. 788-793.
- Ichiyanagi T., Kashiwada Y., Ikeshiro Y., Shida Y., Horie M., Matsugo S., Konishi T. Complete assignment of bilberry (Vaccinium myrtillus L.) anthocyanins separated by capillary zone electrophoresis.//Chem. Pharm. Bull.-2004(а).-52.-p. 226-229.
- Ichiyanagi T., Hatano Y., Matsugo S., Konishi T. Structural dependence of HPLC separation pattern of anthocyanins from bilberry (Vaccinium myrtillus L.).//Chem. Pharm. Bull.-2004(6).-52.-p. 628-630.
- Ichiyanagi T., Hatano Y., Matsugo S., Konishi T. Simultaneous comparison of relative reactivities of twelve major anthocyanins in bilberry towards reactive nitrogen species.//Chem. Pharm. Bull.-2004(b)-52.-p. 1312-1325.
- Ichiyanagi T., Hatano Y., Matsugo S., Konishi T. Kinetic comparison of anthocyanin reactivity towards AAPH radical, hydrogen peroxide and t-buthylhydroperoxide using capillary zone electrophoresis.//Chem. Pharm. Bull.-2004(г).-52.-p. 434-438.
- Ichiyanagi T., Rahman M.M., Kashiwada K., Ikeshiro Y., Shida Y., Hatano Y., Matsumoto H., Hirayama M., Tsuda T., Konishi T. Absorption and metabolism of delphinidin 3-O-β-D-glucopyranoside in rats.//Free Radical Biol. Med.-2004(д).-36.-p. 930-937
- Ichiyanagi T., Rahman M.M., Kashiwada K., Ikeshiro Y., Shida Y., Hatano Y., Matsumoto H., Hirayama M., Konishi T. Absorption and metabolism of delphinidin 3-O-β-D-glucopyranoside in rats.//Biofactors.-2004(e).-21.-p. 411-413.


