Содержание ауксина у люцерны хмелевидной (Medicago lupulina L.) при инокуляции грибом Rhizophagus irregularis на фоне низкой обеспеченности доступным фосфором
Автор: Юрков А.П., Веселова С.В., Якоби Л.М., Степанова Г.В., Кудоярова Г.Р., Шишова М.Ф.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Кормовые культуры: физиология растений
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Арбускулярную микоризу (АМ) образуют 92 % семейств наземных растений с грибами отдела Glomeromycota. АМ может определять продуктивность растений и их адаптацию к неблагоприятным факторам среды, особенно при низком количестве питательных веществ в почве. Показано, что доступность неорганического фосфора (Pi) - ключевой фактор развития АМ симбиоза. Развитие АМ симбиоза приводит к морфофизиологическим модификациям в корневой системе растений, что указывает на возможность АМ-индуцированных изменений активности эндогенных регуляторов роста. В последние несколько лет выявлена роль ауксина в становлении взаимоотношений между растением-хозяином и АМ грибом. При экзогенной обработке ауксином показано ускорение прорастания спор АМ гриба, интенсификация процесса колонизации и последующего роста гиф. В настоящем исследовании впервые проведена оценка динамики эндогенной концентрации индолилуксусной кислоты (ИУК) в корнях и листьях у сильно микотрофной линии люцерны хмелевидной ( Medicago lupulina L. var. vulgaris Koch) в условиях низкого содержания доступного для растений фосфора в почве. В качестве модели была выбрана люцерна хмелевидная, сортопопуляция ВИК32, линия MlS-1. Для инокуляции использовали штамм RCAM00320 АМ гриба Rhizophagus irregularis из коллекции Всероссийского НИИ сельскохозяйственной микробиологии. Содержание ИУК определяли в корнях и надземных частях. В фазу семядолей (1-е сут после посадки) были взяты семядоли, в фазу первого настоящего листа (14-е сут) - округлый и 1-й настоящий лист, в фазу второго настоящего листа (21-е сут) - округлый, 1-й и 2-й настоящий листы, в фазу стеблевания (35-е сут) - 2-й, 3-й и 4-й лист, в фазу цветения (50-е сут) - три верхних листа до первого соцветия (3-й, 4-й и 5-й листы). При низком содержании фосфора в почве растения в контроле очень медленно увеличивали биомассу корней и побегов. Существенное накопление биомассы было отмечено только в фазу цветения. Инокуляция практически не влияла на увеличение массы корня (вплоть до фазы цветения), но индуцировала многократное увеличение массы надземной части. Первый отклик на микоризацию был выявлен для побегов с 14-х сут. Наиболее значительный прирост надземной массы АМ растений наблюдался в фазу стеблевания. Анализ степени микоризации показал, что арбускулы играют ключевую роль в формировании эффективного симбиоза у люцерны в фазу 1-го и 2-го листа: значение a/(1-a), характеризующее кратность превышения обилия арбускул над обилием внутрикорневого мицелия, возрастало до 8,0±0,7 и 18,5±1,3; в более поздние фазы (стеблевание и цветение) роль арбускул снижалась в сравнении с развитием внутрикорневого мицелия. Увеличение содержания ИУК в корнях в фазу 1-го листа (в 2,2 раза), то есть уже на самых ранних этапах формирования АМ симбиоза, привело к ингибированию роста корня. В то же время повышение количества эндогенной ИУК в листьях в фазу 2-го листа (в 1,8 раза) предшествовало увеличению масса надземных частей, а значит, рост концентрации ИУК существенно интенсифицировал развитие надземных частей в фазах стеблевания и цветения.
Ауксин, индолилуксусная кислота, арбускулярная микориза, симбиотическая эффективность
Короткий адрес: https://sciup.org/142214076
IDR: 142214076 | УДК: 636.086.3:581.1:577.171.52:58.071:631.847.3 | DOI: 10.15389/agrobiology.2017.4.830rus
Текст научной статьи Содержание ауксина у люцерны хмелевидной (Medicago lupulina L.) при инокуляции грибом Rhizophagus irregularis на фоне низкой обеспеченности доступным фосфором
Арбускулярная микориза (АМ) — широко распространенный в природе симбиоз, формируемый большинством семейств растений (92 %) с грибами отдела Glomeromycota. Она обладает значительным разнообразием морфотипов и играет ключевую роль в луговых и лесных экосистемах, способствуя существенному усилению минерального (особенно фосфатного) питания растений (1, 2). АМ может определять продуктивность растений и их адаптацию к неблагоприятным факторам среды, особенно при низком количестве питательных веществ в почве. Показано, что доступность неорганического фосфора (Pi) — ключевой фактор развития АМ симбиоза. При недостатке фосфора длина корня может увеличиваться более чем на 80 % благодаря развитию гриба (3), тогда как рост доступности Pi значительно снижает интенсивность колонизации (4). В то же время развитие арбускулярной микоризы не всегда сказывается на длине корня: АМ может влиять на число боковых корней, модулируя его архитектуру. Предполагают, что такое изменение приводит к увеличению числа аппрес-сориев. Подтверждением этой гипотезы служат данные об индукции формирования боковых корней у Medicago truncatula при прорастании грибных спор, а также увеличение числа боковых корней у lrt1 мутанта кукурузы при формировании АМ (5, 6). Морфофизиологические модификации в корневой системе растений указывает на возможность АМ-индуцированных изменений в активности эндогенных регуляторов роста. Согласно современным представлениям, многие из фитогормонов участвуют в индукции корнеобразования при фосфатном голодании (7-11). Поскольку ауксин играет ключевую роль в регуляции развития корня, возникло предположение, что этот гормон может влиять и на развитие AM (12, 13).
В последние несколько лет выявлена роль ауксина в становлении взаимоотношений между растением-хозяином и АМ грибом. Экзогенная обработка ауксином ускоряла прорастание спор, интенсифицировала процесс колонизации и последующий рост гиф (12). Увеличение концентрации индолилуксусной кислоты (ИУК) наблюдалось при колонизации корней лука-порея АМ грибами (14) и сопровождалось изменениями в структуре корней — они становились более многочисленными, разветвленными и укороченными (15, 16). В тоже время индуцированное АМ накопление ИУК не носило системного характера. Инокулируя одну часть корней растения и сохраняя интактной другую (split-root system), показали, что гормон накапливался только в корнях, непосредственно подвергшихся инокуляции (17). Получены данные об увеличении содержания другого природного ауксина — индол-3-масляной кислоты (ИМК) при АМ-колонизации корней кукурузы (18, 19) (ИМК также известна как регулятор роста корня) (20). У мутантов с нарушениями биосинтеза ауксина, таких как «кустистый» («bushy») мутант гороха ( Pisum sativum ), характеризующийся низким количеством ИУК в побегах и корнях, а также диагеотропический мутант («dia-geotropica») томата ( Solanum lycopersicum ), устойчивый к ауксину, отмечена сниженная АМ-колонизация (13, 21). Наряду с повышением количества свободной ИУК наблюдалось изменение содержания ее конъюгатов с сахарами и амидами, что коррелировало с накоплением транскриптов генов, кодирующих ИУК-амидосинтетазу и GHЗ-подобный белок при микориза-ции корней томатов (22). Еще один механизм регуляции количества свободной ИУК может быть связан с белками — переносчиками ауксина семейства PINs, обеспечивающими его полярный транспорт в осевых органах и латеральное перераспределение. Мутанты с нарушением кодирования этих переносчиков имели ослабленный симбиоз с АМ грибами, вероятно, из-за изменения интенсивности закладки латеральных корней (23, 24).
Приведенные данные свидетельствуют о существенной динамике накопления ауксина в корнях растений при формировании взаимовыгодного АМ симбиоза. В процесс вовлекаются системы синтеза, конъюгации и транспорта гормона. Подобная многокомпонентность, по-видимому, служит причиной того, что в ряде случаев роль ауксина не прослеживалась или проявлялась слабо (25). Активность компонентов может значительно изменяться в зависимости от вида, возраста и стадии онтогенеза растения.
В настоящем исследовании впервые на примере сильно микотрофной линии люцерны хмелевидной продемонстрировано повышение содер- жания ауксина в корнях уже на ранних этапах формирования АМ, причем микоризация приводила к ингибированию роста корня, но одновременно инициировала развитие побега. Впервые высказано предположение о том, что АМ опосредованно (через значительное увеличение количества ИУК) благотворно влияет на развитие ассимиляционного аппарата.
Целью нашей работы был анализ эффективности микоризации и оценка динамики эндогенной концентрации индолилуксусной кислоты в корнях и листьях у люцерны хмелевидной в условиях низкого содержания доступного для растений фосфора в почве.
Методика. В качестве модельного растения была выбрана люцерна хмелевидная ( Medicago lupulina L. var. vulgaris Koch), сортопопуляция ВИК32, линия MlS-1. Для инокуляции использовали штамм RCAM00320 АМ гриба Rhizophagus intraradices (N.C. Schenck & G.S. Sm.) C. Walker & A. Schuessler 2010 (ранее известен как Glomus intraradices N.C. Schenck & G.S. Sm. 1982, штамм CIAM8) из коллекции Всероссийского НИИ сельскохозяйственной микробиологии, поддерживаемый в лабораторных условиях на плектрантусе ( Plectranthus australis R. Br.) (26).
Исследования проводили в условиях вегетационного эксперимента, (27) при выращивании на субстрате с низким содержанием доступного фосфора (Рд). Использовали дерново-подзолистую легкосуглинистую почву с содержанием P205 и K2O по Кирсанову — соответственно 3,9 и 7,0 мг на 100 г, органического вещества — 3 %, pHKCl после известкования — 6,1. Субстратом служила воздушно-сухая почвенно-песчаная смесь в соотношении 2:1, которую дважды (с интервалом 2 сут) автоклавировали в течение 1 ч при 134 ° С и 2 атм. (токсичность после обработки отсутствовала). Растения высаживали по 4 на один сосуд, наполненный 210 г почвенно-песчаной смеси, и выращивали при неактивной вентиляции в световом боксе, который предварительно подвергали УФ-стерилизации. Режим смены дня и ночи — 18 ч/6 ч, температура воздуха — 24-26 ° С, световой поток — 1500-1700 лм. В опытном варианте выполняли инокуляцию корнями плектрантуса, микоризованными RCAM00320, в контроле — немикоризованными корнями плектрантуса.
Для количественной оценки микоризации (обилия арбускул а, %) использовали мацерацию и окрашивание корней растений с АМ (28) и световую микроскопию (29) согласно описанию (30). Метод усовершенствован с помощью разработанной компьютерной программы в оболочке Microsoft Excel (31). Симбиотическую эффективность АМ определяли по прибавке сырой биомассы надземных частей и корней (32).
Содержание ауксина (ИУК) определяли в корнях и надземных частях (по фазам роста). Отбирали семядоли (1-е сут после посадки, фаза семядолей), округлый и 1-й настоящий лист (14-е сут, фаза 1-го настоящего листа), округлый, 1-й и 2-й настоящий листы (21-е сут, фаза 2-го настоящего листа), 2-й, 3-й и 4-й лист (35-е сут, фаза стеблевания) и три верхних листа (3-й, 4-й и 5-й лист) до первого соцветия (50-е сут, фаза цветения). Растительный материал (лиофилизированные корни и листья) гомогенизировали и экстрагировали 80 % этанолом (1:10 масса/объем) в течение 16-20 ч при 4 ° С. Спиртовой экстракт отделяли центрифугированием и упаривали до водного остатка. Экстракцию ауксинов в диэтиловый эфир из подкисленного водного остатка спиртового экстракта с последующей экстракцией в раствор соды и реэкстракцией в диэтиловый эфир (после подкисления соды) проводили с уменьшением объема на каждом этапе экс-тракции-реэкстрации (33). После метилирования определяли количество ауксинов с помощью твердофазного иммуноферментного анализа (33).
На рисунках представлены средние ( M ) и стандартные ошибки средних (±SEM). Различия оценивали по t -критерию Стьюдента и считали статистически значимыми при Р < 0,05.
Результаты. Метод вегетационного эксперимента позволяет обеспечить оптимальные условия для развития АМ и избежать спонтанного заражения ризобиями и иными симбиотическими микроорганизмами (27). Люцерна хмелевидная (2 n = 16) — один из наиболее широко распространенных видов рода Medicago , подрод Lupularia (Ser.) Grossh., сем. Legum-inosae Endl. Способна к значительному отклику на микоризацию грибом R. irregularis при низком содержании Рд в почве (28), семенная продуктивность — до 2500 шт. с растения (иногда более при выращивании в теплице для размножения). Это самоопылитель с размером генома ∼ 500 Мб. Растения линии MlS-1, использованные в исследовании, демонстрировали признаки карликовости при отсутствии инокуляции АМ грибом и низком количества почвенного Рд. Штамм RCAM00320 — облигатный симбионт (26).
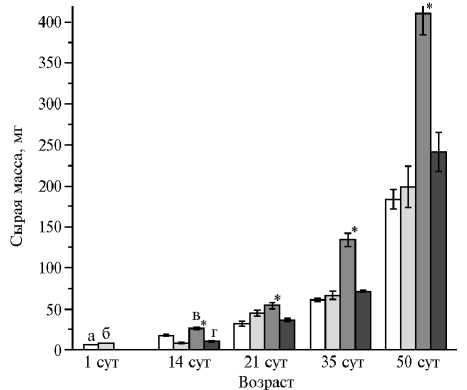
Рис. 1. Динамика накопления сырой биомассы в надземной части (а, в) и корнях (б, г) у растений люцерны хмелевидной ( Medicago lupulina ) без инокуляции (а, б) и при инокуляции грибом Rhizophagus irregularis (в, г) в условиях низкого содержания доступного фосфора в почве . Звездочкой отмечены варианты, в которых различия с растениями без инокуляции (контроль) статистически значимы при P < 0,05.
В развитии люцерны имеется несколько этапов: фаза 1-го и 2-го настоящего листьев, стеблевание и цветение. Ранее было установлено, что в фазу 1-го настоящего листа (на 14-е сут от посадки) происходит первичная колонизация AM, формирование первых арбу-скул и внутрикорневых везикул, начинается образование боковых корней и наблюдается первичный ростовой отклик на микориза-цию. В следующую фазу (на 21-е сут), когда формируется 2-й настоящий лист, выявляется существенный ростовой отклик на микориза-цию, развиваются арбуску-лы в корне. В фазу стеблевания (35-е сут) активно об- разуются симбиотические структуры (арбускулы и везикулы). В начале цветения (50-е сут) усиливается развитие везикул (26). Таким образом, эти сроки наиболее важны для растения и образования АМ.
При низком содержании фосфора в почве растения в контроле очень медленно увеличивали биомассу корней и надземных частей (рис. 1). Динамика изменения массы оказалась сходной для обеих анализируемых частей растений. Существенное накопление биомассы отмечали только в фазу цветения. Инокуляция растений практически не влияла на рост корня, но индуцировала многократное увеличение массы надземной части. Первый отклик на микоризацию наблюдали у побегов с 14-х сут, наиболее значительный прирост надземной массы — в фазу стеблевания.
На ранних этапах онтогенеза растений резко интенсифицировалось развитие R. irregularis , в первую очередь образование арбускул. На разветвлениях периарбускулярной мембраны локализованы основные транспортеры, отвечающие за перенос фосфата, воды и других веществ. Доля арбускул
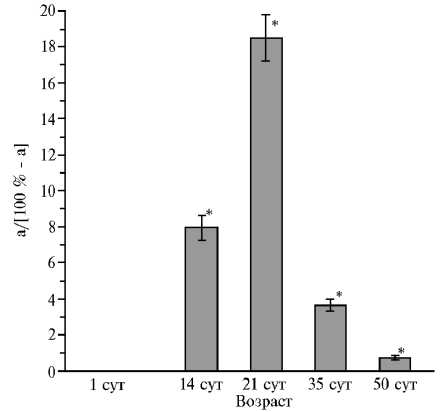
Рис. 2. Соотношение a/(100 % - a), характеризующее кратность превышения обилия арбускул a (%) над обилием внутрикорневого мицелия гриба Rhiz-ophagus irregularis 100 % - a (%) у растений люцерны хмелевидной ( Medicago lupulina ) в условиях низкого содержания доступного фосфора в почве . Звездочкой отмечены варианты, различия между которыми статистически значимы при P < 0,05.
может существенно меняться по мере развития растения, что, вероятно, обусловлено ограниченным временем жизни (4-5 сут) арбуску-лы, причем ее деградация может занимать всего 2,5-5,5 ч (34). По мнению ряда авторов, растение контролирует число арбускул посредством перераспределения потока углеродсодержащих соединений (35). Ранее было показано (26), что арбускулы интенсивно развиваются и на более поздних сроках. Полученные нами результаты, по-видимому, отражают интенсивное развитие мицелия (рис. 2).
На 21-е сут эффективность микоризации в корнях становилась отрицательной (рис. 3) и увеличение числа арбускул не подкреплялось интенсивным ростом корня. На более поздних стадиях развития растений эффективность микоризации имела небольшие положительные значения. Напротив, симбиотическая эффективность надземной части всегда была положительной, к фазе стеблевания достигала 120 % и далее не изменялась.
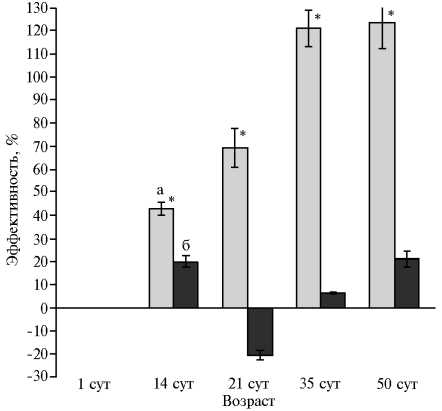
Рис. 3. Симбиотическая эффективность арбуску-лярной микоризы, рассчитанная по сырой массе надземных частей (а) и корней (б) , у растений люцерны хмелевидной ( Medicago lupulina ) при инокуляции грибом Rhizophagus irregularis в условиях низкого содержания доступного фосфора в почве . Звездочкой отмечены варианты, в которых различия с растениями без инокуляции (контроль) статистически значимы при P < 0,05.
Приведенные данные в целом согласуются с общепринятыми представлениями о динамичном развитии АМ. Известно, что в процессе микоризации уменьшается соотношение биомассы корня и побега (1, 36, 37), поскольку усиленное потребление органических веществ корнями инициирует развитие фотосинтезирующих органов. По некоторым данным, от 4 до 20 % фотоассимилятов может быть направлено в микоризованную корневую систему (38-40). Нарушения их транспорта существенно ингибирует развитие АМ, что может рассматриваться как действенный механизм регуляции. В свою очередь, развитие арбускул и внутрикорневого мицелия обеспечивает потребности растения в минеральном питании (41).
Предложенная симбиотическая модель (сильно микотроф- ная линия MlS-1—R. irregularis) позволила охарактеризовать динамические
процессы у гриба и растения-хозяина. Особенно интересны разнонаправ- ленные изменения в накоплении биомассы между побегом и корнем и в эффективности симбиоза.
70-i
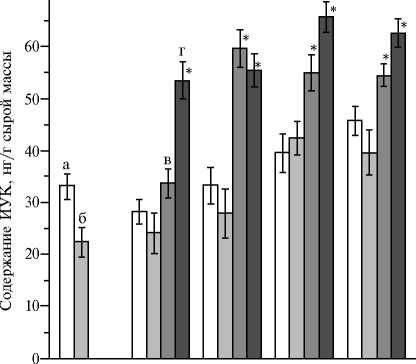
1 сут 14 сут 21 сут 35 сут 50 сут Возраст
Рис. 4. Содержание индолилуксусной кислоты в сырой массе листьев (а, в) и корней (б, г) у растений люцерны хмелевидной ( Medicago lup-ulina ) без инокуляции (а, б) и при инокуляции грибом Rhizophagus irregularis (в, г) в условиях низкого содержания доступного фосфора в почве . Звездочкой отмечены варианты, в которых различия с растениями без инокуляции (контроль) статистически значимы при P < 0,05.
Содержание ИУК в сырой массе корней без АМ было низким в фазу проростка и постепенно возрастало, незначительно увеличиваясь к фазе цветения (в 1,4 раза в надземных частях, в 1,8 раза — в корнях) (рис. 4). Отметим, что содержание ИУК в корнях было ниже, чем в побегах (исключение — фаза стеблевания), что соответствует современным представлениям о балансе ИУК в тканях и органах (42-44). Несмотря на отсутствие симбиотической эффективности, рассчитанной по массе корней, первым откликом на микоризацию было именно увеличение в них количества ИУК в фазу 1-го настоящего листа (см. рис. 4). Содержание ИУК в корнях АМ растений далее оставалось выше контрольных значений в 1,6-2,2 раза и достигало максимума на стадии стеблевания. В надземных частях отклик на микоризацию по содержанию ИУК был зафиксирован в фазу 2-го настоящего листа, после чего количество ИУК не повышалось.
Итак, при инокуляции растений люцерны хмелевидной грибом Rhizophagus irregularis в условиях низкого содержания фосфора в почве наблюдалось достоверное увеличение количества индолилуксусной кислоты в корнях и побегах. Повышение содержания ауксина в корне происходило уже на самых ранних этапах формирования арбускулярной микоризы. При этом инокуляция растений практически не влияла на увеличение его массы корня, но приводила к значительному увеличению массы надземной части. Вероятно, присущий ауксину эффект аттрактанта служит пусковым механизмом для усиления транспорта углеродсодержащих соединений в корень.
Список литературы Содержание ауксина у люцерны хмелевидной (Medicago lupulina L.) при инокуляции грибом Rhizophagus irregularis на фоне низкой обеспеченности доступным фосфором
- Смит С.Э., Рид Д.Дж. Микоризный симбиоз. М., 2012.
- Fusconi A. Regulation of root morphogenesis in arbuscular mycorrhizae: what role do fungal exudates, phosphate, sugars and hormones play in lateral root formation? Annals of Botany, 2014, 113: 19-33 ( ) DOI: 10.1093/aob/mct258
- Harrison M.J. Signaling in the arbuscular mycorrhizal symbiosis. Annual Review of Microbiology, 2005, 59: 19-42 ( ) DOI: 10.1146/annurev.micro.58.030603.123749
- Balzergue C., Puech-Pagès V., Bécard G., Rochange S.F. The regulation of arbuscular mycorrhizal symbiosis by phosphate in pea involves early and systemic signaling events. Journal of Experimental Botany, 2011, 62: 1049-1060 ( ) DOI: 10.1093/jxb/erq335
- Oláh B., Brière C., Bécard G., Dénarié J., Gough C. Nod factors and a diffusible factor from arbuscular mycorrhizal fungi stimulate lateral root formation in Medicago truncatula via the DMI1/DMI2 signalling pathway. The Plant Journal, 2005, 44: 195-207 ( ) DOI: 10.1111/j.1365-313X.2005.02522.x
- Paszkowski U., Boller T. The growth defect of lrt1, a maize mutant lacking lateral roots, can be complemented by symbiotic fungi or high phosphate nutrition. Planta, 2002, 214: 584-590 ( ) DOI: 10.1007/s004250100642
- Rouached H., Arpat A.B., Poirier Y. Regulation of phosphate starvation responses in plants: signaling players and crosstalks. Molecular Plant, 2010, 3: 288-299 ( ) DOI: 10.1093/mp/ssp120
- Chiou T.J., Lin S.I. Signaling network in sensing phosphate availability in plants. Annual Review of Plant Biology, 2011, 62: 185-206 ( ) DOI: 10.1146/annurev-arplant-042110-103849
- Hammond J.P., White P.J. Sugar signaling in root responses to low phosphorus availability. Plant Physiology, 2011, 156: 1033-1040 ( ) DOI: 10.1104/pp.111.175380
- Sato A., Miura K. Root architecture remodeling induced by phosphate starvation. Plant Signaling & Behavior, 2011, 6: 1122-1126 ( ) DOI: 10.4161/psb.6.8.15752
- Niu Y.F., Chai R.S., Jin G.L., Wang H., Tang C.X., Zhang Y.S. Responses of root architecture development to low phosphorus availability: a review. Annals of Botany, 2013, 112: 391-408 ( ) DOI: 10.1093/aob/mcs285
- Ludwig-Müller J. Hormonal responses in host plants triggered by arbuscular mycorrhizal fungi. In: Arbuscular mycorrhizas: physiology and function/Y. Kapulnik, H. Koltai (eds.). Springer, NY, 2010 ( ) DOI: 10.1007/978-90-481-9489-6_8
- Hanlon M.T., Coenen C. Genetic evidence for auxin involvement in arbuscular mycorrhiza initiation. New Phytologist, 2011, 189: 701-709 ( ) DOI: 10.1111/j.1469-8137.2010.03567.x
- Torelli A., Trotta A., Acerbi L., Arcidiacono G., Berta G., Branca C. IAA and ZR content in leek (Allium porrum L.), as influenced by P nutrition and arbuscular mycorrhizae, in relation to plant development. Plant and Soil, 2000, 226: 29-35 ( ) DOI: 10.1023/A:1026430019738
- Berta G., Fusconi A., Trotta A., Scannerini S. Morphogenetic modifications induced by the mycorrhizal fungus Glomus strain E3 in the root system of Allium porrum L. New Phytologist, 1990, 114: 207-215 ( ) DOI: 10.1111/j.1469-8137.1990.tb00392.x
- Trotta A., Carminati C., Schellenbaum L., Scannerini S., Fusconi A., Berta G. Correlation between root morphogenesis, VA mycorrhizal infection and phosphorus nutrition. In: Plant roots and their environment/B.L. McMichael, H. Person (eds.). Elsevier, Amsterdam, 1991.
- Meixner C., Ludwig-Müller J., Miersch O., Gresshoff P., Staehelin C., Vierheilig H. Lack of mycorrhizal autoregulation and phytohormonal changes in the supernodulating soybean mutant nts1007. Planta, 2005, 222: 709-715 ( ) DOI: 10.1007/s00425-005-0003-4
- Kaldorf M., Ludwig-Müller J. AM fungi might affect the root morphology of maize by increasing indole-3-butyric acid biosynthesis. Physiologia Plantarum, 2000, 109: 58-67 ( ) DOI: 10.1034/j.1399-3054.2000.100109.x
- Fitze D., Wiepninga A., Kaldorf M., Ludwig-Müller J. Auxins in the development of an arbuscular mycorrhizal symbiosis in maize. Journal of Plant Physiology, 2005, 162: 1210-1219 ( ) DOI: 10.1016/j.jplph.2005.01.014
- Overvoorde P., Fukaki H., Beeckman T. Auxin control of root development. Cold Spring Harbor Perspectives in Biology, 2010, 2: a001537 ( ) DOI: 10.1101/cshperspect.a001537
- Foo E. Auxin influences strigolactones in pea mycorrhizal symbiosis. Journal of Plant Physiology, 2013, 170: 523-528 ( ) DOI: 10.1016/j.jplph.2012.11.002
- Liao D., Chen X., Chen A., Wang H., Liu J., Liu J., Gu M., Sun S., Xu G. The characterization of six auxin-induced tomato GH3 genes uncovers a member, SlGH3.4, strongly responsive to arbuscular mycorrhizal symbiosis. Plant & Cell Physiology, 2015, 56(4): 674-687 ( ) DOI: 10.1093/pcp/pcu212
- Dubrovsky J.G., Napsucialy-Mendivil S., Duclercq J., Cheng Y., Shishkova S., Ivanchenko M.G., Friml J., Murphy A.S., Benková E. Auxin minimum defines a developmental window for lateral root initiation. New Phytologist, 2011, 191: 970-983 ( ) DOI: 10.1111/j.1469-8137.2011.03757.x
- Boivin S., Fonouni-Farde C., Frugier F. How auxin and cytokinin phytohormones modulate root microbe interactions. Frontiers in Plant Science. 2016, 7(1240): 1-12 ( ) DOI: 10.3389/fpls.2016.01240
- Jentschel K., Thiel D., Rehn F., Ludwig-Müller J. Arbuscular mycorrhiza enhances auxin levels and alters auxin biosynthesis in Tropaeolum majus during early stages of colonization. Physiologia Plantarum, 2007, 129: 320-333 ( ) DOI: 10.1111/j.1399-3054.2006.00812.x
- Юрков А.П., Шишова М.Ф., Семенов Д.Г. Особенности развития люцерны хмелевидной с эндомикоризным грибом. Саарбрюккен, 2010.
- Юрков А.П., Якоби Л.М., Степанова Г.В., Дзюбенко Н.И., Проворов Н.А., Кожемяков А.П., Завалин А.А. Эффективность инокуляции форм люцерны хмелевидной грибом арбускулярной микоризы Glomus intraradices и внутрипуляционная изменчивость растений по показателям продуктивности и микоризообразования. Сельскохозяйственная биология, 2007, 5: 67-74
- Phillips J.M., Hayman D.S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 1970, 55: 158-161 ( ) DOI: 10.1016/S0007-1536(70)80110-3
- Trouvelot A., Kough J.L., Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d'un système radiculaire. Recherche de méthodes ayant une signification fonctionnelle. In: Physiological and genetical aspects of mycorrhizae/V. Gianinazzi-Pearson, S. Gianinazzi (eds.). INRA-Press, Paris, 1986.
- Юрков А.П., Якоби Л.М., Гапеева Н.Е., Степанова Г.В., Шишова М.Ф. Развитие арбускулярной микоризы у сильно микотрофного растения-хозяина -люцерны хмелевидной (Medicago lupulina L.). Онтогенез, 2015, 46(5): 313-326 ( ) DOI: 11.7868/S0475145015050109
- Воробьев Н.И., Юрков А.П., Проворов Н.А. Программа вычисления индексов микоризации корней растений. Свид-во ¹ 2016612112 от 12.02.16 о гос. рег. программы ЭВМ. ФГБНУ ВНИИСХМ (РФ). Заявл. 21.12.2015. Опубл. 20.03.16.
- Одум Ю. Основы экологии. М., 1975.
- Veselov S.Yu., Kudoyarova G.R., Egutkin N.L., Gyuli-Zade V.Z., Mustafina A.R., Kof E.M. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole 3-acetic acid. Physiologia Plantarum, 1992, 86: 93-96 ( ) DOI: 0.1111/j.1399-3054.1992.tb01316.x
- Denison R.F., Kiers E.T. Life histories of symbiotic rhizobia and mycorrhizal fungi. Current Biology, 2011, 21(18): 775-785 ( ) DOI: 10.1016/j.cub.2011.06.018
- Schaarschmidt S., Gonzalez M.C., Roitsch T., Strack D., Sonnewald U., Hause B. Regulation of arbuscular mycorrhization by carbon. The symbiotic interaction cannot be improved by increased carbon availability accomplished by root-specifically enhanced invertase activity. Plant Physiology, 2007, 143: 1827-1840 ( ) DOI: 10.1104/pp.106.096446
- Scannerini S., Fusconi A., Mucciarelli M. The effect of endophytic fungi on host plant morphogenesis. In: Symbiosis: organisms and model systems/J. Seckback (ed.). Kluwer Academic Publishers, Dordrecht, 2001 ( ) DOI: 10.1007/0-306-48173-1_27
- Smith S.E., Smith F.A. Fresh perspectives on the roles of arbuscular mycorrhizal fungi in plant nutrition and growth. Mycologia, 2012, 104: 1-13 ( ) DOI: 10.3852/11-229
- Douds D.D., Pfeffer P.E., Shachar-Hill Y. Carbon partitioning, cost and metabolism of arbuscular mycorrhizae. In: Arbuscular mycorrhizas: physiology and function/Y. Kapulnick, D.D. Jr. Douds (eds.). Kluwer Academic Publishers, Dordrecht, 2000 ( ) DOI: 10.1007/978-94-017-0776-3_6
- Graham J.H. Assessing costs of arbuscular mycorrhizal symbiosis agroecosystems fungi. In: Current advances in mycorrhizae research/G.K. Podila, D.D. Jr. Douds (eds.). APS Press, Saint Paul, 2000 ( ) DOI: 10.4236/oje.2014.41002
- Bago B., Pfeffer P.E., Shachar-Hill Y. Carbon metabolism and transport in arbuscular mycorrhizas. Plant Physiology, 2000, 124(3): 949-958 ( ) DOI: 10.1104/pp.124.3.949
- Feddermann N., Finlay R., Boller T., Elfstrand M. Functional diversity in arbuscular mycorrhiza -the role of gene expression, phosphorus nutrition and symbiotic efficiency. Fungal Ecology, 2010, 3: 1-8 ( ) DOI: 10.1016/j.funeco.2009.07.003
- Albacete A., Ghanem M.E., Martínez-Andújar C., Acosta M., Sánchez-Bravo J., Martínez V., Lutts S., Dodd I.C., Pérez-Alfocea F. Hormonal changes in relation to biomass partitioning and shoot growth impairment in salinised tomato (Solanum lycopersicum L.) plants. Journal of Experimental Botany, 2008, 59: 4119-4131 ( ) DOI: 10.1093/jxb/ern251
- Vysotskaya L.B., Trekozova A.W., Kudoyarova G.R. Effect of phosphorus starvation on hormone content and growth of barley plants. Acta Physiologiae Plantarum, 2016, 38(108): 1-6 ( ) DOI: 10.1007/s11738-016-2127-5
- Емельянов В.В., Кирчихина Н.А., Ласточкин В.В., Чиркова Т.В. Гормональный баланс проростков пшеницы и риса в условиях аноксии. Физиология растений, 2003, 50(6): 922-929.


