Сохранение лесных генетических ресурсов на основе коллекции in vitro: состояние, перспективы, проблемы (аналитический обзор)
Автор: Корчагин О.М., Табацкая Т.М., Машкина О.С.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Лесная селекция и генетика
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Рассматриваются возможности и преимущества использования коллекции in vitro для сохранения (консервации ex situ) и воспроизводства представителей ценного генофонда лиственных древесных пород, проведения прикладных и фундаментальных исследований. Приведена методология формирования и длительного поддержания (от 1 года до 30 лет) живой коллекции in vitro (в виде микрорастений) ценных генотипов березы, тополя, осины и ивы. Показано, что применение питательных сред без гормонов при многолетнем хранении образцов обеспечивает сохранение их жизне- и регенерационной способности, генетических и селекционных (при высадке растений в почву) особенностей материнских деревьев. Выращивание посадочного материала на основе коллекции in vitro позволяет снизить сроки и себестоимость его получения (за счет упрощения и исключения отдельных этапов клонального микроразмножения), повысить эффективность получения качественных саженцев для создания лесных культур целевого назначения (за счет селективного тиражирования генотипов с заданными характеристиками). Представлены данные по использованию коллекции in vitro как генетического ресурса (виды, разновидности, гибриды, сорта; всего 21 вид, 88 генотипов) для проведения исследований по тканевой и клеточной селекции in vitro с целью получения солеустойчивых клонов древесных видов, изучения генетики морфогенеза (в частности, рассеченного листа березы). Обсуждаются проблемы взаимодействия между институтами, имеющими подобные коллекции. Их успешное решение будет способствовать повышению доступности и востребованности коллекций in vitro, расширению их функций, более быстрому внедрению полученных результатов в практику лесного хозяйства.
Коллекция клонов in vitro, генетические ресурсы, лиственные древесные растения, питательные среды без гормонов, посадочный материал
Короткий адрес: https://sciup.org/143180088
IDR: 143180088 | УДК: 630.161:631.52:57.085.23 | DOI: 10.24419/LHI.2304-3083.2023.2.06
Текст научной статьи Сохранение лесных генетических ресурсов на основе коллекции in vitro: состояние, перспективы, проблемы (аналитический обзор)
Коллекции in vitro (биоресурсные коллекции) – это искусственно созданные и длительно поддерживаемые в контролируемых асептических условиях ( in vitro ) образцы живого растительного материала (меристемы, каллуса, эмбриогенных культур, микропобегов, целых микрорастений и др.), соответствующие конкретным генотипам разных видов растений, которые предназначены для их сохранения и воспроизводства. В коллекции in vitro , как правило, сохраняют уникальные и/или хозяйственно ценные генотипы, редкие и исчезающие виды растений, преимущественно те, которые трудно размножаются вегетативно или теряют ценные признаки при семенном размножении [1–3]. Такие «живые» коллекции (включающие уникальные образцы генетических ресурсов и чаще всего организованные при ботанических садах, научно-исследовательских институтах и университетах) представляют собой только часть генетического разнообразия, однако особо ценную для сохранения (консервации ex situ ) и воспроизводства, всестороннего изучения и использования.
Создание и поддержание коллекций представителей ценного генофонда относится к приоритетным направлениям в нашей стране, что отражено в ряде стратегических документов Российской Федерации, последним из которых является Федеральная научно-техническая программа развития генетических технологий на 2019–2027 гг. [4]. Один из запланированных результатов данной программы – создание и функционирование биоресурсных коллекций (включая национальные биоресурсные центры), обеспечивающих хранение и предоставление образцов коллекций в соответствии с мировыми стандартами [4].
В настоящее время в России зарегистрировано около 250 коллекций – растений (82 коллекции), микроорганизмов (44 коллекции), животных (32 коллекции), биоматериалов и клеточных линий человека (15 коллекций) и других живых объектов, а также гербарных и музейных коллекций (63) [3, 5, 6]. К наиболее крупным из них, не только в России, но и в мире, относится коллекция генетических ресурсов культурных растений и их диких родичей Всероссийского института генетических растений имени Н.И. Вавилова (ВИР) (Санкт-Петербург). В коллекции насчитывается более 320 тыс. образцов, хранящихся в виде семян, вегетативных и генеративных органов, культуры тканей (in vitro) в контролируемых условиях при различных температурных режимах [3]. В 2022 г. Указом Президента РФ на базе ФИЦ ВИР им. Н.И. Вавилова был организован Национальный биоресурс-ный центр генетических ресурсов растений [7], одной из задач которого является формирование первого полного Национального каталога особо ценных образцов генетических ресурсов растений. Это важный шаг на пути к интеграции информации о коллекциях растений нашей страны для их сохранения, развития и использования по сетевому принципу.
Создание и длительное поддержание коллекций in vitro ценных генотипов многолетних лесных древесных растений особенно актуально потому, что это связано не только с обеднением и сокращением генофонда лесов из-за лесных пожаров, глобального изменения климата (в том числе засухи), техногенного загрязнения и других причин, но и со сложностью самого объекта. Сложность обусловлена трудностью черенкования многих древесных видов и пород, снижением у взрослых деревьев (прошедших селекционную оценку) регенерационной активности тканей, высокой зараженностью (бактериальной и грибковой) исходного материала, что затрудняет его введение в культуру in vitro. В условиях же in vitro миниатюрные растения, их отдельные органы и ткани хранятся в строго контролируемых условиях, являются омоложенными образцами (копиями) взрослых деревьев, сохраняющими регенерационную способность на достаточно высоком уровне. При этом большое значение имеет разработка регламентов и технологий культивирования in vitro, обеспечивающих надежное хранение образцов с сохранением их жизне-и регенерационной способности, генетической и хозяйственной ценности материнских деревьев. Это во многом зависит от видовых и генотипических особенностей коллекционного материала,
88 клонов
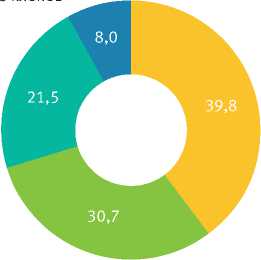
Береза Тополь Осина Ива
Рис. 1. Породный состав коллекции
46 клонов тополя
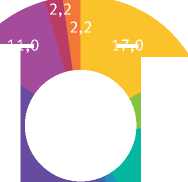
11,0
17,0
9,0
15,0
2,2
2,2
39,2

Populus alba L.
-
■ Populus x canescens Sm.
-
■ Populus alba L. x P. bolleana
Populus trichocarpa Torr. et Gray
Populus nigra L.
Populus tremula L.
-
■ Populus alba L x P. tremula L.
Populus tremuloides Michx.
Populus euramericana (Dode)
Guinier
Рис. 2. Видовой состав коллекции (на примере тополя)
условий его хранения in vitro и других факторов, которые необходимо учитывать при создании коллекции и ее долговременном поддержании.
Коллекцию in vitro клонов ценных генотипов лиственных древесных растений в ФГБУ ВНИИЛ-ГИСбиотех начали формировать (в виде микрорастений) с 1991 г., она является одной из самых старейших в России [8]. Длительность хранения образцов взрослых деревьев составляет от 1 года до 30 лет. В 2018 г. коллекция зарегистрирована как уникальная научная установка (УНУ) на сайте «Научно-технологическая инфраструктура Российской Федерации» (регистрационный номер 569228)1. В состав коллекции входят 88 клонов (генотипов), которые представлены гибридами, сортами, видами и разновидностями, относящимися к 21 виду, 3 родам, 2 семействам (рис. 1–3).
Среди них продуктивные, с хорошим качеством древесины, устойчивые диплоидные и триплоидные гибриды тополя белого ( Populus alba L.) и тополя сереющего ( Populus x canescens Sm.); клоны продуктивных и гнилеустойчивых биотипов осины ( P. tremula L.); продуктивных и засухоустойчивых форм березы повислой ( Betula pendila L.) и березы пушистой ( B. pubescens Ehrh.); форм карельской березы ( B. pendula Roth var. carelica (Mercklin) Hamet-Ahti) с узорчатой

Рис. 3. Общий вид культур березы и тополя в коллекции длительного хранения (1–30 лет), 2022 г.
текстурой древесины; декоративных рассеченно-листных форм березы далекарлийской ( B. pendula “dalekarlica” (L.f.); быстрорастущих биотипов разных видов ивы ( Salix spp.), перспективных для создания биоэнергетических плантаций. Причем более 60 % генотипов являются результатом биоизыскательской деятельности ученых ВНИ-ИЛГИСбиотех, их нет ни в одной аналогичной коллекции России и мира. Большинство из них трудно размножается обычным черенкованием, а отдельные генотипы по разным причинам уже отсутствуют в природе [9]. В последние годы коллекция дополнена новыми клонами и линиями березы и тополя, устойчивыми к засолению питательной среды NaCl и Cd и полученными на основе клеточной и тканевой селекции in vitro [10].
Позднее коллекции in vitro были созданы в Институте леса Карельского научного центра РАН (ИЛ КарНЦ РАН, Петрозаводск) [11], Институте леса им. В.Н. Сукачева СО РАН (Красноярск) [12] и филиале Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (ФИБХ РАН, Пущино Московской обл.) [13]. В ИЛ КарНЦ РАН организована одна из самых крупных коллекций клонов карельской березы (семенного и вегетативного происхождения) и других редких видов сем. Betulaceae2. В составе коллекции Института леса СО РАН хранятся клеточные линии, эмбриогенные культуры и растения-регенеранты Larix sibirica Ledeb. [12], а ФИБХ РАН – ценные генотипы березы и осины [13]. Коллекция ВНИИЛГИСбиотех отличается не только ассортиментом, но и условиями многолетнего поддержания клонов с использованием питательных сред без гормонов, которые впервые были применены нами для березы и тополя [8]. Такой подход снижает вероятность сомаклональ-ной изменчивости и способствует сохранению генетической и хозяйственной ценности образцов.
Цель работы – продемонстрировать методологию формирования коллекции in vitro и возможности ее использования для сохранения, воспроизводства и изучения лесных генетических ресурсов.
Материалы и методы исследований
Формированию коллекции in vitro ценных генотипов лиственных древесных растений должны предшествовать исследования по разработке технологий клонального микроразмножения, которые предпочтительно осуществлять с использованием модели, основанной на пролиферации пазушных (или апикальных) меристем. Такие методы и технологии были ранее разработаны нами для разных видов, гибридов и генотипов березы [14], осины [15], тополя [16], ивы [17].
Для введения в культуру in vitro отбирали только хозяйственно ценные, уникальные экземпляры, как правило, трудночеренкуемые обычным способом. В Центрально-Черноземной области лучшим сроком заготовки побегов (8–10 шт. длиной 10–20 см с 6–7 вегетативными почками на каждом) со взрослых материнских деревьев для введения эксплантов в культуру in vitro являются: февраль – для березы (однолетние зимние одревесневшие побеги), май–июнь – для тополя, осины и ивы (однолетние растущие неодревесневшие (зеленые) побеги). Соблюдение указанных сроков позволяет получить до 80 % жизнеспособных первичных культур. Побеги с хорошо выраженными междоузлиями заготавливали преимущественно из верхнего яруса кроны (онтогенетически более "молодой" зоны возобновления), что повышало эффективность морфогенеза (до 50 % морфогенных культур).
Экспланты (стеблевые сегменты с одной пазушной почкой) отобранных деревьев однократно вводили в культуру in vitro, из них регенерировали (путем прямого органогенеза) микрорастения согласно разработанным методикам [8, 9, 18]. Для индукции побегов использовали питательные среды MS [19] или WPM [20], дополненные 6-бензиламинопурином (БАП) в концентрации 0,2–1,0 мг/л. Режим культивирования: температура – 25±2 °С, фотопериод – 16 ч день / 8 ч ночь, освещенность – 2,0 клк. Для снижения вероятности возникновения сомаклональной изменчивости применение гормональных сред ограничивали 1–3 пассажами культивирования первичных эксплантов. С этой же целью мультипликацию, укоренение микропобегов и многолетнее хранение клонов осуществляли на питательных средах (1/2 MS или 1/2 WPM) без гормонов. В этом случае происходило спонтанное укоренение микропобегов с формированием хорошо развитой корневой системы. Отметим, что большинство исследователей для этих целей применяют питательные среды с гормонами [21–23].
Живые образцы (микрорастения) поддерживали в виде пересадочной коллекции в условиях нормального (стандартные условия культивирования) или замедленного роста (при пониженной температуре) [9, 18]. При хранении в условиях нормального роста (25 °С, 2,0 клк, 16 ч день / 8 ч ночь) проводили редкое субкультивирование микрорастений с интервалом один раз в 4–6 мес. (против 1–2 мес. в норме), а при хранении при пониженной температуре (4 °С, 0,5 клк, 6 ч день / 18 ч ночь) – с более редким интервалом (до 12 мес). В последнем случае осуществляли резервное хранение (дублирование) части особо ценных коллекционных образцов. Для торможения ростовых процессов при стандартных условиях культивирования использовали уплотнение питательной среды путем увеличения концентрации агара (9 г/л вместо 6–7 г/л). В случае необходимости повышения сохранности культур при долгосрочном хранении в питательные среды добавляли активированный уголь (1,5–2 %) для адсорбции продуктов обмена и предотвращения изменения кислотности среды.
С целью снижения вероятности микробной контаминации культур и повышения их сохранности при долгосрочном хранении в качестве культуральных сосудов, использовали биологические пробирки (21x200 мм), в которые высаживали по одному микропобегу. Растения в этом случае хорошо развивались, имели выраженные междоузлия, что благоприятно для их микрочеренкования. Клонирование in vitro микрорастений проводили в стеклянных конических колбах объемом 150 мл, в которые высаживали по 3–5 эксплантов (одноузловых сегментов стебля).
Каждый клон в коллекции представлен не менее чем 20–30 образцами (микрорастениями)
и сопровожден паспортом. Паспорта включают детальные сведения об образце: регистрационный номер, таксономический статус объекта хранения, автор(ы) и год создания клона, характеристика материнского дерева (происхождение, место произрастания, оригинатор (или автор сбора материала), хозяйственная и селекционная ценность, условия культивирования in vitro (световой режим, питательная среда, периодичность пересадки, другие особенности), характеристика клона (морфологические, биотехнологические, молекулярно-генетические и другие особенности, его фотография), плоидность, результаты тестирования in vitro и ex vitro . Молекулярно-генетическая паспортизация (для идентификации образцов, а также защиты прав обладателей интеллектуальной собственности селекционных достижений) проводилась на основе микросател-литных маркеров. Следует отметить, что в работе с биоресурсными коллекциями микросателлит-ные маркеры широко используют для идентификации образцов разных культур [24, 25].
Основные функции коллекции:
-
1) сохранение и воспроизводство представителей ценного генофонда;
-
2) сокращение сроков выращивания и снижение себестоимости посадочного материала для создания лесных культур целевого назначения или восстановления генофонда редких и/или исчезающих видов;
-
3) исследования по клеточной и тканевой селекции для усовершенствования существующих и получения новых форм;
-
4) проведение методических, прикладных и фундаментальных исследований в области биотехнологии, генетики и селекции, в том числе изучение генетики морфогенеза с использованием созданных нами модельных объектов (уникальных сомаклональных вариантов).
Результаты и обсуждение
Тестирование коллекционного материала в ходе длительного культивирования in vitro. Для обеспечения основной функции коллекции
(консервация ex situ и воспроизводство ценных генотипов) нами периодически проводится тестирование коллекционного материала (оценка характеристик данного клона в процессе длительного хранения, его генетической стабильности и идентичности исходным экземплярам), которое осуществляется на основе биотехнологической оценки ( in vitro ), хромосомного анализа и ДНК-технологий, результатов полевых испытаний ( ex vitro ).
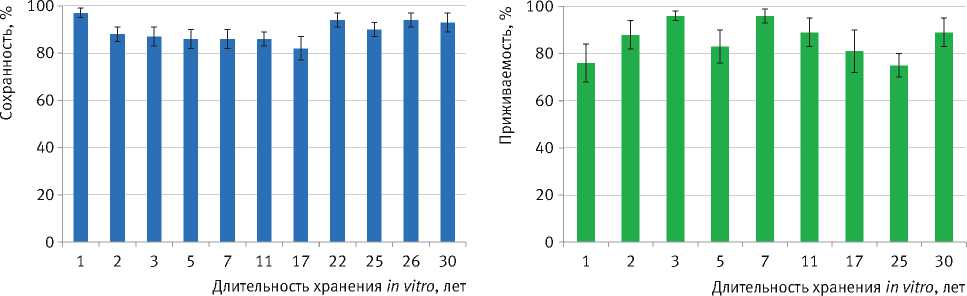
Установлено, что оба способа хранения (стандартные условия культивирования и условия замедленного роста – при пониженной температуре) обеспечивают высокие биотехнологические параметры, а также стабильно высокую сохранность (до 100 %) и регенерационную способность (укореняемость – 90–100 %, коэффициент мультипликации культур: 4,3–7,0 – для березы, 4,0–8,2 – для тополя и осины, 5,8–8,2 – для ивы). Так, например, на протяжении 30-летнего срока хранения при стандартных условиях культивирования клона Ia высокоствольной формы карельской березы отмечена высокая сохранность растений in vitro (82–97 %) и их приживаемость в теплице – ex vitro (75–96 %) (рис. 4). Сохраняются особенности роста клонов в высоту в условиях in vitro и ex vitro , их внутриклоновая однородность по росту, отсутствуют признаки сомаклональной изменчивости [18].
Хромосомный анализ показал, что коллекционные клоны разного срока хранения in vitro демонстрируют идентичность материнским деревьям по плоидности (у березы – диплоиды 2n=28, триплоиды 2n=42 или тетраплоиды 2n=56; у тополя и осины – диплоиды 2n=38 или триплоиды 2n=57) и уровню миксоплоидии. Так, клоны карельской березы Ia и Ю сохранили диплоидный (2n=28), а клон 3пш березы пушистой – тетраплоидный (2n=56) уровень плоид-ности, присущий их материнским деревьям (рис. 5). При этом содержание клеток с модальным (диплоидным или тетраплоидным) числом хромосом высокое (до 90 %), а незначительная часть (до 10 %) приходится на долю анеуплоид-ных клеток. Клон Тр карельской березы является выраженным миксоплоидом (как и его материнское дерево). Содержание триплоидных клеток (2n=42) в среднем составило 60 %, диплоидных (2n=28) – 30 %, анеуплоидных – 10 %. Причем такое соотношение сохранялось в течение всего периода хранения [9, 26].
Микросателлитный анализ коллекционных клонов березы, тополя и осины разной длительности хранения in vitro , находящихся в условиях in vitro и ex vitro (теплица, питомник), подтвердил их внутриклоновую генетическую однородность и стабильность (низкую мутабельность), а также идентичность материнским деревьям [9, 26].
Известно, что митохондриальная ДНК (мтДНК) и хлоропластная ДНК (хлДНК) более чувствительны к повреждающим факторам по сравнению с ядерной ДНК, что связывают
а б
Рис. 4. Сохранность in vitro ( а ) и приживаемость ex vitro ( б , в теплице) растений клона Ia карельской березы разного срока хранения in vitro , % общего числа высаженных микропобегов
Illllllllllllll
шшмммш
Illllllllllllll
Illllllllllllll
лет
клон
Анеуплоидные клетки
Триплоидные ( 2n=42 )
Тетраплоидные ( 2n=56 )
Диплоидные ( 2n=28 )
Рис. 5. Статус плоидности и соотношение клеток с различным числом хромосом в корневой меристеме растений клонов карельской березы (Ia, Ю, Тр) и березы пушистой (3пш) в процессе длительного хранения in vitro .
с несовершенством у них систем репарации и отсутствием гистонов, а также прокариотической организацией генома. МтДНК локализована в матриксе митохондрий (т.е. в непосредственной близости с сайтами продукции активных форм кислорода – АФК) [27, 28].
Наши исследования выявили большее количество повреждений неядерной ДНК (мтДНК и хлДНК) у клонов тополя белого 26-летнего срока хранения по сравнению с 5-летними [29]. Накопление повреждений мтДНК и хлДНК с увеличением длительности хранения может приводить к нарушениям энергетического баланса, метаболизма, фотосинтеза, роста и развития. Однако у клонов 26-летнего срока хранения in vitro не обнаружены видимые признаки онтогенетического старения и сомаклональной изменчивости, изменения статуса плоидности; сохранился уровень экспрессии генов ogg1 и xrcc1, отвечающих за репарацию ДНК, которая является адаптивной реакцией растительного организма на стресс. Это может быть связано с оптимальными условиями длительного хранения на питательных средах без гормонов. Установлено, что мтДНК и хлДНК триплоидных клонов с возрастом накапливают меньше повреждений, чем диплоидные клоны. У триплоидов выявлено и более высокое содержание копий мтДНК, что может обеспечить их большую устойчивость к стрессовым условиям при высадке в грунт [29].
Выращивание посадочного материала и создание плантационных культур на основе коллекции in vitro. Выращивание посадочного материала на основе коллекции in vitro дает целый ряд преимуществ (по сравнению с традиционным черенкованием), среди которых – повышение эффективности выращивания качественного посадочного материала (за счет селективного, круглогодичного, массового тиражирования генотипов с заданными свойствами) для создания лесных культур целевого назначения, лесоразведения; снижение сроков и себестоимости получения посадочного материала за счет исключения достаточно трудоемких этапов введения эксплантов в культуру in vitro и регенерации растений, упрощения этапа клонирования in vitro (при применении безгормональных питательных сред).
Выращенный на основе коллекции in vitro посадочный материал лиственных древесных растений был использован нами для создания опытных плантационных культур (на площади более 2 га) карельской березы (5 клонов) и березы повислой (2 клона), тополя белого и тополя сереющего (6 клонов), осины (3 клона). Их возраст в настоящее время – 21–29 лет [9, 26]. Мы – одни из первых, кто предложил проводить непосредственную высадку микрорастений березы, тополя и осины из культуры in vitro сразу в нестерильный грунт теплицы (рис. 6), что также упрощает и удешевляет процесс выращивания посадочного материала. Полученный таким способом посадочный материал имел достаточно высокую приживаемость и сохранность ex vitro (теплица, лесной питомник) – 70–100 %.
Результаты экономических расчетов (на примере березы) показали, что использование коллекции живых образцов позволяет снизить расходы на выращивание посадочного материала (по сравнению с полным циклом его получения – от заготовки материала с дерева до выращивания растений в теплице). Себестоимость одного саженца березы пушистой, выращенного на основе коллекции in vitro (на июнь 2019 г.), составила 15,61 руб. (против 18,77 руб. по полному циклу). При проведении непосредственной высадки регенерантов (т.е. из культуры in vitro сразу в теплицу) себестоимость снизится на 25,8 % относительно технологии полного цикла (13,93 руб.) [30]. Конкурентным по цене является и создание плантационных культур на основе коллекции in vitro . Полная себестоимость создания 1 га плантации карельской березы посадочным материалом in vitro (при схеме посадки 3 х 6 м) составила 297 863,95 руб. По данным изучения конъюнктуры рынка посадочного материала (на июнь 2022 г.), минимальная цена на саженцы березы начинается от 100 руб./шт., тогда как производственная себестоимость одного саженца in vitro карельской березы с открытой корневой системой (ОКС) на выходе из теплицы составила 24,20 руб. [30].

Рис. 6. Непосредственная высадка растений березы в теплицу после длительного (25 лет) культивирования в условиях in vitro
Многолетние полевые испытания клонов после их длительного хранения in vitro демонстрируют хорошее состояние и высокую сохранность (75–97 %), поддержание специфичных для их исходных генотипов особенностей роста и относительной внутриклоновой однородности, а также идентичности исходным экземплярам (по особенностям роста, габитусу, качеству древесины, плоидности и молекулярно-генетическим особенностям).
У разноплоидных (диплоидных и триплоид-ных) коллекционных клонов тополя и осины выявлена аналогичная динамика роста с исходными деревьями, достаточно высокая продуктивность древостоев. Так, в возрасте 19 лет средняя высота деревьев осины составила 18–20 м, диаметр ствола – 26–38 см, объем ствола – 0,423–0,931 м3, запас древесины – 117–383 м3/га. Триплоидный ( 2n=57 ) клон осины отличается наиболее высокой сохранностью (71,4 % против 65,8 % и 44,4 % у диплоидных клонов), наилучшими техническими свойствами древесины (по плотности и длине волокна), отсутствием признаков заболевания сердцевинной гнилью [26].
У клонов карельской березы каллусного происхождения (после 1, 5, 10 и 11 лет хранения in vitro ) наблюдалось раннее (с 3–5 лет), полное
(у всех деревьев к 5–8-летнему возрасту) и хорошо выраженное проявление внешних и анатомических признаков узорчатости древесины (рис. 7). У растений, полученных по обычной технологии (семенным путем), признаки узорчатости проявлялись позже – в 10–12 лет. Выращивание карельской березы каллусного происхождения позволит получать высококачественную древесину не только в массовом количестве, но и в более короткие сроки [9].
Коллекция in vitro как генетический ресурс для проведения прикладных и фундаментальных исследований. Коллекция in vitro – это не только стратегический резерв ценного генофонда нашей страны, но и генетический ресурс, а также модель для проведения прикладных и фундаментальных исследований в области лесной генетики, селекции и биотехнологии.
На основе коллекции in vitro нами выполняются исследования по клеточной и тканевой селекции для получения селекционно улучшенного посадочного материала березы и тополя, в частности толерантного к негативным факторам среды. Для лесных древесных растений эти вопросы остаются слабоизученными. Известно, что засоление питательных сред хлоридом натрия (NaCl) позволяет моделировать как солевой, так и осмотический стресс, отбирать солеустойчивые и засухоустойчивые формы [31, 32]. Показана возможность использования кадмия (Cd), обладающего не только токсическим, но и осмотическим действием, в качестве осмотического стрессора для отбора in vitro устойчивых к водному дефициту вариантов [33, 34]. Это определило наш выбор стрессоров (NaCl, Cd) в исследованиях по тканевой и клеточной селекции.
Нами разработана схема селекции in vitro (на примере разных видов березы) на устойчивость к хлориду натрия (NaCl) (рис. 8). Она основана на использовании двух модельных биотест-систем: сначала коллекции клонов березы in vitro (культура микропобегов, тканевая селекция), а затем стеблевых каллусных культур, полученных от наиболее устойчивых к засолению клонов, т.е. на генетическом разнообразии коллекции (виды, разновидности, полиплоиды, гибриды) и индуцированной клеточной гетерогенности каллусных культур [10].
Данная схема может быть адаптирована для других стрессоров, пород и видов лиственных древесных растений.
По результатам испытания экспериментального материала березы in vitro и ex vitro (с использованием селективных сред in vitro

1 2 3 4
Рис. 7. Внешнее проявление признаков узорчатости древесины (хорошо выраженные вздутия на поверхности ствола) у деревьев карельской березы после 1 года (1), 5 лет (2), 10 (3) и 11 лет (4) хранения в коллекции in vitro . Семилукский лесной питомник, Воронежская обл.
I этап тканевая селекция in vitro (микропобеги)
II этап клеточная селекция in vitro (каллусы)
III этап испытание ex vitro (регенерантные линии)
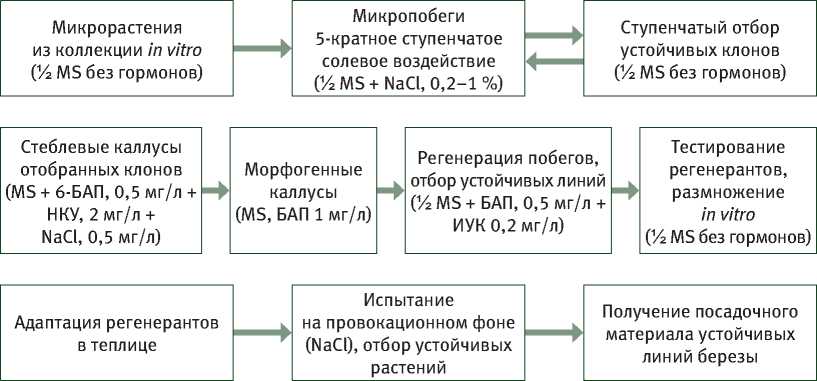
Рис. 8. Схема селекции in vitro березы на устойчивость к солевому стрессу [10]
и провокационного фона ex vitro ) отобрано 7 наиболее устойчивых к засолению NaCl линий березы, из них 3 показали комплексную устойчивость (как к NaCl, так и к Cd).
Имеющиеся в коллекции оригинальные сома-клональные варианты березы являются удобными моделями для изучения генетики морфогенеза, механизмов сомаклональной изменчивости. Так, разработана модельная система, позволившая выявить значительный вклад эпигеномных механизмов в морфогенез рассеченного листа березы под влиянием условий культивирования – гормонов (ауксина β-индолилуксусной кислоты) или эпимутагенов (5-азацитидина, никотиновой кислоты) [35]. Показана возможность получения на основе коллекции in vitro посадочного материала березы с гарантированным сохранением морфотипа с декоративными листьями.
Перспективы развития коллекции. Нерешенные проблемы. Коллекция ВНИИЛГИСбио-тех развивается путем пополнения новыми образцами лиственных древесных растений с расширением видового и породного состава. Так, в последние годы в рамках выполнения государственных заданий Федерального агентства лесного хозяйства здесь проводят исследования по изучению и разработке протоколов и технологических решений клонального микроразмножения экономически ценных генотипов твердолиственных пород (дуба черешчатого и ясеня обыкновенного), разных видов клена и липы.
Развитие коллекции заключается и в расширении ее функций, в частности путем совершенствования биотехнологий: условий длительного хранения in vitro , методов селекции in vitro для получения улучшенного посадочного материала. Коллекцию предполагается использовать для развития генетических технологий (в том числе технологий генетического редактирования, выявления генетических маркеров, ассоциированных с селекционно значимыми признаками и др.). Важность проведения таких исследований определена Федеральной научно-технической программой развития генетических технологий на 2019–2027 гг. [4].
Отмечается, что, несмотря на существование в нашей стране достаточно большого количества биоресурсных коллекций (около 250 коллекций, различающихся по объектам и направлениям), до сих пор отсутствует единая информационная система, обеспечивающая доступ специалистов к информации о существующих в России коллекциях, унифицированный формат предоставления данных о составе коллекций (в соответствии с мировыми стандартами). Не отработан механизм взаимодействия биоресурсных коллекций по сетевому принципу [3, 6].
Так, например, до сих пор не сформированы единая стратегия и методики создания, регистрации, хранения и использования коллекций in vitro лесных древесных растений. Не определен перечень объектов (пород, видов, гибридов, сортов), подлежащих предпочтительному хранению в коллекции in vitro . Нередко коллекционные образцы длительно хранят в виде побегов без корней (а не полноценных растений) на питательных средах с гормонами цитокининовой природы, что затрудняет последующий этап их укоренения и может привести к сомаклональ-ной изменчивости. Исследователи используют разные подходы, протоколы и ДНК-маркеры для молекулярно-генетической паспортизации и идентификации образцов. Все это затрудняет тесное взаимодействие между организациями (НИИ, ботаническими садами, вузами), имеющими сходные типы коллекций.
В 2013 г. на базе ФГБУ «ВНИИЛГИСбиотех» был создан «Центр лесных биотехнологий», одна из основных задач которого – поддержание работ по сохранению лесных генетических ресурсов, в том числе селекционных достижений. При участии членов экспертной рабочей группы (особенно д-ра биол. наук Л.В. Ветчинниковой) по направлению «Клональное микроразмножение» Межведомственного научно-координационного совета было разработано Положение о банке in vitro лесных древесных растений в структуре «Центра лесных биотехнологий»3. В нем представлены предложения и основные требования к формированию, длительному поддержанию, паспортизации и контролю коллекций лесных древесных растений. Положение было рассмотрено и утверждено на VII заседании Межведомственного научно-координационного совета «Центра лесных биотехнологий» (28 июня 2017 г., Москва, Рослесхоз). Следует отметить, что только 2 научных института-держателя (ВНИИЛГИСбиотех и ИЛ КарНЦ РАН) создали интернет-порталы с предоставлением доступной информации о поддерживаемых in vitro коллекциях лесных древесных растений4.
Решение этих вопросов будет способствовать повышению доступности и востребованности коллекций, расширению их функций за счет объединения усилий исследователей различных направлений (биотехнологов, генетиков, селекционеров и др.) в рамках сетевого взаимодействия, внедрению полученных результатов в практику лесного хозяйства.
Выводы
Показана возможность длительного надежного хранения in vitro (от 1 года до 30 лет) коллекционных образцов ценных генотипов березы, тополя, осины, ивы с использованием безгормональных питательных сред, которые обеспечивают высокую жизне- и регенерационную способность, возможность полноценного развития растений in vitro и ex vitro (в полевых условиях), а также сохранение генетических и селекционных особенностей материнских деревьев.
Использование in vitro коллекции существенно расширяет возможности сохранения ( ex situ консервации) лесных генетических ресурсов. Выращивание посадочного материала на основе коллекций позволяет упростить отдельные этапы клонального микроразмножения, что снижает сроки его получения и себестоимость, повышает конкурентоспособность, способствует повышению эффективности получения качественных саженцев для создания лесных культур целевого назначения, воспроизводства быстрорастущих лиственных пород после пожаров, засухи, рубок, техногенного загрязнения.
Кроме того, коллекции in vitro , включающие уникальный генетически разнообразный материал лесных древесных растений, представляют особую ценность для проведения методических, прикладных и фундаментальных исследований в области биотехнологии, генетики и селекции.
Список литературы Сохранение лесных генетических ресурсов на основе коллекции in vitro: состояние, перспективы, проблемы (аналитический обзор)
- Решетников, B.R Биотехнология растений и перспективы ее развития / B^. Решетников, E.B. Спиридо-вич, A.M. Носов // Физиология растений и генетика. - 2014. - Т. 46. - № 1. - С. 3-17.
- Молканова, О.И. Особенности размножения и сохранения коллекции ценных и редких видов растений в условиях in vitro / О.И. Молканова, Л.И. Коновалова, Т.С. Стахеева // Бюллетень ГНБС. - 2016. - № 120. - С. 17-23.
- Хлесткина, Е.К. Генетические ресурсы России: от коллекций к биоресурсным центрам / Е.К. Хлесткина // Труды по прикладной ботанике, генетике и селекции. - 2022. - Т. 183. - № 1. - С. 9-30.
- Федеральная научно-техническая программа развития генетических технологий на 2019-2027 годы. Постановление Правительства РФ от 22.04.2019 № 479 (с изм. от 28.08.2021).
- Колчанов, Н.А. Биоресурсные коллекции институтов Министерства науки и высшего образования: опыт инвентаризации и развития / Н.А. Колчанов // VII Съезд Bавиловского общества генетиков и селекционеров, посвящ. 100-летию кафедры генетики СПбГУ, и ассоциированные симпозиумы (Санкт-Петербург, 18-22 июня 2019). - Санкт-Петербург: BBM, 2019. - С. 399.
- Информационная система по биоресурсным коллекциям институтов ФАНО России / С.А. Лашин, Д.А. Афонников, М.А. Генаев [и др.] // Bавиловский журнал генетики и селекции. - 2018. - Т. 22. - № 3. -С. 386-393.
- О Национальном центре генетических ресурсов растений. - Текст: электронный. - Указ Президента Российской Федерации от 08.02.2022 № 44. Официальный интернет-портал правовой информации. - Режим доступа: URL: http://publication.pravo. gov.ru/Document/View/0001202202080014 [дата обращения: 16.02.2023].
- Длительное микрочеренкование для массового клонального размножения карельской березы и тополя / О.С. Машкина, Т.М. Табацкая, Л.М. Стародубцева // Физиология растений. - 1999. - Т. 46. - № 6. - С. 950-953.
- Табацкая, Т.М. Опыт долговременного хранения коллекции ценных генотипов березы с использованием безгормональных питательных сред / Т.М. Табацкая, О.С. Машкина // Лесоведение. - 2020. - № 2. - С. 147-161.
- Mashkina, O.S. In vitro selection of birch for tolerance to salinity stress / O.S. Mashkina, T.M. Tabatskaya, O.M. Korchagin // IOP Conference Series: Earth and Environmental Science. - 2021. - Р. 13. - 875(1): 012082. DOI:10.1088/1755-1315/875/1/012082.
- Bетчинникова, Л^. Карельская береза: важнейшие результаты и перспективы исследований / Л^. Bет-чинникова, А.Ф. Титов. - Петрозаводск: КарНЦ РАН, 2021. - 243 с.
- Особенности соматического эмбриогенеза длительно пролиферирующих эмбриогенных клеточных линий Larix sibirica in vitro / И.Н. Третьякова, М.Э. Пак, А.С. Иваницкая [и др.] // Физиология растений. - 2016. - Т. 63. - № 6. - С. 812-822.
- Vidyagina, E.O. Long-term of different aspen genotypes in vitro without repotting / E.O. Vidyagina, M.V. Filippov, K.A. Shestibratov // Plant cell biology in vitro and biotechnology: Proc. Conf. - Kazan (October 14-18). - 2013. - 274 p.
- Способ микроклонального размножения карельской березы / Г.П. Бутова, Т.М. Табацкая, Л.Л. Скробо-ва. - А.с. SU 1597386 A1. - Опубл. 07.10.1990. - Бюл. № 37.
- Машкина, О.С. Микроклональное размножение хозяйственно ценных генотипов осины / О.С. Машкина, Ю.Н. Исаков // Сохранение, изучение и воспроизводство генетических ресурсов лесных древесных растений. -Bоронеж, 2007. - С. 47-58.
- Шабанова, Е.А. Клональное микроразмножение хозяйственно-ценных форм тополя / Е.А. Шабанова, О.С. Машкина // Лесохозяйственная информация. - 2015. - № 4. - С. 74-81.
- Метод клонального микроразмножения различных видов и гибридов ивы / О.С. Машкина, Т.М. Табацкая, А.И. Горобец [и др.] // Биотехнология. - 2010. - № 1. - С. 51-59.
- Машкина, О.С. Технология долгосрочного хранения в культуре in vitro ценных генотипов березы и выращивание на ее основе посадочного материала / О.С. Машкина, Т.М. Табацкая, Н.И. Внукова // Биотехнология. - 2019. - Т. 35. - № 3. - С. 57-67.
- Murashige, T. A revised medium for rapid growth and bio assays with Tobacco tissue cultures / T. Murashige, F. Skoog // Physiol Plantarum. - 1962. - Vol. 15. - № 13. - Р. 473-497.
- Lloyd, G. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia by use of shoot tip culture / G. Lloyd, B. McCown // Plant Propagators Soc. Comb. Proc. - 1980. - № 30. - P. 421-427.
- Assessment of genetic and epigenetic stability in long-term in vitro shoot culture of pea (Pisum sativum L.) / P. Smykal, L. Valledor, R. Rodriguez [et al.] // Plant Cell Reports. - 2007. - V. 26. - № 11. -Р. 1985-1998.
- Концевая, И.И. Длительное хранение микрорастений березы в культуре тканей / И.И. Концевая // Лесоведение. - 2009. - № 5. - С. 50-56.
- Егорова, Н.А. Влияние длительного субкультивирования на клональное микроразмножение Melissa officinalis L. и Origanum vulgare L. / Н.А. Егорова, О.В. Якимова // Вестник Томского государственного университета. Биология. - 2019. - № 47. - С. 22-39
- Хлесткина, Е.К. Молекулярные маркеры в генетических исследованиях и в селекции / Е.К. Хлесткина // Вавиловский журнал генетики и селекции. - 2013. - Т. 17. - № 4-2. - С. 1044-1054.
- Номенклатурные стандарты и генетические паспорта сортов картофеля, выведенные селекционерами Ленинградского НИИСХ «Белогорка» / Н.С. Клименко, Т.А. Гавриленко, И.Г. Чухина [и др.] // Биотехнология и селекция растений. - 2020. - Т. 3. - № 3. - Р. 18-54.
- Полевые испытания размноженных in vitro клонов осины (Populus tremula L.): рост, продуктивность, качество древесины, генетическая стабильность / О.С. Машкина, Е.А. Шабанова, И.Н. Вариводина [и др.] // Лесной журнал. - 2019. - № 6. - С. 25-38.
- Herrero, A. Effect of aging on mitochondrial and nuclear DNA oxidative damage in the heart and brain throughout the life-span of the rat / A. Herrero, G. Barja // Age. - 2001. - № 24. - Р. 45-50.
- Simplified qPCR method for detecting excessive mtDNA damage induced by exogenous factors / A.P. Gureev, E.A. Shaforostova, A.A. Starkov [et al.] // Toxicology. - 2017. - V. 382. - Р. 67-74.
- Study of the amount of oxidative damage to mitochondrial and chloroplast DNA in clones of white poplar (Populus alba L.) during long-term in vitro cultivation for 26 years / A.P. Gureev, O.S. Mashkina, E.A. Shabanova [et al.] // Plant Mol Biol. - 2021. - Vol. 106. - № 6. - P. 479-489.
- Результат экономических исследований по выращиванию посадочного материала древесных лиственных культур и созданию плантаций с использованием методов биотехнологии / Н.И. Животягина, О.С. Машкина, Т.М. Табацкая [и др.] // Актуальные проблемы гуманитарных и социально-экономических наук. - 2022. - № 4 (93). - С. 3-8.
- Developing stress tolerant plants through in vitro selection - An overview of the recent progress / M.K. Rai, R.K. Kalia, R. Singh [et al.] // Environmental and Experimental Botany. - 2011. - Vol. 71. - № 1. - Р. 89-98.
- Munns, R. Comparative physiology of salt and water stress / R. Munns // Plant, Sell and Environment. - 2002. - № 25. - P. 239-250.
- Ветчинникова, Л.В. Влияние кадмия на морфо- и органогенез березы in vitro / Л.В. Ветчинникова, Т.Ю. Кузнецова, А.Ф. Титов // Труды Карельского научного центра РАН. - 2014. - № 5. - С. 174-181.
- Сергеева, Л.Е. Клеточная селекция с ионами тяжелых металлов для отбора форм пшеницы и кукурузы, устойчивых к осмотическим стрессам / Л.Е. Сергеева, Л.И. Бронникова // Фактори експериментально! еволюцп органiзмiв. - 2018. - Т. 22. - С. 318-322.
- Машкина, О.С. Морфогенез рассеченного листа березы в культуре in vitro / О.С. Машкина, Т.М. Табацкая // Онтогенез. - 2020. - Т. 51.- № 6. - С. 460-472.


