Сократительная активность и энергетический метаболизм постинфарктного сердца на фоне диабетического поражения в эксперименте
Автор: Кондратьева Д.С., Афанасьев С.А., Егорова М.В., Реброва Т.Ю., Попов С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2-1 т.26, 2011 года.
Бесплатный доступ
Цель работы: исследовать сократительную активность и энергетический метаболизм постинфарктного миокарда крыс на фоне диабета. Сократительную активность оценивали по реакции папиллярных мышц на экстрасистолические воздействия. В группы сравнения включали интактных животных, животных с постинфарткным кардиосклерозом, крыс с сахарным диабетом (стрептозотоцин, 60 мг/кг), а также животных с постинфарктным кардиосклерозом на фоне сахарного диабета. Было обнаружено, что при постинфарктном кардиосклерозе и диабете в отдельности возбудимость миокарда крыс повышается, тогда как при сочетании этих патологий возбудимость остается в пределах контрольных значений. Постэкстрасистолическое сокращение миокарда крыс с постинфарктным кардиосклерозом и диабетом в отдельности угнеталось. При сочетанной патологии постэкстрасистолическая потенциации миокарда крыс сохранялась на уровне контрольных значений. Состояние процессов окислительного фосфорилирования кардиомиоцитов крыс наиболее близко к контрольным значениям в группе с сочетанной патологией. Авторы считают, что гипергликемия на стадии формирования постинфарктного ремоделирования повышает адаптивные возможности миокарда, что способствует сохранению ритмоинотропных реакций миокарда, а также способствует менее выраженному нарушению энергетического метаболизма.
Сократимость, постинфарктное и диабетическое ремоделирование миокард крысы, саркоплазматический ретикулум, экстрасистолические и постэкстрасистолические сокращения
Короткий адрес: https://sciup.org/14919438
IDR: 14919438 | УДК: 616.127-004
Текст научной статьи Сократительная активность и энергетический метаболизм постинфарктного сердца на фоне диабетического поражения в эксперименте
Как известно, сочетание ишемической болезни сердца и сахарного диабета повышает вероятность сосудистых катастроф. Развитие сократительных дисфункций при диабетическом поражении миокарда связано как с ремоделированием клеточных мембран кардиомиоцитов [1], так и с нарушением энергетического метаболизма. Снижение содержания и доступности АТФ для метаболических процессов служит дополнительным фактором дисбаланса гомеостаза Са2+ в кардиомиоцитах. Одной из ключевых энергозависимых структур кардиомиоцитов, отвечающих за внутриклеточный гомеостаз Са2+, и соответственно, за инотропный ответ клетки, является сар- коплазматический ретикулум (СР). Показано, что нарушение функций этой внутриклеточной структуры при сердечной недостаточности сопровождается инверсией ритмоинотропных реакций миокарда [2, 3]. Причиной этого является зависимость функционального состояния СР, в частности, активности его Са2+-транспортирующих систем от энергетической обеспеченности отдельных кардиомиоцитов [4]. Вместе с тем механизмы развития инотропных нарушений, связанных с ремоделированни-ем кальций-транспортируюших систем, а также состояние окислительного фосфорилирования кардиомиоцитов при сердечной недостаточности на фоне сахарного диабета недостаточно изучены.
Цель исследования: оценить сократительную активность и энергетический метаболизм постинфарктного сердца на фоне диабетического поражения.
Материал и методы
Работа выполнена на 45 половозрелых крысах-самцах линии Вистар. Животных разделили на 4 группы: I группу составили интактные животные (n=12), II группу – крысы с постинфарктным кардиосклерозом (ПИКС), (n=11), III группу – животные с индуцированным сахарным диабетом (n=8), и IV группу – крысы, которым через 2 недели после коронароокклюзии моделировали диабет (n=8). Инфаркт миокарда моделировали путем окклюзии левой нисходящей коронарной артерии [2]. Сахарный диабет моделировали однократным введением стрептозотоцина (Sigma, США) в дозе 60 мг/кг, внутрибрюшинно, разведенного в 0,01 моль/л цитратном буфере (рН 4,5) [5, 6]. Крыс IV группы брали в эксперимент через 4 недели после индукции диабета. Концентрацию глюкозы в сыворотке крови определяли ферментно-ко-лорометрическим тестом (Biocon Diagnostic, Германия). В сердцах крыс II и IV групп оценивали размер постинфарктных рубцов методом планиметрии [7].
В день эксперимента животных, находящихся под легким эфирным наркозом, обездвиживали смещением шейного отдела позвоночника. Извлекали сердце из грудной полости и промывали его в проточной камере через аорту раствором Кребса–Хензеляйта следующего состава (в мМ): NaCl – 120; KCl – 4,8; CaCl2 – 2,0; MgSO4 – 1,2; KH2PO4 – 1,2; NaHCO3 – 20,0; глюкоза – 10,0 (Sigma, США). Выделенные папиллярные мышцы помещали в термостабилизированную проточную камеру. Один конец мышцы фиксировали к стенке камеры, а второй – закрепляли на штоке изометрического датчика (6МХ1С). Перфузию мышц осуществляли при 36,5 °С оксигенированным (О2 – 95%, СО2– 5%) раствором Кребса–Хензеляйта. Стимуляцию мышц проводили электрическими импульсами прямоугольной формы длительностью 5 мс при частоте 0,5 Гц. Регистрировали кривые изометрического сокращения папиллярных мышц. Экстрасистолическое воздей- ствие оказывали при помощи однократного нанесения внеочередного электрического импульса через 0,2–1,5 с от начала регулярного цикла [2]. Измеряли амплитуду эк-страсистолического (ЭС) и постэкстрасистолического (ПЭС) сокращения и выражали ее в процентах к амплитуде регулярного цикла.
Митохондрии сердца получали методом дифференциального центрифугирования в стандартной сахарозной среде, содержащей (мМ) 300 сахарозу, 10 ЭДТА, 8 трис, рН 7.4. Митохондрии суспендировали в 250 мМ растворе сахарозы. Скорость поглощения кислорода митохондриями определяли полярографически с помощью электрода Кларка. Измерение проводили в среде, содержащей (мМ) 300 сахарозу, 10 КСl, 5 КН2РО4, 5 сукцинат (или 5 малат + 5 глутамат), 1 ЭДТА, 5 трис, рН 7.4. Измерения проводили в термостатируемой ячейке объемом 1 мл при температуре 27 °С и постоянном перемешивании при помощи магнитной мешалки. Регистрировали скорость поглощения кислорода без АДФ и в присутствии 100 мкМ АДФ. Ингибирование фосфолипазы А2 проводили при помощи бром-фенацилбромида Реакцию начинали добавлением суспензии митохондрий (2 мг белка). Концентрацию белка в пробе определяли методом Лоури. В работе использовали реактивы фирм Sigma и ICN. Скорость потребления кислорода приведена в нМ О2 в мин на 1 мг белка.
Полученные данные обработаны общепринятыми методами вариационной статистики, представлены как M± σ , статистическую значимость различий показателей оценивали с использованием t-критерия Стьюдента и U Манна–Уитни.
Результаты и обсуждение
Проведенные исследования показали, что ремоделирование миокарда после коронароокклюзии во II группе сопровождалось снижением массы тела на 18,8% и гипертрофией сердца на 90% по сравнению с I группой (табл. 1). Индукция диабета через 4 недели в III группе вызывала снижение массы тела на 56% (р<0,01), тогда как в IV группе отмечалось снижение массы тела только на 26%. Повышение концентрации глюкозы в крови наблюдалось в III и IV группах, что свидетельствует о развитии сахарного диабета в этих группах.
Исследование инотропной реакции на ЭС воздействия показало, что амплитуда ЭС сокращения миокарда животных II группы после ЭС интервала длительностью 0,25 с была выше на 8% (р<0,01) по сравнению с I группой, при этом с увеличением длительности ЭС интервала эта разница увеличивалась и достигала 16% (р<0,01), рисунок 1.
Повышение амплитуды ЭС сокращений во II группе свидетельствует об увеличении внутриклеточного содержания ионов кальция, участвующих в ЭС сокращении. Как известно, ишемическое поражение сердца характеризуется угнетением синтеза АТФ, что приводит к нарушению работы АТФ–зависимых ионных насосов и, соответственно, к повышению внутриклеточной концентрации Na+ и Са2+ [8]. Экстрасистола в III группе появлялось уже после нанесения электрического стимула через 0,225 с, тогда
Таблица 1
Изменение веса тела и сердца крыс
|
Группы |
n |
mТ, г |
Глюкоза, моль/л |
mС/mТ, мг/г |
mЛЖ/m C, мг/мг |
Площадь зоны рубца,% |
|
I |
12 |
298±23,7 |
6±0,37 |
3,29±0,21 |
0,645±0,013 |
- |
|
II |
11 |
242±11,17*# |
7±0,13# |
6,27±0,33*# |
0,687±0,016* |
51,3±8,9 |
|
III |
8 |
160±14,8* |
27±2,75* |
3,77±0,31 |
0,676±0,014 |
- |
|
IV |
8 |
221±4,51* |
18±1,79* |
3,37±0,11 |
0,673±0,019 |
46,1±2,7 |
Примечание: n – количество животных, mС – масса сердца, mТ – масса тела, mЛЖ – масса левого желудочка. * p<0,01 статистическая значимость различий по сравнению с I группой, # – р<0,01 статистическая значимость различий по сравнению с IV группой.
как ЭС сокращение миокарда животных в остальных группах возникало только при воздействии электрическим стимулом через 0,25 с. Как известно, экстрасистоличес-
кий стимул вызывает инотропный ответ только в случае, если воздействие попадает в фазу относительной реф-рактерности [9]. Из этого следует, что развитие диабета
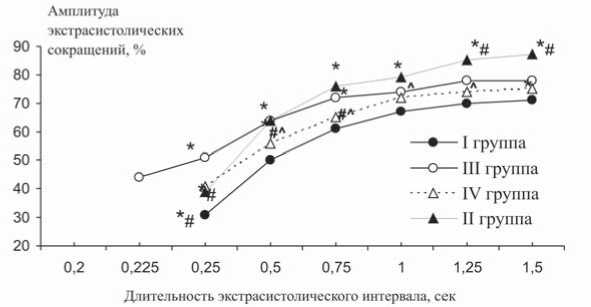
Рис. 1. Динамика экстрасистолических сокращений миокарда крыс с постинфарктным кардиосклерозом и диабетическим поражением.
Примечание: по оси ординат – амплитуда сокращений в процентах по отношению к регулярным сокращениям; по оси абсцисс – длительность ЭС интервала в секундах; * – p<0,001 в сравнении с I группой, # – p<0,01 в сравнении с III группой, h – p<0,01 в сравнении со II группой; здесь и далее.
приводит к укорочению фазы абсолютной рефрактерности и повышению возбудимости клеток сердца. Кроме того, амплитуда ЭС сокращений III группы после коротких ЭС интервалов была на 20% выше, чем в I группе (рис. 1). Динамика экстрасистолического сокращения миокарда животных IV группы была сходна с реакцией I группы (рис. 1). Как видно из полученных результатов, сочетание ишемического и диабетического поражения миокарда парадоксально способствует уменьшению выраженности изменений динамики ЭС сокращений, полученных на фоне ПИКС и диабета в отдельности.
Как известно, внеочередной электрический импульс инициирует дополнительное поступление внеклеточных ионов кальция в миоплазму кардиомиоцитов. Эти дополнительные Са2+ аккумулируются в СР и участвуют в первом ПЭС сокращении, амплитуда которой превышает значение регулярного цикла [9]. Как видно из рисунка 2, ПЭС потенциация во II группе практически не наблюдалась.
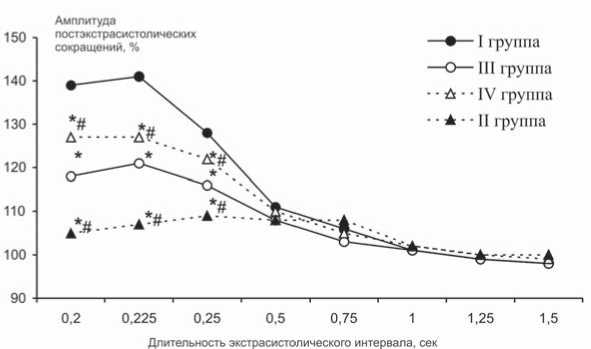
Рис. 2. Постэкстрасистолические сокращения миокарда крыс с постинфарктным кардиосклерозом и диабетическим поражением
Амплитуда ПЭС сокращений в таком миокарде была чуть больше исходных значений вне зависимости от длительности ЭС интервала. Этот факт свидетельствует о значительном снижении депонирующей функции СР. Скорее всего, это связано с тем, что в условиях постинфарктного ремоделирования миокарда крыс в кардиомиоцитах нарушается работа систем СР, ответственных за реализацию функций захвата и выброса ионов кальция [10]. В III группе ПЭС потенциация миокарда была достоверно меньше в сравнении с I группой (рис. 2). ЭС воздействие с короткими интервалами вызывало повышение ПЭС сокращения на 27–19% в IV группе (рис. 2), что свидетельствует о лучшем сохранении Са2+ – депонирующей способности СР.
Таблица 2
Скорость потребления кислорода и дыхательный контроль митохондрий сердца крыс в различных экспериментальных моделях
|
Группы |
Скорость потребления кислорода, нМО /мин на мг белка |
ДК |
|
|
Исходно |
На фоне бромфенацилбромида |
||
|
I |
10,5±1,8 |
10,6±1,4 |
3,4 |
|
II |
44,7±2,8* |
38,0±1,7*# |
2,0 |
|
III |
35,2±3,5* |
21,1±2,4*# |
1,9 |
|
IV |
20,9±1,5* |
11,6±1,5*# |
2,3 |
Примечание: в скобках указана степень снижения величины ДК по отношению к ДК интактных животных; * – р<0,01 различия по отношению к I группе; # – р<0,01 различия в каждой группе между исходным показателем и на фоне бромфенацил-бромида; ДК – дыхательный контроль.
Исследование скорости дыхания митохондрий кардиомиоцитов показало, что скорость исходного поглощения кислорода II, III и IV групп значительно превышала значения I группы (табл. 2). Наблюдаемое увеличение потребления кислорода может быть обусловлено протонофорным действием жирных кислот [11] и разобщением окисления и фосфорилирования в митохондриях. Действительно, при добавлении в среду измерения АДФ мы получили выраженное снижение величины дыхательного контроля II и III групп. Однако в IV группе при добавлении АДФ величина дыхательного контроля оказалась наиболее близкой к значениям I группы. Как известно, при сердечно-сосудистых патологиях отмечается повышение активности эндогенных фосфолипаз и, как следствие, накопление свободных жирных кислот [12], которое провоци- рует разобщение процессов окисления и фосфорилирования [11]. Ингибирование фосфолипазы А2 при помощи бромфенацилбромида не изменило скорость дыхания митохондрий в I группе, однако в остальных группах этот показатель достоверно снижался (табл. 2). Это подтверждает факт повышения активности фосфолипазы А2 при развитии патологических состояний. Полученные данные свидетельствуют о том, что нарушение процессов энергетического метаболизма кардиомиоцитов наименее выражено в группе животных с сочетанной патологией.
Результаты исследований позволяют говорить о том, что индукция диабета на фоне формирования постинфарктного ремоделирования сердца парадоксально способствует сохранению в кардиомиоцитах функциональной активности систем ионного транспорта, отвечающих, в частности, за работу СР как внутриклеточного депо Са2+, а также способствует лучшему сохранению энергетического метаболизма. Возможно, это связано с гликозилированием мембран кардиомиоцитов в условиях гипергликемии, что приводит к увеличению ригидности мембран и препятствует избыточному притоку Са2+ в миоплазму [13]. Другой фактор, обеспечивающий адаптивные реакции при сочетанном развитии постинфарктных и диабетических нарушений миокарда, может быть связан с особенностями внутриклеточного энергетического метаболизма. Видимо, повышение уровня глюкозы на начальных стадиях развития ПИКС стимулирует процессы гликолиза в кардиомиоцитах. Известно, что положительный эффект глюкозы на работу сердца при экспериментальной ишемии миокарда связан с повышением гликолитической продукции АТФ [14]. Вероятно, в результате сдвига энергетического метаболизма в сторону гликолитической продукции АТФ сохраняется функциональная активность Са2+-транспортирующих насосов СР, поскольку АТФ, образующаяся в процессе гликолиза, является незаменимым источником энергии для Са2+-АТФазы ионного насоса СР [14]. Вместе с тем установленные нами данные согласуются с результатами об ишемической резистентности миокарда животных с небольшим сроком стрептозотоцин-индуцированного диабета [6, 15].
Таким образом, в эксперименте индукция сахарного диабета на стадии формирования постинфарктного ремоделирования повышает адаптивные возможности миокарда, что способствует сохранению ритмоинотропных реакций миокарда, связанных с работой кальций-транс-портирующих систем СР, а также способствует менее выраженному нарушению энергетического метаболизма.
Работа подготовлена по материалам исследований, финансируемых Министерством образования и науки в рамках ФЦП “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2012 годы” (ГК № 02.527.11.0007) и гранта 7 Рамочной программы Рос-сия-ЕС (№ 241558).
Список литературы Сократительная активность и энергетический метаболизм постинфарктного сердца на фоне диабетического поражения в эксперименте
- Ziegelhoffer-Mihalovicova B., Waczulikova I., Sikurova L. et al. Remodelling of the sarcolemma in diabetic rat hearts: the role of membrane fluidity//Mol. Cell Biochem. -2003. -Vol. 249 (1-2). -P. 175-82.
- Кондратьева Д.С., Афанасьев С.А., Фалалеева Л.П. и др. Инотропная реакция миокарда крыс с постинфарктным кардиосклерозом на экстрасистолические воздействия//Бюл. экспер. биол. -2005. -Т. 130 (6). -C. 613-616.
- Кондратьева Д.С., Афанасьев С.А., Евтушенко А.В. и др. Сравнительная оценка инотропной реакции изолированного миокарда пациентов с ишемической и ревматической болезнью сердца после кратковременных периодов покоя на фоне амиодарона//Кардиология. -2008. -Т. 10. -С. 45-50.
- Marengo F.D., Marquez M.T., Bonazzola P. et al. The heart extrasystole: an energetic approach//Am. J. Physiol. -1999. -Vol. 276(1). -P. H309-H316.
- Дубилей Т.А., Бадова Т.А., Мигован С.А. и др. Влияние ишемии/реперфузии на функцию изолированного сердца у крыс разного возраста со стрептозотоциновым диабетом//Проблемы старения и долголетия. -2007. -Т. 16 (1). -С. 11-20.
- Satoh N., Sato T., Shimada M. at al. Lusitropic effect of MCC-135 is associated with improvement of sarcoplasmic reticulum function in ventricular muscles of rats with diabetic cardiomyopathy//J. Pharmacol. Exp. Ther. -2001. -Vol. 298 (3). -P. 1161-1166.
- Усачева М.А., Попкова Е.В., Смирнова Е.А. и др. Адаптация сердечно-сосудистой системы к постинфарктному кардиосклерозу у крыс с разной врожденной адренореактивностью миокарда//Бюл. экспер. биол. -2007. -Т. 144 (12). -С. 624-628.
- Sniecinski R., Liu H. Reduced efficacy of volatile anesthetic preconditioning with advanced age in isolated rat myocardium//Anesthesiology. -2004. -Vol. 100 (3). -P. 589-597.
- Vassallo D.V., Lima E.Q., Campagnaro P. et al. Mechanisms underlying the genesis of post-extrasystolic potentiation in rat cardiac muscle//Braz. J. Med. Biol. Res. -1995. -Vol. 28(3). -P. 377-383.
- Sen L., Cui G., Fonarow G.C., Laks H. Differences in mechanisms of SR dysfunction in ischemic vs. idiopathic dilated cardiomyopathy//Am. J. Physiol. Heart Circ. Physiol. -2000. -Vol. 279. -P. H709-H718.
- Мохова Е.Н., Хайлова Л.С. Участие анионных переносчиков внутренней мембраны митохондрий в разобщающем действии жирных кислот//Биохимия. -2005. -Т. 70, № 2. -С. 197-202.
- Молчанов С.Н., Люсов С.А., Говорин А.В. и др. Сывороточные липиды при различных стадиях и морфофункциональных типах сердечной недостаточности у больных, перенесших инфаркт миокарда//Рос. кардиол. журнал. -2005. -№ 2. -С. 10-17.
- Waczulikova I., Ziegelhoffer A., Orszaghova Z. et al. Fluidising effect of resorcylidene aminoguanidine on sarcolemmal membranes in streptozotocin_diabetic rats: blunted adaptation of diabetic myocardium to Ca2+ overload//J. Physiol. Pharmacol. -2002. -Vol. 53 (4). -P. 727-739.
- Vanoverschelde J.L., Janier M.F., Bakke J.E. et al. Rate of glycolysis during ischemia determines extent of ischemic injury and functional recovery after reperfusion//Am. J. Physiol. -1994. -Vol. 267(5 Pt 2). -P. H1785-H1794.
- Chen H., Shen W.L., Wang X.H. et al. Paradoxically enhanced heart tolerance to ischaemia in type 1 diabetes and role of increased osmolarity//Clin. Exp. Pharmacol. Physiol. -2006. -33 (10). -P. 910-916.


