Соленостная толерантность сообществ макрозообентоса малых рек бассейна Средней и Нижней Волги
Автор: Зинченко Татьяна Дмитриевна, Головатюк Лариса Владимировна, Шитиков Владимир Кириллович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-1 т.18, 2016 года.
Бесплатный доступ
Выполнен сравнительный анализ изменчивости видовой структуры сообществ макрозообентоса в водотоках бассейна Средней и Нижней Волги c разным уровнем минерализации. На основе ординационной модели распределения чувствительности видов по градиенту солености осуществлено выделение таксономических групп в условиях реализуемых состояний речных экосистем при колебаниях солености. Рассматривается возможность использования биотического индекса SPEARsalinity для оценки эффекта влияния минерализации на донные сообщества.
Малые реки, минерализация, макрозообентос, галотолерантность видов, структура донных сообществ
Короткий адрес: https://sciup.org/148204893
IDR: 148204893 | УДК: 574.587
Текст научной статьи Соленостная толерантность сообществ макрозообентоса малых рек бассейна Средней и Нижней Волги
Разные виды гидробионтов в силу своих определенных онтогенетических и экологических особенностей обладают различной степенью толерантности по отношению к факторам среды: одни и те же условия могут оказаться оптимальными для одной композиции таксонов и неоптимальными для другой. Поэтому основной задачей факториальной экологии является оценка толерантных интервалов, в пределах которых наблюдается устойчивое развитие каждой симпатрической совокупности видов. При этом выделяется зона оптимума, наиболее благоприятная для жизнедеятельности вида, и критические точки, определяющие границы адаптационных реакций организмов, за пределами которых угнетающее действие данного фактора становится ярко выраженным [1].
Изменение видовой структуры сообществ макрозообентоса речных беспозвоночных определяется как влиянием гидрохимических факторов, связанных с концентрацией в воде различных ингредиентов, так и геоморфологией рельефа, скоростью течения и глубиной реки, типом донных отложений, степенью зарастаемости участков макрофитами и другими биотопиче-скими особенностями. В настоящее время ис-
пользуются два основных подхода, позволяющие отделить эффекты химического воздействия от влияния естественных экологических факторов. Первый сводится к применению методик статистического анализа, которые оценивают доли вариации, объясняемые каждым из факторов, в основе которых положены различные многомерные алгоритмы ординации [2, 3]. Другой подход сводится к нахождению такого подмножества показателей, которые не зависят от естественных ландшафтно-экологических флуктуаций (например, устойчивость видовой структуры вдоль градиента речного континуума), но чувствительны к экстремальной изменчивости токсикантов техногенного происхождения. Важным инструментом для оценки экологического состояния пресноводных экосистем являются, например, различные биотические индексы, основанные на таксономических свойствах сообществ беспозвоночных: индекс р.Тренд (Trend Biotic Index), индекс EPT (доля групп Ephemeroptera, Plecoptera и Trichoptera, %), соотношение числа наблюдаемых и ожидаемых таксонов (O/E) и др. [4].
Содержание в воде минеральных веществ является важнейшим абиотическим фактором, оказывающим определяющее влияние на видовую структуру сообществ беспозвоночных. Объектом многочисленных исследований являются водные экосистемы с высоким естественным уровнем минерализации, которые географически широко распространены, особенно в аридных зонах мира [5, 6, 7, 8, 9, 10, 11]. Такие мезо- и гипергалинные речные системы представляют значительный интерес в плане развития в них галотолерантных и галофильных видов, часто редких, имеющих ограниченное распространение или относящихся к эндемичным формам [5, 12]. Можно привести пример обобщающего сравнительного анализ изменения видового состава гидробионтов в водотоках с различной степенью минерализации, выполненного для отдельных регионов Австралии [13]. На основе этих данных был разработан биотический индекс SPEARsalinity для оценки эффекта влияния минерализации на пресноводные сообщества, учитывающий различную физиологическую чувствительность организмов отдельных видов, а также особенности их размножения, питания и кислородного обмена [14].
В настоящей статье проводится обобщение многолетних данных гидробиологических исследований, проводимых на малых реках Среднего и Нижнего Поволжья, с целью сравнительного анализа изменчивости видовой структуры сообществ макрозообентоса в водотоках с различной минерализацитей вод. На основе построения статистической модели распределения чувствительности видов по градиенту минерализации осуществляется выделение таксономических групп с разной степенью галотолерантности.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Гидробиологическую съемку сообществ донных организмов проводили на 33 малых и средних реках Среднего и Нижнего Поволжья, в том числе, на 6 соленых реках в бассейне оз. Эльтон [15, 16]. Исследования выполняли в рамках гидробиологического мониторинга [17] в разные месяцы вегетационного периода 1990-2015 гг. с различной частотой отбора проб. Поскольку для статистического анализа необходимо условие однородности выборочного усилия при сопоставлении видового состава, то вся совокупность из 772 проб, взятых для расчетов, была разделена на 16 «кластеров», объединенных географической общностью и сходной морфологией рельефа. Подробные данные о составе кластеров, уровне минерализации вод, числе станций наблюдений и объеме гидробиологических исследований представлены в табл. 1.
Образцы макрозообентоса собирали в прибрежье и медиали рек дночерпателем Экмана-Берджи или гидробиологическим скребком. Фиксацию организмов и последующую камеральную обработку собранного материала проводили согласно общепринятым методикам [18, 19]. Всего было выявлено 666 видов и таксонов водных беспозвоночных (табл. 1).
Статистическая обработка проводилась с целью оценки градиента показателя, определяемого нами как «максимум соленостной толерантности (МСТ)». Ему соответствуют значения минерализации (мг/л), при которых в среднем предполагается наибольшее обилие (т.е. численность + встречаемость) каждого обнаруженного вида гидробионтов. Для расчета МСТ использовался один из методов ординации – неметрическое многомерное шкалирование (NMS, nonmetric multidimensional scaling [20]).
Различие видовой структуры бентосных сообществ для каждой пары i и j выделенных кластеров оценивались по формуле Брея-Кертиса, которая обеспечивала по сравнению с другими метриками дистанций (Жаккара, Кульчицкого, Евклида и др.) максимум коэффициента корреляции Спирмена (р = 0,68) между искомой орди-нацией и фактором минерализации: d j = 1 — 2] Т man[ a ik , a jk ] I ^ ( a ik + a jk ) ; ak=pklog(N k ), k = 1 k = 1
где pk – относительная частота встречаемости, Nk – средняя численность (экз/м2) k -го вида, k = 1, 2,…, s , s = 666 – число обнаруженных видов. С учетом всех комбинаций i и j формировалась матрица взаимных расстояний D размерностью 16×16.
Для получения NMS-ординации взаимные расстояния между точками отображаемых кластеров рек на плоскости с латентными осями S1 и S2 подбирались таким образом, чтобы внести минимальные искажения по сравнению с исходной конфигурацией объектов в многомерном пространстве видов. Одновременно оценивались средневзвешенные координаты отдельных видов донных организмов на NMS-проекции, устанавливающие их положение относительно выделенных местообитаний, в результате чего строилась совмещенная ординационная диаграмма (биплот – см. рис. 1).
Значения максимумов соленостной толерантности МСТ для каждого вида макрозообентоса рассчитывались следующим образом:
-
- по эмпирическим значениям минерализации вод каждого кластера рек подбиралась трехмерная обобщенная аддитивная модель GAM [21] от координат S1 и S2 с использованием многомерных сглаживающих сплайнов;
-
- по построенной модели находились прогнозируемые значения Y^ k , соответствующие координатам наиболее вероятного положения каждого k -го вида на NMS-проекции, k = 1, 2, …, s , а также предикторные ошибки регрессии.
Расчеты проводились с использованием статистической среды R v. 3.02 и ее пакетов vegan и mgcv.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ видового разнообразия донных сообществ малых рек на исследуемой территории показал четкую дифференциацию водотоков в зависимости от минерализации. Как свидетельствует ординационная диаграмма на рис. 1, гидробиологические пробы из слабо минерализованных рек (1-12) и из притоков оз. Эльтон (13-16) заняли крайние положения на главной
Таблица 1. Состав изученных рек, объем и результаты гидробиологических исследований
Вторая ось ординации S2 определяет изменчивость структуры донных сообществ, обуслов- ленную широтным градиентом и ландшафтногеографическими особенностями. В частности, наблюдается вертикальная упорядоченность кластеров от равнинных рек лесостепной зоны -рр. Байтуган (3) и Сок (1 в верхнем течении) до р. Б. Иргиз (11) и Еруслан (12), протекающих в более засушливых степных регионах.
С ординацией рек тесно связана ординация групп донных организмов (см. рис. 1), где местоположение каждого вида рассчитывалось как средневзвешенное от нескольких его возможных местообитаний. Еще раз обратим внимание на тот важный факт, что при расчете координат точек биплота ординационной диаграммы не учитывались факторы среды, а только взаимное различие-сходство видовой структуры сообществ бентоса для 16 групп водотоков. Однако, поскольку оказалась выявлена высокая статистическая связь между структурой сообществ и уровнем солености водотоков, можно построить трехмерную сглаживающую поверхность распределения логарифма минерализации по ординационной диаграмме и рассчитать для каждого вида значение толерантности МСТ, при котором появление вида наиболее вероятно. Построенная аддитивная модель в форме сглаживающего сплайна с 6 степенями свободы имела коэффициент детерминации R2 = 0.946 и предикторную ошибку не более 30 мг/л.
Вместе с тем, при интерпретации результатов нами допускается определенная условность, поскольку в составе исходных данных отсутствовали водотоки в промежуточном диапазоне солености М от 1200 до 10000 мг/л. Например, вид Ischnura elegans 4 раза встретился в реках Сок, Шлама и Съезжая (М = 450-550 мг/л) и 7 раз в высокоминерализованных притоках оз. Эльтон (М > 10000 мг/л), что привело к рассчитанному по модели средневзвешенному значению МСТ = 1805 мг/л. Поскольку реки с такой соленостью отсутствуют в исходной базе данных, эту величину нельзя обосновать эмпирическими параметрами. Поэтому показатель максимума соленостной толерантности использовался нами в основном для группировки: при МСТ до 1000 мг/л виды считались олигогалобными (пресноводными), при МСТ свыше 10000 мг/л – полигалобными (галофиль-ными), а имеющие промежуточные значения – мезогалобными эвригалинными видами.
Из данных табл. 1 нетрудно сделать вывод, что соленые реки существенно уступают слабо минерализованным по своему видовому богатству. Если ограничиться видами, встретившимися в пробах не менее 10 раз (или не менее 3 раз в соленых реках), то из 183 видов галофильными можно считать 27, а эвригалинными – 16 (см. списки в табл. 2).
Дополнительными показателями группировки является соотношение абсолютных или относительных частот встречаемости вида в соленых и слабоминерализованных водотоках. Например, для Nais elinguis соотношение возможности обнаружения составляет φ = (22/250) /
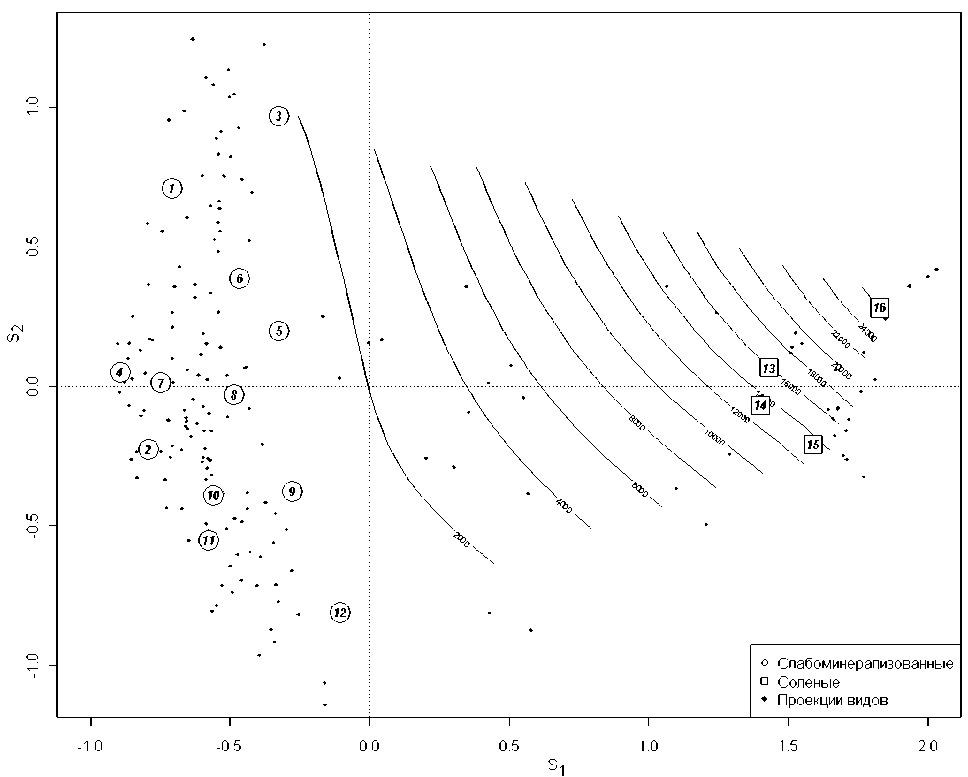
Рис. 1. Ординация сообществ макрозообентоса методом многомерного неметрического шкалирования.
Обозначения номеров кластеров рек – в табл. 1. Серым цветом показаны изолинии минерализации воды (мг/л), рассчитанные по аддитивной модели
Таблица 2. Таксономический состав галофильных и эвригалинных групп мекрозообентоса (М – минерализация, МСТ = максимум соленостной толерантности, г/л)
|
Таксон высшего уровня |
Наименование вида |
Встречаемость |
МСТ |
||
|
Все-го |
М <1200 |
M > 10000 |
|||
|
Галофильные виды |
|||||
|
Chironomidae |
Cricotopus salinophilus |
149 |
149 |
30497 |
|
|
Coleoptera |
Berosus bispina |
10 |
10 |
29793 |
|
|
Chironomidae |
Chironomus salinarius |
110 |
110 |
29175 |
|
|
Oligochaeta |
Enchytraeus issykkulensis |
5 |
5 |
28566 |
|
|
Stratiomyidae |
Stratiomys sp. |
3 |
3 |
25737 |
|
|
Ceratopogonidae |
Palpomyia sp. |
70 |
3 |
67 |
25691 |
|
Coleoptera |
Hygrotus enneagrammus |
25 |
25 |
23951 |
|
|
Coleoptera |
Berosus fulvus |
16 |
16 |
22402 |
|
|
Culicidae |
Culex sp. |
8 |
8 |
19682 |
|
|
Coleoptera |
Enochrus quadripunctatus |
8 |
1 |
7 |
17559 |
|
Ephydridae |
Ephydra sp. |
71 |
11 |
60 |
17172 |
|
Chironomidae |
Tanytarsus kharaensis |
55 |
55 |
16917 |
|
|
Ceratopogonidae |
Dasyhelea sp. |
4 |
4 |
16876 |
|
|
Heteroptera |
Sigara lateralis |
14 |
14 |
16834 |
|
|
Oligochaeta |
Paranais simplex |
39 |
39 |
16776 |
|
|
Chironomidae |
Cricotopus (Isocladius) ornatus |
13 |
13 |
16770 |
|
|
Heteroptera |
Paracorixa concinna |
10 |
10 |
16770 |
|
|
Chironomidae |
Chironomus aprilinus |
54 |
54 |
16748 |
|
|
Amphipoda |
Gammarus lacustris |
41 |
41 |
16564 |
|
|
Chironomidae |
Glyptotendipes salinus |
60 |
60 |
16408 |
|
|
Coleoptera |
Berosus sp. |
23 |
3 |
20 |
16378 |
|
Ceratopogonidae |
Mallochohelea sp. |
4 |
4 |
16054 |
|
|
Chironomidae |
Microchironomus deribae |
55 |
55 |
16043 |
|
|
Oligochaeta |
Nais elinguis |
27 |
5 |
22 |
13982 |
|
Heteroptera |
Sigara sp. |
35 |
35 |
13444 |
|
|
Muscidae |
Lispe sp. |
4 |
1 |
3 |
12943 |
|
Stratiomyidae |
Nemotelus sp. |
12 |
4 |
8 |
10919 |
|
Эвригалинные виды |
|||||
|
Stratiomyidae |
Odontomyia sp. |
14 |
5 |
9 |
7519 |
|
Coleoptera |
Paracymus aeneus |
9 |
1 |
8 |
7350 |
|
Coleoptera |
Enochrus sp. |
6 |
1 |
5 |
6258 |
|
Chironomidae |
Cricotopus caducus |
4 |
1 |
3 |
4303 |
|
Oligochaeta |
Limnodrilus profundicola |
34 |
14 |
20 |
2057 |
|
Odonata |
Ischnura elegans |
11 |
4 |
7 |
1805 |
|
Chironomidae |
Paratanytarsus inopertus |
5 |
1 |
4 |
1694 |
|
Heteroptera |
Sigara assimilis |
9 |
5 |
4 |
1690 |
|
Ceratopogonidae |
Sphaeromias pictus (miricornis) |
32 |
11 |
21 |
1529 |
|
Chironomidae |
Cricotopus sp. |
34 |
15 |
19 |
1527 |
|
Psychodidae |
Psychoda sp. |
13 |
7 |
6 |
1493 |
|
Ceratopogonidae |
Culicoides sp. |
209 |
133 |
76 |
1323 |
|
Chironomidae |
Glyptotendipes paripes |
9 |
3 |
6 |
1213 |
|
Chironomidae |
Cricotopus gr.sylvestris |
146 |
84 |
62 |
1170 |
|
Oligochaeta |
Nais pseudoobtusa |
9 |
6 |
3 |
1050 |
|
Oligochaeta |
Nais communis |
25 |
15 |
10 |
1002 |
(5/522) = 9.2, т.е. вероятность встретить этот вид Данные о галотолерантности видов в донных в соленых водотоках почти в 10 раз выше, чем в сообществах могут быть использованы для ана-слабоминерализованных. лиза речных экосистем в условиях происходящих
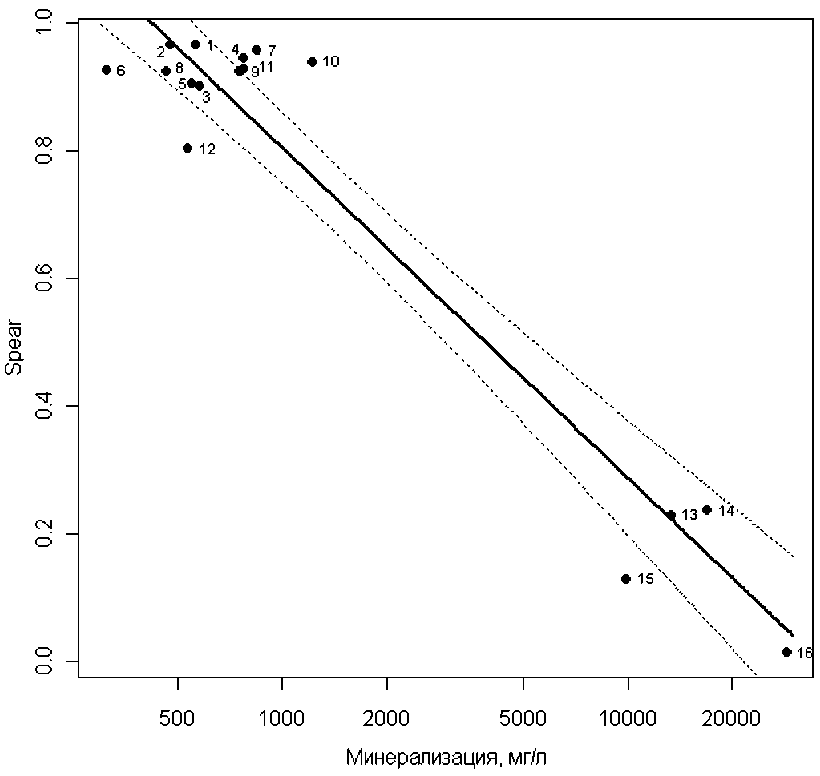
Рис. 2. Зависимость между структурой сообществ макрозообентоса, выраженной индексом SPEARsalinity, и минерализацией в логарифмической шкале для водотоков Среднего и Нижнего Поволжья. Обозначения номеров кластеров рек – в табл. 1
климатических изменениях. Например, для оценки эффекта влияния засоления на пресноводные сообщества рек Южной Австралии [14] был предложен биотический индекс, который вычисляется как относительное обилие видов, чувствительных к воздействию минерализации, к общей числен- ности организмов:
SPEAR salinity
2 ' = 1log( ^ + 1 + 1) y.
2/=1log(-v-i+ 1) , где xi – обилие (численность) вида i, yi = 1, если вид i классифицирован как «вид, чувствительный к воздействию фактора», и yi = 0 в противном случае, s – общее число анализируемых таксонов.
Нами были выполнены расчеты этого индекса применительно к рекам Среднего и Нижнего Поволжья. В качестве «чувствительных видов» yi = 1 принимались все обнаруженные таксоны, за исключением перечисленных в табл. 2, которым было присвоено значение yi = 0. На рис. 2 представлена модель регрессии, построенная по данным табл. 1:
SPEARsalinity = 2.36 -0.225 ln(M), (R2 = 0.925, p = 0), которая может служить для градуировки искомой зависимости и использоваться для прогноза уровня солености тестируемого водотока по рассчитанной величине SPEAR.
Список литературы Соленостная толерантность сообществ макрозообентоса малых рек бассейна Средней и Нижней Волги
- Gauch H.G., Whittaker R.H. Coenocline simulation.//Ecology. 1972. Vol. 53. P. 446-451.
- Legendre P., Legendre L. Numerical Ecology. 3rd ed. Amsterdam: Elsevier Sci. BV, 2012. 990 p.
- Шитиков В.К., Зинченко Т.Д., Розенберг Г.С. Макроэкология речных сообществ: концепции, методы, модели. Тольятти: Кассандра, 2012. 257 с.
- Семенченко В.П. Принципы и системы биоиндикации текучих вод. Минск: Орех, 2004. 125 с.
- Williams W.D. Salinization of rivers and streams: an important environment hazard//Ambio. 1987, Vol. 16. P. 180-185.
- Williams W.D. Salinity as a determinant of the structure of biological communities in salt lakes//Hydrobiologia. 1988, Vol. 381, P. 191-201.
- Williams W.D. Anthropogenic salinisation of inland waters//Hydrobiologia. 2001, Vol. 466. P. 329-337.
- Laprise R., Dodson J.J. Nature of environmental variability experienced by benthic and pelagic animals in the St. Lawrence Estuary, Canada//Mar. Ecol. Prog. Ser. Vol. 94. 1993. P. 129-139.
- Aquatic Coleoptera and Heteroptera assemblages in water bodiies from ephemeral coastal streams ("ramblas") of south-eastern Spain/Moreno J.L., Millán A., Suarez M.L.,Vidal-Abarca M.R., Velasco J.//Archiv hydrobiol. 1997, Vol. 141, P. 93-107.
- Williams D.D., Williams N.E. Aguatic insects in an estuarine environment: densities,distribution and salinity tolerance//Freshw. Biol. 1998. Vol. 39. P. 411-421.
- Структурно-функциональные характеристики экосистем малых соленых озер Крыма/Е.В. Балушкина, С.М. Голубков, М.С. Голубков, Л.Ф. Литвинчук//Биология внутр. вод. 2007. №2. С. 11-19.
- Зинченко Т.Д., Головатюк Л.В. Соленостная толерантность донных организмов речных вод (обзор)//Аридные экосистемы. 2013. Т. 19. № 3(56). С. 5-11.
- The definition of species richness used by species sensitivity distributions approximates observed effects of salinity on stream macroinvertebrates/Kefford B.J., Marchant R., Schäfer R.B., Metzeling L., Dunlop J.E., Choy S.C., Goonan P.//Environ Pollut. 2011. Vol. 59. P. 302-310.
- A similarity-index based method to estimate chemical concentration limits protective for ecological communities/Kefford B.J., Schäfer R.B., Liess M., Goonan P., Metzeling L., Nugegoda D.//Environmental Toxicology and Chemistry. 2010. Vol. 29, P. 2123-2131.
- Зинченко Т.Д. Эколого-фаунистическая характеристика хирономид (Diptera, Chironomidae) малых рек бассейна Средней и Нижней Волги (Атлас). Тольятти: Кассандра, 2011. 258 с.
- Зинченко Т.Д., Головатюк Л.В. Биоразнообразие и структура сообществ макрозообентоса соленых рек аридной зоны юга России (Приэльтонье)//Аридные экосистемы. 2010. Т. 16. № 3 (43). С. 25-33.
- Зинченко Т.Д. Методологический подход к проведению мониторинговых исследований природных гидросистем (на примере Волжского бассейна)//Чтения памяти В.Я. Леванидова, вып. 4. 2008. Владивосток. С. 25-30.
- Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоемах. Зообентос и его продукция. Л. 1983. 59 с.
- Особенности пресноводных экосистем малых рек Волжского бассейна/под ред. Г.С. Розенберга, Т.Д. Зинченко. Тольятти: Кассандра, 2011. 322 с.
- McCune B., Grace J.B., Urban D.L. Analysis of Ecological Communities. Gleneden Beach (Oregon): MjM Software, 2002. 285 p.
- Wood S.N. Generalized Additive Models: An Introduction with R. Chapman, Hall/CRC, 2006. 410 p.


