Сопряженность уровня гликемии и функциональных показателей миокарда у больных ишемической болезнью сердца на фоне сахарного диабета 2-го типа
Автор: Кондратьева Д. С., Афанасьев С. А., Будникова О. В., Ворожцова И. Н., Ахмедов Ш. Д., Шипулин В. М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Введение. Строгий контроль уровня гликемии не всегда приводит к положительным эффектам, связанным со снижением сердечно-сосудистых осложнений. При этом сочетанное развитие сахарного диабета 2-го типа (СД2) и ишемической болезни сердца (ИБС) существенно затрудняет адекватный контроль гликемического статуса.Цель исследования: изучение сопряженности уровня гликемии и функциональных показателей миокарда у больных ИБС, ассоциированной с СД2.Материал и методы. В исследование включены пациенты с диагнозом «хроническая ИБС, ассоциированная с СД2». По данным эхокардиографического исследования (ЭхоКГ) изучали структурно-функциональные показатели сердца и сократительные свойства миокарда ex vivo пациентов в зависимости от уровня гликированного гемоглобина (НbА1с). Исследования ex vivo проводили на изолированных трабекулах, выделенных из фрагмента ушка правого предсердия, полученного во время операции коронарного шунтирования. Для оценки сократительной функции трабекул использовали экстрасистолическое (ЭС) воздействие и эффект покоя (post-rest реакция).Результаты. Пациентов распределили в две группы по уровню НbА1с: менее 8% - 1-я группа, более 8% -- 2-я группа. По основным клиническим исходным показателям группы были сходны. Фракция выброса (ФВ) была выше у пациентов 1-й группы, толщина задней стенки левого желудочка (ЗСЛЖ) у пациентов 1-й группы была меньше по сравнению с аналогичными показателями 2-й группы. При исследовании сократительной активности миокарда ex vivo было установлено, что ЭС сокращение миокарда пациентов 2-й группы возникало на более ранних экстрасистолических интервалах (ЭИ), что свидетельствует о более высокой возбудимости мембран кардиомиоцитов. При этом постэкстрасистолические (ПЭС) сокращения трабекул пациентов 2-й группы имели значимую потенциацию. Амплитуда post-rest (PR) сокращений трабекул пациентов обеих групп была потенцированной на коротких периодах покоя, однако с увеличением длительности периодов покоя значительно нарастала только во 2-й группе. После длинных периодов покоя PR реакция миокарда пациентов 1-й группы не имела потенциации.Заключение. Результаты выполненной работы показали, что в популяции пациентов с ИБС и СД2 повышенный уровень HbA1c соответствует лучшим показателям функционального состояния миокарда по данным исследований сократительной активности изолированных трабекул.
Сахарный диабет, ишемическая болезнь сердца, уровень гликемии, гликированный гемоглобин, структурно-функциональные показатели сердца, сократительная активность миокарда, экстрасистолические и постэкстрасистолические сокращения, post-rest инотропная реакция
Короткий адрес: https://sciup.org/149126161
IDR: 149126161 | УДК: 616.12-005.4:616.379-008.64]:616.127:616.153.45 | DOI: 10.29001/2073-8552-2020-35-1-133-141
Текст научной статьи Сопряженность уровня гликемии и функциональных показателей миокарда у больных ишемической болезнью сердца на фоне сахарного диабета 2-го типа
–141
Высокая распространенность больных сахарным диабетом 2-го типа (СД2) наблюдается не только в общей популяции населения развитых стран мира, но также и в структуре коморбидных заболеваний. Так, почти у 50% больных с диагнозом «ишемическая болезнь сердца» (ИБС) выявляется СД2, нарушенная толерантность к глюкозе или гипергликемия натощак [1]. При этом гипергликемическое состояние у этих пациентов становится одним из основных повреждающих факторов, ухудшающих прогноз и течение основного заболевания [2]. Клинические исследования показали, что адекватное управление гликемией существенно снижает риск осложнений течения ИБС, в том числе и риск развития сердечно-сосудистых катастроф [3, 4]. Такая ситуация во многом действительна для пациентов молодого и среднего возраста с небольшой длительностью СД2 с относительно низким уровнем HbA1c, у которых был получен значительный положительный эффект от строгого гликемического контроля [5]. Вместе с тем не всегда строгий контроль уровня гликемии у пациентов с СД2 приводит к однозначным положительным результатам. Так, у больных пожилого возраста, имеющих длительную историю СД2 с исходно высоким базовым уровнем HbA1c, гликемический контроль не является столь значимым [6–8]. Кроме того, метаанализ, проведенный в 2015 г., не подтвердил связь между снижением HbA1c у больных СД2 и уменьшением сердечно-сосудистой смертности, инфарктом миокарда или инсультом [9]. По результатам другого метаанализа, интенсивный контроль HbA1c ниже 7% у больных СД2 также не выявил существенных положительных эффектов, связанных со снижением смертности, или осложнений сердечно-сосудистых заболеваний (ССЗ) [10]. В этом отношении еще большую проблему представляет коморбидное состояние, поскольку сочетанное развитие СД2 с ИБС не только увеличивает риск возможных сердечно-сосудистых осложнений, но и существенно затрудняет адекватный контроль гликемического статуса [11]. Контроль гликемии при ко-морбидном заболевании может способствовать предупреждению субклинических и клинических повреждений органов-мишеней, улучшению качества жизни, уменьшению показателей смертности и инвалидности. Учитывая неоднозначность влияния гликемии на функциональное состояние органов-мишеней, в том числе сердца, целью нашего исследования стало изучение сопряженности уровня гликемии и функциональных показателей миокарда у больных ИБС, ассоциированной с СД2.
Материал и методы
В исследование были включены 40 пациентов (14 женщин и 26 мужчин) в возрасте 61,6 [56; 68] лет с диагнозом «хроническая ИБС (стенокардия напряжения II–III функционального класса по NYHA), ассоциированная с СД2». Работа была одобрена комитетом по биомедицинской этике НИИ кардиологии (Томск) и выполнена согласно требованиям Хельсинкской декларации по лечению и обследованию людей. Все пациенты дали ин- формированное согласие на проведение исследования. Пациентам проводилось физикальное обследование для определения соответствия критериям включения. При этом наличие у больных острой формы ИБС, кето-ацидотического состояния или иной клинически значимой сопутствующей патологии (гепатитов и онкопатологии) служило основанием для невключения больных в исследование.
Эхокардиографическое исследование (ЭхоКГ) выполнялось на ультразвуковой системе Vivid E9 (GE Healthcare) из стандартных позиций с измерением показателей внутрисердечной гемодинамики, определением размеров отделов сердца и фракции выброса (ФВ) левого желудочка (ЛЖ) по методу Симпсона (рекомендации по хронической сердечной недостаточности – ХСН, 2018) [12]. Всем пациентам проводили хирургическое лечение – коронарное шунтирование, они получали стандартную лекарственную терапию согласно рекомендациями по лечению основных и сопутствующих заболеваний.
Гликированный гемоглобин (НbА1с) определяли в крови включенных в исследование пациентов турбидиметрическим методом на анализаторе Konelab (Финляндия) с использованием коммерческих наборов компании Thermo Fisher Scientific (Финляндия).
Сократительную функцию миокарда больных изучали ex vivo на изолированных трабекулах, выделенных из фрагмента ушка правого предсердия. Фрагмент ушка правого предсердия иссекали на стадии подключения аппарата искусственного кровообращения во время операции коронарного шунтирования. Трабекулы, отпрепарированные (с поперечным сечением 0,5–0,7 мм и длиной 5 мм) с помощью объект-микрометра, помещали в термостабилизированную (36 оС) проточную камеру установки для изучения сократительной активности мышечных препаратов (Standard Muscle Research System, Scientific Instruments GmbH, Германия) объемом 1 мл. Суперфузию мышц осуществляли раствором Кребса – Хензеляйта, для оксигенации которого использовали карбоген (О2– 95%, СО2 – 5%) [13].
Стимуляцию мышц проводили электрическими импульсами прямоугольной формы длительностью 5 мс, подаваемыми с частотой 0,5 Гц. Сократительную активность мышц регистрировали в изометрическом режиме, используя датчик Force transducer KG4 (Scientific Instruments GmbH, Германия). Оценивали развиваемое мышцей напряжение в пересчете на площадь ее сечения (мН/мм2). Перед началом проведения тестирующих воздействий мышцы адаптировали в течение 60 мин к условиям суперфузии и электрической стимуляции. Кривые одиночного цикла «сокращение – расслабление» мышц регистрировали и обрабатывали при помощи программы MUSCLEDATA (Scientific Instruments GmbH, Германия).
Для оценки сократительной способности кардиомиоцитов использовали нагрузочные тесты, основанные на изменении режима электрической стимуляции изолированных мышц. С этой целью проводили экстрасисто-лический тест, для чего на фоне базовой стимуляции наносили однократно внеочередной электрический импульс через 0,2–1,5 с (экстрасистолический интервал – ЭИ) от начала регулярного цикла «сокращение – расслабление» мышц. Оценивали величину экстра-систолического (ЭС) и постэкстрасистолического (ПЭС) инотропного ответа мышц, которую выражали в процентах к амплитуде регулярного цикла [14]. Нагрузочный post-rest (PR) тест осуществляли следующим образом: на фоне регулярных сокращений прекращали электрическую стимуляцию мышечных полосок однократно на периоды от 4 до 60 с (периоды покоя) с последующим возобновлением регулярных стимулирующих импульсов [13].
Статистический анализ проводили с помощью лицензионного пакета программ STATISTICA 12.0 (Statsoft Inc, США). Нормальность закона распределения количественных показателей оценивали с помощью критерия Шапиро – Уилка (Shapiro – Wilk). Параметры, подчиняющиеся нормальному закону распределения, представлены как среднее значение и стандартное отклонение ( M ± SEM ); не подчиняющиеся нормальному закону распределения – как медиана и интерквантильные интервалы Me [ Q 25; Q 75]. Качественные данные представлены частотой встречаемости и ее процентом. Статистическую значимость различий качественных данных оценивали с помощью χ2 Пирсона или точного теста Фишера. Оценку статистически значимых различий результатов исследования проводили с использованием непараметрического метода ( U -критерий Манна – Уитни). Различия между группами считали статистически значимыми при уровне значимости р < 0,05.
Результаты
Согласно современным рекомендациям, целевые уровни гликемии для пожилых людей соответствуют HbA1c < 7,5–8,0% [14]. На этом основании выборка пациентов была разделена на 2 группы. В 1-ю группу включили 22 пациента с уровнем HbA1с менее 8,0%, при этом медиана выборки составила 6,8% [5,5; 7,9%], во 2-ю группу – 18 пациентов с уровнем HbA1с более 8,0%, медиана выборки этой группы была 9,16% [8,0; 10,3%].
Сравнительный анализ сформированных групп показал, что по основным исходным показателям они были сопоставимы ( р > 0,05), в том числе по возрасту и длительности заболевания СД2 (табл. 1).
Таблица 1. Клинико-анамнестическая характеристика исследуемых пациентов
Table 1. Clinical and anamnestic characteristics of patients
|
Показатели Parameters |
1-я группа Group 1 |
2-я группа Group 2 |
р |
|
Возраст, лет Age, years |
62,29 [56; 68] |
60,83 [58; 64] |
0,553 |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
30,07 [26,95; 34] |
33,02 [29,36; 34,22] |
0,169 |
|
Длительность СД2, лет T2DM duration, years |
5 [2; 6,5] |
6,86 [2,5; 11] |
0,298 |
Окончание табл. 1
End of table 1
|
Показатели Parameters |
1-я группа Group 1 |
2-я группа Group 2 |
р |
|
Функциональный класс стенокардии напряжения, n (%): Functional class of angina pectoris, n (%): |
|||
|
– 1 |
1 (4) |
2 (11) |
0,104 |
|
– 2 |
5 (23) |
6 (33) |
0,099 |
|
– 3 |
16 (73) |
10 (56) |
0,083 |
|
Функциональный класс хронической сердечной недостаточности по NYHA, n (%): Functional class of CHF by NYHA, n (%): |
|||
|
– I |
4 (18) |
4 (22) |
0,875 |
|
– II |
13 (59) |
8 (40) |
0,954 |
|
– III |
5 (23) |
69 (33) |
0,931 |
|
Инфаркт миокарда, n (%): Myocardial infarction, n (%): |
|||
|
– 1 эпизод – 1 episode |
13 (59) |
10 (56) |
0,935 |
|
– 2 эпизода – 2 episodes |
1 (4) |
2 (11) |
0,885 |
|
Уровень холестерина, |
4,45 |
4,53 |
|
|
мМ/л Cholesterol, mM/L |
[3,6; 5,1] |
[3,3; 5,58] |
0,903 |
|
Уровень триглицеридов, |
2,03 |
2,01 |
|
|
мМ/л Triglycerides, mmol/L |
[1,36; 1,99] |
[1,4; 2,55] |
0,817 |
|
Уровень глюкозы |
6,93 |
7,99 |
0,044 |
|
натощак, мМ/л Fasting glucose, mmol/L |
[6,2; 7,4] |
[6,6; 9,2] |
|
|
Постпрандиальный уро- |
8,13 |
9,02 |
0,297 |
|
вень глюкозы, мМ/л Postprandial glucose, mmol/L |
[6,2; 9,5] |
[7,7; 9,5] |
Примечание: NYHA – Нью-Йоркская кардиологическая ассоциация.
Note: NYHA – New York Heart Association.
Анализ результатов ЭхоКГ пациентов обеих групп выявил, что основные структурно-функциональные показатели сердца были сопоставимы между собой, кроме ФВ и толщины задней стенки левого желудочка (ЗСЛЖ), таблица 2.
При исследовании сократительной активности миокарда ex vivo было установлено, что для мышечных трабекул миокарда пациентов 1-й группы, ЭС ответ был получен только в том случае, если внеочередной стимулирующий импульс подавали через 0,25 с от начала базового цикла (рис. 1). Для мышечных трабекул миокарда пациентов 2-й группы первый ЭС ответ был зафиксирован уже при ЭИ 0,225 с.
С увеличением длительности ЭИ во всех группах было отмечено повышение амплитуды ЭС сокращения. Однако статистически значимой разницы в амплитуде ЭС сокращений между группами обнаружить не удалось.
Таблица 2. Структурно-функциональные показатели сердца пациентов по результатам эхокардиографического исследования
Table 2. Echocardiography-based structural and functional indicators of the heart
|
Показатели Parameters |
1-я группа Group 1 |
2-я группа Group 2 |
р |
|
ФВ, % EF, % |
63 [43; 74] |
57 [44; 68] |
0,025 |
|
ЛП, мм LA, mm |
41 [38; 44] |
40 [33; 58] |
0,250 |
|
ПЖ, мм RA, mm |
23 [21; 25] |
25 [18; 29] |
0,052 |
|
КДР ЛЖ, мм LVIDd, mm |
50 [48; 53] |
50 [45; 60] |
0,926 |
|
КСР ЛЖ, мм LVIDs, mm |
33 [30; 39] |
33 [29; 49] |
0,576 |
|
КДО ЛЖ, мл LV EDV, ml |
117 [87; 125] |
119 [85; 157] |
0,573 |
|
КСО ЛЖ, мл LV ESV, ml |
37 [32; 55] |
44 [27; 83] |
0,075 |
|
МЖП, мм IVS, mm |
11 [10,3; 12,5] |
12 [8; 15] |
0,221 |
|
ЗСЛЖ, мм LV PW, mm |
10,5 [10; 10,6] |
10,85 [9; 12,5] |
0,038 |
|
ММ, г MM, g |
200 [163; 211] |
202 [142; 268] |
0,276 |
|
СДПЖ, мм рт. ст. RV-systolic pressure, mmHg |
30 [24; 30] |
27 [23; 37] |
0,717 |
|
УО, мл SV, mL |
70 [57; 82] |
58,5 [43; 91] |
0,365 |
|
ЧСС, уд./мин HR, bpm |
65 [57; 70] |
71 [60; 93] |
0,009 |
|
Е, см/с E, sm/s |
64 [52; 85] |
65,5 [38; 128] |
0,277 |
|
А, см/с A, cm/s |
88 [64; 94] |
89 [58; 120] |
0,555 |
Примечание: ФВ – фракция выброса, ЛП – левое предсердие, ПЖ – правый желудочек, КДР – конечный диастолический размер, КСР – конечный систолический размер, КДО – конечный диастолический объем, КСО – конечный систолический объем, МЖП – межжелудочковая перегородка, ЗСЛЖ – задняя стенка левого желудочка, ММ – масса миокарда, СДПЖ – систолическое давление в правом желудочке, УО – ударный объем, ЧСС – частота сердечных сокращений.
Note: EF – ejection fraction, LA – left atrium, RV – right ventricle, LVIDd – left ventricular internal diameter in diastole, LVIDs – left ventricular internal diameter in systole, LV EDV – left ventricular end-diastolic volume, LV ESV – left ventricular end-systolic volume, IVS – interventricular septum, LV PW – left ventricular posterior wall, LV MM – left ventricular myocardial mass, RV – right ventricular systolic pressure, SV – stroke volume. HR – heart rate.
На рисунке 2 отражена динамика ПЭС сокращений после воздействия внеочередного электрического импульса. Амплитуда ПЭС сокращений трабекул пациентов 1-й группы статистически значимо не отличалась от базовых сокращений на всех ЭС интервалах. Нанесение внеочередного импульса через 0,225, 0,25 и 0,5 с вызывало значимую потенциацию сокращений полосок миокарда пациентов 2-й группы относительно базовых значений и аналогичных сокращений миокарда пациентов 1-й группы.
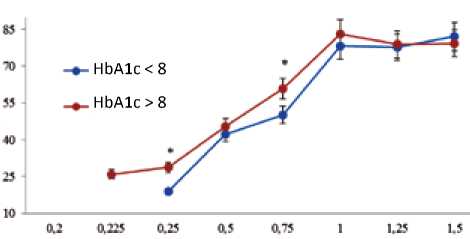
Рис. 1. Динамика экстрасистолических сокращений миокарда пациентов
Примечание: по оси ординат – амплитуда экстрасистоличе-ского сокращения в процентах по отношению к регулярному сокращению; по оси абсцисс – длительность экстрасистоли-ческого интервала в секундах, * – статистически значимое различие между группами ( р < 0,05).
Fig. 1. Dynamics of extrasystolic contractions of the patient myocardium
Note: the amplitude of the extrasystolic contraction is indicated on the ordinate axis as a percentage of the regular contraction; the duration of ES interval in seconds is indicated on the abscissa axis; * – statistically significant differences between the groups ( p < 0.05).
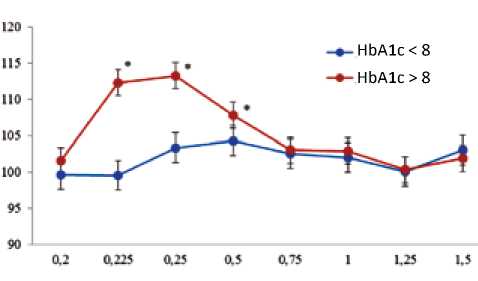
Рис. 2. Динамика постэкстрасистолических сокращений миокарда пациентов
Примечание: по оси ординат – амплитуда постэкстрасистоли-ческого сокращения в процентах по отношению к регулярному сокращению; по оси абсцисс – длительность интервала в секундах,* – статистически значимое различие между группами ( р < 0,05).
Fig. 2. Dynamics of post-extrasystolic contractions of patient myocardium
Note: the amplitude of the post-extrasystolic contraction is indicated on the ordinate axis as percentage of regular contraction; the interval in seconds is indicated on the abscissa axis; * – statistically significant differences between the groups (p < 0.05).
Результаты PR теста показали, что воздействие периодами покоя 4–16 с вызывало появление потенциации сокращения миокарда пациентов обеих, т. е. амплитуда сокращений после периодов покоя превышала базовые циклы. При этом динамика зависимости амплитуды сокращений от длительности периодов покоя значимо различалась между группами (рис. 3). Так, амплитуда первого сокращения миокарда пациентов после периодов покоя имела значимые различия между группами после воздействия периодами покоя длительностью 12 с и более. При этом амплитуда сокращений миокарда пациентов 1-й группы на коротких периодах покоя была наибольшей, а с увеличением длительности покоя она снижалась до базовых значений. Динамика амплитуды сокращений миокарда пациентов 2-й группы имела положительную зависимость. Так, потенциация инотропного ответа миокарда пациентов 2-й группы на коротких периодах покоя (4–10 с) была 55–68%, а с 12 с значительно нарастала и составляла более 100%; после 60 с периода покоя – 182% относительно базовых сокращений. Кроме того, после 12 с периода покоя появлялась статистически значимая разница между PR сокращениями сравниваемых групп.
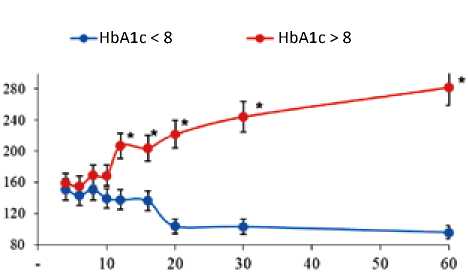
Рис. 3. Динамика post-rest сокращений миокарда пациентов Примечание: по оси ординат – амплитуда сокращения после периода покоя в процентах по отношению к регулярному сокращению; по оси абсцисс – длительность периода покоя в секундах, * – р < 0,05 статистически значимое различие между группами.
Fig. 3. Dynamics of post-rest myocardial contractions in patients Note: the amplitude of contraction after the rest period is indicated on the ordinate axis as a percentage relative to the regular contraction; the length of the resting period in seconds is indicated on the abscissa axis, * – p < 0.05, a statistically significant difference between the groups.
Обсуждение
Как показали результаты нашего исследования, функциональные свойства и сократительные возможности миокарда пациентов с ИБС, ассоциированной с СД2, различались в зависимости от уровня НbА1с. Так, по данным ЭхоКГ, у пациентов с уровнем HbA1c менее 8% ФВ имела статистически значимо более высокие значения в сравнении с соответствующими показателями пациентов с уровнем HbA1c более 8%. Кроме того, у пациентов с уровнем HbA1c менее 8% были обнаружены статистически значимо более низкие значения толщины ЗСЛЖ. Исследования ex vivo показали, что возбудимость миокарда у пациентов с более высокими показателями HbA1c была выше, при этом сократительный резерв миокарда у этих пациентов на данном этапе заболевания сохранялся в большей степени.
Как известно, нарушения углеводного обмена, в первую очередь СД, приводят к развитию структурных изменений ЛЖ. Показано, что пациенты с СД2 имеют более высокую массу миокарда ЛЖ, при этом частота развития гипертрофии ЛЖ (ГЛЖ) у этих больных возрастает по мере увеличения длительности СД [16]. В рамках Фрамингемского исследования была обнаружена связь между повышением толерантности к глюкозе и ЭхоКГ параметрами ЛЖ у больных СД [17]. Кроме того, было установлено, что масса миокарда и толщина стенки ЛЖ находятся в прямой зависимости от выраженности нарушений углеводного обмена [18]. Наши исследования также подтвердили, что более высокий уровень HbA1c связан с большими значениями толщины ЗСЛЖ.
Как показали исследования ex vivo , появление ЭС миокарда пациентов с уровнем HbA1c более 8% наблюдалось после нанесения электрического стимула через 0,225 с в отличие от миокарда пациентов группы сравнения. ЭС сокращение миокарда больных 1-й группы возникало при нанесении импульса только через 0,5 с. Эта особенность ЭС реакций миокарда свидетельствует о более высокой возбудимости сарколеммы кардиомиоцитов пациентов 2-й группы с уровнем HbA1c более 8%. Как известно, внеочередной электрический импульс вызывает появление сокращения только в случае, если воздействие попадает в фазу относительной рефрактер-ности [19]. Из этого следует, что повышение тяжести СД может приводить к укорочению фазы абсолютной реф-рактерности и, соответственно, способствовать повышению возбудимости кардиомиоцитов.
Согласно существующим представлениям об электромеханическом сопряжении, импульс электрической стимуляции, попадающий в 3-ю фазу потенциала действия, не способен вызывать сократительный ответ, но он инициирует дополнительное поступление ионов внешнего кальция в миоплазму кардиомиоцитов, который запасается в саркоплазматическом ретикулуме (СР). Дополнительно поступившие ионы кальция в СР участвуют в ПЭС цикле «сокращение – расслабление» [19]. В результате этого амплитуда ПЭС сокращения превышает значение регулярного цикла. В этих условиях величина ПЭС сокращения отражает эффективность работы Са2+-транспортирующих систем СР. Поскольку миокард пациентов 2-й группы оказался более возбудим, то, соответственно, большее количество ионов кальция поступало в саркоплазму при внеочередном возбуждении и, соответственно, запасалось в СР. В результате ПЭС сокращения изолированных трабекул пациентов с уровнем HbA1c более 8% оказались потенцированными. Кроме того, больший инотропный эффект ПЭС сокращений может быть связан с активностью Са2+-АТФ-азы СР, которая обеспечивает захват дополнительных ионов кальция в СР. Как показал PR тест, трабекулы пациентов 2-й группы имели также потенцированный инотропный ответ на периоды покоя. Механизм этого явления связан с кальций-аккумулирующей активностью СР. Доказано, что во время периода покоя в результате работы Са2+-АТФ-азы происходит накопление дополнительных ионов кальция в СР, которые затем выбрасываются при первом после периода покоя сокращении [13]. Как следствие, амплитуда сокращений после периодов покоя превышает базовые сокращения. В связи с этим можно предположить, что в кардиомиоцитах пациентов с уровнем HbA1c более 8% активность или количество Са2+-АТФ-азы выше по сравнению с миокардом пациентов, у которых уровень HbA1c менее 8%. Известно, что эффективная работа Са2+-АТФ-азы СР определяется достаточностью энергообеспеченности кардиомиоцитов. По этой причине доступность энергетического субстрата для этого фермента является важным фактором его активности. Наиболее важным источником энергии для Са2+-АТФ-азы является АТФ, образующаяся в процессе гликолиза [20]. Поскольку при хронической ишемии миокарда гликолиз становится преимущественным источником энергопродукции [21], то, вероятно, повышение доступности субстрата для гликолитических процессов, скорее всего, за счет инсулин-независимых механизмов, способствует нормализации энергетической обеспеченности метаболических реакций патологической клетки. Возможно, умеренно повышенный уровень глюкозы у пациентов с сочетанной патологией позволяет поддерживать энергообеспеченность кардиомиоцитов и, соответственно, сохранять сократительный резерв миокарда, связанный с функциональной активностью Са2+-транспортирующей системы СР.
В настоящем исследовании было показано, что в популяции пациентов с ИБС и СД2 повышенный уровень HbA1c соответствует лучшим показателям функционального состояния миокарда, по данным исследований сократительной активности изолированных мышечных трабекул.
Заключение
На основании вышесказанного мы можем сделать вывод о том, что, несмотря на неблагоприятный долгосрочный прогноз влияния коморбидной патологии на миокард, в краткосрочной перспективе создаются условия для сохранения сократительной функции сердца. Наше исследование показало, что у пациентов с ИБС на фоне СД2 с уровнем НbА1с выше 8%, но не более 10% сохраняется сократительный резерв миокарда.
Список литературы Сопряженность уровня гликемии и функциональных показателей миокарда у больных ишемической болезнью сердца на фоне сахарного диабета 2-го типа
- Сахарный диабет 2-го типа: от теории к практике; под ред. И.И. Дедова, М.В. Шестаковой. М.: Медицинское информационное агентство; 2016:571.
- Leon B.M., Maddox T.M. Diabetes and cardiovascular disease: Epidemiology, biological mechanisms, treatment recommendations and future research. World J. Diabetes. 2015;6(13):1246-1258. DOI: 10.4239/wjd.v6.i13.1246.
- Stratton I.M., Adler A.I., Neil H.A., Matthews D.R., Manley S.E., Cull C.A. et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): Prospective observational study. BMJ. 2000;321(7258):405-412. DOI: 10.1136/ bmj.321.7258.405.
- Holman R.R., Paul S.K., Bethel M.A., Matthews D.R., Neil H.A.W. 10-year follow-up of intensive glucose control in type 2 diabetes. N. Engl. J. Med. 2008;359(15):1577-1589. DOI: 10.1056/NEJMoa080647.
- Nathan D.M., Cleary P.A., Backlund J.Y., Genuth S.M., Lachin J.M., Orchard T.J. et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N. Engl. J. Med. 2005;353(25):2643-2653. DOI: 10.1056/NEJMoa052187.
- The ACCORD Study Group. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N. Engl. J Med. 2011;364(9):818-828. DOI: 10.1056/NEJMoa1006524.
- Skyler S., Bergenstal R., Bonow R., Buse J., Deedwania P., Gale E.A. et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Circulation. 2009;119(2):351-357. DOI: 10.1161/CIRCULATIONAHA.108.191305.
- Zoungas S., Chalmers J., Neal B., Billot L., Li Q., Hirakawa Y. et al. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N. Engl. J. Med. 2014;371(15):1392-1406. DOI: 10.1056/NEJ-Moa1407963.
- Bejan-Angoulvant T., Cornu C., Archambault P., Tudrej B., Audier P., Brabant Y. et al. Is HbA1c a valid surrogate for macrovascular and microvascular complications in type 2 diabetes? Diab. Metabol. 2015;41(3):195-201. DOI: 10.1016/j.diabet.2015.04.001.
- Wang P., Huang R., Lu S., Xia W., Sun H., Sun J. et al. HbA1c below 7% as the goal of glucose control fails to maximize the cardiovascu lar benefits: a meta-analysis. Cardiovasc. Diabetol. 2015;14:124. DOI: 10.1186/s12933-015-0285-1.
- IDF Annual Report 2015 by International Diabetes Federation. URL: issuu.com/int.diabetes. federation/docs/idf.
- Рябова Т.Р., Рябов В.В., Соколов А.А., Дудко В.А., Репин А.Н., Марков В.А. и др. Динамика структурно-геометрических и функциональных показателей левого желудочка в ранние и поздние сроки инфаркта миокарда. Ультразвуковая и функциональная диагностика. 2001;(3):54-60.
- Uhl S., Freichel M., Mathar I. Contractility measurements on isolated papillary muscles for the Investigation of Cardiac Inotropy in Mice. J. Vis. Exp. 2015;(103):53076. DOI: 10.3791/53076.
- Кондратьева Д.С., Афанасьев С.А., Реброва Т.Ю., Попов С.В. Сопряженность сократительной активности миокарда и уровня окислительного стресса у крыс при сочетанном развитии постинфарктного кардиосклероза и сахарного диабета. Известия Российской академии наук. Серия биологическая. 2019;(2):197-203.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом; под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова; 8-й вып. М.: УП ПРИНТ; 2017:112.
- Palmieri V., Bella J.N., Arnett D.K., Liu J.E., Oberman A., Schuck M.Y. et al. Effect of type 2 diabetes mellitus on left ventricular geometry and systolic function in hypertensive subjects: Hypertension Genetic Epidemiology Network (HyperGEN) Study. Circulation. 2001;103(1):102-107. DOI: 10.1161/01.cir. 103.1.102.
- Fox C.S. Cardiovascular disease risk factors, type 2 diabetes mellitus, and the Framingham Heart Study. Trends Cardiovasc. Med. 2010;20(3):90-95. DOI: 10.1016/j.tcm.2010.08.001.
- Королева Е.В., Хохлов А.Л. Факторы, влияющие на развитие структурно-функциональных нарушений сердца у больных сахарным диабетом 2-го типа. Международный научно-исследовательский журнал. 2017;58(4):156-159. DOI: 10.23670/IRJ.2017.58.152.
- Sprenkeler D.J., Vos M.A. Post-extrasystolic potentiation: Link between Ca(2+) homeostasis and heart failure? Arrhythm. Electrophysi-ol. Rev. 2016;5(1):20-26. DOI: 10.15420/aer.2015.29.2.
- Zima A.V., Kockskamper J., Blatter L.A. Cytosolic energy reserves determine the effect of glycolytic sugar phosphates on sarcoplas-mic reticulum Ca2+ release in cat ventricular myocytes. J. Physiol. 2006;577(1):281-293. DOI: 10.1113/jphysiol.2006.117242.
- Ritterhoff J., Tian R. Metabolism in cardiomyopathy: every substrate matters. Cardiovasc. Res. 2017;113(4):411-421. DOI: 10.1093/cvr/cvx017.


