Сорбция акридина и его производных на углеродсодержащих сорбентах
Автор: Красичкова С.А., Начкина Л.В., Черняева О.Ю., Юрова В.Ю.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 16 т.5, 2017 года.
Бесплатный доступ
Определены сорбционные характеристики образцов по отношению к акридину и 9-фенилакридину в растворах. Построена изотерма адсорбции акридина и 9-фенилакридина.
9-фенилакридин, адсорбция, акридин, графит, изотермы, катализаторы, механизм сорбции, флуориметрический метод
Короткий адрес: https://sciup.org/147249397
IDR: 147249397 | УДК: 543.544.-414:547.82
Текст научной статьи Сорбция акридина и его производных на углеродсодержащих сорбентах
Несмотря на существенный прогресс, достигнутый в последние годы в области водородной энергетики, практическое использование разработанных технологий по-прежнему весьма ограничено вследствие низкой эффективности синтетических катализаторов. В настоящее время для решения данной проблемы интенсивно изучается возможность использования комплексов переходных металлов при помощи бионеорганического (биомиметического) подхода, основанного на имитации функциональной структуры каталитических фрагментов – железо- и/или никель-содержащих гидрогеназ. Несмотря на высокую каталитическую активность гидрогеназ практически при полном отсутствии перенапряжения, их использование в промышленных масштабах не представляется возможным ввиду сложности их получения в больших количествах и чрезвычайно высокой чувствительности к окружающим условиям (температуре, pH, наличию кислорода) [1].
К настоящему моменту синтезировано множество комплексов переходных металлов, обладающих высокой активностью в электрокаталитической генерации водорода, в том числе превосходящих гидрогеназы по каталитической активности и величине перенапряжения. Несмотря на это, ни один из большого многообразия молекулярных комплексов не сочетал низких значений перенапряжения с доступностью, высокой 1
активностью и стабильностью, что является необходимым условием экономически жизнеспособного катализатора. Использование катализаторов, содержащих полиароматические группы, позволит осуществить эффективную иммобилизацию катализатора за счет сильной физической сорбции на поверхность углеродных носителей и получить стабильные высокоэффективные гетерогенные каталитические системы для получения водорода из воды.
Изучение сорбции акридина и 9-фенилакридина проводилось статическим методом при соотношении твердой фазы и жидкой 1:100, при непрерывном перемешивании растворов и комнатной температуре. Содержание акридина и 9-фенилакридина после сорбции определяли флуориметрическим методом на спектрофлуориметре RF 5301 PC Shimadzu.
Для построения калибровочных графиков использовали флуориметрический метод. На рисунках 1–4 представлены калибровочные графики зависимости интенсивности (I) от концентрации оптически активного вещества (С):
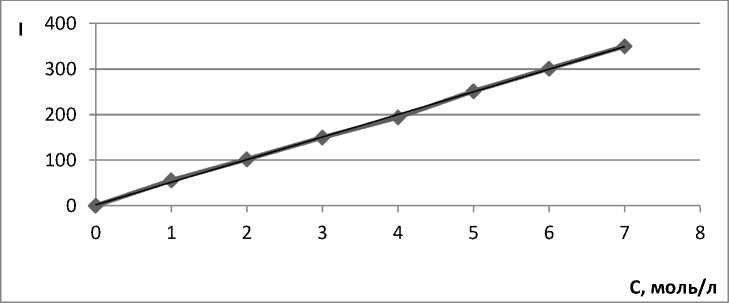
Рис. 1. Калибровочная кривая для определения концентрации акридина в ацетонитриле.
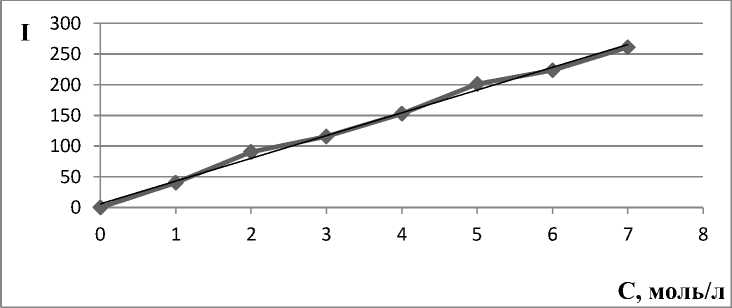
Рис. 2. Калибровочная кривая для определения концентрации акридина в дихлорметане.
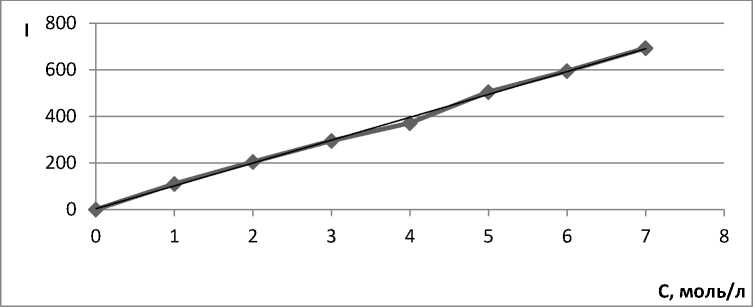
Рис. 3. Калибровочная кривая для определения концентрации 9-фенилакридина в ацетонитриле.
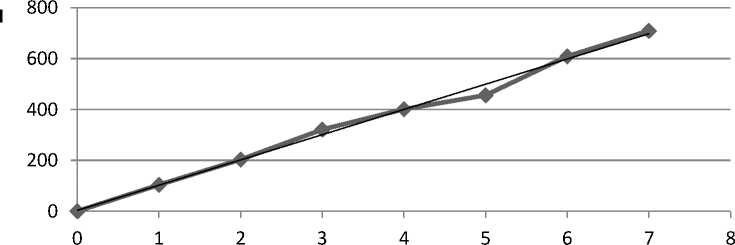
С, моль/л
Рис. 4. Калибровочная кривая для определения концентрации 9-фенилакридина в дихлорметане.
Для оценки правильности построения калибровочного графика и точного определения содержания акридина и 9-фенилакридина в органических растворителях использовали метод наименьших квадратов [2].
Исследование кинетики сорбции позволяет установить скорость достижения равновесия в системе «сорбент – сорбат». Экспериментальные данные по продолжительности сорбции акридина и 9-фенилакридина в органических растворителях представлены на рисунках 5–8.
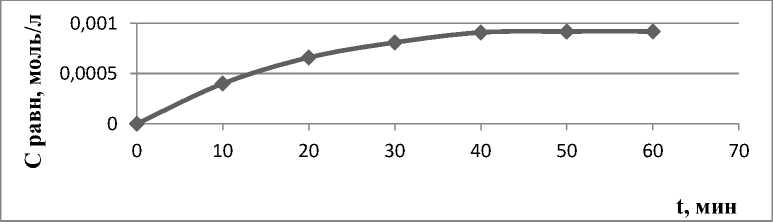
Рис. 5. Кинетическая кривая сорбции акридина углеродсодержащим сорбентом в ацетонитриле.
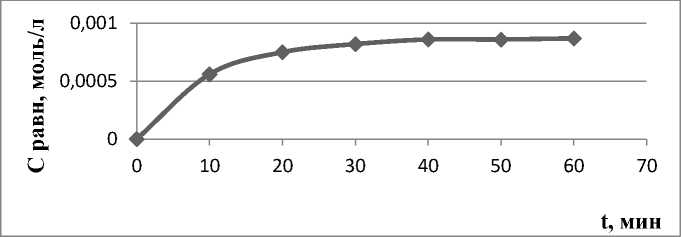
Рис. 6. Кинетическая кривая сорбции акридина Углеродсодержащим сорбентом в дихлорметане.
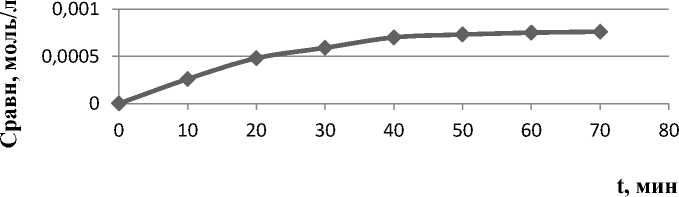
Рис. 7. Кинетическая кривая сорбции 9-фенилакридина углеродсодержащим сорбентом в ацетонитриле.
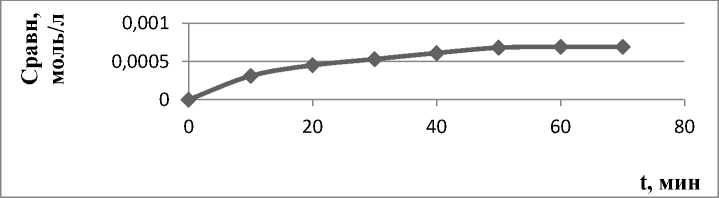
Рис. 8. Кинетическая кривая сорбции 9-фенилакридина углеродсодержащим сорбентом в дихлорметане.
Как видно из представленных рисунков, сорбции акридина из ацетонитрила и дихлорметана протекают быстрее (рис. 5 и 6) по сравнению с 9-фенилакридином в тех же условиях. В случае акридина адсорбционное равновесие достигается через 50 минут сорбции, а у 9-фенилакридина ‒ через 60 мин. Это может быть связано с наличием у акридина плоской структуры, тогда как у 9-фенилакридина заместитель в 9-м положении вывернут относительно плоскости гетероцикла. Это приводит к уменьшению возможности сорбции 9-фенилакридина за счет π-π взаимодействия [3]. Наличие плоской структуры в случае акридина способствует лучшему взаимодействию между графено-подобными участками углеродсодержащего сорбента и молекулой акридина, что способствует более высокой скорости сорбции на начальном этапе по сравнению с 9-фенилакридином.
Для невозбужденных молекул акридина в буферном растворе константа протолитического равновесия равна рК=5,45. В растворах акридина до рН 5,7 преимущественно существует катионная форма. При дальнейшем повышении рН увеличивается концентрация молекулярной формы акридина. Для акридина наблюдаются две полосы интенсивности в УФ-области, причем полоса при более длинных волнах заходит в видимую область, благодаря чему акридин кажется слегка окрашенным в желтый цвет. При образовании катиона в результате протонирования атома азота поглощение распространяется в видимую часть спектра, вследствие чего соли акридина имеют отчетливую желтую окраску [4].
Изучены концентрационные зависимости акридина и 9-фенилакридина от рН раствора в интервале 1‒4. Полученные результаты представлены на рисунках 9 и 10. Из рисунков видно, что с увеличением рН раствора наблюдается рост сорбции акридина и 9-фенилакридина углеродсодержащим сорбентом, что соответствует уменьшению концентрации акридина и 9-фенилакридина в растворе, что приводит к уменьшению содержания акридина и 9-фенилакридина.
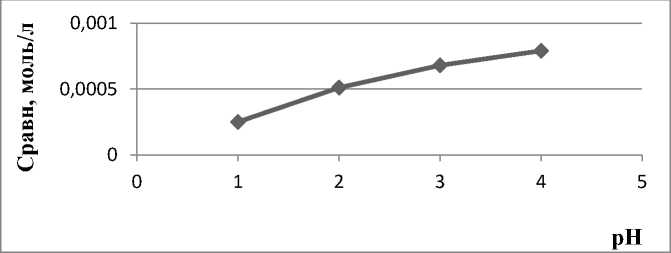
Рис. 9. Влияние рН раствора на сорбцию 9-фенилакридина (С=10-3 моль/л)
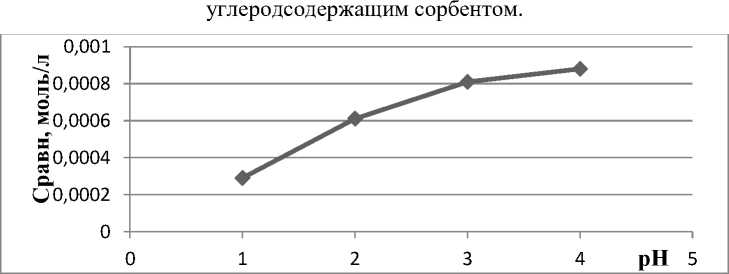
Рис. 10. Влияние рН раствора на сорбцию акридина (С=10-3 моль/л) углеродсодержащим сорбентом.
По изотермам сорбции (их форме) можно cделать определенные выводы о характере поверхности сорбента. Как видно, изотермы сорбции акридина и 9-фенилакридина углеродсодержащим сорбентом соответствуют изотермам мономолекулярной адсорбции Ленгмюра и имеют выпуклую форму.
Это равновесие может быть описано уравнением Ленгмюра [5]:
К
А=А ∞ с
1+ Кс где А ‒ величина адсорбции, кмоль/кг; А∞ ‒ предельная мономолекулярная адсорбция (емкость монослоя); К – константа адсорбционного равновесия (находятся отношением констант адсорбции и десорбции и характеризуют энергию взаимодействия адсорбата с адсорбентом); С – концентрация адсорбата в растворе, кмоль/м3.
Константа Генри связана с константой уравнения Ленгмюра соотношением [6]:
К г =А ∞ К равн
Экспериментальные результаты адсорбции обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
1 _ 1 1 1
А “ А » АЮК С р
Графическая зависимость 1 = f(- 1 ) выражается прямой, пересекающей ось ординат. А Ср
Отрезок, отсекаемый на оси ординат, определяет величину, обратную емкости монослоя — .
Тангенс угла наклона прямой равен , что позволяет найти константу адсорбционного равновесия Кравн [7].
Изотермы приведены к линейной форме, для которых рассчитаны следующие параметры: tgα (тангенс угла наклона прямой), K равн (константу адсорбционного равновесия), ∆G0 адс (изменение энергии Гиббса адсорбции) по формулам ниже.
Тангенс угла наклона прямой равен:
1 tgα=
∞ равн и позволяет найти константу адсорбционного равновесия Кравн.:
К равн. =tga •Л ю
Зная константу адсорбционного равновесия, можно рассчитать изменение энергии Гиббса адсорбции:
∆G0 адс , = -RTlnK
Как видно из таблицы
изменения энергии Гиббса для углеродсодержащих сорбентах
1, экспериментальные полученные значения величин процессов сорбции акридина и 9-фенилакридина на имеют отрицательные значения и характеризуются самопроизвольным протеканием.
Таблица 1
Термодинамические параметры сорбции акридина и 9-фенилакридина углеродсодержащим сорбентом
|
Параметры |
Акридин из ацетонитрила |
Акридин из дихлорметана |
9-фенилакридин из ацетонитрила |
9-фенилакридин из дихлорметана |
|
1 |
2 |
3 |
4 |
5 |
|
tgα |
8 |
7,22 |
7,43 |
6,89 |
|
K |
6,976 |
6,310 |
4,872 |
4,56 |
|
∆G0 адс , кДж |
-21,528 |
-23,885 |
-16,868 |
-19,631 |
По проделанной работе можно сформулировать следующие выводы. Изучена сорбция акридина и 9-фенилакридина на углеродсодержащем сорбенте типа Vulcan xc72 в соотношении sp3/sp2 атомов углерода. Выявлены основные закономерности сорбции акридина и 9-фенилакридина на углеродсодержащем сорбенте, связанные с наличием у адсорбатов плоской структуры. Экспериментально определены кинетические и термодинамические характеристики процессов сорбции. Показано, что все они имеют отрицательные значения изменения энергии Гиббса, т.е. протекают самопроизвольно.
Список литературы Сорбция акридина и его производных на углеродсодержащих сорбентах
- Порай-Кошиц А. Е., Тер-Саркисян Г. С. Реакции конденсации бензпроизводных 9-метилакридина. Сообщение 1. Превращение 9-метил-3,4-бензакридина // Изв. АНСССР хим. - 1951. - № 5. - С. 601-609.
- Зефиров Н.С. Химическая энциклопедия: в 5 т. - М.: Мир, 1998. - Т. 5. - 783 с.
- Бартон Д. Общая органическая химия: в 12 т. / пер. с англ. под ред. К. Кочеткова. - Т. 8: Азотосодержащие циклы. - М.: Химия, 1985. - 752 с.
- Дорохова Е. Н., Прохорова Г. В. Аналитическая химия. Физико-химические методы анализа. - М.: Высшая школа, 1991. - 255 с.
- Головина А. П., Левшин Л. В. Химический люминесцентный анализ неорганических веществ: учеб. пособие для вузов. - М.: Химия, 1988. - 248 с.
- Чарыков А. К. Математическая обработка результатов химического анализа. - Л.: Химия, 1984. - 168 с.
- Фридрихсберг Д. А. Курс коллоидной химии. - Л.: Химия, 1984. - 368 с.


