Сорбция ионов церия (III) из водных растворов природным клиноптилолитсодержащим туфом
Автор: Кожевникова Нина Михайловна
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
Изучены равновесия и кинетика сорбциии ионов церия (III) из сульфатных растворов природным клиноптилолитсодержащим туфом. Показано, что из разбавленных растворов (
Природный цеолит, ионы церия (iii), изотермы сорбции, кинетические закономерности
Короткий адрес: https://sciup.org/148180976
IDR: 148180976 | УДК: 549.67:546.657
Текст научной статьи Сорбция ионов церия (III) из водных растворов природным клиноптилолитсодержащим туфом
Природные цеолиты, модифицированные ионами редкоземельных элементов (РЗЭ), перспективны для получения эффективных стимуляторов регенерационной терапии и биологически активных препаратов. Показано, что лечебный эффект достигается за счёт ионообменных и сорбционных свойств природных цеолитов, которые эффективны за счёт дренажного действия и на системном уровне стимулируют детоксикационные функции лимфатических структур [1]. Лантан и церий, введённые в матрицу цеолита, обладают нейропротекторным действием [2]. Методом сорбционной технологии разработаны эффективные нейропротекторные препараты на основе клиноптилолита Холин-ского месторождения и лантана [3]. Из [1, 3-5] следует , что с орбционная технология могла бы повысить биологическую активность природных цеолитов путём введения в матрицу цеолита ионов лантана и церия.
Ранее нами изучены равновесие и кинетика сорбции катионов лантана, неодима и самария морденит- и клиноптилолитсодержащим туфом [1, 4, 5]. На изотерме сорбции указанных ионов РЗЭ выявлено наличие максимумов, обусловленных взаимодействием в системе цеолит – ионы РЗЭ. Влияние природы РЗЭ на равновесие и кинетику сорбции требует более глубокого изучения закономерностей сорбции в системе цеолит – ионы редкоземельного элемента.
Цель настоящей работы – исследовать влияние на процессы сорбции ионов церия (III) клинопти-лолитсодержащим туфом концентрации растворов, размера зерен сорбента и соотношения масс твердой и жидкой фаз.
Экспериментальная часть
В качестве сорбента использовали клиноптилолитсодержащий туф следующего состава: масс.%: SiO 2 – 68.11, MgO – 2.65, Al 2 O 3 – 12.84, CaO – 4.17, Na 2 O – 2.87, K 2 O – 2.47, Fe 2 O 3 – 1.08, FeO – 0.35, P 2 O 5 – 0.05, TiO2 – 0.58, CuO – 0.003, Mn – 0.08, F – 0.002; Si/Al = 5.25 [1]. Содержание цеолита в породе определяли методом РСА с помощью ПЦЛ-2 [6], оно составило 61 мас.%.
Для исследования равновесия и кинетики поглощения ионов церия (III) клиноптилопитсодержа-щий туф измельчали на шаровой мельнице МС-23200 фирмы Simens, отбирали методом рассева фракцию зерен диаметром 0.25-0.5 и 1-2 мм, отделяли от пыли, высушивали при комнатной температуре 24 ч и отбирали навеску. Время высушивания 24 ч выбрано на основании трех контрольных взвешиваний через каждые 3 ч сушки. Исследование равновесия проводили в статических условиях в водных растворах Ce 2 (SO 4 ) 3 методом постоянных масс при комнатной температуре [6, 7]. Содержание ионов церия (III) анализировали фотометрическим методом с арсеназо III, отличающимся высокой чувствительностью и избирательностью [8]. Емкость поглощения рассчитывали по разности концентраций ионов церия (III) в растворе до и после сорбции из результата трех параллельных опытов, размах варьирования, нормированный на среднее арифметическое, не превышал 3%.
Равновесие сорбции церия (III) на клиноптилолитсодержащем туфе изучали в широком концентрационном интервале (10-5-10-2 моль/л), что позволило выявить изменения на начальных и конечных участках кривых равновесия. Кинетику поглощения ионов церия изучали методом ограниченного объема при соотношении твердой (Т) и жидкой (Ж) фаз 1:10 и 1:50 из растворов сульфата церия (III) концентрацией 0.001-0.003 моль/л при постоянном перемешивании. Время контакта с сорбентом изменяли от 5 мин до 6 сут. Влияние размеров зерен сорбента изучено на зернах сорбента диаметром 0.25-0.5, 1-2 мм.
Кинетические параметры рассчитывали из кривых Q – τ, где Q – количество сорбированных ионов церия (III), ммоль/г, τ – время (с), по методике, разработанной для сорбции на цеолитах [9] и приведены в табл. Кривые равновесия сорбции церия (III) из растворов сульфата церия на природном цеолите, полученные для зерен различного размера (~0.25-0.50 и 1-2 мм) при соотношении масс 1:50,1:10, представлены на рис. 1.
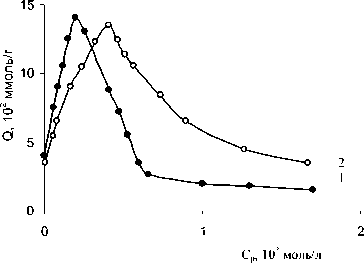
Рис. 1. Изотерма сорбции церия из растворов сульфата церия. Q – количество сорбированных ионов церия (III) (моль/г), C р – равновесная концентрация Ce(III) в растворе (моль/л), 1 – d=0.25-0.5 мм, Т:Ж= 1:50; 2 – d=1-2 мм, Т:Ж=1:10.
Обе кривые равновесия имеют особенность, заключающуюся в наличии острого максимума, который можно объяснить склонностью РЗЭ к комплексообразованию в растворах. Для состояния водных растворов церия (III) характерны процессы гидратации, гидролиза, полимеризации и комплексообразования. В нейтральных и кислых водных растворах ионы церия находятся в виде аквакомплексов типа [Ce(H 2 O) n ]3+ и гидроксоаквакомплексов [Ce(H 2 O) n OH]2+, где n = 5-8 [10]. Скорость обмена будет определяться отщеплением гидратной оболочки. Повышение концентрации раствора приводит к упрочнению комплексов РЗЭ, что обусловливает понижение сорбции вследствие увеличения энергии отщепления гидратной оболочки. В растворах сульфата церия зафиксировано также образование комплексов состава [Ce(SO 4 ) n ]3 – 2n, где n = 1-3. при низких концентрациях сульфат ионов (<0.03 М) преобладают катионы [CeSO 4 ]+, хотя в этих условиях могут образоваться и анионные комплексы.
Таблица
Кинетические параметры сорбции Се (III)
из сульфатных растворов природным клиноптилолитсодержащим туфом
|
Параметр |
Концентрация раствора, моль/л |
||
|
0.001* |
0.002** |
0.003*** |
|
|
τ ∞ , мин |
1575 |
1694 |
1637 |
|
dQ/d τ∙105 ммоль/(г ∙ с) |
5.6 |
4.3 |
4.7 |
|
K, мл/∙г |
49.4 |
41.7 |
59.3 |
|
R, 104 с–1 |
4.5 |
4.2 |
4.7 |
|
D, 108 см2/с |
4.5 |
3.8 |
3.9 |
|
B, 104 с–1 |
8.8 |
7.6 |
8.4 |
*d = 0.25-0.5 мм, Т : Ж = 1 : 50, **d = 1-2 мм, Т : Ж = 1 : 10, ***d = 1-2 мм, Т : Ж = 1 : 10.
Можно предположить, что при возрастании концентрации раствора до точки экстремума происходит сорбция аква- и гидроксокомплексов церия (III), так как эти комплексы имеют более высокий заряд иона и повышенную селективность цеолита к ним. Размеры окон и полостей исследуемого цеолита составляют 5-7 Å, что значительно превышает размеры аква- и гидроксоаквакомплексов. Предполагаемый механизм обменной сорбции путем замещения Na+, K+, H+ на Ce3+ подтверждают данные работ [6, 7]. Размеры зерен и соотношение масс твердой и жидкой фаз влияют на положение максимума на изотермах (рис. 1). Максимум обменной емкости (ОЕ) на зернах с d = 0.25-0.5 мм и Т:Ж = 1:50 (рис. 1, кривая 1) сдвинут в область меньших равновесных концентраций, при увеличении размеров зерен (d = 1-2 мм) и Т : Ж = 1:10 максимум ОЕ находится в области более высоких концентраций (рис. 1, кривая 2).
Таким образом, на мелких зернах туфа максимальная ОЕ, равная 0.145 ммоль/г, достигается при меньшем расходе реагента.
Кинетические кривые поглощения ионов церия (III) имеют сходный вид (рис. 2). Кинетические параметры, приведенные в табл. 1, указывают на зависимость скорости поглощения ионов церия (III) от размеров зерен клиноптилолитсодержащего туфа и концентрации раствора. Уменьшение размеров зерен сорбента приводит к увеличению поверхности, что сказывается на увеличении скорости поглощения dQ/dτ по внешнедиффузионному механизму. При увеличении концентрации растворов сульфата церия (III) сокращается время достижения равновесного состояния τ ∞ , наблюдается увеличение констант скоростей внешне- (R) и внутридиффузионного (B) процессов коэффициента распределения K, а также значения эффективного коэффициента диффузии D. Значения констант R и B имеет одинаковый порядок, что подтверждает смешанный механизм сорбции ионов церия (III) кли-ноптилолитсодержащим туфом.
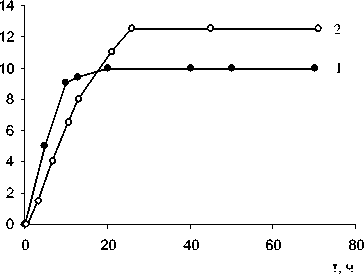
Рис. 2. Кинетические кривые сорбции церия (III) из водных растворов сульфата церия (III) клиноптилолитсо-держащим туфом. Q – количество сорбированных ионов церия (III) (моль∙г-1), τ – время сорбции; 1 – 0.001 моль/л, d = 0.25-0.5 мм, Т:Ж = 1:50; 2 – 0.003 моль/л, d=1-2 мм, Т:Ж = 1:10;


