Сорбция комплексов титана с органическими кислотами на оксиде титана (IV)
Автор: Гейнц Наталья Сергеевна, Воробьев Дмитрий Владимирович, Корина Елена Александровна, Морозов Роман Сергеевич, Авдин Вячеслав Викторович, Белозерова Анастасия Анатольевна, Большаков Олег Игоревич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.13, 2021 года.
Бесплатный доступ
Нанокристаллический диоксид титана, по причине его эффективности, невысокой стоимости, нетоксичности, фото- и термической стабильности, является наиболее изученным полупроводниковым оксидным материалом, нашедшим применение в солнечных элементах Гретцеля, в качестве компонента керамических, композиционных, каталитических и сорбционных материалов. Эффективность нанокристаллического диоксида титана определяется множеством факторов, многие из которых контролируются методами нанотехнологии: размер частиц, кристалличность, фазовый состав, морфология и состав поверхности. Задача исследователей отследить, изучить, понять и в пределе превратить в манипулируемый инструмент контроля каждый из озвученных параметров. В этой работе мы рассматриваем сорбцию трёх различных органических комплексов на родственной фазе - оксиде титана в виде наночастиц. Сорбция комплексов рассматривается как контролируемый прирост фазы оксида и может быть в перспективе использована в качестве метода модификации поверхности. Описывается метод получения двух комплексов титана с органическими кислотами, один из которых - комплекс с фенилгликолевой кислотой - получен впервые. Сравнение физико-химических параметров сорбции органических комплексов титана показал, что абсолютные значения энергии Гиббса сорбции комплексов являются довольно низкими. Показано также, что самым высоким сродством обладает комплекс с лимонной кислотой, а наличие ароматической компоненты в органической кислоте почти вдвое увеличивает предельную концентрацию комплекса на поверхности сорбента.
Оксид титана, пероксокомплекс титана, органические кислоты, адсорбция, свободная энергия гиббса
Короткий адрес: https://sciup.org/147234259
IDR: 147234259 | УДК: 544.723 | DOI: 10.14529/chem210208
Текст научной статьи Сорбция комплексов титана с органическими кислотами на оксиде титана (IV)
Согласно каноническому обзору по поверхностным свойствам кристаллического оксида титана даже самые химически чистые и высококристалличные оксидные материалы характеризуются разнообразными молекулярными поверхностными дефектами: нуль-размерными, линейными ступенями, изгибами и линейными дислокациями [1]. Часто подобные дефекты формируются целенаправленно, что приводит к усилению функциональности оксидных материалов.
Стабильные водорастворимые мономолекулярные комплексы титана и органических кислот с устойчивым стехиометрическим и элементным составом давно известны и изучены, в том числе рентгеноструктурным анализом. Они широко используются в гидротермальном синтезе на-нокристаллического оксида титана. Данные комплексы термически устойчивы в широком диапазоне pH и разлагаются только при сильном нагреве [2–5].
В настоящей статье мы исходим из гипотезы о хемосорбировании вышеупомянутых водорастворимых комплексов титана на поверхности нанокристаллической оксидной фазы с формированием прочной связи Ti-O-Ti. По сути, хемосорбция комплексов на поверхности – это заторможенный (контролируемый) рост оксидной фазы, остановленный на стадии, предваряющей полную потерю хелатной и анионной оболочки водорастворимого комплекса титана (схема 1).
Формируемые таким образом оксититановые новообразования на поверхности формируют новый тип дефектности условно сферических (эллиптических) наночастиц, которые станут новыми центрами сорбции или катализа.
Контролируемое осаждение частиц – предшественников оксидных фрагментов – требует стабильного во времени и условиях эксперимента субстрата молекулярного типа. Конвенциальные прекурсоры оксида титана – галогениды, алкоксиды, ацетилацетонат – не подходят для данной задачи ввиду их низкой стабильности и быстрого гидролиза в присутствии воды. Поэтому требуется получение стабильных во времени и в водных условиях координационных соединений титана на основе бидентантных органических кислот.
Хемосорбирование координационных соединений титана может обеспечить прочное сцепление с сорбентом – оксидом титана. Для рассмотрения возможности сорбции этих комплексов требуется изучение физико-химии процесса с построением изотерм. Для этой цели были получены два комплекса титана с органическими кислотами, а еще один, коммерчески доступный, был закуплен.
°V-°x ]нои'"П
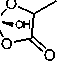
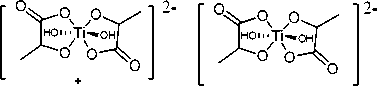
он о о о о он о о
О ОН О О О О
НО^ I Лк I Лк I Лк I Лк I Л^ I А I Лк I Л^ I Л^ I Л^ I Л^ I Л^ I Л^ I лн
Лк Лк Л^Лк Лк Лк X XnXtX„ ,
I О I О I O/1 о I Л I О I О I О I О I О I О I ° I О I OH
oooooooooooooo
OH
TiC Лк Лк Лк Лк^Лк Лк Лк Лк Лк^Лк Лк
I О I О 1^0 I О I о I OIO 1^0 I о I О I O^l^l^o 1^0 -----------ТОО
о о
о
Т< Лк ,Ti' ■о I О I О I О’ о о о
о о
Т< Лк ,Ti' ’О I о I О I О’ ООО
о
О^ НО. ОН Оч
/Т|\ /Т|\ 7?
оооооооноооооно\
Т< >i( >i( >iC >iC 'TiC 'TiC Ti >i( Л< Лк Лк Л' I О I О I О I ХО I О I О I ^о I1 О I О I О I О I о о о о о о о ои о о о о о
Схема 1. Гипотетическая схема гомодопирования поверхности наночастиц оксида титана
Экспериментальная часть
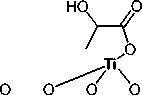
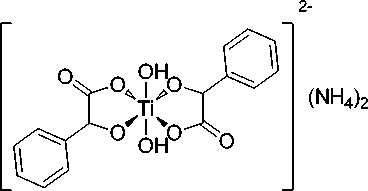
Изопропоксид титана (IV) (> 98 %, Acros), изопропанол (99,7 %, Химреактив), водный раствор бис(аммоний-лактато)дигидроксид титана (IV) (TiBALDH) (50 вес. %, Sigma-Aldrich) ( 1а ), миндальная кислота (100 %, Bingospa), лимонная кислота (ЧДА, «ЛенРеактив»), NH 4 OH (25 %, «НеваРеактив»), H 2 O 2 (40 %, «Биохим-Реагент») были использованы без предварительной очистки.
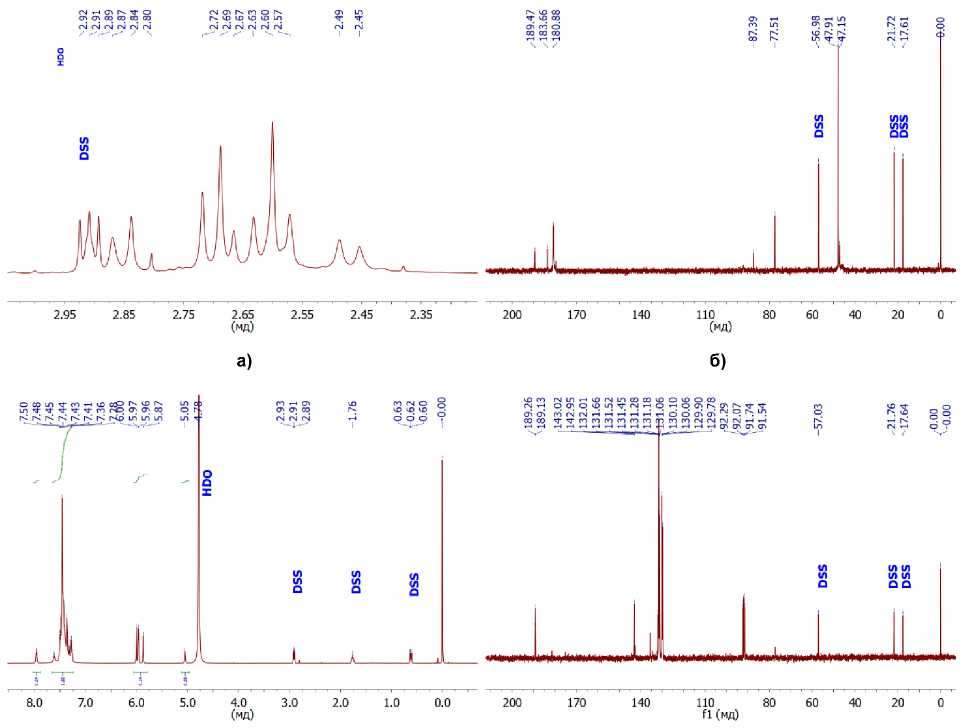
Регистрация ИК-спектров пропускания производилась на приборе Shimadzu IRAffinity S1 в диапазоне волновых чисел от 400 до 4000 см–1 с разрешением 4 см–1 путем усреднения 100 сканов. Образец прессовали в таблетки с KBr (квалификации ОСЧ), спектр которого перед измерениями регистрировался как спектр фона, а затем вычитали из спектра образца. Элементный анализ проводился на автоматическом CHNS анализаторе Perkin Elmer РЕ 2400, серия II; термический анализ (ТГ–ДСК) проведен на синхронном термическом анализаторе Netzsch STA 449 F1 Jupiter. Кривые записывали при линейном нагреве со скоростью 5 K/мин в атмосфере воздуха (40 мл/мин) в корундовых микротиглях (5 мкл) с крышкой, имеющей отверстие для обеспечения газообмена. Масса навески образцов составляла около 5 мг (зависимости строили для относительного изменения массы, %). Навески реагентов брали на весах Sartorius серии СРА, знак точ- ности 0,01 мг. Перед измерением образцы выдерживали не менее трех суток в вакуумном сушильном шкафу Binder GmbH при давлении 8 мБар. Спектры ядерного магнитного резонанса регистрировались на спектрометре Bruker Advance-500 с рабочей частотой 500 МГц. Растворитель – D2O c 0,75 % 3-(триметилсилил)пропансульфоната натрия (DSS) в качестве внутреннего стандарта с сигналами 1H (8, м.д.): 2,91 (м); 1,75 (м); и 0,63 (м) и референсным сигналом 0. 13С (8, м.д.): 57,03; 21,76; 17,64; 0,00.
Комплексы титана с органическими кислотами получали по следующей методике. В плоскодонную колбу на 100 мл помещали 0,41 г (0,0085 моль) порошкообразного титана, 40 мл 30%-ного раствора H2O2 и 5 мл раствора NH4OH. Реакционную смесь перемешивали на магнитной мешалке до полного растворения титана (от 1…1,5 ч), поддерживая температуру смеси в диапазоне 5^10 ° С. После растворения светло-желтый раствор пероксокомплекса титана фильтровали и приливали к нему раствор кислоты (17 ммоль) в 2…3 мл воды, не допуская нагрева смеси выше 25 ° С. После добавления кислоты температуру в реакционной смеси продолжали поддерживать в диапазоне 15…20 °С в течение еще 2…3 часов. Выделение комплексов титана с гидроксокисло-тами из водных растворов проводили выпариванием в сушильном шкафу при температуре 40…50 °С. Выход реакции – 100 %.
Нанокристалличный диоксид титана для сорбции, получали золь-гель методом. В колбе Эр-ленмейера на 500 мл, в 360 мл изопропанола растворяли 40 мл тетраизопропоксида титана, раствор перемешивали в течение 10 минут, далее добавляли 20 мл воды по каплям, при этом происходило немедленное образование непрозрачной взвеси. После этого раствор перемешивали без нагревания в течение 15 минут, затем кипятили полученную смесь с обратным холодильником в течение 72 часов. Полученный осадок отфильтровывали и промывали дистиллированной водой 8 раз; далее прокаливали при 500 °С в течение часа.
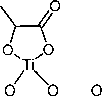
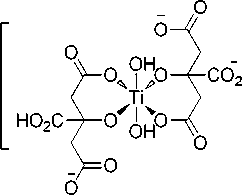
Комплекс титана с лимонной кислотой (далее – 1б ) имеет следующий вид:
5-
(NH4)5
Характеристики комплекса 1б : кристаллы желтого цвета, т. пл. 210…215 °С. Найдено (% ат.): C 25,40; H 5,60; N 12,53. Брутто-формула: C 12 H 31 N 5 O 17 Ti. Вычислено (%): C 25,50; H 5,53; N 12,39. Спектр ЯМР 1H (500 MHz, D2O) δ 2,84 (t, J = 16.4 Hz, 1H), 2,69 (t, J = 13.1 Hz, 2H), 2,60 (t, J = 15,5 Hz, 3H), 2,47 (d, J = 16,8 Hz, 1H). Спектр ЯМР 13С (126 MHz, D 2 O) δ 189,47 (CO 2 H), 183,66(CO 2 H), 180,88(CO 2 H), 87,39 (C-OH.), 77,51(C-OH), 47,91 (CH 2 ), 47,15 (CH 2 ). ИК-спектр (KBr), υ/cm–1 : 1560, 1398 (O=C-O–) 3196, 3050, 2836, 1237, 1076, 953, 913, 856, 801, 683, 544. Термоанализ, TiO 2 , %: найдено – 12,51; вычислено – 14,17.
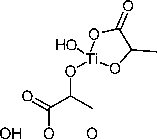
Комплекс титана с миндальной кислотой (далее – 1в ) имеет следующий вид:
Комплекс 1в , кристаллы бежевого цвета, т. пл. 175–180 °С. Найдено ( %): C 46,20; H 4,86; N 6,77. Вычислено для C 16 H 22 N 2 O 8 Ti: ( %) C, 45,95; H, 5,30; N, 6,70. Спектр ЯМР 1H (500 MHz, D 2 O) δ 7,97–7,26 (фенил), 6,00–4,78 (HCO). Спектр ЯМР 13С (126 MHz, D 2 O) δ 189,25–189,13 (CO 2 H), 143,01–129,78 (фенил), 92,28–91,53 (HCO). ИК-спектр (KBr), υ/cm–1: 1635, 1326 (O=С-O–) 3421,
3181, 3060, 3030, 2926, 2855, 1452, 1327, 1057, 948, 802, 752, 667, 557. Термоанализ, TiO 2 , %: найдено – 19,72; вычислено – 19,16.
Рентгенофазовый анализ провели на порошковом рентгеновском дифрактометре Rigaku Ultima IV с излучением CuK a (1,5405929 А) в диапазоне 2 9 5...90 ° с дискретностью 0,02 ° , скорость сканирования – 2 град/мин. Кристаллическая фаза была определена по библиотеке рентгеновских спектров в программе Portable Crystal Impact Match. Размер кристаллов был определен для наиболее интенсивного рефлекса на 25 град 2 9 , соответствующего грани (101) по формуле Шеррера.
Определение удельной поверхности и пористости проводилось методом низкотемпературной адсорбции азота на приборе ASAP Micromeritics 2020. Навеска образца составляла 100 мг. Стадии измерения предшествовала стадия дегазации, проводимая при температуре 200 °С в течение 2 ч. Удельную поверхность определяли методом БЭТ.
Адсорбцию комплексов титана с органическими кислотами на нанокристаллическом оксиде титана исследовали по следующей методике. Три серии исходных растворов комплексов титана с органическими кислотами готовили растворением сухих комплексов титана – лактата, цитрата, фенилгликолята – в дистиллированной воде. Концентрации комплексов в сериях: 0,1; 0,2; 0,3; 0,4; 0,5; 1,0; 2,0; 3,0; 5,0; 7,0 и 10 мМ. К 20 мг нанокристаллического оксида титана добавляли по 5 мл раствора комплекса титана каждой концентрации. Полученные суспензии встряхивали 24 ч при комнатной температуре. Полученные взвеси отстаивали 30 мин и фильтровали через шприцевые фильтры с размером пор 0,22 мкм (регенирированная целлюлоза, пр-ва ООО «Влад-фильтр»). Полученный фильтрат использовали для определения концентрации комплекса в растворе после сорбции.
Содержание титана в растворах определяли на атомно-эмиссионном спектрометре Perkin Elmer «Optima 2100 DV» с использованием операционных параметров, рекомендованных производителем. Для получения спектров из ряда наиболее чувствительных линий титана была отобрана эмиссионная линия Ti II 336, 121 нм, так как по результатам экспериментального опробования она показала наименьший разброс нескольких последовательных измерений эмиссии.
Обсуждение результатов
Характеризация полученного диоксида титана
ИК-Фурье спектр нанокристаллического TiO2 представлен на рис. 1а. Наиболее интенсивная и широкая полоса при 400 ÷ 900 см–1 относится к колебаниям кристаллической решетки диоксида титана [6–9]. Полоса при 3000 ÷ 3700 см–1 соответствует валентным колебаниям поверхностных гидроксильных групп, а малая полоса при 1650 см–1 соответствует режиму деформаций внутренних O-H связей [10–13].
Изотерма адсорбции азота представлена на рис. 1б. Низкотемпературная адсорбция азота показывает изотерму между 1-м и 4-м типом согласно классификации IUPAC [14]. Удельная поверхность рассчитывалась на основе метода БЭТ и равна 94,4 м2/г.
На рис. 1в показана рентгенограмма прокаленного образца TiO 2 наночастиц. Значения характеристик 2Ѳ и плоскостей [ hkl ] составляют 25,36° [101], 38,01° [004], 48,10° [200], 54,11° [105], 54,98° [211], 62,76° [204], 68,96° [116], 70,30° [220], 75,25° [215] и 82,77° [303]. Это соответствует тому, что полученные частицы имеют кристаллическую структуру анатаза [15–18]. Наиболее интенсивные пики рутила и брукита при 27° и 30° соответственно не были обнаружены, т. е. кристаллическая фаза полученного диоксида титана представляет собой 100%-ный анатаз. Средний размер кристалла, рассчитанный по уравнению Шеррера с использованием FWHM наиболее интенсивного пика анатаза при 25,36° соответствует 11,6 нм.
Структуры комплексов титана
Структуры использованных для сорбции на нанокристаллическом оксиде титана водорастворимых молекулярных комплексов титана с органическими кислотами представлены на рис. 2: коммерчески доступный TiBALDH ( 1а) , цитратный (1б) и фенилгликолятный ( 1в ). Комплекс титана с лимонной кислотой описан только в форме его тетраядерного производного [19]. Комплекс с миндальной кислотой ранее получен и охарактеризован не был. Как видно из структур, каждый атом титана в комплексе окружен двумя лигандами – органическими оксикислотами.
Гейнц Н.С., Воробьев Д.В., Сорбция комплексов титана с органическими кислотами Корина Е.А. и др. на оксиде титана (IV)
Для соединений 1а и 1в б иде н тантные лиганды формируют суммарный заряд а н и он а , равный –2. В слу ча е с те трад е н та н т н ым ли га нд ом – лимонной кислотой – суммарный заряд может быть иным.
|
. 3400 |
1635 \ 450V |



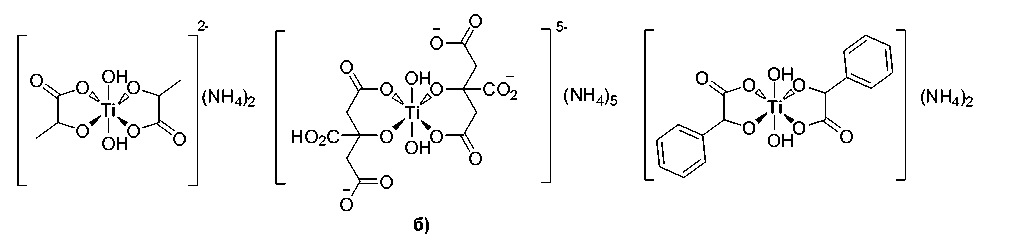
В к омп ле кс е титан а с ф е н и лгли коле в ой к ис лото й 1б спектр ЯМР демонстрирует сложные си гналы , отн ос ящ ие с я к фе н и льным и бензильному протонам, что также ука зыв а е т на ра з ли чный тип коор д и н иров а н и я ор г а н и ческого лиганда, причем эту разность нельзя от н ес ти иск лючи те л ьн о к р а ц е ми че ск ой с ме с и и с ходной миндальной кислоты. Скорее всего, име е т ме с то та у томе рн а я изомерия лиганда [25].
в) г)
Рис. 3. Спектры ЯМР 1H и 13С молекулярных комплексов Ti c лимонной (а, б) и миндальной кислотами (в, г)
Адс орбци я во д ора с твори мых комплексов титана на нанокристалличес к о м T iO 2
Адс орб ц ию в од ор а с тв оримых к омп л е кс ов ти та н а р и с . 1(а–в) на нанокристаллическом диоксиде титана проводили п р и тем п ера туре 20 ºС (293 К). По полученным экспериментальным данн ы м б ы ли п ос тр ое н ы графики зависимости величины адсорбции от равнов е сной концентрации соответс тв ующ е го к омп лек с а т итана в растворе после адсорбции (изотермы а д с ор б ц и и ) . Адс орбцию водорастворимы х к о м п л е ксов титана (А, ммоль/г) на поверхности твер д ого сорб е н т а ( н а ночастицы TiO2) ра ссчиты ва ли п о у ра в нен ию
A = V ( C 0 - C e ) , (1)
m где А – равновесная адсорбция, ммоль/г; С0 и Се – концентрации соответствующего комплекса титана в растворе до адсорбции и после адсорбции, ммоль/л; V – объем раствора, взятый для адсорбции, л; m – навеска адсорбента, г.
Количественные исследования адсорбции водорастворимых комплексов титана на TiO2 показывают поведение, подобное ленгмюровскому, с начальным поглощением, линейно пропорциональным концентрации, а затем при более высоких концентрациях адсорбтива адсорбция дости- гает предела (рис. 4). Поэтому для обработки наших экспериментальных данных мы использовали модель Ленгмюра:
A = A m KC e
1 + KCe ’ где Am – предельная сорбция или емкость монослоя, т. е. количество адсорбированного вещества, покрывающее поверхность адсорбента плотным монослоем, ммоль/г; K – константа адсорбционного равновесия; Сe – равновесная концентрация водорастворимого комплекса титана в растворе после сорбции, ммоль/л.
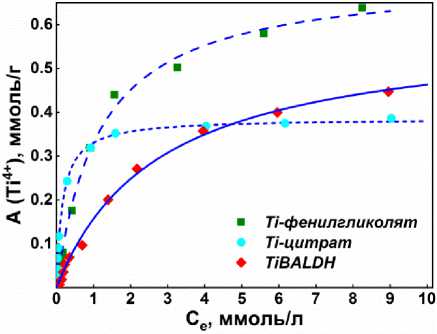
Рис. 4. Изотермы адсорбции водорастворимых комплексов титана: TiBALDH (1а); Ti-цитрат (1б); Ti-фенилгликолят (1в)
Для определения константы адсорбции мы использовали линейную форму уравнения Ленг- мюра:
11 1
A = A m + A m KC e "
При экстраполяции зависимости 1/ C e / 1/ А по угловому коэффициенту tg а = AmK прямой и отрезку, отсекаемому на оси ординат при С e = 0, равному 1/ Am , были вычислены константы адсорбции ( K ) и предельные адсорбционные емкости насыщенного адсорбента ( A m , мг/г).
Подстановкой вычисленных величин К в уравнение Вант-Гоффа (3) были рассчитаны свободные энергии Гиббса (Δ G 0, кДж/моль):
AG0 = -RTlnK , где R – универсальная газовая постоянная, Дж/моль·K; Т – температура, при которой проходил процесс адсорбции, К.
Параметры адсорбции ( A m , K и Δ G 0) водорастворимых комплексов титана на нанокристалли-ческом TiO 2 , рассчитанные по модели Ленгмюра, представлены в таблице.
Термодинамические параметры сорбции молекулярных комплексов титана на нанокристаллическом оксиде титана
|
Молекулярный комплекс титана |
A m , ммоль/г |
K |
∆ G 0, кДж/моль |
|
TiBALDH ( 1а ) |
0,43 |
0,5 |
1,7 |
|
Ti-цитрат ( 1б ) |
0,39 |
6,0 |
-4,4 |
|
Ti-фенилгликолят ( 1в ) |
0,72 |
0,9 |
0,4 |
Заключение
Сорбция комплексов титана с органическими кислотами на нанокристаллическом оксиде титана изучена в воде при комнатной температуре. Построение изотерм сорбции комплексов титана позволило вычислить константу сорбции, производную энергии Гиббса и предельную сорбцию.
Сравнение физико-химических параметров сорбции органических комплексов титана показало, что абсолютные значения энергии Гиббса сорбции комплексов являются довольно низкими. Положительное значение свободной энергии Гиббса сорбции лактата титана 1а говорит о том что модель однослойной сорбции не подходит для описания процесса и имеет место полислойная сорбция. Показано также, что самым высоким сродством к TiO 2 и высоким коэффициентом распределения в области малых концентраций обладает комплекс с лимонной кислотой (рис. 2в). Наличие ароматической компоненты в органической кислоте увеличивает предельную концентрацию комплекса на поверхности сорбента почти в два раза.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Грант № 20-03-00904 А.
Список литературы Сорбция комплексов титана с органическими кислотами на оксиде титана (IV)
- Diebold U. The Surface Science of Titanium Dioxide. Surf. Sci. Rep., 2003, vol. 5-8 (48), pp. 53-229. DOI: 10.1016/S0167-5729(02)00100-0
- Truong Q.D., Dien L.X., Vo D.-V.N., Le T.S. Controlled Synthesis of Titania Using Water-Soluble Titanium Complexes. J. Solid State Chem., 2017, vol. 251, pp. 143-163. DOI: 10.1016/j .jssc.2017.04.017
- Kharkar D.P., Patel C.C. Peroxy Titanium Oxalate. Proc. Indian Acad. Sci., 1956, vol. 44, pp. 287-306. DOI: 10.1007/BF03046055
- Collins J.M., Uppal R., Incarvito C.D., Valentine A.M. Titanium(IV) Citrate Speciation and Structure under Environmentally and Biologically Relevant Conditions. Inorg. Chem., 2005, vol. 44, pp. 3431-3440. DOI: 10.1021/ic048158y
- Rhine W.E., Hallock R.B., Davis W.M., Wong-Ng W. Synthesis and Crystal Structure of Barium Titanyl Oxalate, BaTi(O)(C2O4)25H2O: a Molecular Precursor for Barium Titanate (BaTiO3). Chem. Mater., 1992, vol. 4, pp. 1208-1216. DOI: 10.1021/cm00024a019
- Nolan N.T., Seery M.K., Pillai S.C. Spectroscopic Investigation of the Anatase-to-Rutile Transformation of Sol-Gel-Synthesized TiO2 Photocatalysts. J. Phys. Chem. C., 2009, vol. 36 (113), pp. 16151-16157. DOI: 10.1063/1.5082479
- Pambudi A.B., Kurniawati R., Iryani A. Effect of Calcination Temperature in the Synthesis of Carbon Doped TiO2 Without External Carbon Source. AIP Conf. Proc., 2018, vol. 2049, pp. 1-5. DOI: 10.1063/1.5082479
- Kinsinger N.M., Wong A., Li D., Villalobos F., Kisailus D. Nucleation and Crystal Growth of Nanocrystalline Anatase and Rutile Phase TiO2 from a Water-Soluble Precursor. Cryst. Growth Des., 2010, vol. 10, pp. 5254-5261. DOI: 10.1021/cg101105t
- Zhou H., Sun S., Ding H. Surface Organic Modification of TiO2 Powder and Relevant Characterization. Adv. Mater. Sci. Eng., 2017, vol. 2017, pp. 1-8. DOI: 10.1155/2017/9562612
- Primet M., Pichat P., Mathieu M.V. Infrared Study of the Surface of Titanium Dioxides. I. Hy-droxyl Groups. J. of Phys. Chem.,1971, vol. 9 (75), pp. 1216-1220. DOI: 10.1021/j100679a007
- Lewis K.E., Parfitt G.D. Infra-Red Study of the Surface of Rutile. Trans. Farad. Soc., 1966, vol. 62, pp. 204-214. DOI: 10.1039/TF9666200204
- Karkare M.M. Choice of Precursor not Affecting the Size of Anatase TiO2 Nanoparticles but Affecting Morphology Under Broader View. Int. Nano. Lett., 2014, vol. 4, pp. 1-8. DOI: 10.1007/s40089-014-0111-x
- Hafizah N., Sopyan I. Nanosized TiO2 Photocatalyst Powder via Sol-Gel Method: Effect of Hydrolysis Degree on Powder Properties. Int. J. Photoenergy., 2009, pp. 1-8. DOI: 10.1155/2009/962783
- Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Sing K.S.W. Physisorption of Gases, with Special Reference to the Evaluation of Surface Area and Pore Size Distribution (IUPAC Technical Report). Pure Appl. Chem., 2015, vol. 87, pp. 1051-1069. DOI: 10.1515/pac-2014-1117
- Praveen P., Viruthagiri G., Mugundan S., Shanmugam N. Sol-Gel Synthesis and Characterization of Pure and Manganese Doped TiO2 Nanoparticles - A New NLO Active Material. Spectrochim. Acta A., 2014, vol. 120, pp. 548-557. DOI: 10.1016/j.saa.2013.12.006
- Bagheri S., Shameli K., Hamid S.B.A. Synthesis and Characterization of Anatase Titanium Dioxide Nanoparticles Using Egg White Solution via Sol-Gel Method. J. Chem., 2012, vol. 2013, pp. 1-5. DOI: 10.1155/2013/848205
- Araghi M.E.A., Shaban N., Bahar M. Synthesis and Characterization of Nanocrystalline Barium Strontium Titanate Powder by a Modified Sol-Gel Processing. Mater. Sci., 2016, vol. 34(1), pp. 63-68. DOI: 10.1515/msp-2016-0020
- Devi R.S., Venckatesh R., Sivaraj R. Synthesis of Titanium Dioxide Nanoparticles by Sol-Gel Technique. IJIRSET., 2014, vol. 3(8), pp. 15206-15211. DOI: 10.15680/IJIRSET.2014.0308020
- Kakihana M., Tada M., Shiro M. Structure and Stability of Water Soluble (NH4)8[Ti4(C6H4O7)4(O2)4]-8H2O. Inorg. Chem., 2001, vol. 5, pp. 891-894. DOI: 10.1021/ic001098l
- Guy A., Jones P., Hill S.J. Identification and Chromatographic Separation of Antimony Species with a-Hydroxy Acids. Analyst., 1998, vol. 123, pp. 1513-1518. DOI: 10.1039/A708574E
- Kakihana M., Tomita K., Petrykin V., Tada M., Sasaki S., Nakamura Y. Chelating of Titanium by Lactic Acid in the Water-Soluble Diammonium Tris(2-hydroxypropionato)titanate(IV). Inorg. Chem., 2004, vol. 43, pp. 4546-4548. DOI: 10.1021/ic040031l
- Tomita K., Petrykin V., Kobayashi M., Shiro M., Yoshimura M., Kakihana M. A Water-Soluble Titanium Complex for the Selective Synthesis of Nanocrystalline Brookite, Rutile, and Anatase by a Hydrothermal Method. Angew. Chem. Int. Ed. Engl., 2006, vol. 45, pp. 2378-2381. DOI: 10.1002/anie.200503565
- Tomita K., Kobayashi M., Petrykin V., Yin S., Sato T., Yoshimura M., Kakihana M. Hydrothermal Synthesis of TiO2 Nanoparticles Using Novel Water-Soluble Titanium Complexes. J. Mater. Sci., 2008, vol. 43, pp. 2217-2221. DOI: 10.1007/s10853-007-2113-9
- Kobayashi M., Petrykin V., Kakihana M., Tomita K. Hydrothermal Synthesis and Photocatalyt-ic Activity of Whisker-Like Rutile-Type Titanium Dioxide. J. Am. Ceram., 2009, vol. 92, pp. S21-S26. DOI: 10.1111/j.1551-2916.2008.02641.x
- Chiang Y., Kresge A.J., Pruszynski P., Schepp N.P., Wirz J. The Enol of Mandelic Acid, Detection, Acidity in Aqueous Solution, and Estimation of the Keto-Enol Equilibrium Constant and Carbon Acidity of Mandelic Acid. Angew. Chem. Int. Ed. Engl., 1990, vol. 29, pp. 792-794. DOI: 10.1002/anie .199007921


