Сорбция органических красителей слоистым двойным гидроксидом магния и алюминия
Автор: Тронов А.П., Толчев А.В., Фадеев В.В., Авдин В.В., Морозов Р.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Методами рентгенофазового анализа, спектрофотомерии, инфракрасной спектроскопии исследована сорбция органических красителей на примере метиленового оранжевого (МО) и метиленового синего (МС) слоистым двойным гидроксидом (СДГ) магния и алюминия с удельной поверхностью ~ 200 м2/г, полученного методом низкого насыщения. Показано, что сорбционная емкость слоистого двойного гидроксида в случае раствора метиленового оранжевого достигает 82 %, а для раствора метиленового синего - 15 %. Экспериментально установлено, что сорбция красителей не приводит к структурным изменениям СДГ, о чем свидетельствует отсутствие каких-либо значимых изменений в рентгеновской дифракционной картине образцов до и после сорбции. Сделано предположение о том, что сорбция красителей происходит на поверхности образца (физическая сорбция). В пользу физической сорбции свидетельствует большая удельная поверхность слоистого двойного гидроксида. Анализируются возможные причины различной сорбционной емкости для растворов МО и МС.
Слоистый двойной гидроксид, магний, алюминий, гидротальцит, сорбция, метиленовый синий, метиленовый оранжевый, сорбционная емкость, физическая сорбция, удельная поверхность
Короткий адрес: https://sciup.org/147246059
IDR: 147246059 | УДК: 546. | DOI: 10.14529/chem240415
Текст научной статьи Сорбция органических красителей слоистым двойным гидроксидом магния и алюминия
Проблема удаления токсичных органических красителей из сточных вод, например, текстильных производств, является актуальной и требует своего решения. Наиболее предпочтительным, эффективным и недорогим является процесс адсорбции [1]. В качестве адсорбентов используют различные материалы, например цеолиты, полимеры, активированный уголь, углеродные нанотрубки, слоистые двойные гидроксиды (СДГ). Анализ литературных данных [2–15] показывает, что в последнее время большое внимание уделяется системам на основе СДГ благодаря их большой площади поверхности, структурной стойкости, простоте и дешевизне их синтеза [16– 18]. Ранее нами были синтезированы слоистые двойные гидроксиды из растворов солей магния и алюминия методами низкого и высокого насыщения реакционной смеси, различающиеся скоростью подачи раствора солей в щелочную среду и ее концентрацией. Показано, что образец, синтезированный по методу низкого насыщения, представляет собой однофазный слоистый двойной гидроксид магния и алюминия, который характеризуется большой удельной поверхностью ~ 200 м2/г [19].
Целью данной работы являлось исследование процесса сорбции органических красителей на примере метиленового оранжевого (МО) и метиленового синего (МС) слоистым двойным гидроксидом магния и алюминия, полученным по методу низкого насыщения.
Экспериментальная часть
Образец СДГ получали по методу низкого насыщения. Для этого готовили раствор, содержащий соли магния и алюминия, взятые в мольном соотношении катионов 3:1. В мерной колбе на 75 мл растворяли Mg(NO 3 ) 2 ·6H 2 O массой 19,2 г (0,075 моль) и Al(NO 3 ) 3 ·9H 2 O массой 9,4 г (0,025 моль). Раствор солей прибавляли по каплям со скоростью 0,5 мл/мин в колбу, содержащую 50 мл 0,2 М раствора Na 2 CO 3 . Для поддержания рН системы в диапазоне 9,5-10,0 капельным методом добавляли 1,6 М раствор NaOH. Температуру реакционной среды поддерживали равной ~ 60 °C при постоянном перемешивании пропеллерной мешалкой со скоростью вращения 400 об/мин. После окончания осаждения полученную суспензию выдерживали при 80 °C в течение 4 часов также при постоянном перемешивании. Далее суспензию разделяли центрифугированием при скорости вращения 3500 об/мин, промывая осадок теплой дистиллированной водой до достижения рН маточного раствора значений 7,0–7,5. Осадки сушили при комнатной температуре в эксикаторе с CaCl 2 в течение 96 часов.
Для исследования процесса сорбции органических красителей была разработана методика, суть которой заключается в следующем. Строили калибровочные кривые сорбции растворов красителей, записывая значения оптической плотности для диапазона известных концентраций растворов красителей при длине волны максимального светопоглощения λ = 460 нм для МО и λ = 665 нм для МС, соответственно. Толщина светопоглощающего слоя составляла l = 0,5 см. В качестве раствора сравнения использовалась дистиллированная вода. Измерения проводили на спектрофотометре ПЭ-5300ВИ.
Изучение кинетики сорбции проводили путем добавления 250 мг СДГ в 100 мл раствора красителя с концентрацией 20 мг/л. Смесь перемешивали при комнатной температуре пропеллерной мешалкой со скоростью вращения 300 об/мин. Далее, через определенные промежутки времени отбирали по 3 мл исследуемого раствора красителя. Пробы центрифугировали при скорости вращения 3500 об/мин в течение 5 минут, а затем определяли равновесную концентрацию краси- теля в растворе. Количество красителя, перешедшего из раствора в твердую фазу, определяли по формуле m (%) =
C o C
. C 0 .
■ 100 ,
где С 0 и С – исходная и равновесная концентрации красителя в растворе (мг/л), соответственно.
Рентгенофазовый анализ слоистых двойных гидроксидов до и после сорбции проводился с использованием порошкового дифрактометра Rigaku Ultima IV, Cu K a -излучение. Инфракрасная спектроскопия проводилась на аппарате Shimadzu IRAffinity-1S.
Результаты исследования сорбции органических красителей образцом СДГ представлены на рис. 1. Анализ сорбционной кривой для метиленового синего (см. рис. 1а) позволяет сделать вывод о том, что процесс удаления красителя из раствора начинает происходить уже в первую минуту, достигая значения, равного 11 %. Затем, до конца эксперимента, концентрация МС практически не менялась, а ее среднее значение составляло ~ 12 %. Конечное количество сорбированного красителя из раствора на СДГ составило 12,8 %.
Характер сорбции метиленового оранжевого, как следует из данных, представленных на рис. 1б , отличается от такового для метиленового синего. Так, на кривой сорбции МО процесс удаления красителя также начинается в первую минуту добавления СДГ в раствор красителя, однако, уже через 2 минуты количество сорбированного из раствора красителя достигает ~75 %. В течение последующих 30 минут наблюдается монотонное увеличение величины m до ~ 80 % и далее, до конца эксперимента величина m достигает 82 %.
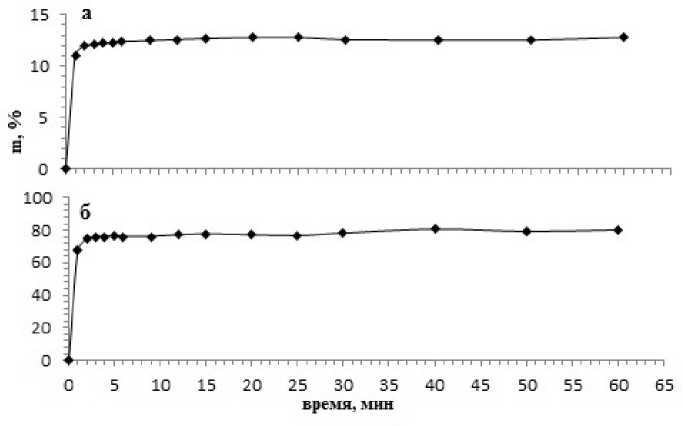
Рис. 1. Кривые сорбции красителя МС (а) и МО (б) на образце СДГ
На рис. 2 представлены результаты ИК спектроскопии образцов до и после сорбции красителей. Так, на спектрах образца СДГ (см. рис. 2а), полученного методом низкого насыщения, наблюдается широкая полоса максимума в области 3000–3600 см–1, соответствующая валентным колебаниям связи O–H, которые можно отнести как к гидроксильным группам, так и к молекулам воды, адсорбированным на поверхности, а также находящимся в межслоевом пространстве СДГ. Интенсивные полосы поглощения в области 1370–1400 см–1 относятся к валентным симметричным колебаниям связей C=O и N=O, которые характеризуют карбонат и нитрат-анионы в межслоевом пространстве [20–23]. Соседний максимум в области 1645 см-1 характеризует деформационные колебания связи O–H [24–26]. Максимум в области 440 см–1, согласно [22], можно отнести к колебаниям связей Mg–O и Al–O.
На спектрах образцов СДГ (см. рис. 2б,в) можем наблюдать, что интенсивность полос поглощения, относящаяся к валентным колебаниям связей C=O и N=O при 1370–1400 см–1 заметно увеличилась после сорбции. В литературе отмечается, что это связано с асимметричным растяжением анионов [27]. Так, в случае с анионным красителем МО, интенсивность светопропускания умень- шилась с 35 до 15 %, а в случае с катионным красителем МС – до 25 %. У образца СДГ + МО наблюдаются полосы поглощения при 1030 см–1, 1110 см–1, характеризующие валентные колебания связи S–O, и C–S, соответственно, которые относятся к сульфонат-анионам красителя МО [28]. О наличии молекулы МО свидетельствуют также полоса поглощения при 1120 см–1, относящаяся к валентным колебаниям 1, 4-го заместителя в бензольном кольце, и полоса поглощения при 1150 см–1, характеризующая валентные колебания связи C–N [29, 30].
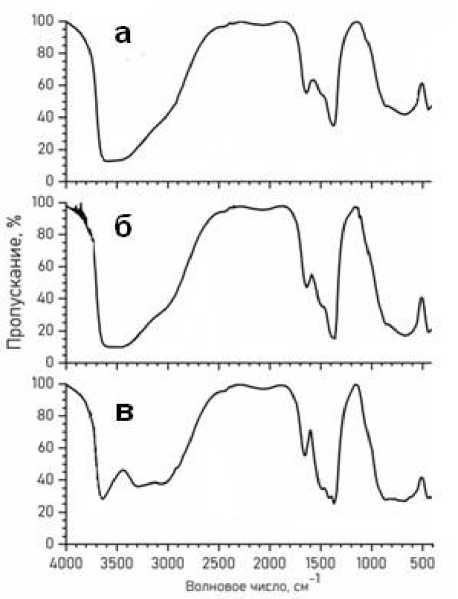
Рис. 2. ИК-спектры образцов: а) СДГ; б) СДГ + МО; в) СДГ + МС
На рис. 3 представлены фрагменты дифрактограмм образцов до и после сорбции красителей.
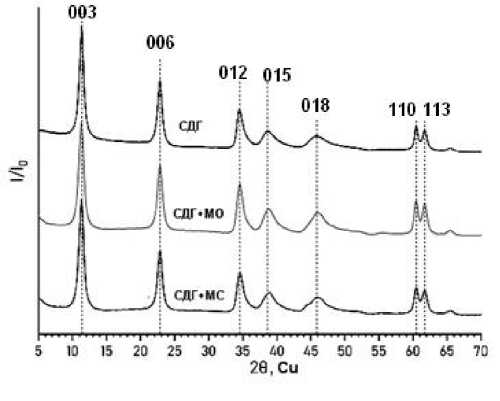
Рис. 3. Дифрактограммы образцов до и после сорбции красителей
Проведенный анализ углового распределения дифракционных максимумов и сравнение экспериментальных данных с литературными (ICCD card № 70–18802151) [31, 32] позволил сделать вывод о том, что исходный образец до проведения на нем сорбции можно отнести к слоистому двой- ному гидроксиду магния и алюминия. Из сравнения дифрактограмм образцов СДГ до и после проведения сорбции красителей следует, что сорбция красителей не приводит к структурным изменениям СДГ, о чем свидетельствует отсутствие каких-либо значимых изменений в дифракционной картине образцов: положения, полуширины и интенсивности дифракционных максимумов.
Обсуждение результатов
Отсутствие структурных изменений в слоистом двойном гидроксиде магния и алюминия после проведения сорбции, с учётом перехода значительной части красителя из раствора в твёрдую фазу (в случае метилового оранжевого она достигает 82 %), позволяет предположить, что сорбция красителей осуществляется на поверхности образцов СДГ в результате межмолекулярных взаимодействий на внешних слоях СДГ, то есть в данном случае имеет место физическая сорбция. В пользу физической сорбции свидетельствует также то, что образец СДГ, используемый в экспериментах, обладает большой площадью удельной поверхности, достигающей ~ 200 м2/г.
Существенное различие в сорбционной емкости СДГ для метиленового синего и метилового оранжевого можно объяснить следующим образом. Известно, что СДГ относят к классу неорганических соединений, состоящих из положительно заряженных бруситоподобных слоёв и отрицательно заряженных, гидратированных молекулами воды, межслоевых пространств. Часто их называют гидротальцитами или анионными глинами. Состав идеального гидратальцита, согласно [33] имеет вид [Mg 6 Al 2 (OH) 16 CO 3 ·4H 2 O], а структурную формулу СДГ можно представить в виде [M(2+) 1–x M(3+) x (OH) 2 ]x+(An–) x/n ·mH 2 O, где M(2+) и M(3+) двух- и трехвалентные катионы металлов, которые занимают центры октаэдров с общими ребрами, в вершинах которых находятся OH–группы, образуя при этом бесконечные двумерные поверхностные слои (рис. 4). An–– анионы, которые занимают гидратированную межслоевую область, уравновешивающие общий заряд молекулы [34]. К ним относят широкое множество как неорганических анионов, например, PO43–, CO 3 2–, NO 3 –, Hal– и т. д.; так и органических: карбоксилаты, сульфонаты, бензоаты, сукцинаты, полиоксометаллаты. Помимо этого, в качестве анионов могут выступать и сложные биомолекулы – ДНК [34], аминокислоты [2–4], белки и ферменты [5, 6] и т. д.
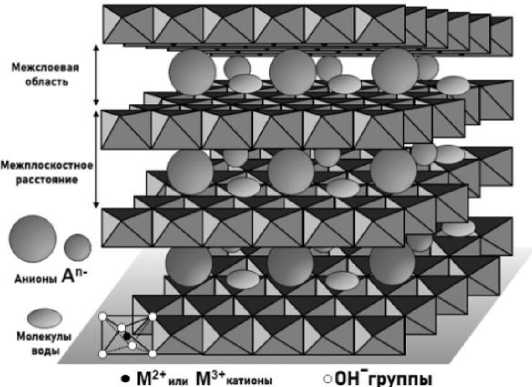
Рис. 4. Обобщенная структура слоистого двойного гидроксида
Органический краситель МС относится к катионным красителям (рис. 5а), из чего следует, что образовавшаяся в ходе диссоциации в водном растворе окрашенная катионная часть молекулы, вследствие кулоновского отталкивания с одноименным зарядом слоев СДГ (см. рис. 4), не позволяет сорбироваться полностью. В данном случае основным фактором удержания ионов красителя на СДГ являются межмолекулярные взаимодействия между функциональными группами красителя и OH-группами, находящимися на внешнем слое СДГ [7, 8, 35]. К таким видам взаимодействия можно отнести водородные связи S–H, N–H, O–H, C–H и другие. МО, напротив, является анионным красителем (рис. 5б), поэтому образовавшаяся окрашенная анионная часть молекулы МО сорбируется гораздо лучше на внешних положительно заряженных слоях СДГ, чем молекулы МС.
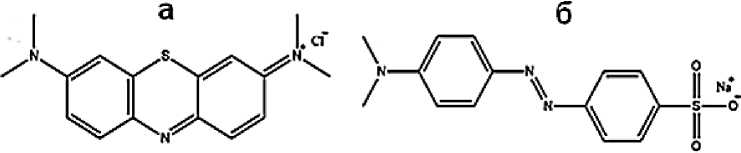
Рис. 5. Строение молекул органических красителей: а – МС; б – МО
Заключение
Исследована сорбция органических красителей на примере метиленового оранжевого (МО) и метиленового синего (МС) слоистым двойным гидроксидом магния и алюминия, полученного методом низкого насыщения.
Установлено, что, сорбция красителей не приводит к структурным изменениям СДГ, сделан вывод о том, что, сорбция красителей происходит на поверхности образца (физическая сорбция).
Показано, что сорбционная ёмкость слоистого двойного гидроксида магния и алюминия, полученного методом низкого насыщения, в случае раствора метиленового оранжевого достигает 82 %, а для раствора метиленового синего – 12,8 %. Предложены возможные причины различия сорбционной емкости для растворов МО и МС.
Список литературы Сорбция органических красителей слоистым двойным гидроксидом магния и алюминия
- Zhou Y. // Environmental pollution. 2019. V. 252. P. 352. DOI: 10.1016/j.envpol.2019.05.072.
- Aisawa S. // Journal of Solid State Chemistry. 2001. V. 162, No. 1. P. 52. DOI: 10.1006/jssc.2001.9340.
- Fudala A., Palinko I., Hrivnak B., Kiricsi I. // Journal of thermal analysis and calorimetry. 1999. V. 56, No. 1. P. 317. D0I:10.1023/A: 1010190315865.
- Aisawa S., Takahashi S., Ogasawara W. // Clay science. 2000. V. 11, No. 3. P. 317. D0I:10.11362/jcssj clayscience 1960.11.317.
- Gardner E.A., Yun S.K., Kwon T. et al. // Applied clay science. 1998. V. 13, No. 5-6. P. 479. DOI: 10.1016/S0169-1317(98)00040-4.
- Bravo-Suarez J.J., Paez-Mozo E.A., Oyama S.T. // Chemistry of materials. 2004. V. 16, No. 7. P. 1214. DOI: 10.1021/cm034853c.
- Miyata S. // Clays and Clay minerals. 1980. V. 28, No. 1. P. 50. DOI: 10.1346/CCMN.1980.0280107.
- Rives V., Ulibarri M.A. // Coordination chemistry reviews. 1999. V. 181, No. 1. P. 61. DOI: 10.1016/S0010-8545(98)00216-1.
- Hibino T., Yamashita Y., Kosuge K. // Clays and Clay Minerals. 1995. V. 43, No. 4. P. 427. DOI: 10.1346/CCMN.1995.0430405.
- Ambrogi V., Fardella G., Grandolini G. et al. // International Journal of Pharmaceutics. 2001. V. 220, No. 1-2. P. 23. DOI: 10.1016/S0378-5173(01)00629-9.
- Khan A.I., O'Hare D. // Mater. Chem. 2002. V. 12, No. 11. P. 3191. DOI: 10.1039/B204076J.
- Wang Q., O'Hare D. // Chemical Reviews. 2012. V. 112, No. 7. P. 4124. DOI: 10.1021/cr200434v.
- Pan D.A., Zhang H., Zhang T. et al. // Chemical Engineering Science. 2010. V. 65, No. 12. P. 3762. DOI: 10.1016/j.ces.2010.03.013.
- Evans D.G., DuanX. // Chem. Commun. 2006. V. 5. P. 485. DOI: 10.1039/B510313B.
- Williams G.R., O'Hare D. // Journal of Materials Chemistry. 2006. V. 16, No. 30. P. 3065. DOI: 10.1039/B604895A.
- Hajek M., Kutalek P., Smolakova L. et al. // Chemical Engineering Journal. 2015. V. 263. P. 160. DOI: 10.1016/j.cej.2014.11.006.
- Tanaka R., Ogino I., Mukai S.R. // ACS omega. 2018. V. 3, No. 12. P. 16916. DOI: 10.1021/acsomega.8b02557.
- Dixit M. // Journal of Industrial and Engineering Chemistry. 2013. V. 19, No. 2. P. 458. DOI: 10.1016/j.jiec.2012.08.028.
- Fadeev V.V., Tronov A. P., Tolchev A. V. et al. // Russian Journal of Inorganic Chemistry. 2023. V. 68, No. 5. P. 538. DOI: 10.1134/S0036023623600478.
- Varga G., Szabados M., Kukovecz A. et al. // Materials Research Letters. 2020. V. 8, No. 2. P. 68. DOI: 10.1080/21663831.2019.1700199.
- Abniki M., Moghimi A., Azizinejad F. // Journal of the Serbian Chemical Society. 2020. V. 85, No. 9. P. 1223. DOI: 10.2298/JSC191011004A.
- Chen L, Sun B, WangX. et al. // Journal of Materials Chemistry B. 2013. V. 1, No. 17. P. 2268. DOI: 10.1039/C3TB00044C.
- Cardinale A.M., Carbone C., Consani S. et al. // Crystals. 2020. V. 10, No. 6. P. 443. DOI: 10.3390/cryst10060443.
- Kim H.S., Kudo T, Honma I. // Solid State Ionics. 2010. V. 181, No. 19-20. P. 883. DOI: 10.1016/j.ssi.2010.04.037.
- Wang X., Zhu X., Meng X. // RSC advances. 2017. V. 7, No. 56. P. 34984. DOI: 10.1039/C7RA04646D.
- Aisawa S., Nakada C., Hirahara H. et al. // Applied Clay Science. 2019. V. 180. P. 1. DOI: 10.1016/j.clay.2019.105205.
- Lafi R., Charradi K., Djebbi M.A. et al. // Adv.Powder Technology. 2016. V. 27, No. 1. P. 232. DOI: 10.1016/j.apt.2015.12.004.
- DriciSetti N., Jouini N., Derriche Z. // Journal of Physics and Chemistry of Solids. 2010. V. 71, No. 4. P. 556. DOI: 10.1016/j.jpcs.2009.12.035.
- Zaghloul A., Benhiti R., Aitlchou A. et al. // Materials Today: Proceedings. 2021. V. 37. P. 3793. DOI: 10.1016/j.matpr.2020.07.676.
- Kuljiraseth J., Wangriya A., Malones J.M.C. et al. // Applied Catalysis B: Environmental. 2019. V. 243. P. 415. DOI: 10.1016/j.apcatb.2018.10.073.
- Kong L., Tian Y., Pang Z. et al. // Chemical Engineering Journal. 2019. V. 371. P. 893. DOI: 10.1016/j cej.2019.04.116.
- Leont'eva N.N., Drozdov V.A., Bel'skaya O.B. et al. // Russian Journal of General Chemistry. 2020. V. 90. P. 509. DOI: 10.1134/S1070363220030275.
- Cavani F., Trifiro F., Vaccari A. // Catalysis today. 1991. V. 11, No. 2. P. 173. DOI: 10.1016/0920-5861(91)80068-K.
- Kwak S.Y. // Solid State Ionics. 2002. V. 151, No. 1-4. P. 229. DOI: 10.1016/S0167-2738(02)00714-2.
- D'Souza S.A. // Advances in pharmaceutics. 2014. V. 2014. P. 1-12. DOI: 10.1155/2014/304757.


