Сорбционная очистка никелевых растворов от металлов-примесей
Автор: Тимофеев Константин Леонидович, Краюхин Сергей Александрович, Мальцев Геннадий Иванович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Металлургия техногенных и вторичных ресурсов
Статья в выпуске: 1 т.16, 2016 года.
Бесплатный доступ
Рассмотрена возможность сорбционной очистки никелевых растворов от цинка, меди, железа в производстве никеля сернокислого реактивного марки «ч» на смолах с функциональными группами: аминодиуксусная (Lewatit TP207); бис-2,4,4-триметилпентил-фосфиновая кислота (Lewatit TP272); аминофосфоновая (Purolite S940). Определены величины статической (СОЕ) и динамической (ДОЕ) обменной емкости исследованных сорбентов по металлам-примесям в технологических растворах состава, г/дм3: 147,6 Ni; 2,02 Zn; 0,36 Cu; 0,17 Fe; 9,8 H2SO4, и модельных бинарных растворах «никель - металл» состава, г/дм3: 75,9-88,6 Ni; 7,1 Zn; 0,52 Cu; 0,34 Fe; 4,7 H2SO4. В статическом режиме при увеличении соотношения объемов сорбента и раствора (Т : Ж) степень извлечения металлов возрастает. При Т : Ж = 0,1 из технологических растворов наиболее полно извлекаются на смолах, %: Cu > 60 (TP207); Fe(III) ≈ 50 (S940), при совместной сорбции других металлов не более 8-14 % от исходного содержания. Изотермы сорбции металлов-примесей из модельных растворов согласно значениям коэффициентов корреляции (R2 > 0,95) удовлетворительно описываются моделями Ленгмюра и Фрейндлиха. Использование сорбционной технологии не позволяет производить достаточную очистку растворов от металлов-примесей, что устраняется применением ступенчатой экстракции на Д2ЭГФК и Versatic 10.
Сорбция, изотерма, экстракция, никель, цинк, медь, железо
Короткий адрес: https://sciup.org/147156994
IDR: 147156994 | УДК: 66.08 | DOI: 10.14529/met160123
Текст научной статьи Сорбционная очистка никелевых растворов от металлов-примесей
При электролитическом рафинировании меди применяют электролит, содержащий 30–45 г/дм3 меди в виде сульфата и около 200 г/дм3 свободной серной кислоты. Помимо этого, в электролите присутствуют примеси NiSO 4 , FeSO 4 , As 2 O 3 , ZnSO 4 , CaSO 4 и др. В связи с накоплением этих примесей и переходом в раствор меди часть электролита выводят из процесса и утилизируют его переработкой на медный купорос [1]. После нейтрализации серной кислоты медьсодержащими материалами раствор поступает на выпаривание и охлаждение в кристаллизаторах для выделения медного купороса. Маточный раствор направляют на извлечение никелевого купороса [2].
В производстве никеля сернокислого на ОАО «Уралэлектромедь» [3] при очистке технологических растворов от меди, железа, цинка используют сепарированный мел [4]. При этом потери металла с некондиционными никельсодержащими солями составляют свыше 12 %, что снижает извлечение никеля в товарный продукт. Кроме того, использование меловой очистки не позволяет получать продукт марок выше «ч» (ГОСТ 4465 74), что, как правило, не устраивает потребителей – производителей никелевых аккумуляторов) (табл. 1).
Для исключения потери никеля и повышения комплексности использования сырья и качества готового продукта исследована возможность использования сорбционной технологии для очистки никельсодержащих растворов от металлов-примесей.
Методика исследований
В качестве объектов исследований использовали слабокислотные катиониты и твердый экст-
Таблица 1
Качество никеля сернокислого
|
Наименование |
Содержание, %, ppm |
||||
|
Ni, % |
Zn |
Cu |
Ca |
Mg |
|
|
Никель сернокислый марки «ч» АО «Уралэлектромедь» |
21,2–22,2 |
40 |
10 |
300 |
800 |
|
Требования потребителя |
≥ 22 |
< 10 |
< 5 |
< 5 |
< 50 |
|
ГОСТ 4465–74 |
≥ 20,3 |
≥ 100 |
≥ 20 |
Сумма щелочных металлов не более 0,2 % |
|
Металлургия техногенных и вторичных ресурсов
Таблица 2
Основные физико-химические свойства исследованных смол и экстрагентов
|
Наименование |
Purolite S940 |
Lewatit TP207 |
Lewatit TP272 |
|
Тип катионита |
Слабокислотный катионит |
ТВЭКС |
|
|
Функциональная группа |
Аминофосфоновая H 2 NO 2 P |
Амино-диуксусная CH 6 NO 3 P |
Бис-(2,4,4) триметил-пентилфосфиновая C 16 H 35 O 2 P |
|
Матрица |
Сшитый полимер |
||
|
Гранулы, мм |
0,30–0,85 |
0,4–0,5 |
0,3–1,6 |
Таблица 3
Состав модельных двухкомпонентных растворов
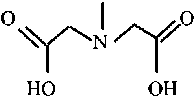
Функциональные группы смол:
Purolite S940
I nh2
Lewatit TP207
Lewatit TP272
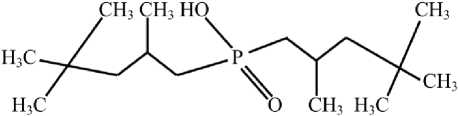
Иониты переведены в H+-форму в статических условиях – выдержаны в течение 72 ч при перемешивании в растворе 5 % H 2 SO 4 при соотношении объемов жидкой и твердой фаз Ж : Т = 100 с последующей отмывкой водой до рН 5–6. Из-за малого насыпного веса смолы ТР272 происходило ее всплывание на поверхность раствора. Для обеспечения контакта ионита с раствором, смолу поместили в хлопчатобумажные пористые утяжеленные мешочки.
Концентрацию элементов в исходных и равновесных растворах определяли атомно-абсорбционным методом на приборе АА-7000 Shimadzu (Япония) [5]. Навески смол взвешивали на аналитических весах ВЛР-200.
Построение кривых сорбции из растворов статическим методом с определением статической обменной емкости (СОЕ) осуществляли по опытным данным, полученным при температуре 22–24 °С методом переменных объемов при соотношении Ж : Т= 10–200. Общая продолжительность контакта смолы с раствором при перемешивании составила двое суток.
Степень извлечения (α) – безразмерная величина, показывающая, какая доля исходного количества элемента находится в фазе сорбенте:
α = g c / g о , где g с и g о – абсолютные массовые количества (г, моль) извлекаемого элемента в фазе смолы и в объеме исходного раствора, соответственно. Степень извлечения элемента обычно выражается в процентах.
Изотермы сорбции описывали по моделям Ленгмюра и Фрейндлиха [6]. Константы Kads и Qs определяли решением уравнения Ленгмюра в координатах «1/ Q р – 1/ C р»:
Постоянные Ks и n определены аналогично с помощью графического решения уравнения Фрейндлиха в координатах «lg Q р – lg C р»:
lg Q р = lg Ks + n .lg Cр .
При проведении сорбции в динамическом режиме исходный раствор из напорной емкости подавали на сорбционные колонки, содержащие 40 см3 ионитов, снизу вверх с постоянной часовой скоростью 1,5 удельных объема на объем ионита, контролируя химический состав очищенного раствора через 0,5–3,75 удельных объемов.
Насыщенные смолы регенерировали раствором 20 % H 2 SO 4 без нагрева при Ж : Т=5 на протяжении 24 ч. Расчет степени извлечения ионов металлов вели по результатам, полученным при сорбции и десорбции.
За критерий качества очищенного раствора (проскок ионов меди, железа, цинка) принято требование к содержанию данных примесей не более, г/дм3: 0,02 медь; 0,015 железо; 0,09 цинк [4].
Результаты исследования и их обсуждение
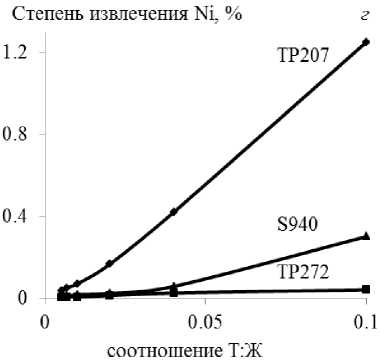
При сорбции металлов-примесей из технологического раствора на смолах извлечение элементов пропорционально возрастает с увеличением отношения Т:Ж в интервале 0,01–0,1, достигая максимума при 0,1 (рис. 1).
Наибольшее извлечение меди (~ 64 %) выявлено на Lewatit TP207 и железа(III) (~ 49 %) на Purolite S955 при относительно невысокой совместной сорбции Zn и Fe (~ 8–12 %), Zn и Cu (~ 14 %), соответственно.
Максимальное извлечение никеля из технологического раствора (~ 1 %) установлено для смолы Lewatit TP207.
Влияние конкурирующих элементов при протекании сорбционных процессов исследовано на модельных двухкомпонентных растворах «Ni–Ме» (табл. 4).
Результаты сорбции металлов из модельных растворов подтвердили селективность смолы TP207 к ионам меди, а S940 – к ионам железа(III). Для данных смол степени извлечения меди и железа из двухкомпонентных растворов выше, чем из многокомпонентных. В бинарном растворе «Ni–Fe3+» все иониты показали высокие (> 90 %) степени извлечения железа(III).
Значения степени извлечения металлов из модельных растворов уменьшаются в интервалах (%) и рядах сорбентов:
медь (94,2–4,2) ТР207 > S940 > ТР272;
железо (III) (99,4–92,7) S940 > ТР207 > ТР272;
цинк (23,8–11,3) в ряду: S940 > ТР207 > ТР272.
Совместная сорбция цинка из бинарных систем не превышает 5 и 10 % при значениях Т : Ж, равных 0,2 и 0,4, соответственно.
Для бинарных растворов показано, что значительная доля статической емкости ионитов TP207 (55,6–95,7 %) и S940 (63,7–95,3 %) приходится на
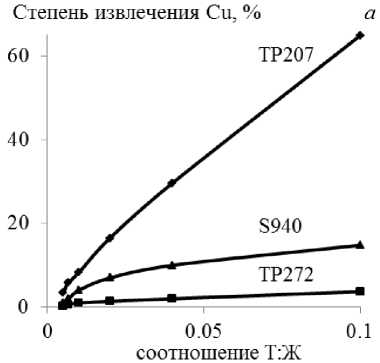
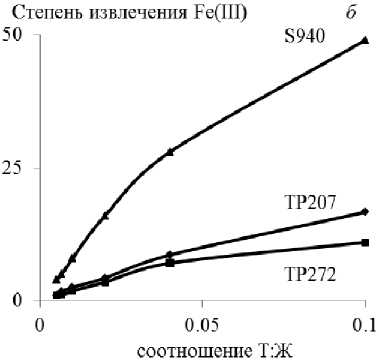
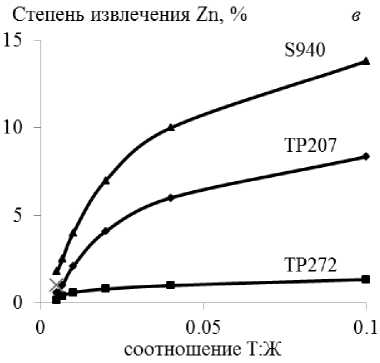
Рис. 1. Зависимость извлечения ионов меди ( а ), железа(III) ( б ), цинка (в ), никеля ( г ) из технологического раствора от величины соотношения Т : Ж
Металлургия техногенных и вторичных ресурсов
Таблица 4
Показатели статической сорбции ионов из модельных растворов
Для описания равновесия ионообменных реакций на исследуемых сорбентах вывели уравне- ния изотермы и определили константы обмена. На примере ионов цинка представлены изотермы сорбции из модельного раствора «Ni–Zn» при соотношении Т : Ж = 0,01–0,2, а также результаты графического решения изотерм по моделям Ленгмюра и Фрейндлиха (рис. 2).
Модель изотермы Ленгмюра основана на том,
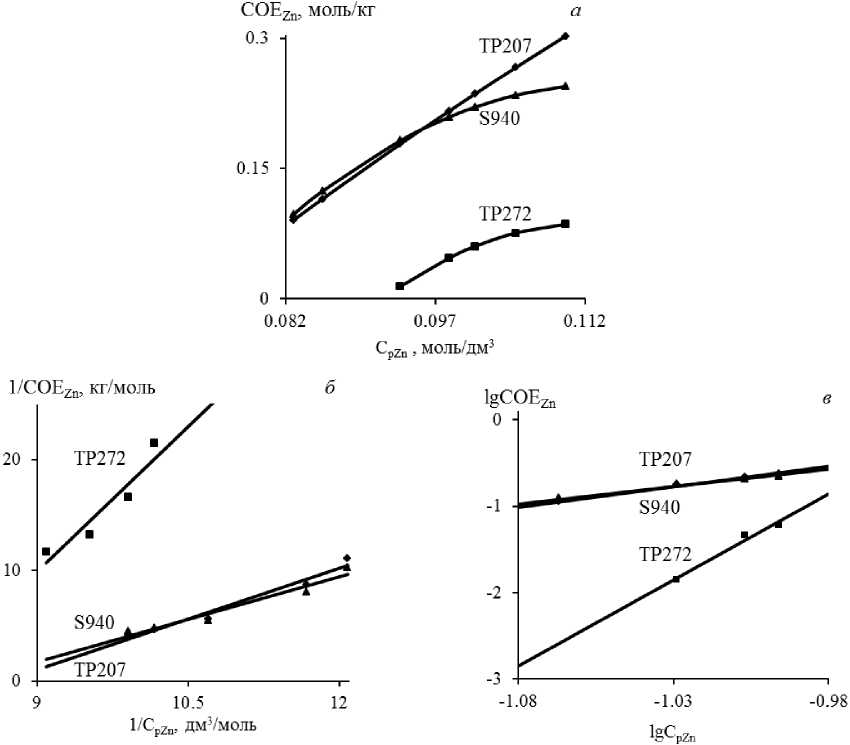
Рис. 2. Изотермы сорбции ионов цинка ( а ) и графическое решение изотерм по моделям Ленгмюра ( б ) и Фрейндлиха ( в )
что на поверхности катионита образуется мономо-лекулярный сорбционный слой и все активные места обладают равной энергией и энтальпией сорбции [7]. Модель Фрейндлиха используется для описания сорбции на гетерогенной поверхности, когда изначально заполняются активные сорбционные положения с наименьшей энергией, что сопровождается непрерывным изменением энергии сорбции [8].
Из данных рис. 2, a видно, что на начальных участках изотермы сорбции величина сорбируемости цинка практически пропорциональна равновесной концентрации ионов в растворе (участок Генри), то есть при малом содержании металла в растворе наблюдается количественная сорбция. При высоких равновесных концентрациях ионов в растворе изотермы сорбции постепенно выходят на насыщение, а концентрация металла в фазе смолы после непрерывного возрастания стабилизируется. Вид изотерм показывает, что кривые сорбции цинка на ТР207 и S940 идут выше, чем на ТР272. Следовательно, сродство первых двух смол к ионам цинка выше, чем у третьего сорбента.
Для определения значений констант, входящих в уравнения изотерм Ленгмюра и Фрейндлиха, использованы линейные формы уравнений данных моделей: «1/СОЕ – 1/ Ср » и «lgСОЕ – lg Ср », соответственно (рис. 2, б , в ). Значения параметров, входящих в уравнения моделей, а также коэффициенты корреляции ( R 2) представлены в табл. 5.
Количественной мерой сродства сорбированных ионов к поверхности катионитов служит величина Ks , входящая в уравнение изотермы Фрейндлиха. Значения величины Ks подтверждают наибольшее сродство ионов меди и цинка к смоле ТР272, занимающих 27,0–58,9 % емкости ионита при сорбции из бинарных никелевых растворов (см. табл. 3). Однако на степень извлечения металлов оказывает влияние и величина СОЕ, которая оказалась наименьшей для ТР272 среди исследованных катионитов.
Значения коэффициентов корреляции (R2) показывают, что сорбция исследованных ионов ме- таллов наилучшим образом описывается моделью Фрейндлиха. Модель Ленгмюра дает меньшие значения R2 для всех смол. Это дополнительно указывает на то, что в структуре ионитов немного активных центров с одинаковой энергией, то есть они не удовлетворяют граничным условиям применимости модели Ленгмюра с мономолекуляр-ным покрытием, что может служить косвенным подтверждением применимости модели Фрейндлиха. Согласно этой модели адсорбция происходит на гетерогенной поверхности, и активные центры обладают разными величинами энергии адсорбции, которая непрерывно изменяется на протяжении всего процесса.
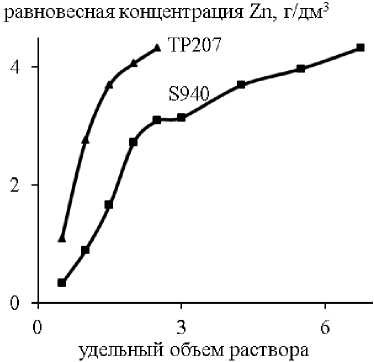
Закономерности статической сорбции были также изучены в динамических условиях. Наименее эффективно процесс сорбции меди, железа и цинка протекал на ионите Lewatit TP272. Содержание всех примесей в очищенном растворе сразу превышало требования ГОСТ 4465–74. Суммарная полная динамическая емкость смолы (ПДОЕ, мг/см3) по Cu, Fe, Zn составила 2,64. Выходные кривые сорбции примесей на ионитах Lewatit TP207 и Purolite S940 представлены на рис. 3.
В динамическом режиме смола TP207 подтвердила свою высокую селективность к меди: динамическая обменная емкость (до «проскока») составила 2,09 мг/см3, величина фильтроцикла – 10,5 удельных объемов очищенного раствора никеля. Максимальную ДОЕ по железу(III) показал ионит S940 – 0,24 мг/ см3 при V ж/ V т = 1,5. По цинку «проскок» наблюдался в течение всего процесса сорбции.
По результатам сорбции и десорбции была рассчитана ПДОЕ ионитов по никелю и примесям (табл. 6).
Значительная доля емкости смол TP207 и S940 приходится на ионы никеля (80,65–83,65 %) при минимальном содержании железа(III) (2,10–2,65 %) в фазе сорбента. Соотношение величин емкости медь/цинк находится в обратной зависимости для TP207 (12,8/3,9) и S940 (2,45/11,8).
Таблица 5
Параметры сорбции металлов-примесей в бинарных системах
|
Система |
Сорбат |
Сорбтив |
Ленгмюр |
Фрейндлих |
||||
|
Qs , моль/кг |
Kads |
R 2 |
lg Ks |
n |
R2 |
|||
|
«Ni–Zn» |
Zn |
TP207 TP272 S940 |
0,353 |
5,62 |
0,966 |
4,17 |
4,80 |
0,991 |
|
0,107 |
13,76 |
0,898 |
18,67 |
19,93 |
0,972 |
|||
|
0,174 |
34,64 |
0,949 |
3,44 |
4,09 |
0,975 |
|||
|
«Ni–Cu» |
Cu |
TP207 TP272 S940 |
0,353 |
123,4 |
0,998 |
0,81 |
0,74 |
0,999 |
|
0,107 |
8,19 |
0,943 |
13,88 |
7,47 |
0,966 |
|||
|
0,174 |
18,03 |
0,946 |
5,75 |
3,31 |
0,968 |
|||
|
«Ni–Fe (III)» |
Fe(III) |
TP207 TP272 S940 |
0,353 |
100,3 |
0,993 |
0,58 |
0,70 |
0,999 |
|
0,107 |
296,6 |
0,995 |
0,02 |
0,54 |
0,998 |
|||
|
0,174 |
494,1 |
0,993 |
0,05 |
0,45 |
0,998 |
|||
Металлургия техногенных и вторичных ресурсов
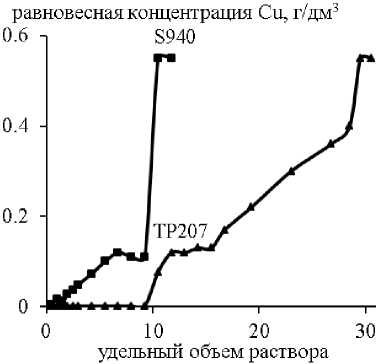
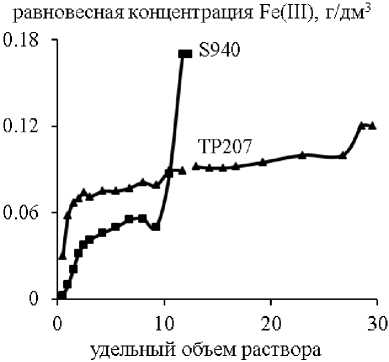
Рис. 3. Зависимость равновесной концентрации ионов примесей от удельного объема ( V ж / V т ) очищенного раствора никеля на смолах S940 и ТР207
Полная динамическая обменная емкость ионитов
Таблица 6
|
Ионит |
ПДОЕ Me , мг/см3/( ПДОЕ Me /∑ ПДОЕ), % |
∑ ПДОЕ, (мг/см3)/% |
|||
|
Сu |
Fe (III) |
Zn |
Ni |
||
|
TP207 |
9,235/12,8 |
1,91/2,65 |
2,81/3,90 |
58,04/80,65 |
71,995/100 |
|
S940 |
1,478/2,45 |
1,283*/2,1 |
7,105/11,8 |
50,4/83,65 |
60,266/100 |
По результатам сорбции.
Таким образом, при сорбции из раствора сульфата никеля в динамическом режиме содержание ионов цинка в очищенном растворе сразу превысило требования «проскока» (0,09 г/дм3), а фильтроцикл по меди оказался незначительным (10,5 удельных объемов), что очевидно объясняется кинетическими ограничениями процесса ионного обмена на смолах.
Указанные причины обусловили прекращения испытаний сорбционной технологии извлечения примесей на ионитах Purolite S-940, Lewatit TP207 и Lewatit TP272 и проведение исследований экстракционной технологии.
Для извлечения примесей был использован известный фосфорорганический экстрагент Д2ЭГФК (ди-2-этилгексилфосфорной кислоты), а для извлечения никеля из очищенного раствора – Versatic 10 (разветвленная третичная C10 карбоновая кислота) [9, 10].
При лабораторных испытаниях 10 % Д2ЭГФК (соотношение О : В = 1 : 1) и 35 % Versatic 10 (О : В = 5 : 1) в разбавителе (керосин), получен очищенный раствор, из которого при выпарке-кристаллизации никеля сернокислого выделен продукт высокой чистоты маркой выше «х.ч.» (табл. 7), что обуславливает актуальность проведения дальнейших укрупненных и опытно-промышленных испытаний экстракции.
Таблица 7
Химический состав очищенного раствора после экстракции и полученного сульфата никеля
|
Наименование |
Содержание |
||||
|
Ni |
Zn |
Cu |
Ca |
Mg |
|
|
Очищенный раствор, г/дм3 |
120 |
0,005 |
0,007 |
0,005 |
0,006 |
|
Сульфат никеля |
22,3 % |
< 5 ppm |
< 10 ppm |
||
Заключение
-
1. При сорбции металлов-примесей (цинк, медь, железо) из технологического никельсодержащего раствора на смолах Lewatit TP207 и ТР272, Purolite S940 извлечение элементов пропорционально возрастает с увеличением отношения твердой и жидкой фаз (Т : Ж) в интервале 0,01–0,4.
-
2. Наибольшее извлечение меди (~ 64 %) и никеля (~ 1 %) выявлено на Lewatit TP207, железа (III) (~ 49 %) – на Purolite S955, при относительно невысокой совместной сорбции Zn и Fe (~ 8–12 %), Zn и Cu (~ 14 %), соответственно.
-
3. Значения степени извлечения металлов-примесей из модельных бинарных растворов «никель – металл» уменьшаются в интервалах (%) и рядах сорбентов:
-
4. На основании значений коэффициента корреляции ( R 2) показано, что выделение исследованных ионов металлов-примесей наилучшим образом описывается моделью Фрейндлиха, когда взаимодействие происходит на гетерогенной поверхности, и активные центры ионообменных смол обладают разными величинами энергии адсорбции, которая непрерывно изменяется на протяжении всего процесса.
-
5. При испытаниях процесса сорбции в динамических условиях установлено, что концентрация цинка в очищенном растворе не уменьшается ниже «проскока» (0,09 г/дм3), а фильтроцикл ионитов по меди и железу сравнительно мал – 10,5 и 1,5 удельных объемов соответственно при динамической обменной емкости 2,09 г/дм3 и 0,24 г/дм3.
-
6. Лабораторными испытаниями по очистке никелевого раствора с использованием экстракции на реагентах Д2ЭГФК и Versatic 10 установлена возможность глубокого извлечения примесей с получением готового продукта качества выше марки «х.ч» по ГОСТ 4465–74.
медь (94,2–4,2) ТР207 > S940 > ТР272;
железо(III) (99,4–92,7) S940 > ТР207 > ТР272;
цинк (23,8–11,3) в ряду: S940 > ТР207 > ТР272.
Список литературы Сорбционная очистка никелевых растворов от металлов-примесей
- Шульга, Е.В. Производство медного купороса, как способ стабилизации работы переделов электрорафинирования меди и никеля/Е.В. Шульга, А.И. Юрьев, А.И. Девочкин//Цветные металлы. -2013. -№ 6. -С. 68-73.
- Сидоренко, А.Ю. Получение сернокислого никеля из отработанных электролитов медной промышленности/А.Ю. Сидоренко, Г.Г. Михайлов, Г.П. Животовская//Вестник ЮУрГУ. Серия «Металлургия». -2006. -№ 10 (65). -С. 104-109.
- ГОСТ 4465-74. Никель (II) сернокислый 7-водный. Технические условия. -М.: ИПК Издательство стандартов, 2004. -11 с.
- ТИ 00194429-0400-15-2013. Производство никеля сернокислого. Технологическая инструкция. -Верхняя Пышма: ОАО «Уралэлектромедь», 2013. -48 с.
- ГОСТ Р 54920-2012. Концентраты цинковые. Атомно-абсорбционный метод определения меди, свинца, кадмия, кобальта, железа, калия, натрия, золота, серебра, индия, кальция и магния. -М.: Стандартинформ, 2014. -29 с.
- Солдатов, В.С. Ионообменные равновесия в многокомпонентных системах/В.С. Солдатов, В.А. Бычков. -Минск: Наука и техника, 1988. -359 с.
- Воюцкий, С.С. Курс коллоидной химии/С.С. Воюцкий. -М.: Химия, 1976. -512 с.
- Adamczuk, А. Equilibrium, thermodynamic and kinetic studies on removal of chromium, copper, zinc and arsenic from aqueous solutions onto fly ash coated by chitosan/A. Adamczuk, D. Kołodyńska//Chemical Engineering Journal. -2015. -Vol. 274. -P. 200-212.
- Gharabaghi, М. Separation of nickel and zinc ions in a synthetic acidic solution by solvent extraction using D2EHPA and Cyanex 272/М. Gharabaghi, M. Irannajad, A. Azadmehr//Physicochemical Problems of Mineral Processing. -2013. -№ 49 (1). -Р. 233-242.
- Пат. 2203969 Российская Федерация. Способ селективной экстракции ионов меди, кобальта и никеля из водных растворов/Л.А. Воропанова, Ю.Е. Крутских, В.Н. Титухина. -Заявл. 14.05.2001; опубл. 10.05.2003.


