Сорбционное концентрирование благородных металлов комплексообразующими полимерами на основе 1-винил-1,2,4-триазола
Автор: Шаулина Л.П., Ермакова Т.Т., Кузнецова Н.П., Волкова Л.И., Мячина Г.Ф.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Исследованы сорбционные свойства сополимеров триазола с акриловой кислотой и благородными металлами.
Сорбция, благородные металлы, извлечение
Короткий адрес: https://sciup.org/148179521
IDR: 148179521 | УДК: 546.92
Текст научной статьи Сорбционное концентрирование благородных металлов комплексообразующими полимерами на основе 1-винил-1,2,4-триазола
Для сорбционного концентрирования благородных металлов интерес представляют сополимеры, содержащие в макромолекулах атомы азота, кислорода и серы. Наряду с функциональными группами, имеющими указанные атомы, на свойства сорбентов оказывают влияние и сшивающие агенты, которые обеспечивают определенную структуру макромолекул, их химическую и термическую устойчивость [1-4].
В статическом режиме изучены сорбционные свойства комплексообразующих сополимеров 1-винил-1,2,4-триазола с акриловой кислотой (С1) и акрилонитрилом (С2) (рис. 1, табл. 1) по отношению к катиону серебра и анионным хлоридным комплексам серебра, золота (3+), платины (4+), палладия (2+).
Сорбент 1 (С1)
Сорбент 2 (С2)
CH CH CH 2
CH CH CH 2

COOH
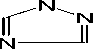
CN
Рис. 1. Структурные формулы сополимеров
Таблица 1.
Состав исследуемых сополимеров
|
Сорбент |
Состав |
Соотношения компонентов в сополимере |
[N],% |
|
С1 |
ВТ + АК |
65 : 35 |
30,6 |
|
С2 |
ВТ + АН |
16 : 84 |
29,3 |
Влияние природы и концентрации кислот в интервале 1-7 М на извлечение металлов показано для сорбента С1 (рис. 2). Сорбция хлоридных комплексов палладия и золота сополимером С1 слабо зависит от концентрации соляной и серной кислот до 5М, затем резко падает. Для сополимеров при сорбции катионной формы серебра, его хлоридного комплекса и комплекса платины наблюдается постепенное снижение извлечения во всем интервале концентраций. Для азотнокислых растворов в указанном интервале кислотности извлечение платины, золота и палладия несколько ниже, чем для соляно- и сернокислых.
Характер зависимости извлечения ацидокомплексов металлов от концентрации кислот свидетельствует в пользу ионообменного механизма взаимодействия по протонированному четвертичному атому азота с учетом конкурирующего влияния аниона кислоты (1 стадия).
Дальнейшее участие активных атомов азота в координационном взаимодействии (стадия 2, рис. 3) установлено при изучении ИК- и КР-спектров образцов сополимеров, сополимеров, обработанных кислотами, и концентратов. Изменения отмечены в области частот 1500-1530 см-1, 300-360 см-1, характерных для протонированной и депротонированной форм атома азота и его формы, участвующей в координации. Для сополимера С2 не происходит изменений полосы 2242 см-1, которая соответствует группе –С = N, следовательно, эта группа не участвует в координации.
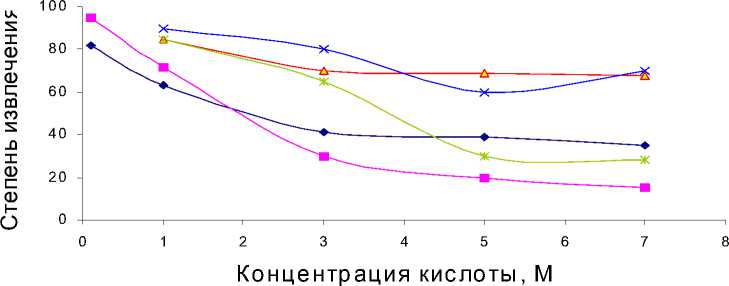
Ag (HNO3) Ag (HCl) Pt (HCl) Pd (HCl) [AuCl4]-
Рис. 2. Влияние кислотности растворов на извлечения ионов металлов
Стадия 1
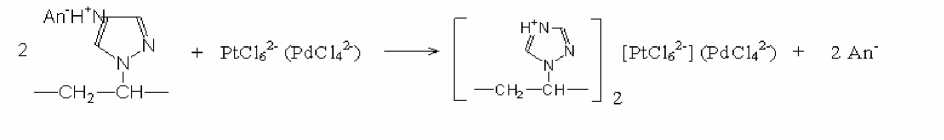
Стадия 2
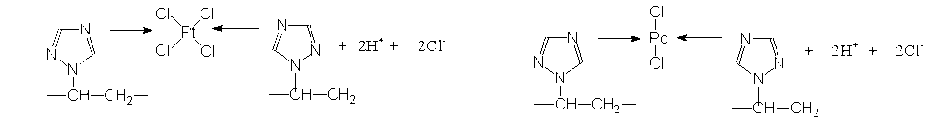
Рис. 3. Механизм взаимодействия хлоридных комплексов
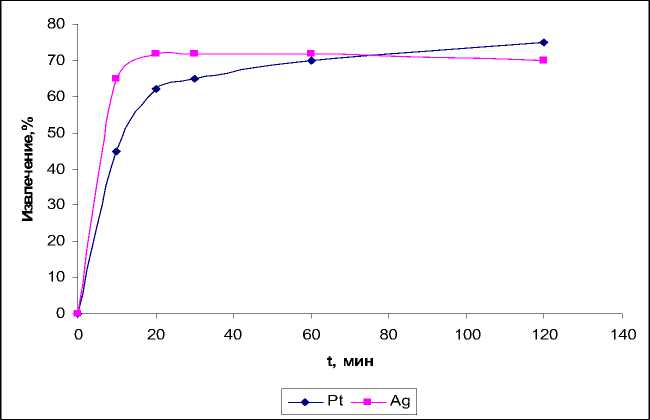
Рис. 4. Зависимость степени извлечения ионов металлов от времени контакта фаз
Соотношение компонентов ([Ме] : [N]) в представленных структурах (стадия 2) подтверждено расчетами мольного соотношения концентраций из данных элементного анализа концентратов.
Извлечение характеризуется высокой кинетикой: при времени установления равновесия от 15-20 мин для хлоридных комплексов платины и палладия, 30 - золота, 15 – серебра, время полусорбции составляет от 5 мин для платины и 7 - палладия, 7, 10 - серебра и золота соответственно (рис. 4).
Анализ кинетических кривых сорбционного процесса: расчет степени достижения равновесия, кинетического коэффициента сорбции, коэффициентов диффузии показал, что извлечение носит смешанно-диффузионный характер [5].
Из кривых равновесного распределения металлов (рис. 5) рассчитаны значения сорбционной емкости и коэффициенты распределения (табл. 2).
Большие значения сорбционной емкости отмечаются для сорбента 1 при практически одинаковом содержании атомов азота. Как следует из таблицы 1, соотношение звеньев винилтриазола и акрилонитрила в полимере составляет 16:84, т.е. содержание атомов азота выше в акрилонитриле. Но как было установлено при исследовании ИК-спектров, атомы этого компонента не принимают участие во взаимодействии. Таким образом, по сравнению с С1 концентрация активных атомов азота в С2 значительно ниже.
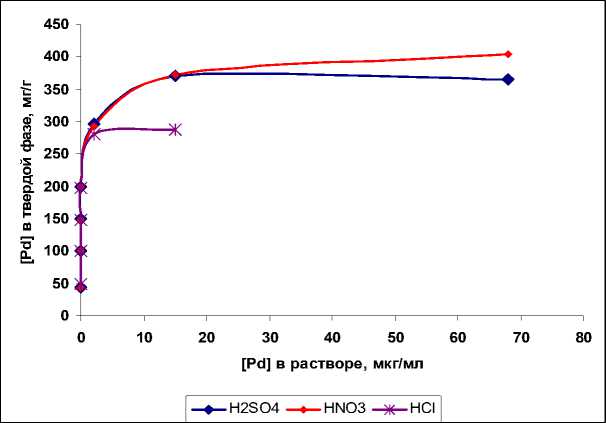
Рис. 5. Кривые равновесного распределения палладия между твердой фазой и 1 М растворами кислот для сорбента С1
Максимальное значение сорбционной емкости получено для комплексов золота и палладия (700 и 400 мг/г соответственно). Значения коэффициентов распределения при этом составляют 4 ⋅ 103 и 7 ⋅ 105. Сорбент 1 более эффективен для извлечения низких концентраций палладия.
Таблица 2
Значения сорбционной емкости и коэффициентов распределения металлов в 1М растворах кислот
|
Среда 1 М |
Е мг/г; Д см3/г |
|||
|
Pt \ |
Pd \ |
Au \ |
Ag |
|
|
Сорбент 1, [N],%= 30,6 |
||||
|
HCI |
250; 4,6 ⋅ 104 |
370; 3,0 105 |
700; 4,2 ⋅ 103 |
75; 1,3 ⋅ 103 |
|
H 2 SO 4 |
280; 2,4 ⋅ 104 |
400;7,0 ⋅ 105 |
300;1,8 ⋅ 103 |
|
|
HNO 3 |
280; 5.8 ⋅ 103 |
300;2,3 ⋅ 105 |
650; 3,3 ⋅ 103 |
320; 7,7 ⋅ 103 |
|
Сорбент 2, [N],%= 29,3 |
||||
|
HCI |
130; 6,9 ⋅ 103 |
140; 9,5 ⋅ 104 |
280;1,9 ⋅ 104 |
|
|
H 2 SO 4 |
80; 9,8 ⋅ 103 |
140; 7,6 104 |
115; 2,0 ⋅ 103 |
|
|
HNO 3 |
40; 1,6 ⋅ 103 |
80; 1,8 ⋅ 104 |
150;1,5 ⋅ 103 |
175;3,5 ⋅ 103 |
Установлено, что помимо ацидокомплексов палладий извлекается и в виде его хлоридных палладий-оловянных комплексов
Из 1М растворов кислот не сорбируются ионы железа, никеля, кобальта, но извлекаются ионы меди. Микроколичества палладия, золота количественно извлекаются из 1М растворов кислот, содержащих ионы других металлов, а также из смеси 1М растворов кислот, растворов кислот, содержащих 100-200-кратные количества хлорида натрия.
Из фазы сорбента палладий количественно элюируется 3%-ным раствором тиомочевины в 1М соляной кислоте как при комнатной температуре, так и при нагревании в течение 30 мин.
Таким образом, комплекс исследований показал, что полученные сополимеры являются довольно эффективными сорбентами благородных металлов.


