Сорбционные свойства наноструктурированного порошка MgO, полученного из модельного раствора бишофита
Автор: Мацукевич И.В., Шевчук В.В., Полховская О.В., Матрунчик Ю.В., Конк Д.А., Вашук В.В.
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология и экология
Статья в выпуске: 2 (33), 2017 года.
Бесплатный доступ
Предметом исследования данной работы является оксид магния, который находит широкое применение в качестве сорбента, катализатора, идентификатора загрязняющих химических и токсических веществ в процессах водо- и газоочистки. Исследована кристаллическая структура, дисперсность, микроструктура и сорбционные свойства порошка MgO, полученного методом осаждения из бишофита. Установлено, что наноструктурированный мезопористый порошок оксида магния является эффективным сорбентом ионов тяжелых металлов в водных средах. Изучена возможность повышения сорбционной способности MgO путем химической активации сорбента хлоридом магния и выявлено, что в присутствии хлорид-ионов его сорбционная ёмкость по отношению к ионам тяжелых металлов возрастает на 20-30 %, что делает оксид магния практически значимым материалом для очистки бишофита от примесей тяжелых металлов.
Тяжелые металлы, сорбционные свойства, оксид магния, бишофит, метод осаждения, размер частиц
Короткий адрес: https://sciup.org/142212334
IDR: 142212334 | УДК: 661.846.22:544.723
Текст научной статьи Сорбционные свойства наноструктурированного порошка MgO, полученного из модельного раствора бишофита
межуточного продукта горноперерабатывающей промышленности как бишофит, который, в частности, можно использовать для получения оксида магния.
Оксид магния является технологически значимым материалом, так как имеет очень широкий круг применения: используется для гетерогенного катализа в органическом синтезе [1–4], в производстве датчиков влажности и кислых газов [5], в процессах водо- и газоочистки от кислых примесей [6], для дезактивации химического оружия и боевых отравляющих веществ и нейтрализации токсических выбросов [7], в качестве антибактериального агента [8] и др. Оксид магния – многообещающий сорбент целого ряда веществ: тяжелых металлов, органических красителей, фторид-ионов, а также таких газов, как диоксид углерода и серы [9–13].
Целью работы является исследование сорбционных свойств наноструктурированного порошка MgO , полученного из бишофита, по отношению к ионам тяжелых металлов в водных средах. Для достижения данной цели необходимо было решить следующие задачи: методом осаждения с последующей термообработкой получить порошок MgÎ ; изучить его кристаллическую структуру, дисперсность, микроструктуру и сорбционные свойства.
Порошок оксида магния получали методом осаждения с последующей термообработкой. Для этого готовили модельный рассол бишофита – концентрированный раствор хлорида магния, содержащий примеси натрия, калия и сульфат-ионов из MgCl2·6H2O (х.ч.), MgSO4·7H2O (ч.), KCl (х.ч.), NaCl (х.ч.), после растворения всех компонентов модельный раствор фильтровали через бумажный обеззоленный фильтр ТУ 6-091678-95. Полученный раствор анализировали химическим и пламенно-фотометрическим методами анализа для уточнения состава модельного раствора. Содержание ионов щелочных металлов определяли на фотометре Sherwood Model 410. Плотность модельного раствора бишофита установили при помощи ареометра АОН-4 ГОСТ 18481-81. Уточненный состав раствора и его плотность приведены в таблице 1.
К двукратно разбавленному рассолу бишофита одномоментно подавали весь заранее рассчитанный объем 2 M водного раствора осадителя, приготовленного из NaOH (ч.д.а.), при этом показатель рН среды осаждения составлял 12. После осаждения полученный гелеобразный осадок многократно промывали дистиллированной водой, фильтровали через бумажный обеззоленный фильтр ТУ 6-09-1678-95 и сушили до постоянной массы при температуре 105 °С. Оксид магния получали отжигом гидроксида магния при температуре 420 °С в течение 2 ч. Полученный образец подвергали тщательному перетиранию.
Идентификацию образцов проводили при помощи рентгенофазового анализа (РФА) (рентгеновский дифрактометр Bruker AXS (Германия), Cu-K α -излучение). Размеры кристаллитов ( t1, нм), то есть размеры первичных частиц, оценивали по уширениям рентгеновских дифракционных пиков с помощью формулы Дебая-Шеррера [14]. Гранулометрический состав (распределение по размерам вторичных частиц) порошков определяли при помощи системы для исследования наночастиц Malvern Zetasizer Nano ZS (Великобритания). Исследования гранулометрического состава порошков MgO проводили предварительно обработав их спиртовые суспензии в ультразвуковой ванне с рабочей частотой 17 ± 1,7 кГц в течение 30 мин.
Растворы с концентрацией ионов марганца, кобальта, меди и свинца 100 мг/л были получены с использованием Mn(NO3)2·6H2O (ч.), Ñî(NO3)2·6H2O (ч.), Ñu(NO3)2·6H2O (х.ч.) и Pb(NO3)2 (х.ч.) соответственно. После добавления навески сорбента MgO растворы выдерживали при постоянном перемешивании. Через различные временные интервалы и после отстаивания смеси в течение 5 – 10 мин отбирали аликвоты растворов. Концентрации ионов тяжелых металлов (марганца, кобальта, меди и свинца) в растворах определяли с помощью атомно-абсорбционного спектрометра ContrAA 300 (Германия) с пламенным атомизатором. Сорбционную емкость ( qt , мг/г) рассчитывали по формуле
|
Таблица 1 – Состав модельного рассола бишофита и его плотность |
||||
|
Содержание компонентов, мас. % |
Плотность, г/см3 |
|||
|
MgCl2 |
NaCl |
KCl |
MgSO4 |
|
|
I 30,3 |
0,62 |
0,23 |
1,56 |
1,315 ______) |
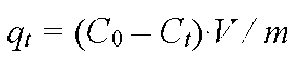
где Ñ0 и Ñt – начальная концентрация ионов тяжелого металла и их концентрация после контакта сорбента с раствором в течении времени t соответственно, мг/л; V – объем раствора, л; m – масса навески сорбента, г. По аналогичной методике проводили исследование сорбционной активности оксида магния в присутствии хлорида магния при мольном соотношении n(MgCl2) / / n(MgO) = 1/1 .
После сушки при температуре 105 °С образец, согласно результатам РФА, представлял собой гидроксид магния со структурой брусита и гексагональной кристаллической решёткой, а после отжига при температуре 420 °С материал идентифицировался как оксид магния со структурой периклаза (рисунок 1 а ). Параметр элементарной ячейки составил a = 0,42213 нм, что хорошо согласуется с литературными данными [15]. Размер первичных частиц t1 наноструктуриро-ванного порошка оксида магния, рассчитанный по уширениям рентгеновских дифракционных пиков с помощью формулы Дебая-Шеррера, составил 8,1 нм.
Ранее авторами в работе [16] установлено, что порошок MgO, полученный методом осаждения с последующей термообработкой, является ме-зопористым, а также показано, что после термообработки MgO сохраняет основные адсорбционно-структурные свойства, сформированные на этапе синтеза гидроксида магния, что может выступать в качестве дополнительного фактора регулирования этиx свойств. Удельная поверхность и средний диаметр пор наноструктуриро-ванного порошка ÌgO составляли 124 м2/г и 35 нм соответственно. Данный образец также показал очень высокое значение удельного объема пор – 1,038 см3/г [16].
Как видно из рисунка 1 б , размеры вторичных частиц оксида магния, полученного из бишофита методом осаждения, изменялись в широких пределах, а распределение частиц по размерам характеризуется бимодальностью. Преобладающими являлись фракции с размерами частиц 50–70 нм и 200–400 нм. Наличие в порошке оксида магния крупных частиц обусловлено, очевидно, тем, что эти частицы представляют собой не отдельные зерна, а их агрегаты.
Как видно из таблицы 2, наноструктуриро-ванный порошок оксида магния, полученный из бишофита, является весьма эффективным сорбентом ионов тяжелых металлов в водных средах. Уже по истечении 2 часов контакта сорбента с раствором концентрация ионов меди и свинца
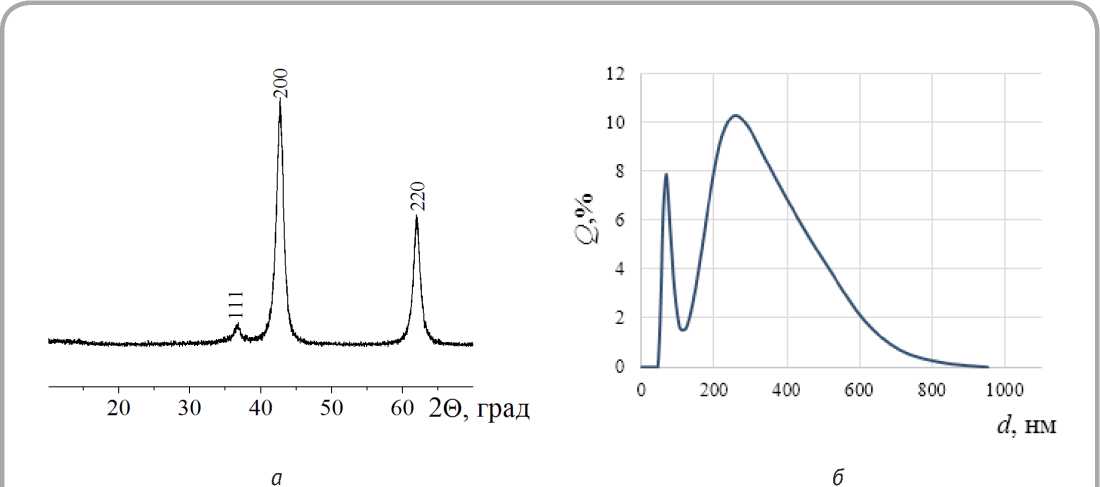
Рисунок 1 – Рентгеновская дифрактограмма (а) и результаты гранулометрического анализа (б) порошка оксида магния, полученного методом осаждения из бишофита
уменьшилась примерно в 5 раз,тогда как содержание ионов марганца и кобальта – примерно в 40 и 100 раз соответственно.
В работе была исследована возможность повышения сорбционной способности оксида магния по отношению к ионам тяжелых металлов в водных средах путем активации сорбента хлоридом магния. В таком случае, как и ожидалось, достигнуто значительное повышение эффективности очистки воды от ионов тяжелых металлов, что объясняется следующим. Оксид магния вступает в химическое взаимодействие с водным раствором хлорида магния и образовывать высокодисперсный осадок основного хлорида магния в соответствии с химической реакцией (2)
. (2)
Далее соли тяжелых металлов реагируют с этим осадком и осаждаются на его поверхности в виде соответствующих нерастворимых основных солей или гидроксидов, например, по уравнению (3)
. (3)
В присутствии хлорида магния как активатора процесса сорбции в пределах чувствительности прибора ионы марганца и кобальта не обнаружены уже после 2 часов взаимодействия сорбента с раствором, а ионы меди и свинца – через 4 часа (таблица 2). Полученный результат хорошо согласуется с данными работ [17, 18], в которых авторы нашли простой и эффективный способ очистки водных растворов минерала бишофита от тяжелых металлов и установили, что оксид магния обеспечивает более эффективное удаление примесей по сравнению с силикагелем, активированным углем и оксидом алюминия.
Таким образом, в работе методом осаждения из бишофита получен порошок нанострук-турированного оксида магния, который находит широкое применение в качестве адсорбента, катализатора, идентификатора загрязняющих химических и токсических веществ, в процессах водо- и газоочистки. Исследована кристаллическая структура, дисперсность, микроструктура и
Таблица 2 – Сорбционные свойства нанаоструктурированного оксида магния, полученного из бишофита, по отношению к ионам тяжелых металлов в водных средах
|
Время контакта сорбента с раствором t, ч |
Сорбент |
Mn |
Co |
Cu |
Pb |
||||
|
Ñ t , мг/л |
qt, мг/г |
Ñt , мг/л |
qt , мг/г |
Ñ t , мг/л |
qt, мг/г |
Ñ t , мг/л |
qt, мг/г |
||
|
2 |
MgO |
2,27 |
6,98 |
0,67 |
7,10 |
23,70 |
5,45 |
18,63 |
5,81 |
|
MgO + активатор # |
0* |
7,14 |
0* |
7,14 |
1,59 |
7,03 |
0,36 |
7,12 |
|
|
4 |
MgO |
1,17 |
7,06 |
0,33 |
7,12 |
||||
|
MgO + активатор # |
0* |
7,14 |
0* |
7,14 |
|||||
|
6 |
MgO |
0* |
7,14 |
0* |
7,14 |
||||
|
MgO + активатор # |
0* |
7,14 |
0* |
7,14 |
|||||
|
24 |
MgO |
0* |
7,14 |
0* |
7,14 |
0* |
7,14 |
0* |
7,14 |
|
MgO + активатор # |
0* |
7,14 |
0* |
7,14 |
0* |
7,14 |
0* |
7,14 |
|
Примечание:
# – в качестве активатора процесса сорбции использовался хлорид магния, взятый в мольном соотношении n(MgCl2)/n(MgO)= 1/1 ;
* – в пределах чувствительности прибора присутствие ионов тяжелых металлов обнаружено не было, однако, они могли присутствовать в следовых количествах.
сорбционные свойства порошка MgO. Средний размер первичных частиц Mg(OH)2 составлял 8,1 нм, а размеры вторичных частиц изменялись в пределах от 40 до 825 нм. Установлено, что на-ноструктурированный мезопористый порошок оксида магния является эффективным сорбентом ионов тяжелых металлов в водных средах, что, вероятно, связано с его высокой удельной поверхностью. Изучена возможность повышения сорбционной способности MgO путем химической активации сорбента хлоридом магния и выявлено, что в присутствии хлорид-ионов его сорбционная ёмкость по отношению к ионам тяжелых металлов возрастает на 20–30 %. Этот факт делает оксид магния практически значимым материалом для эффективной очистки бишофита от примесей тяжелых металлов.
Авторы благодарят Н.Л. Будейко за проведение рентгенофазового анализа оксида магния. Работа выполнена при поддержке ГПНИ «Химические технологии и материалы» (подпрограмма «Новые химические технологии и продукты», задание 1.01).
Список литературы Сорбционные свойства наноструктурированного порошка MgO, полученного из модельного раствора бишофита
- Umar, A., Hahn, Y. B. (2010), Metal Oxide Nanostructures and their Applications. American Scientific Publishers, USA.
- Jun, Ch., Shuanghong T., Jiang, L., Ya, X. (2015), Catalytic performance of MgO with different exposed crystal facetstowards the ozonation of 4-chlorophenol, Applied Catalysis: General, 2015, vol. 506, рp. 118-125.
- Selvama, N.C.S., Kumara, R. T., Kennedyb, L.J., Vijaya, J. J. (2013), Comparative study of microwave and conventional methods for the preparation and optical properties of novel MgO-micro and nano-structures, Journal of Alloys and Compounds, 2011, vol. 509, pp. 9809-9815.
- Demirci, S., Öztürk, B., Yildirim, S., Bakal, F., Erol, M., Sancakoğlu, O., Yigit, R., Celik, E., Batar, T. (2015), Synthesis and comparison of the photocatalytic activities of flame spray pyrolysis and sol-gel derived magnesium oxide nanoscale particles, Materials Sciencein Semiconductor Processing, 2015, vol. 34, pp. 154-161.
- Yu, J.C., Xu, A., Zhang, L., Song, R., Wu, L. (2004), Synthesis and characterization of porous magnesium and oxide nanoplates, Journal of Physical Chemistry, 2004, vol. 108, pp. 6-70.
- Rizwan, W., Ansari, S. G., Dar, M. A., Kim, Y. S., Shin, H. S. (2007), Synthesis of magnesium oxide nanoparticles by sol-gel process, Materials Science Forum, 2007, vols. 558-559, pp. 983-986.
- Zeyneb, C., Sema (Akyil), E., Sabriye (Doyurum), Y. (2012), Magnesium Oxide Nanoparticles: Preparation, Characterization, and Uranium Sorption Properties, Environmental Progress & Sustainable Energy, 2012, vol. 31, iss. 4, pp. 536-543.
- Bindhul, M. R., Umadevi, M., Michea, M. Kavin, Arasu, M. V., Al-Dhabi, N. A. (2016), Structural, morphological and optical properties of MgO nanoparticles for antibacterial applications, Materials Letters, 2016, vol. 166, pp. 19-22.
- Gao, G. L. Zhang, W., Li, H., Lang, L., Xu, Z. (2008), Controllable fabrication of mesoporous MgO with various morphologies and their absorption performance for toxic pollutants in water, Cryst. Growth Des., 2008, vol. 8, pp. 3785-3790.
- Nagappa, B., Chandrappa, G. T. (2006), Mesoporous nanocrystalline magnesium oxide for environmental remediation, Micropor. Mesopor. Mat., 2006, vol. 106, pp. 212-218.
- Sasaki, M., Fukumoto, N., Moriyama, S., Hirajima, T. (2011), Sorption characteristics of fluoride on to magnesium oxide-rich phases calcined at different temperatures, J. Hazard. Mater., 2011, vol. 191, pp. 240-248.
- Wang, Q., Luo, J., Zhong, Z., Borgna, A. (2011), CO2 capture by solid adsorbents and their applications: currents status and new trends, Energy Environ. Sci., 2011, vol. 4, pp. 42-55.
- Srivastavaa, V., Sharmab, Y. C., Sillanpää, M. (2015), Green synthesis of magnesium oxide nanoflower and its application for the removal of divalent metallic species from synthetic wastewater, Ceramics International, 2015, vol. 69, pp. 2764-2772.
- Jenkins, R., Snyder, R. L. (1996), Introduction to X-ray Powder Diffractometry. John Wiley & Sons Inc., pp. 89-91.
- Powder Diffraction File. Swarthmore: Joint Committee on Powder Diffraction Standard: Card № 01-074-1225.
- Ручец, А. Н., Бесараб, C. B., Мацукевич, И. В. (2016), Адсорбционные свойства наноструктурированных порошков Mg(OH)2 и MgO, Новые горизонты 2016: материалы Белорусско -Китайского молодежного инновационного форума, Минск, 2016, c. 201-202.
- Озеров, А. А., Сысуев, Б. Б., Солодунова, Г. Н., Мерешкова, Н. Ю. (2015), Эффективная технология очистки бишофита методом адсорбции на оксиде магния, Международный журнал прикладных и фундаментальных исследований, № 7, с. 83-85.
- Петров, В. И., Спасов А. А., Озеров, А. А., Сысуев, Б. Б. (2012), Способ очистки бишофита. Патент РФ № 2442593 С2, 2012.


